Оптимизация этапов технологии получения удвоенных гаплоидов кабачка (Cucurbita pepo L.) в культуре неопыленных семяпочек in vitro
Автор: Ермолаев Алексей Станиславович, Домблидес Елена Алексеевна
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 5 (67), 2022 года.
Бесплатный доступ
Актуальность. Для создания эффективной технологии получения удвоенных гаплоидов (DH-технологии) кабачка в культуре неопыленных семяпочек in vitro необходимо подобрать оптимальные значений многих факторов, степень влияния каждого из которых на гиногенез может существенно отличаться. Целью исследования являлась оптимизация отдельных этапов технологии. Методы. Для индукции эмбриогенеза использовали жидкую и агаризованную (7 г/л) среду IMC с различной концентрацией сахарозы (от 20 до 80 г/л) и различными регуляторами роста растений (2 мг/л 2,4 D; 0,2 мг/л ТДЗ; 0,8 мг/л 2,4 D и 1,2 мг/л НУК). Результаты. Оптимальным для изученных генотипов кабачка оказался предварительно заизолированный с вечера, сорванный утром раскрывшийся бутон. Стерилизация завязей кабачка краткосрочным обжиганием после обработки 96% спиртом, позволяет существенно сократить временные затраты на этот этап без потери эмбриогенного потенциала. Для индукции гиногенеза в культуре неопыленных семяпочек кабачка возможно использовать жидкую питательную среду IMC c сахарозой от 20 до 40 г/л. Использование питательной среды с 2 мг/л 2,4 D для большинства генотипов оказалось более эффективным и позволяло получить большее количество эмбриоидов, по сравнению с питательной средой содержащей 0,2 мг/л ТДЗ и со средой с 0,8 мг/л 2,4 D и 1,2 мг/л НУК. Образование эмбриоидов наблюдалось уже через 5 недель культивирования. Заключение. Нам удалось завершить полный цикл технологии получения удвоенных гаплоидов в культуре неопыленных семяпочек in vitro для 30 генотипов кабачка и получить DH-растения, которые являются ценным исходным материалом как для селекционеров, так и для генетических исследований. Оптимизация этапов технологии позволила достичь максимального результата для отдельных генотипов - 55 эмбриоидов на 100 культивируемых семяпочек.
Кабачок (cucurbita pepo l.), dh-растения, культура неопыленных семяпочек in vitro, гиногенез, гаплоид, imc (induction medium for cucurbitaceae)
Короткий адрес: https://sciup.org/140295701
IDR: 140295701 | УДК: 635.621.3:631.531.011.2:573.6 | DOI: 10.18619/2072-9146-2022-5-5-14
Текст научной статьи Оптимизация этапов технологии получения удвоенных гаплоидов кабачка (Cucurbita pepo L.) в культуре неопыленных семяпочек in vitro
Оригинальные статьи / Originalarticles УДК 635.621.3:631.531.011.2:573.6
Кабачок (Cucurbita pepo L.) относится к семейству Cucurbitaceae Juss, роду Cucurbita L. и имеет боль- шую экономическую значимость и широкое распространение во многих странах мира. В качестве овощной продукции его выращивают для получения плодов, которые достаточно быстро растут и могут быть готовы к употреблению через 5-7 дней после цветения, задолго до того, как плод достигнет своего полного размера (биологическая спелость). Кабачки могут употребляться в пищу в свежем, тушеном, жареном виде, а также в виде соков, пюре, консервов, супов. Этот популярный овощ является одним из наиболее выращиваемых тыквенных культур во всем мире, хотя трудно оценить, сколько его производится на самом деле, поскольку сельскохозяйственная статистика обычно представляет данные по общему производству всех разновидностей кабачка и тыкв [1]. Согласно последним данным Продовольственной и Сельскохозяйственной Организации Объединенных Наций за 2020 год, занимаемая площадь под тыквами и кабачками составляла 2 млн га, а урожайность – 138 тыс. ц/га. Всего же за 2020 год было собрано 27 млн т продукции. Наибольшие площади, занятые под тыквами, кабачками и патиссонами, расположены в Индии – 532 тыс. га (26,4% от мировых площадей) и Китае – 403 тыс. га (19,9%), а Россия по этому показателю находится на седьмом месте (55 тыс. га – 2,8%). Индия и Китай занимают лидирующие позиции и по собранной товарной продукции. В РФ за 2020 год урожай тыкв, кабачков и патиссонов составил 1,1 млн т (4%), что соответствует четвертому месту в мировом производстве, в то же время по показателю урожайности (204 тыс. ц/га) Россия занимает лишь 43 место [2].
Ассортимент тыквенных культур в крупнейших мировых компаниях по производству семян представлен исключительно гибридами F 1 . Помимо проявляющегося эффекта гетерозиса, производство гибридных семян позволяет защищать авторские права селекционера. Среди культур, относящихся к виду C. pepo , в Государственном реестре селекционных достижений, допущенных к использованию в Российской Федерации, гибриды составляют менее 50%, что свидетельствует об отсутствии у селекционеров возможности внедрять технологии, позволяющие быстро создавать родительские линии. Для кабачка, даже несмотря на наличие достаточно крупных цветков, с которыми легко проводить скрещивания, процесс искусственного самоопыления трудоемок ввиду особенностей культуры. У C. pepo цветки раздельнополые, и достаточно тяжело подобрать на одном растении мужские и женские цветки, раскрывшиеся одновременно.Все скрещивания необходимо проводить вручную и индивидуально изолировать каждый цветок. Для создания выровненной линии традиционными методами селекции необходимо проводить инбредные скрещивания в течение 7-10 лет. Все эти моменты обуславливают большие временные и трудовые затраты, необходимые для создания новых чистых линий.
В мировой практике технологии получения удвоенных гаплоидов (DH-технологии) широко используются в селекционных программах для увеличения выхода новых рекомбинантных и полностью гомозиготных форм, на создание которых уходит не более одного года. Культура неопыленных семяпочек in vitro (гиногенез) является одной из наиболее перспективных и востребованных биотехнологий, применяемых для овощных культур семейства Сucurbitaceae. К преимуществам этой технологии помимо качества получаемых DH-линий, относится то,что в ее основе лежит использование женского гаметофита (селекция у тыквенных культур направлена на получение линий с женским типом цветения,закреплен-ным на генетическом уровне), ее безопасность (отсутствие необходимости работы с источником излучения, как при технологии индуцированного партеногенеза in situ), и относительно низкая себестоимость получаемых гомозиготных линий за счет сокращения временных и трудовых затрат (более чем в три раза, по сравнению с традиционным селекционным процессом).
Chambonnet и Dumas de Vaulx [3] первыми получили в культуре неопыленных семяпочек in vitro гаплоидные растения кабачка. В основе этой технологии лежит культивирование на искусственных питательных средах семяпочек или фрагментов завязей, при этом гаплоидные клетки зародышевого мешка под воздействием индуцирующих факторов переходят с гаметофитного пути развития на спорофитный с образованием из них эмбриоидов (прямой эмбриогенез) или морфогенного каллуса, из которого в последующем образуется растение (непрямой эмбриогенез). На следующем этапе самопроизвольно или под воздействием определенных обработок происходит удвоение хромосом и образующийся организм в идеальном варианте приобретает диплоидный набор хромосом с гомозиготным состоянием аллелей.На процесс индукции гиногенеза влияет большое число факторов, таких как генотип растения, условия выращивания донорного растения, стадия развития женского гаметофита, состав питательной среды, стрессовые обработки, поэтому исследования по оптимизации этой технологии направлены на изучение этих факторов с целью увеличения выхода DH-растений. Известно, что селекционные фирмы используют технологию неопыленных семяпочек для получения DH-растений огурца в промышленных масштабах (US Patent 5492827) [4], для остальных тыквенных культур эти технологии еще не получили широкого распространения из-за низкого выхода удвоенных гаплоидов. На данный момент известно о разработке данной технологии в роде Cucurbita для тыквы мускатной C. moschata Duch.[5–8], тыквы крупноплодной C. maxima Duch. [9,8] и различных межвидовых гибридов [10]. Нам удалось обнаружить лишь ограниченное количество публикаций по индукции гиногенеза у кабачка [11–14].
Для создания эффективной технологии необходимо подобрать оптимальные значений многих факторов, степень влияния каждого из которых на гиногенез может существенно отличаться. Целью исследования являлось изучение факторов, влияющих на индукцию эмбриогенеза и регенерацию удвоенных гаплоидов кабачка в культуре неопыленных семяпочек in vitro и оптимизация отдельных этапов технологии.
-
1. Материалы и методы
-
1.1. Растительный материал и условия выращивания донорных растений
-
В работе использовали 30 селекционных образцов кабачка из коллекции лаборатории селекции и семеноводства тыквенных культур ФГБНУ ФНЦО, отличающиеся по окраске и форме плода.Донорные растения выращи- вали в 2019-2021 годах в Московской области в условиях пленочной теплицы и открытого грунта.
Женские бутоны, находящиеся на стадии за 1-3 суток до распускания цветка, с вечера изолировали с использованием колпачка из пергаментной бумаги и на следующий день рано утром срывали.
Сбор бутонов производили с середины июля до середины сентября.
-
1.2. Cтерилизация эксплантов
С женских бутонов удаляли околоцветник и промывали под струей водопроводной воды с коммерческим моющим средством «АОС» в течение двух минут, после чего переносили в ламинарный бокс.
Поверхностную стерилизацию проводили двумя способами:
-
1) в ламинарном боксе завязи опускали на 30 секунд в 96% этанол, затем переносили на 15 минут в 50% водный раствор коммерческого препарата «Белизна» (содержит 10% гипохлорит натрия) с добавлением Твина-20 (1 капля на 100 мл), с последующим трехкратным промыванием в течение 10 минут в стерильной дистиллированной воде. Простерилизованные завязи помещали на стерильную влажную фильтровальную бумагу и сохраняли в стерильных условиях в стеклянных чашках Петри диаметром 10 см.
-
2) в ламинарном боксе завязь пинцетом опускали на 510 секунд в стаканчик с 96% этанолом, после чего вынимали из раствора и быстро поджигали в пламени горелки до выгорания находящегося на поверхности спирта (эту манипуляцию можно было проводить 2 раза). Стерилизовать завязи можно непосредственно перед выделением из них семяпочек.
-
1.3. Культура неопыленных семяпочек in vitro
После стерилизации завязи разрезали скальпелем и выделяли семяпочки с помощью препаровальных игл под стереомикроскопом Stemi 305 (Carl Zeiss Microscopy GmbH, Germany) при 10* увеличении в ламинарном боксе. Изолированные семяпочки без признаков повреждения помещали на поверхность агаризованной индукционной питательной среды в стерильные чашки Петри диаметром 94*16 мм (Greiner Bio-One GmbH, Frickenhausen, Германия) или стеклянные баночки объёмом 100 мл, закрытые пластиковыми крышками Magenta™ B-cap (кат. Номер B8648, Magenta Corporation, Chicago, USA).
Для индукции гиногенеза использовали питательную среду IМС (Induction Medium for Cucurbitaceae – разработана в лаборатории биотехнологии ФГБНУ ФНЦО (ВНИ-ИССОК)). Состав питательной среды представлен минеральной основой (макросоли и микросоли) питательной среды МСм [15] с уменьшенным в два раза содержанием NH 4 NO 3 , дополненную аминокислотами (100 мг/л пролина, 100 мг/л серина, 800 мг/л глутамина), витаминами из прописи среды NLN [16]. В качестве источника углевода использовалась сахароза 30 г/л (для всех опытов, кроме опыта по изучению влияния концентрации сахарозы на индукцию гиногенного развития, где использовалась сахароза в концентрации 20 г/л, 40 г/л, 60 г/л, 80 г/л).
После подведения PH до 5,8 (0.1М раствором NaOH) в питательную среду добавляли 7 г/л агара и стерилизовали автоклавированием при 121oC, 90 kPa в течение 25
минут. При приготовлении питательной среды после ее остывания до 50…60oC в нее добавляли 100 мг/л ампициллина и регуляторы роста:
-
1) 2,4 D – 2 мг/л
-
2) ТDZ – 0,2 мг/л
-
3) 2,4 D – 0,8 мг/л + НУК – 1,2 мг/л.
Для приготовления питательных сред использовали реактивы марки «протестировано для культуры клеток» (Sigma) и сверхчистая вода (Type 1, 18.2 MΩ*cm), полученная с помощью установки для очистки воды Simplicity® UV Water Purification System (Merck KGaA, Darmstadt, Germany).
Культивирование проводили на стеллажах со смешанным освещением люминесцентными лампами двух типов: OSRAM Fluora L36W/77 (с преобладанием синего и красного спектра) и Philips 36W/54-765 (с преобладанием белого спектра), при общей освещенности 2500 люкс, фотопериоде 16 часов – день и 8 часов – ночь при температуре 25°С круглосуточно.
-
1.4. Опыт по влиянию различных концентраций сахарозы на индукцию гиногенеза у кабачка
Эксперимент проводился на генотипах кабачка: Gold Rush F 1 и селекционной линии 228 (получена из сорта Русские Спагетти). Выделенные семяпочки культивировали в одноразовых чашках Петри диаметром 6 см на жидкой питательной среде IМС с 100 мг/л ампициллина и 0,2 мг/л ТДЗ. В опытах использовали разные концентрации сахарозы: 2%, 4%, 6%, 8%. Каждый вариант опыта проводили в 3 повторностях по 20 семяпочек на чашку Петри.
-
1.5. Цитологические наблюдения за развитием семяпочек в культуре in vitro и развитием эмбриои-дов/каллуса
Изучение процесса гиногенеза в культуре неопылен-ных семяпочек проводили каждые 3-7 суток в течение 1,52 месяцев с использованием инвертированного стереомикроскопа Stemi 508 с камерой Axiocam 305 color (Carl Zeiss Microscopy GmbH, Germany).
-
1.6. Получение растений-регенерантов
Нормально развитые образовавшиеся эмбриоиды переносили на безгормональную среду MС [17] с 2% сахарозой и 3 г/л фитогеля.
Плохо развивающиеся эмбриоподобные структуры переносили на регенерационную среду СВМ [18] с 2% сахарозой, 3 г/л фитогеля, 0,2 мг/л НУК, 0,1 мг/л ГК, 0,8 мг/л БАП и 100 мг/л ампициллина, а через 3 недели, после формирования точек роста и нормально развитых побегов для укоренения помещали на безгормональную среду MС с 2% сахарозой и 3 г/л фитогеля. Культивирование проводили на стеллажах со смешанным освещением люминесцентными лампами при тех же условиях, что и для индукции гиногенеза.
-
1.7 Адаптация к условиям ex vitro и выращивание растений-регенерантов
Растения с нормально развитыми листьями и корневой системой переносили в вегетационные сосуды 0,5/1 литр, заполненные смесью торфа и перлита (7:3), накрывали перфорированными пластиковыми стаканчиками для адаптации растений к условиям ex vitro. После появления двух новых листьев стаканчик удаляли.
Растения выращивали в вегетационной камере с лампами досвечивания (Osram plantstar 600 W) при постоянном температурном режиме 25°С, освещенности 8000 люкс и 16ч/8ч- фотопериоде.
Еженедельно проводили подкормку раствором коммерческого комплексного водорастворимого удобрения «Акварин» 1,5-2,0 г/л для стимуляции цветения.
По мере роста растения проводили пересадки в горшки большего обьема (5 л, 8 л). С мая по июль хорошо развитые растения пересаживались в летние пленочные теплицы для оценки по морфологическим признакам и проведения скрещиваний.
-
1.8 Исследование плоидности растений с использованием проточной цитометрии клеточных ядер
Плоидность регенерированных растений определяли методом проточной цитометрии клеточных ядер. Ее проводили на базе биоинженерной лаборатории Алтайского государственного университета в Барнауле с использованием проточного цитометра Partec CyFlow PA (Partec GmbH, Германия) с источником лазерного излучения с длиной волны 532 нм и в ФГБНУ ФНЦО при помощи проточного цитометра CytoFlex в комплектации B2-RO-V2 (Beckman Coulter, USA). Диплоидные (2n=2x=40) растения кабачка использовали в качестве внешних стандартов для определения плоидности. Визуализацию и обработку гистограмм проводили в программном обеспечении Flowing Software 2.5.1. (University of Turku, Finland). Статистические данные рассчитывали в программа XLStat (Addinsoft).
-
1.9 Статистический анализ
Обработку экспериментальных данных проводили с использованием общепринятых математико-статистических методов с использованием пакета прикладных программ M icrosoft Excel 2010 для Windows 10 и Statistika 7.0.
-
2. Результаты и обсуждение
-
2.1 Определение оптимальной стадии развития женского гаметофита для индукции гиногенеза
Правильная идентификация оптимальной стадии развития женского гаметофита для введения в культуру in vitro является одним из важнейших факторов, влияющих на индукцию гиногенеза. Для кабачка характерны женские цветки с ценокарпным гинецеем (пара-карпный тип), состоящим обычно из трех плодолисти-ков,образующих нижнюю завязь,в которой семяпочки располагаются рядами.Зародышевый мешок моноспо-рический, трехмитозный, биполярный, образуется по Polygonium-типу. Мегаспорогенез или первые этапы мегагаметогенеза начинаются за 3-4 дня до распускания цветка.Зародышевый мешок полностью созревает и готов к оплодотворению через несколько часов после раскрытия цветка.В большинстве исследований показано, что оптимальной стадией для введения в культуру in vitro у видов семейства Cucurbitaceae является почти зрелый, либо полностью зрелый зародышевый мешок. Gémes Juhász et al. (2002), проводившие исследования по идентификации оптимальной стадии развития женского гаметофита для индукции гиногенеза огурца, считают, что оптимальным является время за 6 часов до распускания цветка. Цитологические наблюдения показали,что в это время зародышевый мешок обычно восьмиядерный, хотя иногда встречаются и четырехядерные мешки [18]. У кабачка цветки обычно распускаются до 10 часов дня и, следовательно, период за шесть часов до распускания цветка это очень раннее утро, поэтому необходимо определить возможно ли заранее срывать цветок или можно выделять семяпочки из завязей уже полностью распустившихся цветков.
-
Удобно для описания фазы раскрытия цветка использовать такой показатель, как количество дней до распускания цветка.Селекционеры,работающие с кабачком, легко определяют фазу, ориентируясь на
Таблица 1. Влияние фазы развития цветка на индукцию гиногенного развития Table 1. Influence of flower development phase on induction of gynogenic development
|
Генотип (factor A) |
Стадия развития бутона (factor B) |
Эмбриоидов, шт./на чашку Петри |
Индуцированных семяпочек, % |
Two-way ANOVA factors/ factor effect, % |
|
FL-2 |
0c |
0c |
||
|
Gold Rush F 1 |
FL-1 |
1.1b |
4.4b |
factor A ** /2.6 |
|
FL |
4.3a |
17.3a |
factor B ***/81.3 |
|
|
FL-2 |
0b |
0b |
factor A x factor B */2.6 error / 13.5 |
|
|
Камили F 1 |
FL-1 |
0.67b |
2.68b |
|
|
FL |
3.0a |
12.0a |
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого опыта. Для каждого генотипа использовался однофакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием критерия множественных диапазонов Duncan (DMRT). Значения, отмеченные одинаковой буквой, не имели достоверных различий при p ≤ 0.05.
* значимо на уровне 0.05, ** значимо на уровне 0.01, *** значимо на уровне 0.001
В одну чашку Петри диаметром 9,4 см высаживалось 25 семяпочек.
Полностью раскрывшийся цветок (FL), 1 сутки до распускания (FL-1), 2 суток (FL-2).
Note: The values presented are averages for three independent experiments with three replicates within each experiment. Within each genotype, one-way ANOVA was used and average values were compared using Duncan multiple range test (DMRT). Values marked with the same letter had no significant difference at p ≤ 0.05.
* significant at 0.05 level, **significant at 0.01 level, *** significant at 0.001 level, NS = not significant
Twenty-five ovules were planted in a single Petri dish 9.4 cm in diameter.
Fully opened flower (FL), 1 day before flowering (FL-1), 2 days (FL-2).

Рис. 1. Внешний вид женских бутонов кабачка Gold Rush F 1 за двое суток до раскрытия бутона – FL-2 (А.),за 1 сутки до раскрытия бутона – FL-1 (B),в день раскрытия бутона FL (С),масштабная линейка 1 см
Fig. 1. Appearance offemale buds ofSunnyDelightF1 squash two days before bud opening – FL-2 (A.),1 daybefore bud opening – FL-1 (B),on the dayofbud opening – FL (C); Bar=1 cm цвет околоцветника (рис 1.). Проведенные нами на двух генотипах эксперименты с бутонами разной степени раскрытия цветка (2 суток (FL-2), 1 сутки до распускания (FL-1) и полностью раскрывшийся цветок (FL)) показали, что оптимальным для кабачка будет предварительно заизолированный с вечера,сорванный утром раскрывшийся бутон (табл. 1). Для генотипа Gold Rush F1 и Камили F1 было получено 17,3% и 12,0% индуцированных семяпочек из бутонов в стадии FL.
Впоследствии из этих индуцированных семяпочек развились эмбриоиды.В четыре раза меньше эмбриоидов было получено из бутонов на стадии (FL-1) и полное отсутствие гиногенного развития наблюдалось при введении в культуру бутонов на стадии FL-2. Именно из бутонов на стадии FL, содержащих семяпочки с зрелым зародышевым мешком, были получены эмбриоиды у 30 изученных генотипов в дальнейших экспериментах.
В опубликованной литературе по получению удвоенных гаплоидов в культуре неопыленных семяпочек огурца и тыквы также оптимальными для введения в культуру были полураскрывшиеся бутоны или цветки в утренние часы [13,19,14]. Однако в работе Chambonnet D, Dumas De Vaulx R (1986) наилучшие результаты были получены с семяпочками, извлеченными из цветков кабачка на стадии FL-1 (за день до начала распускания цветка), где удалось получить до 4,3 эмбриодов на 100 культивированных семяпочек, в то время как за 2 суток и в день раскрытия цветка количество полученных эмбриоидов снижалось и составило 2,8 и 1,2 эмбриоида соответственно [3].
Стерилизация завязи методом обжигания
На первом этапе работы необходимо было добиться получения хорошо растущей стерильной культуры. Ранее мы использовали режим ступенчатой поверхностной стерилизации c использованием 96% этанола и 50% водного раствора коммерческого препарата «Белизна» (содержит 5-15% гипохлорит натрия), который оказался одинаково эффективным для всех образцов культур семейства Cucurbitaceae , и в сочетании с добавлением в питательную среду ампициллина в концентрации 200 мг/л обеспечивал 100% выход неинфи-цированных жизнеспособных эксплантов. Использование данного режима стерилизации позволяло не только избавиться от контаминации,но и размягчить стенки завязи, обеспечивая более удобное
Таблица 2. Влияние типа стерилизации на индукцию гиногенеза и контаминацию Table 2. Effect of sterilization type on gynogenesis induction and contamination
Тип стерилизации (фактор В)
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого. Использовался однофакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием критерия множественных диапазонов Duncan (DMRT). Значения, отмеченные одинаковой буквой, не имели достоверных различий при p ≤ 0.05.
-
* значимо на уровне 0.05, ** значимо на уровне 0.01, *** значимо на уровне 0.001, NS = не значимо
В одну чашку Петри диаметром 9,4 см высаживали 25 семяпочек; с.о. – селекционный образец.
Note: The values presented are averages for three independent experiments with three replicates within each experiment. Within each genotype, one-way ANOVA was used and average values were compared using Duncan multiple range test (DMRT). Values marked with the same letter had no significant difference at p ≤ 0.05.
-
* significant at 0.05 level, **significant at 0.01 level, *** significant at 0.001 level, NS = not significant
Twenty-five ovules were planted in a single Petri dish 9.4 cm in diameter; с.о. – breeding accession.
извлечение семяпочек [19]. К недостатку этого способа относится длительность этого этапа по времени и то, что поскольку выделение семяпочек из завязи кабачка занимает достаточно продолжительное время (25 семяпочек – 1 чашка Петри – 30 минут), очень часто заранее простерилизованные завязи (стерилизуют сразу несколько завязей,чтоб экономить время и реактивы)в течение рабочего дня хранятся в ламинарном боксе и начинают темнеть,что в последствии может оказывать влияние на индукцию гиногенеза при закладке обширных опытов.
Нами был оптимизирован этап стерилизации завязей кабачка и предложен вариант краткосрочного обжигания после обработки 96% спиртом.Это позволило сократить временные затраты с 50 минут (при использовании ступенчатой стерилизации с использованием 5% раствора гипохлорита натрия) до одной минуты для получения эксплантов со 100% отсутствием контаминации и без потери эмбриогенного потенциала семяпочек (табл. 2).
В литературе возможность использовать метод обжигания встречается в работах по получению удвоенных гаплоидов при использовании технологии индуцированного партеногенеза (опыление облученной пыльцой in situ ) и спасения зародышей у арбуза. Предлагается в ламинарном боксе помещать плоды в поддон из нержавеющей стали, опрыскивать 95 % спиртом из пульверизатора и затем поджигать. При этом в исследовании подчеркивается, что использовать обжигание можно на плодах возрастом 3-4 недели, то есть имеющих уже достаточно прочную кожуру [20]. Только в одной публикации нам встретилось упоминание о возможности стерилизации завязей кабачка краткосрочным обжиганием после смачивания в 95% спирте [3], но этот метод не получил широкого распространения. В большинстве работ используют стерилизацию в течение 60 с в 70% этаноле, затем 20 мин в 5,2% растворе гипохлорита натрия с 2-3 каплями Tween-20 [11–13], либо опускают завязи на 60 с в 70% этанол [10], с последующем асептическим промыванием три раза стерильной дистиллированной водой.
Предложенный нами метод стерилизации позволяет значительно сократить временные затраты и вводить в стерильную культуру завязи непосредственно перед использованием, без длительного хранения в просте-рилизованном виде.
Оптимальный состав питательной среды для получения удвоенных гаплоидов в культуре неопы-ленных семяпочек in vitro .
Оптимальный состав питательной среды определяет успех технологии получения удвоенных гаплои-дов.Обычно в технологии выделяют две питательные среды – индукционная питательная среда и регенерационная питательная среда. Иногда еще используется промежуточная среда – среда для созревания эмбриоидов [21]. Наиболее часто варьирующими компонентами питательных сред являются: (1) источник органического азота, (2) углеводы и (3) регуляторы роста.Традиционно для индукции процесса гиногенеза при культивировании семяпочек C. pepo используют питательную среду MS [11,12,10,22], или индукционную питательную среду СВМ (C ucumber Basal Medium), специально разработанную для огурца [18]. В лаборатории биотехнологии ФГБНУ ФНЦО была разработана новая питательная среда IМС (Induction M edium for C ucurbitaceae), успешно использующаяся для тыквенных культур [13,14]. Состав этой питательной среды значительно отличается от среды СВМ и MS. Эта среда содержит повышенное содержание KNO 3 (2496,3 мг/л), увеличенное содержание никотиновой кислоты (5 mg/l) и обогащенный аминокислотный состав. В предварительно проведенных нами экспериментах по тестированию наиболее часто используемых питательных сред (MS, C BM , IM C ) для индукции гиногенеза в культуре неопыленных семяпочек для кабачка наилучшие результаты были получены на питательной среде IM C , именно поэтому мы ее использовали в последующих экспериментах.
В качестве источника углеводов в питательные среды добавляют сахарозу. В культуральных средах сахароза обычно гидролизуется полностью или частично на составляющие моносахариды – глюкозу и фруктозу под действием инвертазы,расположенной в клеточных стенках растений, либо путем высвобождения внеклеточного фермента.Концентрация сахарозы играет важную роль в культуре неопыленных семяпочек in vitro поскольку обеспечивает определенное осмотическое давление в питательной среде [23,12]. Особенно сильно влияние сахарозы при использовании жидких питательных сред.Нами была
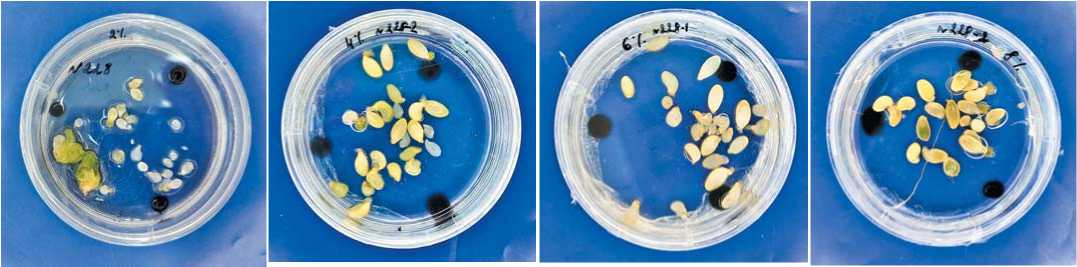
Рис. 2. Изучение влияния концентрации сахарозы в жидкой питательной среде IМС с 0.2 мг/л ТДЗ на индукцию эмбриогенеза у с.о. 228 (45 суток культивирования)
А – сахароза 20 г/л; B – сахароза 40 г/л; C – сахароза 60 г/л; D – сахароза 80 г/л.
Fig. 2. Study of the effect of sucrose concentration in liquid IMS nutrient medium with 0.2 mg/L TDZ on the induction of embryogenesis in s.o. 228 (45 days of cultivation)
заложена серия экспериментов с использованием различной концентрации сахарозы (20 г/л, 40 г/л, 60 г/л, 80 г/л) при использовании агаризованной (7 г/л агара) и жидкой питательной среды IМС с 0.2 мг/л ТДЗ на двух генотипах Gold Rush F 1 и с.о 228.
Впервые была показана возможность использования жидкой питательной среды для индукции гиногенеза в культуре неопыленных семяпочек кабачка (рис. 2). Было отмечено образование эмбриоидов уже через 45 суток культивирования. При увеличении концентрации сахарозы в питательной среде наблюдалась разница в увеличении размеров культивируемых семяпочек уже после первой недели культивирования (семяпочки на питательной среде с сахарозой 20 г/л были в 1,6 раза
Таблица 3. Образование эмбриоидов на индукционных питательных средах с различными регуляторами роста Table 3. Embryoid formation on induction nutrient media with different growth regulators
|
Генотип Эмбриоидов/ на чашку Петри, шт |
Эмбриоидов/на чашку Петри, шт. |
||
|
среда IMC 2 мг/л 2,4 D |
среда IMC 0.2 мг/л TDZ |
среда IMC 0,8 мг/л 2,4 D и 1,2 мг/л НУК |
|
|
Gold Rush F1 |
13.7a |
4.7b |
0c |
|
c.o 228 |
13.3a |
2.0b |
0c |
|
Фараон |
6.3a |
0.7b |
0c |
|
Камили F1 |
2.3a |
0.3b |
0c |
|
c.o 125 |
2.0a |
0.3b |
0c |
|
c.o 1 |
0.7a |
1.3a |
0c |
|
c.o 92 |
0.3a |
1.0a |
0b |
|
c.o 278 |
0.3b |
3.7a |
0b |
|
c.o 35 |
0b |
0.7b |
1.0a |
|
c.o 51 |
4.7a |
0b |
0b |
|
Ролик |
1.7a |
0b |
0b |
|
c.o 38 |
0.7a |
0a |
0a |
|
Грибовский 37 |
1.3a |
0b |
0b |
|
Якорь |
0.3a |
0a |
0a |
|
c.o 263 |
0.3a |
0a |
0a |
|
c.o 549 |
0.7a |
0a |
0a |
|
c.o 564 |
0.7a |
0a |
0a |
|
c.o 556 |
0.7a |
0a |
0a |
|
Уголек |
0a |
0.7a |
0a |
|
c.o 566 |
0a |
0.7a |
0a |
|
c.o 62 |
0a |
0.3a |
0a |
|
c.o 283 |
0a |
0.3a |
0a |
|
c.o 285 |
0a |
0.7a |
0a |
|
Цукеша |
0b |
1.0a |
0a |
|
c.o 279 |
0a |
0.3a |
0a |
|
Погребок |
0b |
4.0a |
0b |
|
c.o 50 |
0a |
0a |
0.7a |
|
Ясмин |
0b |
0b |
9.0a |
|
c.o 550 |
0b |
0b |
2.3a |
|
c.o 541 |
0a |
0a |
0.7a |
Примечание: представленные значения являются средними для трех независимых экспериментов с тремя повторами внутри каждого. Использовался однофакторный дисперсионный анализ (ANOVA), а средние значения сравнивались с использованием критерия множественных диапазонов Duncan (DMRT). Значения, отмеченные одинаковой буквой, не имели достоверных различий при p ≤ 0.05.
В одну чашку Петри диаметром 9,4 см высаживалось 25 семяпочек. с.о. –селекционный образец
Note: The values presented are averages for three independent experiments with three replicates within each experiment. Within each genotype, one-way ANOVA was used and average values were compared using Duncan multiple range test (DMRT). Values marked with the same letter had no significant difference at p ≤ 0.05. Twenty-five ovules were planted in a single Petri dish 9.4 cm in diameter; с.о. – breeding accession
меньше, чем на питательной среде с сахарозой 80 г/л).
Вне зависимости от консистенции питательной среды эмбриоиды были получены только на питательных средах с концентрацией сахарозы 20 г/л и 40 г/л.
Проведенные эксперименты подтвердили полученные ранее нами данные для агаризованных питательных сред, что для индукции эмбриогенеза в культуре неопыленных семяпочек в семействе Cucurbitaceae оптимально использовать питательные среды с концентрацией сахарозы около 30 г/л. Также было показано, что увеличение концентрации сахарозы до 40 г/л не приводило к увеличению индукции у культивируемых семяпочек. При культивировании уже индуцированных семяпочек на среде с повышенной сахарозой (40 г/л) чаще наблюдалось образование аномальных эмбриоидов [14]. Kwack и Fujieda [5] также показали, что самый высокий процент семяпочек тыквы мускатной, образующих зародыши, возникает при концентрации сахарозы 30 г/л, в то время как более низкая (10 г/л) или более высокая (60 или 100 г/л) концентрация приводит к отсутствию эмбриогенеза или к его низкой частоте. На кабачке, по мере увеличения концентрации сахарозы (30, 60 и 90 г/л), процент семяпочек, образующих эмбриоиды, снижается; семяпочки, выращенные на среде MS, содержащей 30 г/л сахарозы, дают наилучшие результаты, в то время как семяпочки,выращенные на среде,дополнен-ной 90 г/л сахарозы, вообще не образуют эмбриоидов [12]. В тоже время другие исследователи предпочитают с 0,2 мг/л ТДЗ и на среде с 0,8 мг/л 2,4 D и 1,2 мг/л НУК появляются через 6-7 недель.
Для девяти генотипов образование эмбриоидов происходило только на среде с добавлением 2 мг/л 2,4 Д; для восьми генотипов – на среде с 0,2 мг/л TDZ; для четырех – на среде с 0,8 мг/л 2,4 D и 1,2 мг/л НУК; восемь генотипов отзывались как на питательной среде с 2 мг/л 2,4 Д, так и с 0,2 мг/л TDZ, а один генотип – на среде с 0,2 мг/л TDZ и на среде с 0,8 мг/л 2,4 D и 1,2 мг/л НУК.
Использование питательной среды с 2 мг/л 2,4 D для большинства генотипов оказалось более эффективным и позволяло получить большее количество эмбриоидов, по сравнению с питательной средой, содержащей 0,2 мг/л ТДЗ, и со средой с 0,8 мг/л 2,4 D и 1,2 мг/л НУК.
Проведенный двухфакторый дисперсионный анализ показал, что и фактор генотипа и фактор использующихся регуляторов роста, а также взаимодействие этих факторов оказывают существенное влияние на выход эмбриоидов. При этом доля влияния фактора генотипа на количество образовавшихся эмбриоидов оказалась 31%, фактора применяемых регуляторов роста – 5%, а их взаимодействие – 57%. При этом доля неучтенных факторов, влияющих на количество эмбриоидов, составила 7%. (рис. 3). Большая доля влияния взаимодействия фактора генотипа и фактора использующихся регуляторов роста свидетельствует о том, что для каждого генотипа необходимо тестировать несколько вариантов питательных сред
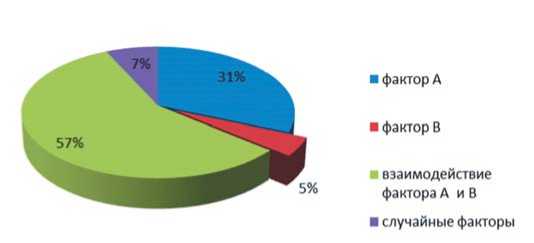
Рис. 3. Доля влияния генотипа (фактора А) и различных регуляторов роста в составе питательной среды (фактор В) и их взаимодействия на выход эмбриоидов в культуре неопыленных семяпочек in vitro
Fig. 3. Proportion ofthe effectofgenotype (factorA) and differentgrowth regulators in nutrientmedia (factorB) and theirinteraction on embryoid yield in an unpollinated ovule culture in vitro
использовать повышенные концентрации сахарозы – 40 г/л [18] или пониженные 20 г/л [22].
Для индукции эмбриогенеза в культуральные среды необходимо добавлять регуляторы роста. В эксперименте по изучению влияния наиболее часто использующихся регуляторов роста (2 мг/л 2,4 Д; 0,2 мг/л ТДЗ; 0,8 мг/л 2,4 D и 1,2 мг/л НУК) минерально-витаминный состав среды был выбран IMC дополненный сахарозой 30 г/л и агаром 7 г/л. Исследование было проведено на 30 генотипах. Была отмечена различная генотип-специфическая реакция на использующиеся в питательной среде регуляторы роста. Несмотря на разный тип использующихся регуляторов роста (2.4Д и НУК относятся к ауксинам, а ТДЗ к цитокининам) и их различающуюся концентрацию, на всех трех вариантах были получены эмбриоиды. Было отмечено, что первые эмбриоиды на среде с 2 мг/л 2,4Д появлялись через 5 недель культивирования, а на среде
Был оптимизирован этап регенерации и укоренения побегов. Нормально развитые образовавшиеся эмбриоиды переносили на безгормональную среду MS с 2% сахарозой и 3 г/л фитогеля. Для плохо развивающихся эмбриоидов необходимо было добавление в питательную среду ампициллина (100 мг/л) и регуляторов роста (НУК 0.2 мг/л, ГК 0,1 мг/л, БАП 0,8 мг/л) для индуцирования дополнительных точек роста. Поскольку у C. pepo цветки раздельнополые, сохраняющие возможность к опылению только 5 часов, и достаточно тяжело подобрать мужские и женские цветки одного возраста для самоопыления,в связи с этим можно рекомендовать на этапе регенерации проводить клональное микроразмножение, чтобы получить как можно больше растений одного генотипа для проведения последующих скрещиваний.
После оптимизации отдельных этапов технологии удалось достичь максимального выхода эмбриоидов у

Рис. 4. Этапы технологии получения DH-растений Cucurbita pepoL. в культуре неопыленных семяпочек in vitro
A – внешний вид женского цветка кабачка за 1 сутки до распускания; B – изоляция женского цветка колпачком из пергаментной бумаги; C – стерилизация завязи методом краткосрочного обжигания; D – выделение неопыленных семяпочек на индукционную питательную среду IMC; E – образование эмбриоидов на 35-60 сутки культивирования; F – эмбриоид, готовый к пересадке на регенерационную питательную среду MS; G – регенерация проростка из эмбриоида (на этой стадии возможно микроклональное размножение); H,I– адаптация растений-регенерантов к условиям ex vitro; J – высадка растений-регенерантов R0 в пленочную теплицу; K – инбредные скрещивания растений-регенерантов R0; L – развитие плода до фазы биологической спелости; M – Плод с семенами от самоопыления,оценка внутреннего строения плода; N – DH-линия на следующий вегетационный год
Fig. 4. Stages ofDH-production technologyofCucurbita pepoL. plants in non-pollinated seedpod culture in vitro
A – appearance offemale summersquash flower1 daybefore flowering; B – isolation offemale flowerbycap ofparchmentpaper; C – sterilization ofovarybyshortburning; D – isolation ofunpollinated ovules on IMC induction nutrientmedium; E – formation ofembryoids on 35-60 days ofcultivation; F – embryoid,readyfortransfertoMS regeneration nutrientmedium; G – regeneration ofseedling from embryoid (microclonalmultiplication is possible atthis stage); H,I-adaptation ofregenerantplants to ex vitro conditions; J – planting of R0 regenerantplants in film greenhouse; K – inbreeding ofR0 regenerantplants; L – fruitdevelopmenttothe phase ofbiological ripeness; M – Fruitwith seeds from self-pollination,evaluation ofinternalstructure offruit; N – DH line forthe nextgrowing year
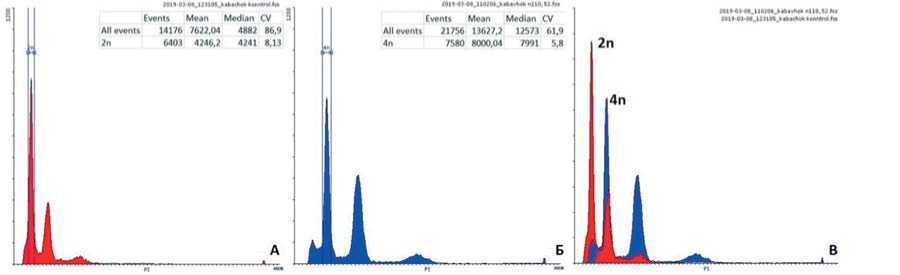
Рис. 5. Примеры гистограмм образцов кабачка. Внешняя стандартизация – образцы исследовали по отдельности,без изменений настроек цитометра. А – контрольный диплоидный образец кабачка (2n=2x=40); Б – тетраплоидный регенерант (2n=4x=80); В – объединенная гистограмма контрольного диплоидного образца кабачка и тетраплоидного образца. Mean – средние значения пиков. Median – медиана пика. CV – коэффициент вариации пика. Events – количество событий. Fig. 5. Examples ofhistograms ofsummersquash samples. Externalstandardization - samples were examined separatelywithout changing cytometersettings. A – controldiploid summersquash sample (2n=2x=40); B – tetraploid regenerant (2n=4x=80); C – Combined histogram ofcontroldiploid summersquash sample and tetraploid sample. Mean – mean values ofthe peaks. CV – coeffi-cientofvariation ofthe peak отдельных генотипов кабачка – 13,7 эмбриоидов на чашку Петри, содержащую 25 семяпочек, что в пересчете на 100 культивируемых семяпочек составит до 55 штук (рис. 4).
Анализ растений-регенерантов с использованием проточной цитометрии клеточных ядер
Было проведено изучение полученного потомства R0 (полученные гомозиготные линии) по уровню плоид-ности с использованием проточной цитометрии клеточных ядер (рис. 5). Среди проанализированных 108 растений-регенерантов кабачка, успешно прошедших этап адаптации, было определено: диплоидов – 32,35%, триплоидов — 26,47%, тетраплоидов – 33,82%, октаплоидов – 4,41% , анеуплоидов — 2,94%.
Гаплоидные растения были обнаружены только в культуре in vitro , а среди высаженных в теплицу растений они отсутствовали, что объяснялось их потерей на этапе регенерации,как наименее жизнеспособных.
Заключение
Нам удалось завершить полный цикл технологии получения удвоенных гаплоидов в культуре неопылен-ных семяпочек in vitro для 30 генотипов кабачка и получить DH-растения, которые являются ценным исходным материалом как для селекционеров, так и для генетических исследований.Оптимизация отдельных этапов технологии позволила достичь максимального результата для отдельных генотипов – 55 эмбриоидов на 100 культивируемых семяпочек.
Об авторах:
Alexey S. Ermolaev – Junior Researcher of Laboratory of Reproductive
Biotechnology in Crop Breeding, ,
Elena A. Domblides – Cand. Sci. (Agriculture), Head of Laboratory of Reproductive Biotechnology in Crop Breeding, ,
Список литературы Оптимизация этапов технологии получения удвоенных гаплоидов кабачка (Cucurbita pepo L.) в культуре неопыленных семяпочек in vitro
- Paris H.S., Lust T.A. Origin of the Zucchini Squash, Cucurbita Pepo Subsp. Pepo Zucchini Group. Acta Hortic. 2020;(1294):1-8. https://doi.org/10.17660/ActaHortic.2020.1294.1.
- FAOSTAT. [Access: 22 May 2022]. Available from: https://www.fao.org.
- Chambonnet D, Vaulx RDD. Obtention of Embryos and Plants from in Vitro Culture of Unfertilized Ovules of Cucurbita Pepo. Cucurbit Genet Coop. 1985;(8):66.
- Dirks R. Patent Number: 5,492,827. 1996.
- Kwack S.N., Fujieda K. Somatic Embryogenesis in Cultured Unfertilized Ovules of Cucurbita Moschata. Journal of the Japanese Society for Horticultural Science. 1988;57(1):34-42. https://doi.org/10.2503/jjshs.57.34.
- Sun S., Zhai Q., Hu J., Chen J., Zhang P. Effects of Several Physiological Factors on Embryo Formation in Unpollinated Ovary Culture of Pumpkin. Plant Physiology Communications. 2009;45(10):977-80.
- Min Z., Li H., Zou T., Tong L., Cheng J., Sun X. Studies of in Vitro Culture and Plant Regeneration of Unfertilized Ovary of Pumpkin. Chinese Bulletin of Botany. 2016;51(1):74.
- Kurtar E.S., Balkaya A., Ozbakir Ozer M. Production of Callus Mediated Gynogenic Haploids in Winter Squash (Cucurbita maxima Duch.) and Pumpkin (Cucurbita moschata Duch.). Czech J Genet Plant Breed. 2018;54(1):9-16. https://doi.org/10.17221/30/2017-CJGPB.
- Shmykova N., Domblides E., Vjurtts T., Domblides A.. Haploid Embryogenesis in Isolated Microspore Culture of Carrots (Daucus carota L.). Life. 2021;11(1):20. https://doi.org/10.3390/life11010020.
- Rakha M.T., Metwally E.I., Moustafa S.A., Etman A.A., Dewir Y.H. Evaluation of Regenerated Strains from Six’Cucurbita’interspecific Hybrids Obtained through Anther and Ovule ’in Vitro’ cultures. Australian Journal of Crop Science. 2012;6(1):23-30.
- Metwally E.I., Moustafa S.A., El-Sawy B.I., Haroun S.A., Shalaby T.A. Production of Haploid Plants from in Vitro Culture of Unpollinated Ovules of Cucurbita Pepo. Plant cell, tissue and organ culture. 1998;52(3):117-21.
- Shalaby T.A. Factors Affecting Haploid Induction through in Vitro Gynogenesis in Summer Squash (Cucurbita pepo L.). Scientia Horticulturae. 2007;115(1):1-6. https://doi.org/10.1016/j.scienta.2007.07.008.
- Shmykova N.A., Khimich G.A., Korotseva I.B., Domblides E.A. Prospective of development of doubled haploid plants of Cucurbitaceae family. Vegetable crops of Russia. 2015;(3-4):28-31. (In Russ.) https://doi.org/10.18619/2072-9146-2015-3-4-28-31.
- Domblides E, Shmykova N, Khimich G, Korotseva I, Kan L, Domblides A, et al. Production of Doubled Haploid Plants of Cucurbitaceae Family Crops through Unpollinated Ovule Culture in vitro. Acta Hortic. 2020;(1294):19-28. https://doi.org/10.17660/ActaHortic.2020.1294.4.
- Masuda K., Kikuta Y., Okazawa Y. A Revision of the Medium for Somatic Embryogenesis in Carrot Suspension Culture. Journal of the Faculty of Agriculture, Hokkaido University. 1981;60(3):183-93.
- Lichter R. Induction of Haploid Plants From Isolated Pollen of Brassica Napus. Zeitschrift für Pflanzenphysiologie. 1982;105(5):427-34. https://doi.org/10.1016/s0044-328x(82)80040-8.
- Murashige T, Skoog F. A Revised Medium for Rapid Growth and Bio-Assays with Tobacco Tissue Cultures. Physiol Plant. 1962;15:437-97. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x.
- Gémes-Juhász A., Balogh P., Ferenczy A., Kristóf Z. Effect of Optimal Stage of Female Gametophyte and Heat Treatment on in Vitro Gynogenesis Induction in Cucumber (Cucumis sativus L.). Plant Cell Reports. 2002;21(2):105-11. https://doi.org/10.1007/s00299-002-0482-8.
- Domblides E.A., Shmykova N.A., Belov S.N., Korottseva I.B., Soldatenko A.V. DH-plant production in culture of unpollinated ovules of cucumber (Cucumis sativus L.). Vegetable crops of Russia. 2019;(6):3-9. (In Russ.) https://doi.org/10.18619/2072-9146-2019-6-3-9
- Sari N., Solmaz I. Doubled Haploid Production in Watermelon. In: Segui-Simarro JM, editor. Doubled Haploid Technology: Volume 3: Emerging Tools, Cucurbits, Trees, Other Species. New York, NY: Springer US; 2021. p. 97-110 https://doi.org/10.1007/978-1-0716-1331-3_6.
- Zou T., Su H.N., Wu Q., Sun X.W. Haploid Induction via Unfertilized Ovary Culture in Watermelon. Plant Cell, Tissue and Organ Culture. 2018;135(2):179-87. https://doi.org/10.1007/s11240-018-1454-1.
- Kurtar E.S., Seymen M. Gynogenesis in Cucurbita Species. In: Segui-Simarro JM, editor. Doubled Haploid Technology: Volume 3: Emerging Tools, Cucurbits, Trees, Other Species. New York, NY: Springer US; 2021. p. 123-33 https://doi.org/10.1007/978-1-0716-1331-3_8.
- Wakizuka T., Nakajima T. Development of Proembryo in Cultured Ovules of Petunia Hybrida Vilm. Japanese Journal of Breeding. 1975;25(3):161-7.


