Оптимизация метода исследования маммосферообразования для оценки IL-6 индуцированной стволовой пластичности дифференцированных клеток рака молочной железы
Автор: Невская К.В., Ефимова Л.В., Корда П.В., Долгашева Д.С., Ибрагимова М.К., Меняйло М.Е., Удут Е.В., Литвяков Н.В., Першина А.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.21, 2022 года.
Бесплатный доступ
Цель исследования - оптимизация метода оценки образования маммосфер после индуцированной интерлейкином 6 (IL6) стволовой пластичности у дифференцированных (CD44-) опухолевых клеток линии рака молочной железы человека T47D. Материал и методы. Проведена оценка жизнеспособности, цитофлуориметрического профиля клеток и их способности к маммосферообразованию при различной исходной конфлюентности (40-50 % и 70-80 %) и методах снятия с поверхности пластика (использование TrypLE, аккутазы, скребка для клеток). Жизнеспособность клеток оценивали методом проточной цитометрии с использованием флуоресцентно-меченного АннексинV и йодистого пропидия. Динамику изменения экспрессии поверхностных маркеров клеток оценивали методом проточной цитометрии с флуоресцентно-меченными антителами к CD24 и CD44. Результаты. Применение скребка для снятия клеток приводило к существенному повышению количества клеток с цитофлуо-риметрическими признаками раннего и позднего апоптоза по сравнению с использованием TrypLE и аккутазы. Использование TrypLE приводило к снижению количества CD44+ клеток, тогда как аккутаза не влияла на представленность данного маркера. Количество маммосфер и их средний диаметр не отличались между исследуемыми группами. Стимуляция дифференцированных (CD44-CD24+) клеток линии T47D IL6 уже через 24 ч приводила к появлению популяций CD44+CD24+ прогениторных и CD44+CD24-/low опухолевых стволовых клеток. Дифференцированные клетки после стимуляции IL6 в течение 24 ч образовывали в 3 раза больше маммосфер по сравнению с контролем. Заключение. Для оценки маммосферообразования целесообразно использовать клетки с конфлюентностью до 80 % и применять аккутазу для снятия с поверхности пластика. Для стимуляции стволовой пластичности у дифференцированных клеток линии T47D достаточной является их инкубация с IL6 в течение 24 ч.
Рак молочной железы, маммосферообразование, интерлейкин 6, стволовая пластичность
Короткий адрес: https://sciup.org/140296695
IDR: 140296695 | УДК: 618.19-006.6:577.2:571.27 | DOI: 10.21294/1814-4861-2022-21-6-59-67
Текст научной статьи Оптимизация метода исследования маммосферообразования для оценки IL-6 индуцированной стволовой пластичности дифференцированных клеток рака молочной железы
Метастазирование является одной из наиболее серьезных проблем в лечении рака. Согласно современным представлениям, способность дифференцированных опухолевых клеток к переходу в опухолевые стволовые клетки (ОСК), т.е. их стволовая пластичность или дедифференцировка, играет определяющую роль в инициации образования метастазов [1–3]. Изучение процесса дедифференцировки опухолевых клеток важно как при исследовании фундаментальных механизмов канцерогенеза, так и для оценки эффективности новых антиметастатических препаратов. Для подтверждения дедифференцировки, произошедшей под действием определенных факторов, in vitro используют такие методы, как оценка маммосферо-образования, определение уровня экспрессии генов и фенотипического профиля клеток с маркерами стволовых клеток.
Анализ образования маммосфер позволяет оценить количество и функциональную активность клеток, способных инициировать опухолевый рост [4]. Стандартный протокол анализа образования маммосфер включает в себя получение суспензии единичных клеток, рассадку на плашки со сверх- низким прикреплением и оценку образования сфероидов размером более 35–100 мкм через 5–14 дней в зависимости от клеточной линии и дизайна эксперимента [5–7]. Одним из основных вариабельных факторов при постановке экспериментов по оценке маммосферообразования является способ снятия клеток с поверхности флакона. В большинстве работ для снятия клеток с поверхности пластика используют растворы ферментов – трипсина, TrypLE или аккутазы [8, 9]. Однако существуют протоколы, предлагающие использование скребка для клеток (скрепера) в качестве альтернативы ферментам [10, 11]. Также остается неизученным вопрос о влиянии исходной конфлюентности клеток перед снятием с поверхности пластика на их способность образовывать маммосферы. Известно, что увеличение конфлюентности может приводить к изменению экспрессии маркеров на поверхности клетки, в том числе и маркеров стволовых клеток [12], что важно для определения субпопуляций клеток и сортинга дифференцированных опухолевых клеток. Влияние конфлюентности на экспрессию цитофлуориметрических маркеров стволовых клеток и маммосферообразование ранее изучены не были. Таким образом, для получения достоверных результатов важно оптимизировать метод мам-мосферообразования, а именно, оценить влияние конфлюентности и выбрать способ снятия клеток, позволяющий сохранить жизнеспособность и представленность рецепторов на мембране клеток. Это позволит минимизировать риск включения в анализ стволовых раковых клеток экспрессирующих CD44, но потерявших данный рецептор в процессе снятия с поверхности пластика.
Целью исследования явилась оптимизация метода оценки образования маммосфер после индуцированной интерлейкином 6 (IL6) стволовой пластичности у дифференцированных (CD44–) опухолевых клеток линии рака молочной железы человека T47D.
Материал и методы
Эксперименты были выполнены на клетках линии T47D (люминальный рак молочной железы типа А), любезно предоставленной А.А. Нуштае-вой, ИБХФМ СО РАН, Новосибирск. Клетки (3–10 пассажа) культивировали в полной питательной среде RPMI-1640 (Gibco, США) с добавлением 10 % эмбриональной телячьей сыворотки (Gibco, США), глутамина (Gibco, США), гентамицина (Gibco, США), амфотерицина В (Синтез, Россия) (ППС RPMI-1640). Клетки с низкой (40–50 %) и высокой (70–80 %) конфлюентностью снимали с поверхности пластика 3 способами: с использованием TrypLE (Gibco, США), аккутазы (Stemcell Technologies, США) или скребка для клеток (Cell Scraper, Corning). Определение фенотипического профиля клеток проводили с использованием антител PE anti-human CD44 (клон BJ18, Sony Biotechnology, США) и APC anti-human CD24 (клон ML5, Sony Biotechnology, США) на проточном цитофлуориметре CytoFlex (Beckman Coulter, США), для исключения мертвых клеток из анализа проводили окрашивание 4’, 6-диамидино-2-фенилиндолом (DAPI, Thermo Fisher Scientific, США). Жизнеспособность клеток определяли с помощью набора AnnexinV:FITC Assay kit (Bio-Rad, Австрия).
Для оценки способности к образованию мам-мосфер 1 тыс. клеток в 1 мл среды Mammocult Basal Medium (Stemcell Technologies, США) с добавлением 10 % Mammocult proliferation supplement (Stemcell Technologies, США), 4 мкг/мл гепарина (Sigma, США), 0,48 мкг/мл гидрокортизона (Stemcell Technologies, США), антибиотика-антимикотика (Gibco, США) рассаживали в лунки 12-луночного планшета. Для уменьшения адгезии клеток к пластику дно лунок планшета предварительно покрывали 1 % агарозой (Хеликон, Россия). Для получения одноклеточной суспензии клетки предварительно пропускали через клеточное сито с размером пор 40 мкм (Corning). Планшеты инкубировали в СО2-инкубаторе в течение 7 дней, после чего получали фотографии всех лунок с помощью сканирующего микроскопа Leica DMi8 (Leica,
Германия). Количество и диаметр маммосфер определяли, используя программное обеспечение ImageJ методом, предложенным Vlachou et al. [13] с модификациями.
Для изучения динамики дедифференцировки клеток под влиянием IL6 клетки линии T47D с конфлюентностью 70–80 % снимали с поверхности пластика с использованием аккутазы, окрашивали флуоресцентно-меченными антителами PE antihuman CD44 и APC anti-human CD24 и отбирали фракцию CD44– на клеточном сортере SH800 (Sony, США). Далее 50 тыс. клеток рассаживали в лунки 6-луночного планшета в 1 мл ППС RPMI-1640. Для индукции дедифференцировки в экспериментальные лунки добавляли 50 нг/мл IL6 (Abcam, США). Через 1, 3, 7 и 10 дней клетки снимали с поверхности лунок, проводили цитофлуориметрическую оценку экспрессии CD44 и CD24, а также изучали способность клеток образовывать маммосферы.
Статистическую обработку проводили с использованием пакета программ GraphPad Prism 8 (GraphPad Software, США). Сравнение количественных данных проводили при помощи t-критерия Стьюдента. Для выявления достоверности различий в случае множественных сравнений использовали однофакторный дисперсионный анализ (one-way ANOVA). Достоверность различий считали значимой при p˂0,05.
Результаты
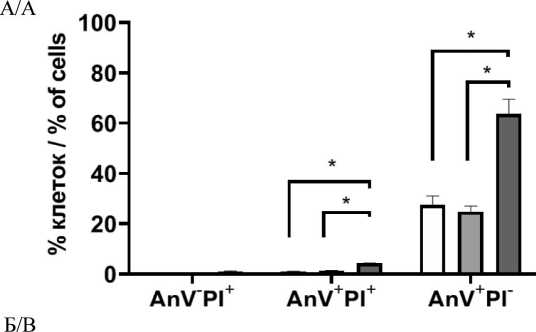
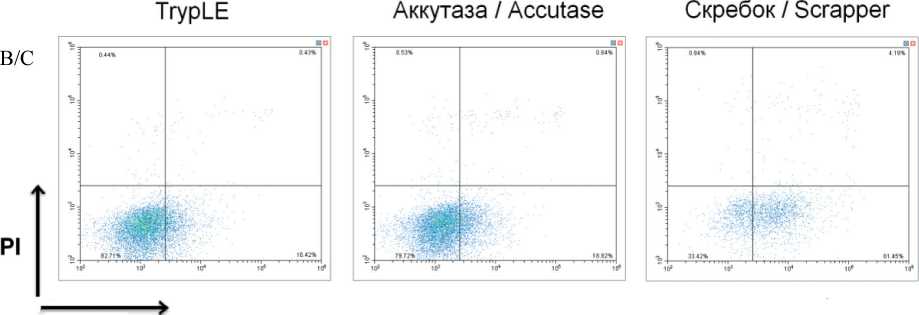
Для оценки роли влияния исходной конфлюент-ности в монослое и выбора метода снятия клеток с пластика оценивали жизнеспособность, фенотипический профиль клеток и их способность образовывать маммосферы. Согласно полученным данным, использование TrypLE и аккутазы приводило к сопоставимым показателям жизнеспособности клеток (рис. 1). Можно отметить, что количество клеток с признаками раннего апоптоза (AnV+PI–) и позднего апоптоза (AnV+PI+) при использовании ферментативных методов снятия клеток (TrypLE и аккутазы) было выше при конфлюентности 40–50 % по сравнению с конфлюентностью 70–80 % (p˂0,05). При использовании TrypLE количество клеток с цитофлуориметрическими признаками апоптоза составило 27,47 ± 3,59 % при низкой конфлюентности и 16,64 ± 0,59 % при высокой конфлюентности, при использовании аккутазы – 24,72 ± 2,28 % и 18,98 ± 1,38 % соответственно.
Снятие клеток с использованием скребка приводило к существенному повышению количества клеток с цитофлуориметрическими признаками раннего и позднего апоптоза вне зависимости от исходного уровня конфлюентности. В случае низкой конфлюентности 63,58 ± 5,94 % клеток имели признаки апоптоза, в случае высокой конфлюент-ности – 62,67 ± 4,60 %. Дополнительным недостатком данного метода снятия клеток с пластика было отсутствие возможности получить одноклеточную суспензию, необходимую для корректной оценки образования маммосфер, ни тщательным пипети-рованием, ни продавливанием через иглу шприца G26, ни обработкой ДНКазой. В связи с этим в дальнейшем для оценки экспрессионного профиля клеток и способности образовывать маммосферы применяли клетки, снятые с поверхности пластика ферментативными методами.
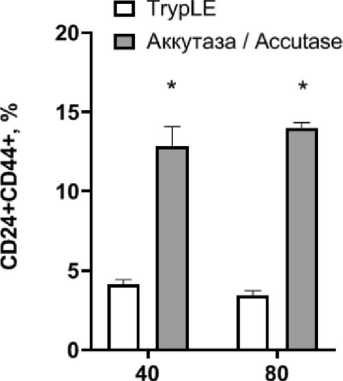
Анализ профиля экспрессии поверхностных маркеров клеток показал, что при использовании аккутазы популяция представлена преимущественно CD44–CD24+клетками, 14,0 ± 0,33 % клеток имеют фенотип CD44+CD24+, а популяция стволовых клеток (CD44+CD24–/low) составляет 2,95 ± 0,21 %. При использовании TrypLE наблюдали уменьшение доли CD24+CD44+ клеток до 4,15 ± 0,28 % и
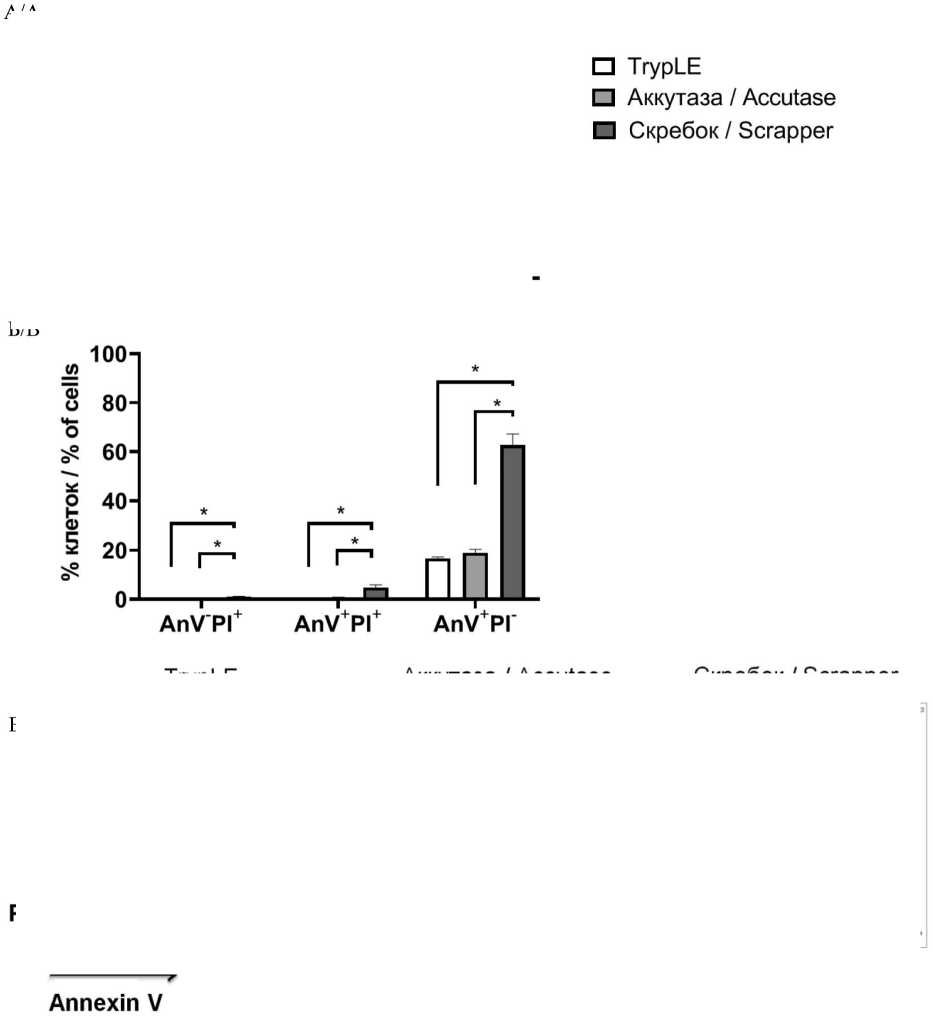
Рис. 1. Количество клеток линии T47D с цитофлуориметрическими признаками раннего апоптоза (AnV+PI–), некроза (AnV–PI+) и позднего апоптоза (AnV+PI+) при различных методах снятия с поверхности пластика: А – клетки с низкой конфлюентностью (40–50 %); Б – клетки с высокой конфлюентностью (70–80 %); В – репрезентативные гистограммы цитофлуориметрических признаков некроза, раннего и позднего апоптоза в исследуемых группах. Данные представлены как среднее ± SD, n=3.
Примечание: * – p˂0,05
Fig. 1. The effects of various cell-detaching methods on cell viability according to annexin V/PI staining protocol for flow cytometry: early apoptotic cells (AnV+PI), necrotic cells (AnV–PI+), late apoptotic cells (AnV+PI+). A – low confluence (40–50 %), Б – high confluence (70–80 %), B – representative flow cytometry histograms early apoptotic cells, necrotic cells, late apoptotic cells. Each data point presents mean ± SD from three experiments. Note: * – p-value˂0.05
3,42 ± 0,31 % при низкой и высокой конфлюент-ности соответственно (рис. 2), что может быть связано со слущиванием рецепторов CD44 и CD24 с поверхности под действием TrypLE.
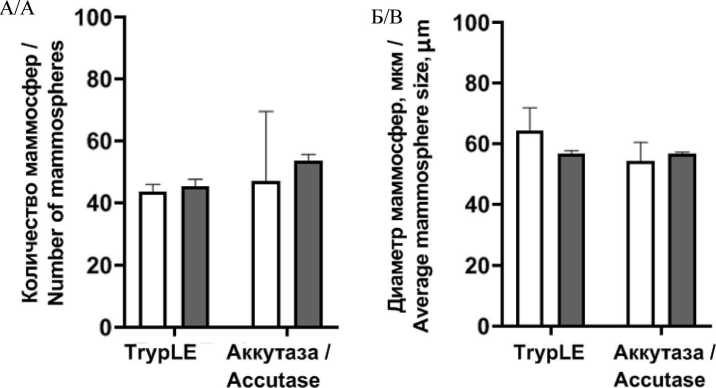
Результаты оценки количества маммосфер, образуемых клетками при различной исходной конфлюентности и методах снятия с поверхности пластика (рис. 3), показали, что количество маммосфер и их средний диаметр не отличались между исследуемыми группами. Однако учитывая, что сохранение CD44 рецепторов на мембране необходимо для выделения популяции дифференцированных клеток методом флуоресцентноактивированной сортировки клеток (FACS) с использованием антител, для проведения дальнейших экспериментов клетки выращивали до
Конфлюентность, % /
Confluence, %
Рис. 2. Зависимость профиля клеток линии T47D от конфлюентности и метода снятия с поверхности пластика. Данные представлены как среднее ± SD, n=3. Примечание: * – p˂0,05 Fig. 2. The dependence of a phenotypic profile of T47D cells on various confluence and cell-detaching methods. Each data point presents the mean and standard deviation of three replicates.
Note: * – p-value˂0.05
_ Низкая конфлюентность/ _ Высокая конфлюентность / Low confluence High confluence
Рис. 3. Маммосферообразование при различной конфлюентности клеток и способах снятия с поверхности пластика: А – количество маммосфер в исследуемых группах; Б – диаметр маммосфер в исследуемых группах.
Данные представлены как среднее ± SD, n=3. Примечание: * – p˂0,05 Fig. 3. The mammosphere formation under different cell confluence and celldetaching methods. A – the number of mammospheres, B – average mam-mosphere size. Each data point presents the mean and standard deviation of three replicates. Note: * – p-value˂0.05
Продолжительность инкубации с IL6, дни / Time of incubation with IL6, days
Б/B 10_ '
0123456789 10
Продолжительность инкубации c IL6, дни I Time of incubation with IL6, days
2 дня /
2 days
10 дней /
10 days
7 дней!
7 days
CD44" клетки после сортинга/
CD44" cells after sorting


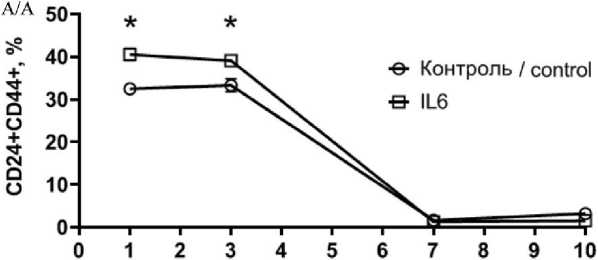
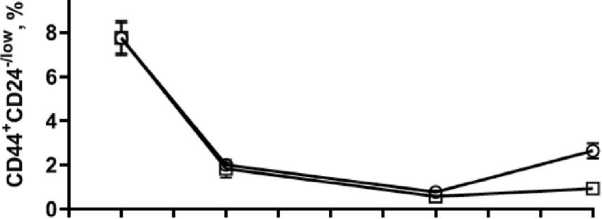
Рис. 4. Влияние продолжительности инкубации после внесения IL6 на фенотипический профиль клеток: А – количество CD24+CD44+ клеток; Б – количество CD24–/lowCD44+ клеток; В – репрезентативные гистограммы изменения фенотипического профиля клеток линии T47D в течение 10 дней инкубации. Примечание: * – p˂0,05
Fig. 4. The effect of incubation time after IL-6 addition on phenotypic profile of the cells. A – the percentage of CD44+ CD24+ cells, B – the percentage of CD24–/lowCD44+ cells, C – representative flow cytometry histograms of T47D cells after IL6 exposure for 10 days. Each data point presents the mean and standard deviation of three replicates. Note: * – p-value˂0.05
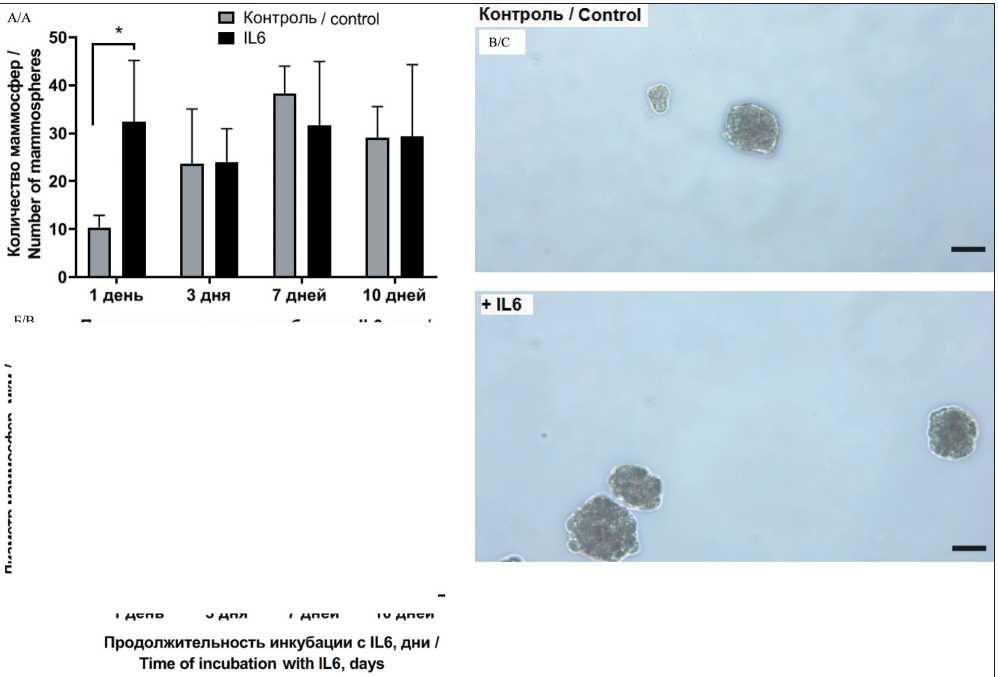
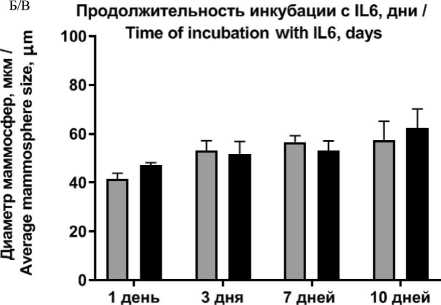
Рис. 5. Влияние продолжительности инкубации после внесения IL6 на способность CD44–CD24+ клеток линии T47D к маммос-ферообразованию: А – количество маммосфер; Б – диаметр маммосфер; В – репрезентативные фотографии маммосфер после инкубации с IL6 в течение 1 сут. Данные представлены как среднее ± SD, n=3. Длина отрезка 20 мкм.
Примечание: * – p˂0,05
Fig. 5. The effect of incubation time after IL-6 addition on mammosphere formation by CD44–CD24+ cells. A – the number of mammo-spheres, B – average mammosphere size, C – Representative images of mammosphere formed by the cells after incubation with IL6 for 1 day. Each data point presents the mean and standard deviation of three replicates. Note: * – p-value˂0.05
70–80 % конфлюентности и снимали с использованием аккутазы.
Вторая часть эксперимента была направлена на изучение динамики изменения экспрессии поверхностных маркеров и способности к мам-мосферообразованию CD44–CD24+ клеток линии T47D (выделенных методом FACS) при инкубации с индуктором дедифференцировки IL6. Уже через 24 ч инкубации CD44–CD24+ клеток наблюдали появление CD44+ клеток (рис. 4). При стимуляции IL6 доля CD44+CD24+ клеток составила 40,52 ± ± 1,41 % и была выше, чем для клеток без стимуляции (32,44 ± 0,51 %) (p˂0,05). Популяция опухолевых стволовых клеток CD44+CD24–/low также возрастала по сравнению с исходной линией без сортировки (2,95 ± 0,21 %) и составила 7,76 ± 0,77 % при добавлении IL6 и 7,75 ± 0,69 % без добавления IL6. К 3-м сут доля CD44+CD24+клеток не изменялась как в опытных, так и в контрольных образцах, однако популяция CD44+CD24-/low снижалась по сравнению с 1-ми сут. К 7-м сут инкубации с IL6 процент CD44+CD24+ клеток резко снижался и к 10-м сут оставался ниже базального уровня экспрессии, характерного для линии T47D.
Анализ способности дифференцированных клеток образовывать маммосферы показал, что клетки после стимуляции IL6 в течение 24 ч образовывали в 3 раза больше маммосфер (рис. 5) по сравнению с контролем (дифференцированными клетками без добавления IL6). Увеличение продолжительности инкубации клеток с IL6 не влияло на их способность образовывать маммосферы (рис. 5А). В то же время при увеличении времени инкубации клеток в контроле (без добавления IL6) до 7 дней наблюдали тенденцию к увеличению количества образуемых маммосфер, что может быть связано со способностью клеток T47D вырабатывать эндогенный эстроген, который способен стимулировать пролиферацию ESR+ опухолевых клеток линии T47D. Интересно отметить, что CD44–CD24+клет-ки как при стимуляции IL6, так и без стимуляции образовывали меньше маммосфер, чем клетки исходной линии T47D, что можно объяснить отсутствием ОСК – CD44+CD24–. Продолжительность инкубации с IL6 не влияла на диаметр маммосфер (рис. 5Б).
Обсуждение
Полученные результаты об использовании аккутазы как оптимального реагента для снятия клеток линии T47D с поверхности пластика согласуются с данными Y. Quan et al. [14], полученными на линии клеток рака молочной железы MCF7. Важно отметить, что обработка TrypLE приводила к значительной потере CD44 рецепторов на поверхности клеток, тогда как количество CD24 рецепторов не изменялось. Это обусловлено тем, что в структуре CD44 содержится длинный трансмембранный домен, имеющий сайты протеолитического расщепления [15]. В то же время CD24 представляет собой сравнительно небольшой белок, закрепленный в мембране за счет гликозилфосфатидилинозитольного якоря. Известно, что TrypLE является трипсиноподобной протеазой и может воздействовать на сайты протеолитического расщепления CD44. Тогда как в составе аккутазы концентрация протеолитических ферментов ниже, так как их действие реализуется в комбинации с коллагенолитическими ферментами. Использование аккутазы позволяет получить одноклеточную суспензию, необходимую для оценки маммосфе-рообразования, и сохранить рецепторы на поверхности клетки для иммунной сортировки, поэтому является предпочтительным методом для выделения популяции дифференцированных клеток с целью дальнейшего исследования индукторов или блокаторов дедифференцировки.
Влияние цитокинов семейства интерлейкина 6 (преимущественно IL6 и онкостатина М) на дедифференцировку показано в широком спектре исследований. IL6 и онкостатин М способны индуцировать дедифференцировку с образованием ОСК или ОСК-подобных клеток посредством воздействия на сигнальные пути (STAT3, STAT1, ERK1/2, PI3K/AKT) и активации факторов транскрипции (Snail, Twist, Zeb1, Slug, Nrf2) [16]. Однако при проведении экспериментальных исследований ключевым остается вопрос о продолжительности инкубации с индуктором.
Согласно полученным данным, стимуляция дифференцированных (CD44–CD24+) клеток линии T47D IL6 уже через 24 ч приводит к появлению новых популяций CD44+CD24+ и CD44+CD24–/low, т.е. является достаточной для индукции дедифференцировки. Полученные данные хорошо согласуются
Список литературы Оптимизация метода исследования маммосферообразования для оценки IL-6 индуцированной стволовой пластичности дифференцированных клеток рака молочной железы
- Fumagalli A., Oost K.C., Kester L., Morgner J., Bornes L., Bruens L., Spaargaren L., Azkanaz M., Schelfhorst T., Beerling E., Heinz M.C., Postrach D., Seinstra D., Sieuwerts A.M., Martens J.W.M., van der Elst S., van Baalen M., Bhowmick D., Vrisekoop N., Ellenbroek S.I.J., Suijkerbuijk S.J.E., Snippert H.J., van Rheenen J. Plasticity of Lgr5-Negative Cancer Cells Drives Metastasis in Colorectal Cancer. Cell Stem Cell. 2020; 26(4): 569-78. https://doi.org/10.1016/j.stem.2020.02.008.
- Hanahan D. Hallmarks of Cancer: New Dimensions. Cancer Discov. 2022; 12(1): 31-46. https://doi.org/10.1158/2159-8290.CD-21-1059.
- Litviakov N., Ibragimova M., Tsyganov M., Kazantseva P., Deryusheva I., Pevzner A., Doroshenko A., Garbukov E., Tarabanovskaya N., Slonimskaya E. Amplifcations of stemness genes and the capacity of breast tumors for metastasis. Oncotarget. 2020; 11(21): 1988-2001. https://doi.org/10.18632/oncotarget.27608.
- Bhandary L., Bailey P.C., Chang K.T., Underwood K.F., Lee C.J., Whipple R.A., Jewell C.M., Ory E., Thompson K.N., Ju J.A., Mathias T.M., Pratt S.J.P., Vitolo M.I., Martin S.S. Lipid tethering of breast tumor cells reduces cell aggregation during mammosphere formation. Sci Rep. 2021; 11(1): 3214. https://doi.org/10.1038/s41598-021-81919-9.
- Bailey P.C., Lee R.M., Vitolo M.I., Pratt S.J.P., Ory E., Chakrabarti K., Lee C.J., Thompson K.N., Martin S.S. Single-Cell Tracking of Breast Cancer Cells Enables Prediction of Sphere Formation from Early Cell Divisions. iScience. 2018; 8: 29-39. https://doi.org/10.1016/j.isci.2018.08.015.
- Lombardo Y., de Giorgio A., Coombes C.R., Stebbing J., Castellano L. Mammosphere formation assay from human breast cancer tissues and cell lines. J Vis Exp. 2015; (97): 52671. https://doi.org/10.3791/52671.
- Montales M.T., Rahal O.M., Kang J., Rogers T.J., Prior R.L., Wu X., Simmen R.C. Repression of mammosphere formation of human breast cancer cells by soy isofavone genistein and blueberry polyphenolic acids suggests diet-mediated targeting of cancer stem-like/progenitor cells. Carcinogenesis. 2012; 33(3): 652-60. https://doi.org/10.1093/carcin/bgr317.
- Iriondo O., Rábano M., Domenici G., Carlevaris O., López-Ruiz J.A., Zabalza I., Berra E., Vivanco M. Distinct breast cancer stem/progenitor cell populations require either HIF1α or loss of PHD3 to expand under hypoxic conditions. Oncotarget. 2015; 6(31): 31721-39. https://doi.org/10.18632/oncotarget.5564.
- Kessel S.L., Chan L.L. A High-Throughput Image Cytometry Method for the Formation, Morphometric, and Viability Analysis of Drug-Treated Mammospheres. SLAS Discov. 2020; 25(7): 723-33. https://doi.org/10.1177/2472555220922817.
- Gallegos K.M., Patel J.R., Llopis S.D., Walker R.R., Davidson A.M., Zhang W., Zhang K., Tilghman S.L. Quantitative Proteomic Profling Identifes a Potential Novel Chaperone Marker in Resistant Breast Cancer. Front Oncol. 2021; 11: 540134. https://doi.org/10.3389/fonc.2021.540134.
- Wang D., Naydenov N.G., Dozmorov M.G., Koblinski J.E., Ivanov A.I. Anillin regulates breast cancer cell migration, growth, and metastasis by non-canonical mechanisms involving control of cell stemness and diferentiation. Breast Cancer Res. 2020; 22(1): 3. https://doi.org/10.1186/s13058- 019-1241-x.
- Ren J., Wang H., Tran K., Civini S., Jin P., Castiello L., Feng J., Kuznetsov S.A., Robey P.G., Sabatino M., Stroncek D.F. Human bone marrow stromal cell confuence: efects on cell characteristics and methods of assessment. Cytotherapy. 2015; 17(7): 897-911. https://doi.org/10.1016/j.jcyt.2015.03.607.
- Vlachou T., Aobuli X., D’Elia E., Santoro A., Moroni M.C., Pelicci P.G. Quantifcation of Self-renewal in Murine Mammosphere Cultures. J Vis Exp. 2019; (153). https://doi.org/10.3791/60256.
- Quan Y., Yan Y., Wang X., Fu Q., Wang W., Wu J., Yang G., Ren J., Wang Y. Impact of cell dissociation on identifcation of breast cancer stem cells. Cancer Biomark. 2012-2013; 12(3): 125-33. https://doi.org/10.3233/CBM-130300.
- Zöller M. CD44: can a cancer-initiating cell proft from an abundantly expressed molecule? Nat Rev Cancer. 2011; 11(4): 254-67. https://doi.org/10.1038/nrc3023.
- Abaurrea A., Araujo A.M., Caffarel M.M. The Role of the IL-6 Cytokine Family in Epithelial-Mesenchymal Plasticity in Cancer Progression. Int J Mol Sci. 2021; 22(15): 8334. https://doi.org/10.3390/ijms22158334.
- West N.R., Murray J.I., Watson P.H. Oncostatin-M promotes phenotypic changes associated with mesenchymal and stem cell-like diferentiation in breast cancer. Oncogene. 2014; 33(12): 1485-94. https://doi.org/10.1038/onc.2013.105.
- Junk D.J., Bryson B.L., Smigiel J.M., Parameswaran N., Bartel C.A., Jackson M.W. Oncostatin M promotes cancer cell plasticity through cooperative STAT3-SMAD3 signaling. Oncogene. 2017; 36(28): 4001-13. https://doi.org/10.1038/onc.2017.33.
- Xie G., Yao Q., Liu Y., Du S., Liu A., Guo Z., Sun A., Ruan J., Chen L., Ye C., Yuan Y. IL-6-induced epithelial-mesenchymal transition promotes the generation of breast cancer stem-like cells analogous to mammosphere cultures. Int J Oncol. 2012; 40(4): 1171-9. https://doi.org/10.3892/ijo.2011.1275.


