Оптимизация методов диагностики и лечения больных с идиопатическим тромбозом глубоких вен
Автор: Баданян А.Л.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1, 2014 года.
Бесплатный доступ
Цель исследования: оптимизация методов диагностики и лечения больных с идиопатическим тромбозом глубоких вен (ТГВ) и анализ полученных нами результатов. Материал и методы: проведен анализ результатов диагностики и лечения 182 больных с идиопатическим ТГВ в возрасте от 22 до 95 лет (основная группа) и 97 пациентов с умеренной и высокой степенью риска развития венозных тромбоэмболических осложнений (ВТЭО) без признаков ТГВ после общехирургических операций (группа сравнения). Всем пациентам проводилось ультразвуковое ангиосканирование (УЗАС) вен нижних конечностей и таза, а также исследовалась система гемостаза на различных этапах лечения. У 60 (32,9%) больных с идиопатическим ТГВ выполнено молекулярно-генетическое исследование ДНК для выявления наследственных тромбофилий. Результаты: по результатам фармакогенетического исследования были определены оптимальные индивидуальные дозы варфарина. В целях профилактики ВТЭО 45 (36,3%) пациентам с эмболоопасным ТГВ выполнены открытые и эндоваскулярные оперативные вмешательства. На фоне проведенной антитромботической терапии среди 55 (28,6%) больных, наблюдаемых в амбулаторном порядке в сроки от 6 мес. до 1 года, достигнуты хорошие результаты у 43 (78,2%) больных, удовлетворительные - у 13 (21,8%) пациентов.
Тромбоз глубоких вен, антикоагулянтная терапия, полиморфизмы, фармакогенетическое исследование
Короткий адрес: https://sciup.org/142211558
IDR: 142211558 | УДК: 615.47:616-073
Текст научной статьи Оптимизация методов диагностики и лечения больных с идиопатическим тромбозом глубоких вен
Актуальность проблемы
Венозные тромбоэмболические осложнения (ВТЭО), самой частой причиной которых является тромбоз глубоких вен (ТГВ), представляют серьезную проблему современного здравоохранения, т.к. являются одной из основных причин смертности и инвалидизации в индустриально развитых странах [1–3].
По данным профессора J.A. Heit из клиники Мейо (Миннесота, США), максимальное количество рецидивов ТГВ (55,4 на 1000 человек) отмечается в первые 6 месяцев после первого эпизода ВТЭО, из которых, в свою очередь, наиболее опасны первые 14 дней. Второй пик рецидивов тромбоза (30 на 1000 человек) развивается к 90 дню после перенесенного тромбоза [4, 5].
Лечебная тактика ведения больных с ТГВ как в России, так и за рубежом не стандартизирована [6–9]. Причиной этому является многофакторность заболевания, а также необходимость индивидуального подхода с оценкой ожидаемой эффективно- сти и экономической обоснованности при выборе лечебных схем. При этом учет индивидуальных генетических особенностей, являющихся доказанным фактором риска развития ВТЭО, необходим у пациентов с ТГВ при тромбофилии, выявленной в результате ДНК-диагностики [10–15].
Цель исследования
Оптимизация методов диагностики и лечения больных с идиопатическим ТГВ и анализ полученных нами результатов.
Материал и методы
В проведенном исследовании представлены результаты диагностики и анализа полученных данных при лечении 182 больных с идиопатическим тромбозом глубоких вен (основная группа) в возрасте от 22 до 95 лет, находившихся на лечении в городской клинической больнице им. С.П. Боткина за период с 2012 по 2014 гг. Среди пациентов с ТГВ
69 (38%) были в возрасте до 45 лет и 113 (62%) – после 45 лет. Количество мужчин и женщин: 87 (48%) и 95 (52%) соответственно.
В группу сравнения вошли 97 пациентов с умеренной и высокой степенью риска развития ВТЭО без признаков ТГВ после общехирургических операций, проведенных под эндотрахеальным наркозом (по C. Samama и M. Samama, 1999) [16]. Критерием сравнимости обеих групп явилась модель индивидуальной оценки риска ВТЭО, разработанная J.A. Caprini [17]. На основании данной модели наблюдалось сходство суммарного количества баллов основной и контрольной групп больных.
Основным методом диагностики ТГВ явилось ультразвуковое ангиосканирование (УЗАС) сосудов системы нижней полой вены (НПВ) и таза. При этом оценивалась их структура, определялись проксимальные границы и протяженность тромба. Пациентам группы сравнения проводилось УЗАС вен нижних конечностей и таза для исключения ТГВ до операции и на 7–8-й день послеоперационного периода.
Лабораторная диагностика системы гемостаза включала общекоагуляционные тесты: количество тромбоцитов, активированное частичное тромбопластиновое время (АЧТВ), концентрация фибриногена, растворимые фибрин-мономерные комплексы (РФМК), Д-димер, активность антитромбина III (АТ III).
У 60 (32,9%) больных с диагностированным ТГВ выполнено молекулярно-генетическое исследование на предмет выявления полиморфизмов, ассоциированных с тромбофилией: мутация FV Leiden , мутации G20210A в гене протромбина, С10034Т в гене фибриногена-γ, C677T в гене МТГФР, 4G/5G-полиморфизма в гене PAI-1 , – 1639G>A в гене субъединицы 1 эпоксидредуктазы витамина К (VKORC1), а также аллелей CYP2C9*2 и CYP2C9*3 гена цитохрома Р450 CYP2C9 .
Лечение ТГВ проводилось по схеме, включающей гепарины различной молекулярной массы с переходом на варфарин под контролем Международного нормализованного отношения (МНО). Однако дальнейшая коррекция лечения и его сроков у больных с ТГВ проводилась с учетом данных, полученных при молекулярно-генетическом исследовании, включая фармакоге-нетическое тестирование.
Открытые и эндоваскулярные оперативные вмешательства проведены 45 (24,7%) пациентам с эмболоопасным ТГВ. Характер оперативных вмешательств представлен в табл. 1.
В целях ускорения венозного кровотока, усиления фибринолитической активности использовались медицинские эластические компрессионные изделия (МЭКИ).
Результаты и обсуждение
Объективные данные, полученные при УЗАС у 182 пациентов основной группы о локализации и частоте тромбоза в системе НПВ отражены в табл. 2.
В результате проведенного исследования выявлено, что левосторонняя локализация тромбоза наблюдалась в 1,5 раза
Таблица 1
Хирургические методы лечения больных с эмболоопасным тромбозом в системе НПВ в зависимости от локализации
|
Локализация тромбоза |
Вид оперативного вмешательства (больные, n=45) |
Всего |
||||||
|
Тромбэктомия |
Перевязка ПБВ |
Имплантация кава-фильтра |
абс. |
% |
||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|||
|
Общая бедренная вена |
13 |
28,9 |
– |
– |
12 |
26,7 |
25 |
55,6 |
|
Поверхностная бедренная вена |
– |
– |
9 |
20 |
– |
– |
9 |
20 |
|
Наружная подвздошная вена |
5 |
11,1 |
– |
– |
– |
– |
5 |
11,1 |
|
Подколенная вена |
– |
– |
1 |
2,2 |
5 |
11,1 |
6 |
13,3 |
|
Итого |
18 |
40 |
10 |
22,2 |
17 |
37,8 |
45 |
100 |
чаще правосторонней: 135 (74,2%) и 47 (25,8%) больных соответственно. У 36 (19,8 %) пациентов имело место двустороннее распространение.
При анализе данных, полученных при ультразвуковом исследовании, обнаружена взаимосвязь вероятности развития ВТЭО при умеренной и выраженной степени подвижности с неровным контуром и гетерогенной структурой у 39 (21,4%) больных.
По результатам проведенного УЗАС у 68 (37,3%) пациентов обнаружена эмболоопасная форма ТГВ с флотацией проксимальной части тромба. Пример ангиосканограмм с наличием флотации тромба в просвете общей бедренной вены представлен на рис. 1.
Данные о частоте локализации эмболоопасных флотирующих тромбов, полученные в нашем исследовании, представлены в табл. 3.
Таблица 2
Локализация и частота тромбоза у больных с ТГВ
|
Локализация |
Больные с ТГВ (n=182) |
Всего |
||||
|
Возраст |
||||||
|
≤45 лет (n=69) |
≥45 лет (n=113) |
|||||
|
абс. |
% |
абс. |
% |
абс. |
% |
|
|
Глубокие вены голени |
12 |
17,4 |
23 |
20,4 |
35 |
19,2 |
|
Проксимальные глубокие вены |
||||||
|
Бедренноподколенный сегмент |
34 |
49,3 |
58 |
51,3 |
92 |
50,5 |
|
Подвздошнобедренный сегмент |
23 |
33,3 |
32 |
28,3 |
55 |
30,3 |
|
Итого |
69 |
100 |
113 |
100 |
182 |
100 |
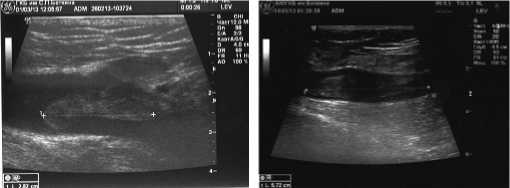
Рис. 1. Ангиосканограммы (продольные срезы) флотирующего тромба общей бедренной вены
Таблица 3
Локализация флотирующего тромба
|
Венозный сегмент |
Количество пациентов (n=68) |
|
|
абс. ч. |
% |
|
|
Нижняя полая вена |
2 |
2,9 |
|
Общая подвздошная вена |
8 |
11,8 |
|
Наружная подвздошная вена |
13 |
19,1 |
|
Общая бедренная вена |
30 |
44,1 |
|
Поверхностная бедренная вена |
11 |
16,2 |
|
Подколенная вена |
4 |
5,9 |
|
Итого |
68 |
100 |
При гемостазеологическом исследовании у больных с ТГВ исходно отмечались признаки тромбинемии – повышение концентрации РФМК у 57 (31,3%). Повышение уровня Д-димера с диагностированным тромбозом глубоких вен выявлено у 171 (93,9%) пациентов, снижение активности АТ III – у 2 (1,1%). В то время как у больных без признаков ТГВ после общехирургических вмешательств на всех этапах наблюдения состояние гемостаза в основном характеризовалось как «компенсированная нормокоагуляция с умеренной тенденцией к гиперкоагуляции». Однако у 12 (12,3%) больных группы сравнения в ближайшем послеоперационном периоде определялся положительный Д-димер при отсутствии ТГВ, что обусловлено развитием и сохранением в течение некоторого периода времени признаков воспаления в послеоперационном периоде. Отсутствием гемо-стазиологического признака тромбинемии у этих больных при ложноположительном Д-димере являлась нормальная концентрации РФМК, что указывает также на значимость данного ге-мостазеологического показателя.
По данным ДНК-диагностики, проведенной у 60 (32,9%) пациентов основной группы, выявлено, что гетерозиготная мутация FV Leiden была обнаружена у 8 (13,3%) пациентов с ТГВ, а у 2 (1,03%) из них – рецидивирующий ТГВ, несмотря на проводимую антитромботическую терапию варфарином. При этом у всех 8 (13,3%) больных выявлена взаимосвязь между степенью распространения тромбоза и мутацией FV Leiden: при мульти-генной форме тромбофилии, сочетании мутации FV Leiden с мутациями в генах протромбина, фибриногена, РАI-1, либо МТГФР присутствовал двусторонний тромбоз с распространением преи- мущественно на проксимальные глубокие вены. Исследованные мутации в гене протромбина (второй по клинической значимости генетический дефект) и фибриногена были обнаружены у 6 (10%) и у 25 (41,7%) пациентов соответственно. При этом клиническая картина у больных с мутацией в гене протромбина характеризовалась ТГВ проксимальных отделов, а у больных с мутацией в гене фибриногена выявлена изолированная дистальная локализация ТГВ, либо в сочетании с проксимальным ТГВ.
Гомозиготная мутация в гене протромбина встречалась у 1 (2%), а фибриногена – у 5 (10%) пациентов. Гетерозиготная мутация в гене протромбина – у 5 (8,3%), а фибриногена – у 18 (30%) больных с ТГВ соответственно.
Для подбора наиболее оптимальных доз варфарина проводилось фармакогенетическое исследование, включающее выявление мутаций в гене VKORC1 , а также аллелей гена цитохрома Р450 CYP2C9*2 и CYP2C9*3 , участвующих в метаболизме (S)-варфарина в печени. Мутация в гене VKORC1 обнаружена у 29 (48,3%) больных, а аллели CYP2C9*2 и CYP2C9*3 – у 13 (21,7%) и 15 (25%) больных соответственно.
При лечении 79 (43,4%) больных с ТГВ в нашем исследовании с использованием НФГ адекватный и безопасный уровень гипокоагуляции (удлинение АЧТВ на 20% от нормы) достигнут у 62 (78,5%) пациентов, а у 17 (21,5%) – наблюдалось чрезмерное повышение АЧТВ (до 70 сек.). Учитывая как высокий риск геморрагических осложнений, так и риск развития рецидива ТГВ, у 17 (21,5%) пациентов проводили коррекцию доз при гепаринотерапии. Остальные 103 (56,7%) пациента получали лечебные дозы НМГ.
Подбор оптимальной индивидуальной дозы варфарина с учетом молекулярно-генетического исследования способствовал уменьшению количества дней, требующихся для поиска индивидуальной дозы препарата, а также позволил избежать возможных геморрагических и тромботических осложнений.
Внашемисследованииу32(25%) пациентовпримолекулярно-генетическом исследовании выявлено носительство аллелей гена цитохрома Р450 CYP2C9 (CYP2C9*2, CYP2C9*3) и VKORC1, которые влияют на величину дозы варфарина и вследствие этого на частоту развития геморрагических осложнений. Именно поэтому пациентам с данными полиморфизмами проводился индивидуальный расчет как насыщающей, так и поддерживающей доз по «калькулятору» Gage, доступному в on-line версии ( [18–20].
Однако следует отметить, что у 128 (66,3%) пациентов при лечении варфарином, даже при тщательном контроле в условиях стационара, МНО оказывалось за пределами целевых значений. Чаще всего у этих пациентов после выписки из стационара не достигалась необходимая гипокоагуляция по результатам данных МНО. При амбулаторном наблюдении у 34 (18,7%) в связи с нерегулируемыми целевыми значениями МНО сохранялся высокий риск развития рецидива ВТЭО, а также геморрагических осложнений. При этом у 19 (22,1%) больных возникли сложности с коррекцией целевых значений МНО, у 13 (15,1%) – геморрагические осложнения в виде носовых кровотечений. Таким образом, у 32 (25%) больных проводимое лече- ние не позволило достичь желаемых результатов по восстановлению венозного кровотока нижних конечностей и тем самым уменьшить риск рецидивирования тромбоза.
Отдаленные результаты проведенной антитромботической терапии 75 (41,2%) больных, наблюдаемых в амбулаторном порядке, показали хорошие результаты в виде полной реканализации по данным УЗАС у 43 (78,2%) больных и удовлетворительные – в виде частичной реканализации у 13 (21,8%) пациентов. Рецидив ТГВ наблюдался у 2 (1,8%) пациентов вследствие самостоятельной немотивируемой отмены проводимой антикоагулянтной терапии варфарином.
Выводы
-
1. При УЗАС у 39 (21,4%) больных с эмболоопасной формой ТГВ обнаружено, что существенное влияние на вероятность развития ВТЭО оказывали умеренная и выраженная степень подвижности проксимальной части тромба с неровным контуром и гетерогенной сруктурой.
-
2. При проведении ДНК-диагностики у 8 (13,3%) больных выявлена взаимосвязь между степенью распространения тромбоза в виде проксимальных двусторонних ТГВ с многососудистой локализацией тромбоза и мультигенной формой мутации FV Leiden.
-
3. Лечение больных с идиопатическим ТГВ явилось патогенетически обоснованным с учетом их индивидуальных генетических особенностей.
-
4. Фармакогенетическое исследование явилось методом оптимизации фармакотерапии, в результате которого достигнуто сокращение сроков подбора индивидуальной дозы вар-фарина и снижение частоты геморрагических осложнений у 32 (25%) пациентов.
Список литературы Оптимизация методов диагностики и лечения больных с идиопатическим тромбозом глубоких вен
- Vandy F.C., Wakefield T.W. Acute Deep Venous Thrombosis: Pathophysiology and Natural History./In book: Rutherford’s Vascular Surgery. 7th edition. 2010; Vol. 1. P. 736-754.
- Baglin T. Venous thromboembolism in hospitalized patients: a public health crisis//Br. J. Haematol. 2008. Vol. 141 (6). P. 764-170.
- Покровский А.В., Сапелкин С.В. Острые венозные тромбозы системы нижней полой вены. Клиническая ангиология: Руководство/Под ред. А.В. Покровского. М.: Медицина, 2004. Т 2. C. 757-772.
- Левшин Н.Ю. Международный мастер-класс по вопросам профилактики венозного тромбоэмболизма (21 Июня 2013, Рим, Италия)//Тромбоз, гемостаз и реология. 2013. №4. С. 3-6.
- Heit J.A. The epidemiology of venous thromboembolism in the community//Arterioscler. Thromb. Vasc. Biol. 2008. Vol. 28. P. 370-372.
- Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений//Флебология. 2010. №1 (выпуск 2).
- Кириенко А.И., Леонтьев С.Г., Лебедев И.С., Петухов Е.Б., Селивестров Е.И., Лапшина И.Ю. Алгоритм ведения больных с острым венозным тромбозом//Флебология. 2008. Т 2, №1. C. 58-62.
- Шевченко Ю.Л. Стойко Ю.М., Лыткин М.И. Основы клинической флебологии. М.: Медицина, 2005. 312 с.
- Kearon C., Akl E.A., Comerota A.J., Prandoni P. et al. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines//Chest. 2012. Vol. 141. e419S-e494S.
- Патрушев Л.И. Генетические механизмы наследственных нарушений гемостаза//Биохимия. 2002. Т. 67, № 1. C. 40-55.
- Патрушев Л.И. Тромбофилические состояния и современные методы их диагностики//Рус. Мед. Журн. 1998. Т. 6, № 3. C. 181-185.
- Варданян А.В., Мумладзе Р.Б., Коваленко Т.Ф., Ройтман Е.В., Патрушев Л.И. Мутации, ассоциированные с тромбофилиями, а также влияющие на метаболизм варфарина, у пациентов, перенесших тромбоз глубоких вен//Бюл. НЦССХ им. А.Н. Бакулева РАМН. 2007. Т. 6, №2. С. 21-28.
- Middeldorp S. Is thrombophilia testing useful?/Hematology Am. Soc. Hematol. Educ. Program. 2011. P. 150-155.
- Khan S., Dickerman J.D. Hereditary thrombophilia//Thromb. J. 2006. Vol. 4. P. 15-38.
- Rosendaal F.R. Once and only once//Circulation. 2010. Vol. 121. P. 1688-1690.
- Samama Ch.M., Samama M.M. Prevention of venous thromboembolism//Congr. Eur. Soc. Anaesthesiol. Amsterdam, 1999. P. 39-43.
- Caprini JA, Arcelus JI, Hasty JH, Tamhane AC, Fabregas F. Clinical assessment of venous thromboembolic risk in surgical patients. Semin Thromb Haemost 1991; 17 (Suppl. 3): 304-12.
- Сычев Д.А. Рекомендации по применению фармакогенетического тестирования в клинической практике//Качественная клиническая практика. 2011. № 1. С. 3-10.
- Сычев Д.А., Антонов И.М., Кропачева Е.С., Панченко Е.П. Какой из алгоритмов дозирования варфарина, основанных на результатах фармакогенетического тестирования, подходят российским пациентам?//Кардиология. 2010. № 4. С. 35-37.
- Gage B.F., Eby C. et al. Use of pharmacogenetic and clinical factors to predict the therapeutic dose of warfarin//Clin. Pharmacol. Ther. 2008, Sep. Vol.84 (3). P. 326-331.


