Оптимизация объема хирургического лечения при органосохраняющем лечении инвазивного рака шейки матки
Автор: Чернышова Алена Леонидовна, Коломиец Лариса Александровна, Синилкин Иван Геннадьевич, Чернов Владимир Иванович, Панкова Ольга Владимировна, Ляпунов А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 4 (64), 2014 года.
Бесплатный доступ
В исследование включено 26 больных раком шейки матки Ia 1-Ib 1 стадий, которым проводилось органосохраняющее лечение в объеме радикальной трансабдоминальной трахелэктомии. Для визуализации «сторожевых» лимфатических узлов вводился радиоактивный лимфотропный наноколлоид, меченный 99mTc за сутки до операции. Сцинтиграфическое исследование проводилось в режиме однофотонной эмиссионной компьютерной томографии области таза. Интраоперационная детекция сторожевых лимфатических узлов осуществлялась при помощи гамма-зонда, измерялся уровень гамма-излучения во всех лимфатических коллекторах. Исследование «сторожевых» лимфатических узлов у больных раком шейки матки способствует точной оценке состояния регионарных лимфатических узлов, уточнению стадии заболевания, индивидуализации объема операций, за счет определения показаний к органосохраняющим вмешательствам.
Рак шейки матки, сторожевые лимфатические узлы, трахелэктомия
Короткий адрес: https://sciup.org/14056443
IDR: 14056443 | УДК: 618.146-006.6-089:616.428-07
Текст научной статьи Оптимизация объема хирургического лечения при органосохраняющем лечении инвазивного рака шейки матки
В течение последних 10 лет в Российской Федерации ежегодно регистрируют до 15 тыс. впервые заболевших раком шейки матки (РШМ), что составляет около 7 % от общего числа онкологических больных. Рак шейки матки наиболее часто выявляется у женщин 40–60 лет. Однако наблюдается рост заболеваемости РШМ у женщин репродуктивного возраста с ежегодным приростом этого показателя на 2–7 % [6, 7], в связи с чем активно разрабатываются новые медицинские технологии лечения РШМ у женщин детородного возраста [2, 5]. В частности, при инвазивном раке шейки матки IA2–IB2 стадий по классификации FIGO у молодых больных все более активно применяется органосохраняющая операция – радикальная абдоминальная трахелэктомия (РАТ). Трансабдоминальный доступ позволяет проводить РАТ при размерах опухоли до 6 см, 1А2–1В2 стадии FIGO [5, 9, 16], в отдельных случаях – при РШМ 1В2–IIA стадий с опухолью размера до 4 см и при отсутствии признаков метастазирования [112].
Суть радикальной абдоминальной трахелэк-томии состоит в полном удалении шейки матки с околошеечной клетчаткой, верхней третью влагалища и тазовыми лимфатическими узлами. При этом сохраняются яичники, маточные трубы и тело матки с внутренним зевом, что и обеспечивает возможность последующей беременности и родов. На первом этапе вмешательства выполняется тазовая лимфаденэктомия, удаленные лимфоузлы подвергают срочному гистологическому исследованию. В зависимости от его результатов ход операции корректируется. В случае метастатического поражения лимфоузлов объем операции изменяется до расширенной экстирпации матки с транспозицией яичников. При отсутствии опухолевых клеток в лимфоузлах выполняют второй этап РАТ – удаление шейки матки с парацервикальной, параметральной клетчаткой и верхней третью влагалища. Интакт-ность проксимального края резекции шейки матки подтверждают при срочном гистологическом исследовании [1, 5, 22].
По статистике примерно у трети больных РШМ отсутствуют лимфогенные метастазы, однако трудности пред- и интраоперационной оценки состояния лимфоузлов не позволяют исключить этап обязательной лимфаденоэктомии при РАТ. Альтернативой может быть исследование сторожевых лимфатических узлов (СЛУ), которое, по мнению ряда авторов, может сократить объём вмешательства, минимизировать травматичность и снизить риск послеоперационных осложнений, что в конечном итоге приведет к значительному улучшению качества жизни больных [2, 4, 21]. Детекция СЛУ является более чувствительным методом, чем тазовая лимфаденэктомия. Отсутствие метастазов в СЛУ теоретически может свидетельствовать о нормальном статусе остальных лимфоузлов регионального коллектора [10, 18]. Появление метода точной клинической оценки состояния регионарных лимфатических узлов способствует сокращению времени и затрат на морфологическое исследование, уточнению стадии заболевания, индивидуализации объема оперативного вмешательства, в том числе органосохраняющего лечения [3, 11, 14, 15].
Целью исследования явилось изучение роли радионуклидного определения СЛУ и оптимизация объема хирургического лечения при органосохраняющем лечении инвазивного рака шейки матки.
Материал и методы
В исследование вошли 26 больных раком шейки матки I стадии, находившихся в репродуктивном возрасте (средний возраст – 28,7 ± 4,5 года), получивших лечение в объеме радикальной трансабдоминальной трахелэктомии в отделе- нии онкогинекологии ФГБУ «НИИ онкологии» СО РАМН с 2010 по 2014 г. Распределение больных на подстадии: Iа1 стадия – 7 (27 %), Iа2 – 8 (31 %); Ib1 – 11 (42 %) пациенток. Во всех случаях морфологически был верифицирован плоскоклеточный неороговевающий рак различной степени дифференцировки.
Всем пациенткам выполнялось радионуклидное выявление сторожевых лимфатических узлов с использованием лимфотропного наноколлоида, меченного 99mTc. Исследование проводилось двумя способами: методом однофотонной эмиссионной компьютерной томографии (ОЭКТ) и интраоперационно с помощью ручного гамма-зонда Gamma Finder II (Германия), путем измерения уровня гамма-излучения во всех лимфатических коллекторах [3, 8].
Для выявления СЛУ радиофармпрепарат вводился за сутки до операции. Инъекции осуществлялись парацервикально по 0,25 мл в 4 точки вокруг опухоли, соответствующие 13, 16, 19 и 22 часам условного циферблата (в дозе 20 MBq в каждой инъекции), отступая от видимых границ опухоли на 5–10 мм. Регистрация распределения радиоактивного наноколлоида в тазовой области выполнялась в режиме ОЭКТ на гамма-камере с двумя фиксированными детекторами «E.CAM-180» (Siemens) спустя 20 мин и 3 ч после введения РФП (рис. 1). Исследование выполняли при настройке гамма-камеры на фотопик излучения 99mTc (140 кэВ) при ширине энергетического окна дифференциального дискриминатора – 15 %. Для исследования использовали высокоразрешающий параллельный коллиматор для низких энергий излучения. Изображение регистрировали в 32 проекциях в матрицу 64×64. Время экспозиции на одну проекцию составляло 20 с. Полученные данные подвергались обработке при помощи специализированной компьютерной системы E.Soft (Siemens) с получением трехмерного изображения.
Для интраоперационного поиска сторожевых лимфатических узлов использовался портативный гамма-зонд Gamma Finder II, обладающий возможностью контактного определения уровней радиоактивности искомых лимфоузлов. Сканер снабжен встроенным коллиматором, позволяющим с большой точностью локализовать источник фотонного излучения и получать достоверную информацию о распределении радиофармпрепарата в тканях и ор- ганах пациента. Интраоперационное определение СЛУ проводилось оперирующим хирургом после вскрытия забрюшинного пространства. Сторожевым считался тот лимфатический узел, радиоактивность которого превышала радиоактивность прочих лимфоузлов более чем в 3 раза [20].
Сторожевой лимфатический узел маркировался и отдельно направлялся на экспресс-цитологическое исследование. Лимфоузел разрезали острой бритвой на параллельные пластины через каждые 2 мм. С поверхности срезов делали мазки-отпечатки, общим количеством 6–10 на стекло. На один лимфоузел приходилось 4–6 стекол. Цитологические препараты окрашивали «Набором для быстрого окрашивания мазков крови Лейкодиф 200» в течение 15 сек. Препараты просматривались с помощью микроскопа Zeiss Axio Scope. A1. Удаленные сторожевые лимфатические узлы, помимо экспресс-цитологии, были также исследованы при плановой гистологической проводке всех групп удаленных лимфатических узлов.
Далее проводилась подвздошно-тазовая лим-фодиссекция в полном объеме. После выполнения лимфодиссекции удаленный макропрепарат повторно исследовался с помощью гамма-зонда (рис. 2) с целью выявления СЛУ, пропущенных во время интраоперационного исследования. Истинное количество СЛУ рассчитывали как сумму сигнальных узлов, выявленных интраоперационно и на макропрепарате.
Результаты исследования
Применение ОЭКТ малого таза и брюшной полости позволило определить сторожевые лимфатические узлы у 21 (80,8 %) больной, при интраоперационной детекции СЛУ выявлены у всех 26 пациенток, в общем количестве – 45 лимфоузлов. При последующем исследовании ма-
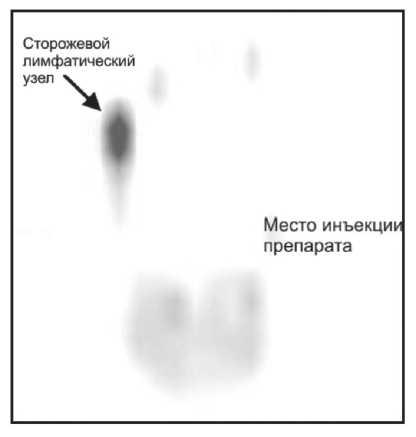
Рис. 1. Визуализация сторожевого лимфатического узла в режиме ОЭКТ области таза
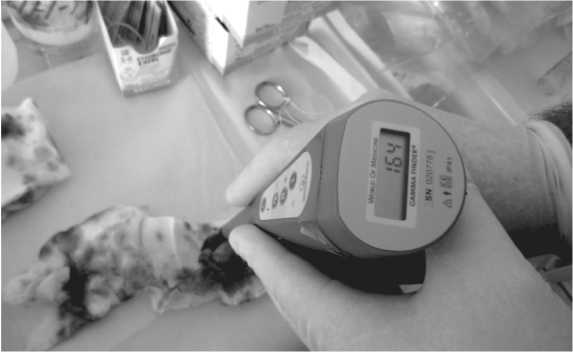
Рис. 2. Детекция сторожевого лимфатического узла в макропрепарате с помощью гамма-зонда
кропрепарата обнаружено 2 лимфатических узла, не маркированных на интраоперационном этапе. Анализ анатомо-топографических особенностей
Таблица
определение местоположения сторожевого лимфатического узла с использованием лимфотропного наноколлоида, меченного 99mTc
По результатам интраоперационного цитологического исследования в 2 случаях было выявлено метастатическое поражение СЛУ, в связи с чем у этих пациенток объем оперативного лечения был увеличен до расширенной экстирпации матки с транспозицией яичников.
При сравнительной оценке чувствительности методики определения СЛУ было установлено, что при ОЭКТ чувствительность составила 72 %, при радиометрии – 93,3 %. Таким образом, методика интраоперационного радиометрического определения СЛУ оказалась более эффективной, чем ОЭКТ. При этом, по данным ряда исследований, которые проводятся в ведущих клиниках мира, при детекции СЛУ оптимальным методом является сочетанное использование радиофармпрепарата и синего красителя (изосульфан). При сравнении предложенных методик было показано, что радиометрический метод является более чувствительным (88,5 %), чем методика с использованием синего красителя (83,9 %), при их сочетанном применении вероятность обнаружения СЛУ возрастает до 91,4 % [17, 19].
Обсуждение
В мире проводится ряд исследований, посвященных изучению проблемы СЛУ при гинекологическом раке [8, 13, 20]. В 2008 г. были опубликованы результаты европейского многоцентрового исследования, проведенного Национальным институтом рака (г. Париж), в котором оценивались прогностическая значимость и особенности анатомического распределения СЛУ при раке шейки матки. Идентификация СЛУ проводилась комбинированным способом (99mТс-наноколлоид + синий изосульфан) с последующим полным удалением тазовых и парааортальных лимфоузлов. Положительная детекция СЛУ составила 96,1 %, из них у 5,5 % больных обнаружены метастазы в СЛУ, при этом ни у одной пациентки не было лимфогенных мета- стазов без поражения СЛУ. Выявлены следующее особенности анатомического расположения СЛУ: в 83,5 % они находились в зоне наружных подвздошных артерий, в 8,5 % – общих подвздошных артерий, в 5,1 % – пресакральные и ретросакраль-ные лимфатические узлы, в 2,7 % СЛУ были в параметральной клетчатке [13].
В ряде случаев СЛУ находятся в параметраль-ной клетчатке достаточно близко к шейке матки, что значительно затрудняет их детекцию во время операции [15]. В этом исследовании максимальное количество СЛУ было выявлено в запирательной ямке – в 50,4 %, на наружной подвздошной артерии – в 31,4 %, на внутренней подвздошной артерии – в 15,2 %, на общей подвздошной артерии – в 6 % наблюдений, в 2 случаях СЛУ находились в области кардинальных связок. Одностороннее поражение СЛУ, выявленное в 52,9 %, вероятнее всего, объясняется односторонним лимфатическим дренажом малого таза.
Аналогичные результаты получены в исследовании H. Hertel et al. (Sunnybrook Health Sciences Center, Тоronto) [16], где СЛУ выявлены в 85 %, при этом частота их метастатического поражения составила 10 %, а случаев skip-метастазов (поражения лимфоузлов минуя сторожевые) не выявлено. Чувствительность метода составила 92 %. Согласно ряду сообщений [3, 4, 18], показатели диагностической эффективности определения СЛУ составляют: чувствительность – 71–100 %, специфичность – 100 %, диагностическая точность – 75–100 %.
Заключение
Выявление сторожевых лимфатических узлов является современным методом диагностики, позволяющим уточнить лимфогенную распространенность рака шейки матки, показана диагностическая эффективность методики, однако пока она не получила широкого применения в клинической практике. Дальнейшие рандомизированные исследования в этом направлении помогут оптимизировать стадирование лимфогенной дис-семинации РШМ и более адекватно определить показания для органосохраняющих операций не только на ранних стадиях заболевания, но и у больных с инвазивным раком шейки матки.


