Оптимизация параметров масс-спектрометрического анализа цианотоксинов на гибридном хромато-масс-спектрометре LTQ Orbitrap XL (ThermoFinnigan)
Автор: Чернова Екатерина Николаевна, Русских Я.В., Подольская Е.П., Жаковская З.А., Царев В.С., Кухарева Г.И.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия
Статья в выпуске: 1 т.23, 2013 года.
Бесплатный доступ
Работа посвящена выбору и оптимизации метода одновременного хромато-масс-спектрометрического определения и идентификации цианобактериальных токсинов анатоксина-а и микроцистинов-LR, -RR и -YR в составе сложных матриц. Показано, что оптимизированный метод позволяет анализировать указанные соединения, являющиеся одними из наиболее опасных экотоксикантов природного происхождения, в концентрациях ниже безопасного уровня присутствия в питьевой воде по данным ВОЗ.
Метаболиты цианобактерий, цианотоксины, микроцистины, анатоксин-а, хромато-масс-спектрометрический анализ, режимы фрагментации cid и hcd
Короткий адрес: https://sciup.org/14264839
IDR: 14264839 | УДК: 543
Текст научной статьи Оптимизация параметров масс-спектрометрического анализа цианотоксинов на гибридном хромато-масс-спектрометре LTQ Orbitrap XL (ThermoFinnigan)
ВВЕДЕНИЕ синов при благоприятных погодных условиях.
Для определения присутствия цианотоксинов
Со второй половины XX века вследствие интенсивного развития промышленности и сельского хозяйства усиливается антропогенное эвтрофиро-вание водоемов, что приводит к нарушению экологического баланса и массовому развитию отдельных видов водорослей (или "цветению"). Массовая вегетация цианобактерий (сине-зеленых водорослей) часто сопровождается выделением и накоплением в водной среде биологически активных веществ и токсинов (цианотоксинов), представляющих опасность для жизни и здоровья человека и животных. Установлено, что метаболиты вызывают острые дерматиты, тяжелые воспаления кишечного тракта и способствуют возникновению опухолей [1].
Для пресноводных водоемов наиболее актуальными источниками опасности являются две группы: нейротоксины, одним из основных представителей которых является анатоксин-а, и гепатоток-сины, включающие в себя все многообразие микроцистинов [2, 3]. Даже малые дозы этих соединений представляют серьезную угрозу для здоровья человека при использовании подверженных "цветениям" водоемов как источников питьевой воды, так и в рекреационых целях [4, 5].
Таким образом, очевидна необходимость систематического контроля содержания цианотоксинов в водоемах в период активной вегетации синезеленых водорослей, т. к. не исключена возможность появления опасных концентраций цианоток- применяются различные методы химического и биологического анализа. Для скринингового неселективного определения используют иммунофер-ментный анализ и исследование ингибирования фосфатазной активности белков [6, 7]. Для индивидуального определения рассматриваемых токсичных соединений необходимо применение различных хроматографических методов [6–10]. В последние годы при анализе и изучении метаболитов цианобактерий широко используется метод жидкостной хроматографии—масс-спектрометрии, особенно в сочетании с тандемной масс-спектрометрией (МСn) высокого разрешения, применяемый для определения малых количеств нелетучих соединений, к которым относятся рассматриваемые токсичные вещества [6, 11–14]. В этом случае надежность идентификации достигается комбинацией данных жидкостной хроматографии — времен удерживания аналитов, и данных масс-спектрометрии — точных значений молекулярных масс, избирательно характеризующих определяемые соединения.
Современные комбинации хроматографии и масс-спектрометрии являются наиболее чувствительными и избирательными методами анализа природных токсинов, обеспечивающими надежную идентификацию и эффективный мониторинг состояния окружающей среды. Данный метод анализа позволяет осуществить разделение компонентов смеси, их идентификацию и коли- чественное определение различных экотоксинов.
С 2008 г. аналитические исследования такого рода выполняются в Санкт-Петербургском Научно-исследовательском Центре экологической безопасности РАН (НИЦЭБ РАН), Санкт-Петербург, Россия [15–17]. Ранее была предложена методика определения микроцистина-RR и анатоксина-а в ходе одного анализа [18]. В последнее время большое внимание уделяется определению не только наиболее распространенных и изученных представителей цианотоксинов (микроцистинов-LR, -RR, -YR), но и других метаболитов цианопрокариот (анабаено-пептинов, аэрогенозы и т. д.) [19]. Таким образом, дальнейшее расширение спектра анализируемых соединений требует от нас модификации аналитической процедуры, которая бы позволила выявлять и другие метаболиты без снижения чувствительности по основным аналитам.
Следует отметить, что оборудование, применяемое нами для проведения анализа, — хромато-масс-спектрометр LTQ Orbitrap (Thermo Finnigan) обладает характеристиками, позволяющими разбивать хроматограмму на несколько временн ы х сегментов. В каждом из сегментов возможно применение различных масс-спектрометрических параметров анализа (таких как напряжение на конусе, фокусирующих линзах и т. д.), индивидуально подобранных для исследуемых соединений. Кроме того, для достоверной идентификации зачастую требуется применение различных методов фрагментации.
Фрагментация с использованием CID-режима ("collision induced dissociation" — "диссоциация, индуцируемая соударениями") в настоящее время является наиболее широко используемой в тандемной масс-спектрометрии. В этом случае ионная диссоциация протонированных молекул происходит в линейной ионной ловушке благодаря столкновению с молекулами инертного газа. Детектирование ион-продуктов возможно как в линейной, так и в орбитальной ионных ловушках. Этот метод является эффективным для фрагментации большинства "малых" молекул. Механизм данной фрагментации не позволяет удерживать в ловушке массы фрагментов менее 28 % от массы иона-прекурсора (интервал отсечения масс — сut off), это явление получило название "правило 1/3". При увеличении энергии столкновений сохраняется общий рисунок тандемного спектра (сохраняя структурную связь между фрагментами), но меняется соотношение интенсивностей ион-продуктов (фрагментарных ионов) с нарастанием доли фрагментов малых масс ( m / z ). Как правило, величина энергии столкновений 25–35 % является достаточной для получения представительного тандемного спектра [20].
HCD-фрагментация (высокоэнергетическая камера столкновений) является альтернативным методом разбиения, при котором ион-продукты образуются в результате многоступенчатого процесса активации. Это способствует детектированию низких m / z продукт-ионов (позволяет "обойти" правило 1/3). Величина энергии HCD значительно влияет на получаемый "рисунок" тандемного спектра ( m / z ион-продуктов) в зависимости от структуры вещества. "Рисунок" тандемных спектров, полученных в HCD-режиме при больших значениях энергии, напоминает вид спектров фрагментации электронным ударом в газовой хроматографии—масс-спектрометрии. В гибридном хромато-масс-спектрометре LTQ Orbitrap (фирмы Thermo Finnigan) выделение ион-прекурсора происходит в линейной ловушке, затем ионы фокусируются в промежуточной (С-trap) ловушке и разбиваются в HCD-камере, а детектируются в орбитальной ловушке с фурье-преобразователем (FTMS — масс-анализатор для точного определения масс) [20].
В связи с особенностями каждого из методов было целесообразным в целях сравнения применить к каждому из исследуемых веществ оба метода фрагментации.
Так, при проведении тандемного анализа "тяжелых" молекул гепатотоксинов (молекулярный вес около 1 000 Да) для поиска сигналов, соответствующих характеристичному фрагменту микроцистинов ( m / z 135.1, АДДА-фрагмент: 3-амино-9-метокси-10-фенил l-2,6,8 триметил дека, 4,6 диеноевой кислоты), оптимальным признано применение HCD-режима (высокоэнергетическая камера столкновений) в орбитальной ловушке. Фрагментация в CID-режиме применялась для анатоксина-а.
Цель данной работы состояла в подборе условий наиболее эффективного хромато-масс-спектрометрического анализа многокомпонентного образца, содержащего не только ряд метаболитов цианобактерий, включающий в себя микроцистины и анатоксин-а, но и значительное количество маскирующих соединений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Используемые реактивы: ацетонитрил сорта "0" (Криохром); метанол марки LC-MS CHROMA-SOLV (Fluka); вода, очищенная с помощью системы Direct-Q (Millipore, электропроводность 0.056 мкСм/см при 25 ºС); перегнанная и ампулирован-ная трифторуксуксная кислота (ТФУ); фильтры "Владипор" (0.45 мкм); SPE-картриджи Oasis HLB (Waters). Стандарты: анатоксина-a фумарат фирм A.G. Scientific, Inc. CA и TOCRIS bioscience UK, микроцистин-LR, -RR, -YR фирмы Sigma Aldrich.
Анализ растворов стандартов
Для калибровочных растворов и оптимизации параметров масс-спектрометрического анализа использовали растворы стандартов различных концентраций в диапазоне от 0.5 до 100 нг/мл в метаноле. Была построена калибровка в условиях детектирования выбранных ионов (SIM) с применением оптимизированного метода масс-спектрометрического анализа для количественного определения трех выбранных микроцистинов и анаток-сина-а.
Подготовка образца
Пробы воды объемом 1 л разделяли посредством фильтрации на фильтрат, содержащий внеклеточные токсины, и биомассу, содержащую внутриклеточные токсины. Фильтрат подвергали твердофазной экстракции на картриджах Oasis HLB 60 мг. (В случае интенсивного цветения сине-зеленых водорослей использовали картридж 200 мг с тем же сорбентом). Экстракцию проводили при нейтральном рН и скорости подачи пробы 5 мл/мин. Для удаления остатков воды сорбент сушили под вакуумом в течение 15 мин. Элюцию проводили последовательно: 15 мл метанола и 10 мл 0.2 % муравьиной кислоты в метаноле. Элюат испаряли на роторном испарителе досуха и перерастворяли в 1 мл 5 % водного ацетонитрила с 0.01 % ТФУ.
Хромато-масс-спектрометрический анализ
Разделение компонентов экстракта пробы проводили на обратнофазной хроматографической колонке (Thermo Hypersil Gold 100×3 мм, 3 мкм) в градиентном режиме в широком интервале органической фазы (от 5 % до 95 % ацетонитрила) (см. таблицу). В качестве подвижных фаз использовали воду и ацетонитрил, обе фазы содержали трифторуксусную кислоту (ТФУ). Скорость потока составляла 0.2 мл/мин.
Масс-спектрометрический анализ проводили в условиях электрораспылительной ионизации в режиме регистрации положительных ионов. Сканируемый диапазон масс ( m / z ) составлял 100– 1200 с разрешением 30 000. Температура ионного источника 320 Т ºС; поток газа-носителя (азот) — 25 л/мин, напряжение на конусе (CV) 3.2 кВ. Чтобы повысить чувствительность метода для количественного определения микроцистинов, использовали орбитальную ионную ловушку (FTMS). Использовали 2 режима получения тандемных спектров: HCD в орбитальной ловушке (для микроцистинов) или CID в ионной ловушке (для анатоксина-а). Энергия столкновений составляла 25 % — в случае CID и 45 % — в случае HCD.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЯ
При всей серьезности проблемы в Российской Федерации отсутствуют санитарно-гигиенические нормативы допустимого уровня содержания цианотоксинов в воде водоемов . В то же время ВОЗ рекомендует значения безопасных уровней содержания в рекреационных зонах: для анатоксина-а — 1 мкг/л, для микроцистинов — 6 мкг/л, допустимые нормы содержания MC-LR в питьевой воде — 1.0 мкг/л. [21]. Величины указанных параметров являлись ориентировочным уровнем при разработке нами аналитической процедуры определения токсичных метаболитов цианобактерий.
При определении малых количеств аналитов главной задачей пробоподготовки являются: 1 — снижение влияния матрицы; 2 — максимальное концентрирование целевых объектов. Общепризнанным методом для достижения обеих целей считается твердофазная экстракция (ТФЭ) на обращенно-фазовом сорбенте, поэтому для пробо-подготовки был выбран этот метод с применением коммерчески доступных патронов Oasis HLB (Waters), которые благодаря развитой гидрофильно-липофильной поверхности сорбента способны
Градиент для хроматографического разделения.
A — водный раствор 0.01 % ТФУ, B — ацетонитрил, содержащий 0.01 % ТФУ
|
Время, мин |
А % |
В % |
|
0.0 |
95 |
5 |
|
10.0 |
95 |
5 |
|
28.0 |
25 |
75 |
|
31.0 |
25 |
75 |
|
31.1 |
5 |
95 |
|
36.0 |
5 |
95 |
удерживать широкий диапазон полярных соединений (вместо SPE ENVI-18DSK, D = 47 мм). Анализ литературных данных показал, что степень извлечения при экстракции микроцистинов с аргининовыми группами (например, микроцистина-RR) выше на картриджах Oasis МСХ (Waters). В свою очередь заявлено, что картриджи Oasis HLB (Waters) удерживают более широкий спектр метаболитов цианотоксинов (хотя выход микроцистинов-RR падает) [19]. В связи с вышесказанным и тем, что изучаемые метаболиты могут представлять минорные компоненты смеси, объем анализируемой пробы природной воды увеличили до 1 л. Далее образец готовили и анализировали в соответствии с процедурами, приведенными в разделах "Подготовка образца" и "Хромато-масс-спектрометрический анализ".
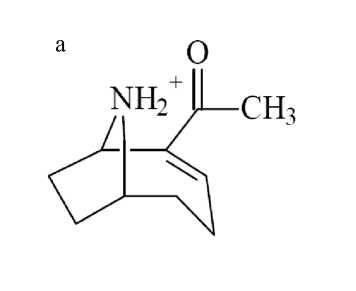
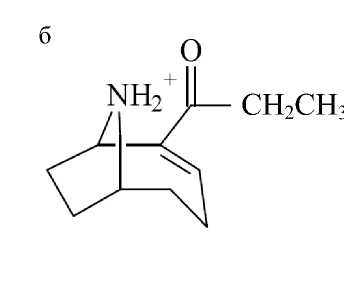
Для оптимизации параметров LCMS-анализа масс-хроматограмму делили на два сегмента, в первом из которых детектировался анатоксин-а. В связи с тем, что молекулярная масса анатоксина-а (165.12) намного ниже по сравнению с микроцистинами и по своим химическим свойствам и структуре (рис. 1) он значительно отличается от остальных метаболитов, в данном сегменте применялись оптимизированные масс-спектрометрические настройки (настройка по конкретной массе вещества) для детектирования ионов анатоксина-а. В этом сегменте (диапазон RT 0–10 мин при изо-кратическом режиме элюирования 5 % водным ацетонитрилом) записывали масс-хроматограмму в трех режимах:
А — сканирование полного ионного тока в диапазоне m / z 100–450: для возможности проведения "ретроспективного" анализа, т. е. детектирования предполагаемого аналита по точным массам характеристичных ионов в уже записанных хроматограммах [22];
В — сканирование выделенного иона (SIM): для увеличения чувствительности анализа;
С — тандемный анализ: для получения характеристических ион-продуктов, подтверждающих идентификацию.
Хромато-масс-спектрометр Orbitrap позволяет проводить фрагментацию в нескольких режимах. Наиболее используемыми являются HCD ("High-energy Collisional Dissociation" — "высокоэнерге-тичная камера соударения") в орбитальной ловушке или CID ("Collision Induced Dissociation" — "диссоциация, индуцируемая соударениями") в ионной ловушке при заданной варьируемой энергии столкновений в диапазоне от 1 до 100 %. Точность определения масс (при неизменной температуре в помещении) не зависит от интенсивности пиков и является достаточно постоянной величиной в пределах калибровки (от недели до месяца).
Фрагментацию анатоксина-а проводили в CID-режиме. Для анатоксина-а, помимо положительнозаряженного молекулярного иона с m / z 166.12, характеристичными являются ион-продукты с m / z 149.10 и 131.08. Данные осколки образуются при потере родительским ионом молекулы NH 3 и затем молекулы воды [23]. Указанные режимы анализа были выбраны в связи с тем обстоятельством, что анатоксин-а детектируется в области m / z , где достаточно велик уровень химического шума, затрудняющий идентификацию аналита.
Первоначальная оптимизация MS-параметров для получения максимального отклика анатокси-на-а проведена на растворе стандарта, т. к. при выбранных условиях разделения смеси на хроматографической колонке в данном диапазоне времен выхода ожидается в основном присутствие близких по физико-химическим свойствам соединений из списка детектируемых соединений малых масс (рис. 1) [24]. Оптимизированные параметры масс-спектрометра для первого сегмента:
а
б
CH 2 CH
Рис. 1. Структура нейротоксинов. а — анатоксин-а ; б — гомоанатоксин-а
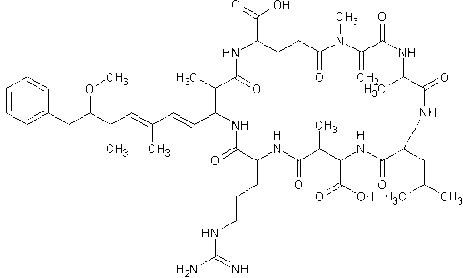
Рис. 2. Структура микроцистинa-LR напряжение на ионопроводящем капилляре 21 В; напряжение на линзах 70 В.
Метаболиты микроцистинов детектировали, сканируя во втором сегменте (интервал Rt 10– 31 мин) полный ионный ток в широком диапазоне масс m/z 100–1200 при стандартной настройке прибора; напряжение на ионопроводящем капилляре — 30 В; напряжение на линзах — 115 В. В MS2-спектрах микроцистинов наблюдали также ион-продукт с m/z 135.08, который является характеристичным ионом, присутствующим в спектрах всех микроцистинов, и соответствует ADDA-фрагменту конечного распада микроцистинов — 3-амино-9-метокси-10-фенил l-2,6,8 триметил дека, 4,6 диеноевой кислоты (рис. 2) [12].
Для трех микроцистинов, стандарты которых использовали для внешней калибровки, применяли режим детектирования выделенных ионов (SIM) — либо протонированного молекулярного (микроцистины-YR и -LR), либо двухзарядного протонированного для микроцистина-RR с целью повышения чувствительности анализа и более точного количественного определения данных соединений. Микроцистин-RR определяли по двухзарядному молекулярному иону с m / z 519.79, т. к. его структура содержит два остатка аргинина с легко протонируемыми фрагментами гуанидина [23, 25].
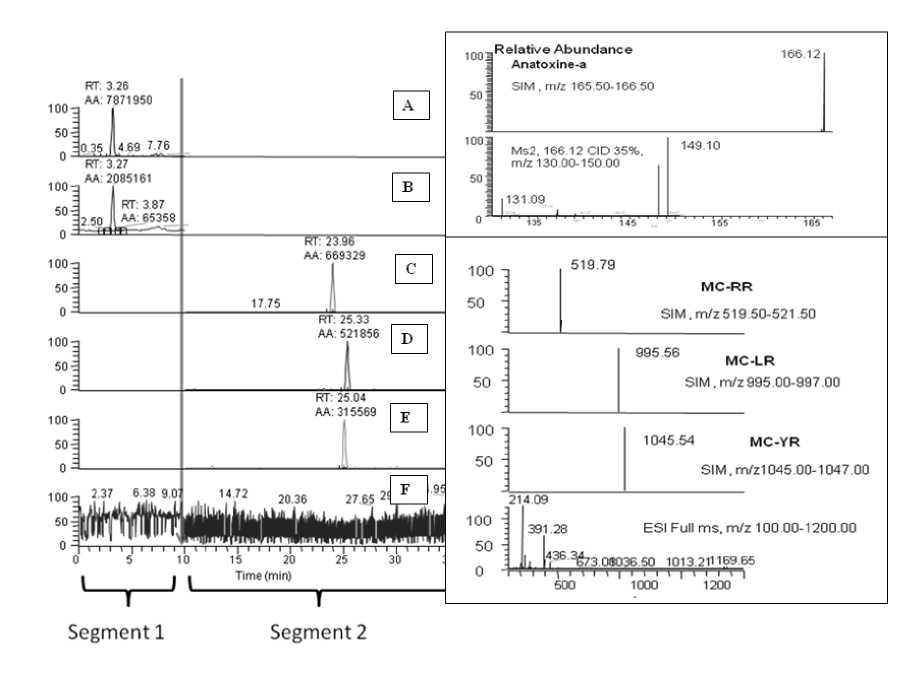
Рис. 3 . Результаты хромато-масс-спектрометрического анализа модельной системы, представляющей собой природную воду с внесенной смесью стандартов
Полученная концентрационная зависимость аналитов (анатоксина-а и микроцистинов-RR, -YR и -LR) была линейна в интервале концентраций растворов от 5 нг/мл до 100 нг/мл экстракта для режима SIM. Порог устойчивого обнаружения микроцистинов-RR, -YR и -LR из раствора стандартов 0.1 нг на ввод (SIM). Для анатоксина-а эта величина составила 0.05 нг на ввод в SIM-режиме. Для исследуемых соединений установлены пределы обнаружения метода и коэффициенты извлечения аналитов, которые составили 5 нг/л при степени извлечения 92 % для анатоксина-а и 10 нг/л при степени извлечения 68 % — для микроцистина-RR, 92 % — для микроцистина-YR и 95 % — для микроцистина-LR из матрицы природной воды, что ниже безопасного уровня содержания данных токсинов даже в питьевой воде по данным ВОЗ [21].
Оптимизированный метод хромато-масс-спектрометрического анализа был применен к модельной системе, представляющей собой природную воду с внесенной смесью описанных выше стандартов в количестве 50 нг каждого аналита. Идентификацию 4 изучаемых цианотоксинов проводили по хроматографическим временам удерживания (совпадение с аналитическим стандартом в пределах 0.3 мин) и точным значениям масс (совпадение в пределах 5 ppm). Результаты хромато- масс-спектрометрического анализа представлены на рис. 3 (A–F).
В большинстве случаев хромато-масс-спектры аналитов образцов природной воды частично включают или перекрываются фоновыми сигналами, что видно по масс-спектрам при соответствующих временах удерживания (в случае детектирования в режиме Full Scan, рис. 3, F). Именно поэтому для определения цианотоксинов было целесообразно применить режим детектирования выбранных ионов (SIM) (рис. 3, A, C, D, E). Стоит отметить важность получения ионов подтверждения для анатоксина-а в первом сегменте (рис. 3, B).
Таким образом, разработанный метод позволяет надежно идентифицировать ряд цианотоксинов в природной воде. Оптимизированные параметры позволяют значительно повысить чувствительность определения. В случае недоступности стандартов интересующих нас метаболитов информации о времени удерживания и молекулярной массе соединения бывает недостаточно для однозначной идентификации соединений. При этом необходимо дополнительное подтверждение надежности идентификации данными фрагментных масс-спектров.
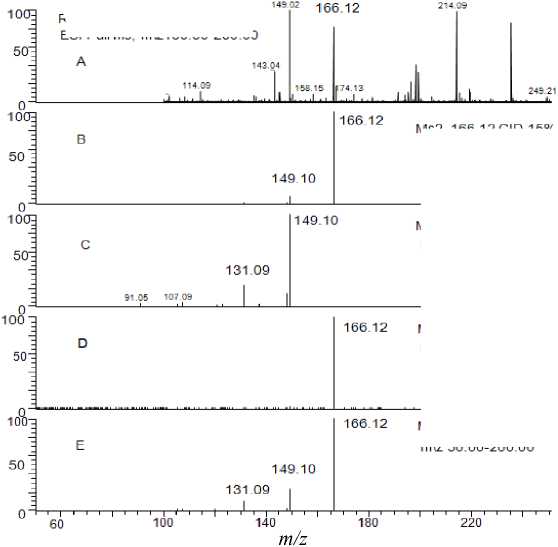
Результаты фрагментации анатоксина-а в различных режимах представлены на рис. 4. Успешность тандемного анализа оценивали по наличию
Relative Abundance
RT:7.3 Anatoxine-a
ESI Full ms. m\z100.00-250.00
m\z 50.00-200.00
Ms2, 166.12 CID 45% m\Z 50.00-200.00
Ms2 166 12HCD 45%
Ms2 166 12HCD 10% m\Z 50.00-200.00
MS2. 1bb.12 CID 1b%
m\z 50.00-200 00
Рис. 4 . Результаты фрагментации анаток-сина-а в режиме фрагментации CID и HCD
в масс-спектре двух заранее установленных характеристичных ион-продуктов. Как показано на рисунке, при фрагментации молекулы анатоксина-а в двух описанных режимах не было выявлено значительных отличий в масс-спектрах. При малых энергиях разбиения в масс-спектрах детектируется молекулярный протонированный ион (рис. 4, В и D), при высоких (рис. 4, C и E ) — присутствуют сигналы, соответствующие характеристичным фрагментам с достаточной интенсивностью для надежной идентификации. К единственному отличию можно отнести наличие сигнала родительского иона в фрагментном масс-спектре, полученном при высокой энергии разбиения в режиме HCD (рис. 4, Е). Кроме того, стоит отметить, что спектры разбиения, полученные в режиме фрагментации CID, характеризуются лучшей воспроизводимостью, из чего можно сделать вывод, что для идентификации анатоксина-а подходят оба метода фрагментации, однако CID предпочтительнее.
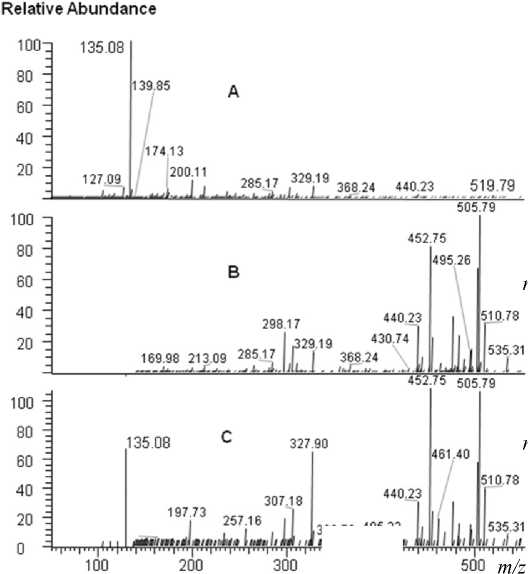
Результаты фрагментации микроцистинов не столь однозначны. Диапазон масс известных микроцистинов достаточно широк (от микроцистина-LA 909.5 Да до одного из производных микроцис-тина-LR 1115.6 Да). Также имеются значительные отличия в структуре, влияющие на ионизацию. Так, в масс-спектрах исследуемых нами стандартов сигналы родительских ионов микроцистина-LR и микроцистина-YR наблюдаются в однозарядной форме, в то время как для микроцистина-RR характерна двузарядная форма (рис. 3). Это оказывает принципиальное влияние на выбор метода фрагментации. В связи с особенностями режима фрагментации CID, а именно "правилом
1/3", описанным выше, для микроцистинов-LR ( m / z 995.56) (рис. 5) и аналогично для микроцис-тина-YR ( m / z 1045.54) невозможно получить фрагментный масс-спектр в диапазоне масс ниже m / z 250 , и, следовательно, идентификация соединения по характеристичному иону (ADDA-фрагменту) становится невозможной. В случае микроцистина-RR диапазон масс значительно сужается, для двузарядного иона m / z 519.79 (рис. 6), что позволяет в полной мере зарегистрировать фрагментные ионы в области низких масс при достаточной энергии разбиения, что продемонстрировано на рис. 6, А, С. Как и в случае анатокси-на-а для микроцистина-RR оба метода фрагментации при высокой энергии разбиения позволяют получить ион с m / z 135.1 и тем самым отнести соединение к классу микроцистинов. Т. е. выбор метода фрагментации не влияет на качество анализа, что неверно для двух остальных исследуемых микроцистинов. Невозможность получить характеристичный ион в режиме CID приводит к необходимости использовать оба режима фрагментации. Для подтверждения наличия ADDA-фрагмента с m / z 135.08 был использован режим HCD при высокой энергии (рис. 5, D), в то время как при необходимости установления целиком структуры микроцистинов более удобен CID-режим, позволяющий получить более насыщенный сигналами спектр в области, близкой к массе родительского иона. Из чего можно сделать вывод, что при анализе микроцистинов целесообразно применять оба режима фрагментации, которые в этом случае будут взаимно дополнять друг друга, обеспечивая точную идентификацию.
Relative Abundance

Full ms, m/z100.00-1100.00
995.56
100 я
395,56
Cut off
В
ms2 995.56; cid15%. m/z 270 00-1100.00
443.2390.84 599 47 696.55 847.31314.93
100 :
967,56
Cut off
135,08
599.39
553.31
527.77 483.15
574 15
866.'
953.31
C
ms2 995,56; cid25%, m/z 270 00-1100 00
D
674 14 75$ 10 1040.84
■ mftrftfnttjniVTimfri^tTW|titrTf ms2 995.56; hcd45% m/z 50.00-1100.00 1000 m/z Рис. 5. Результаты фрагментации MC-LR в режиме фрагментации CID и HCD ms2 519.79; hcd35%; m/z 50.00-550.00 ms2 519.79. cid15%; m/z 100.00-550.00 ms2 519.79, cid35%, m/z 100.00-550.00 368 70 405 22 IN#N j lWWH It I. Рис. 6. Результаты фрагментации MC-RR в режиме фрагментации CID и HCD Таким образом, в результате работы было показано, что оптимизированная методика одновременного анализа нейро- и гепатотоксинов позволяет детектировать анатоксин-а и микроцистины -LR, -RR и -YR в составе сложных матриц с уровнем чувствительности ниже безопасных уровней их содержания в воде водоемов рекреационных зон, принятых в некоторых странах [21, 26, 27]. Работа выполнена при поддержке РФФИ (грант № 11-05-01067-а).