Оптимизация поиска высокоэффективных штаммов клубеньковых бактерий для инокуляции бобовых растений
Автор: Баймиев А.Х., Коряков И.С., Акимова Е.С., Владимирова А.А., Матниязов Р.Т., Баймиев А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Сельскохозяйственная микробиология
Статья в выпуске: 5 т.58, 2023 года.
Бесплатный доступ
Высокоэффективные штаммы клубеньковых бактерий служат основой микроудобрений, используемых при выращивании бобовых растений. Применяя искусственную инокуляцию ризобиями, можно добиться значительного повышения урожайности этих культур. Самый распространенный способ поиска высокоэффективных штаммов указанных микроорганизмов - их выделение из клубеньков самих растений с последующей селекцией штаммов, наиболее эффективно влияющих на урожайность культуры. В настоящей работе нами были проанализированы бактерии, полученные из клубеньков, собранных на разных этапах развития растений трех видов бобовых - лядвенца рогатого ( Lotus corniculatus L.), клевера гибридного ( Trifolium hybridum L.), козлятника восточного ( Galega orientalis Lam.). Показано, что каждое растение вступает в симбиоз только с одним определенным видом бактерии, но с большим числом его генетических вариантов, каждый из которых потенциально может обладать индивидуальными симбиотическими характеристиками. Наибольшее разнообразие штаммов было обнаружено в клубеньках клевера гибридного, а высокой однородностью характеризовались микросимбионты козлятника восточного. Было установлено, что в начале развития всех трех взятых в анализ видов растений клубеньки сформированы наиболее разнообразными штаммами ризобий, обладающими высоким разбросом значений азотфиксирующей активности: для микросимбионтов лядвенца рогатого - от 3,17 до 32,70 N2·растение-1·ч-1, для микросимбионтов козлятника восточного - от 10,08 до 30,75 N2˛растение-1·ч-1, для микросимбионтов клевера гибридного - от 9,91 до 32,42 N2·растение-1·ч-1, и среди них чаще, чем в другие периоды, встречаются высокоэффективные штаммы. В середине же вегетационного периода бактерии, которые образуют клубеньки на корнях исследуемых бобовых растений, имеют относительно выравненные значения эффективности фиксации азота (для микросимбионтов лядвенца рогатого - от 6,35 до 19,13 N2·растение-1·ч-1, для микросимбионтов козлятника восточного - от 15,51 до 23,47 N2·растение-1·ч-1, для микросимбионтов клевера гибридного - от 11,61 до 20,53 N2·растение-1·ч-1), и по величине эти показатели ниже максимальной активности, обнаруживаемой у штаммов в клубеньках в начале вегетации. В конце жизненного цикла клубеньки на корнях анализируемых растений сформированы микроорганизмами, которые с разной эффективностью фиксируют азот, но все же уступают по этому показателю наиболее активным «весенним» штаммам. Таким образом, мы полагаем, что поиск эффективных штаммов клубеньковых бактерий наиболее продуктивен на начальном этапе развития растения.
Ризобии, бобовые растения, lotus corniculatus l, лядвенец рогатый, trifolium hybridum l, клевер гибридный, galega orientalis lam, козлятник восточный, фаза вегетации, азотфиксация, высокоэффективные штаммы
Короткий адрес: https://sciup.org/142239864
IDR: 142239864 | УДК: 579.64:579.262 | DOI: 10.15389/agrobiology.2023.5.864rus
Текст научной статьи Оптимизация поиска высокоэффективных штаммов клубеньковых бактерий для инокуляции бобовых растений
Применение искусственной инокуляции клубеньковыми бактериями (ризобиями) при выращивании бобовых культур приводит к значительному увеличению урожайности этих растений. Впервые ризобии из корневых клубеньков бобовых выделил и затем получил в культуре нидерландский ученый М.В. Бейеринк (Martinus Willem Beijerinck, 16.03.1851-01.01.1931) в 1888 году, а первый биопрепарат на их основе был произведен в Германии в 1896 году под торговым названием нитрагин. В СССР первые партии этого удобрения были произведены в 1930-1935 годах (1). С тех пор для выращивания многих бобовых растений применяются различные биопрепараты, основу которых составляет штаммы клубеньковых бактерий. Поскольку ри-зобии обладают специфичностью по отношению к растению-хозяину, каждый препарат можно применять только на определенной культуре в зависимости от того, какой штамм бактерий в нем содержится (2-4).
∗ Работа была выполнена с привлечением приборного парка ЦКП «Биомика» (отделение биохимических методов исследований и нанобиотехнологии РЦКП «Агидель») и УНУ «КОДИНК». Работа выполнена при финансовой поддержке Российского научного фонда (проект РНФ ¹ 22-24-00207).
Для изготовления препаратов с использованием клубеньковых бактерий прежде всего необходимо выделить и подобрать производственный штамм ризобий, соответствующий бобовому растению определенного вида. Обычно бактерии выделяют непосредственно из клубенька: из крупного клубенька розового цвета, окрашенного леггемоглобином, извлекают небольшое количество растительной ткани и шпателем растирают ее по поверхности агара в чашке Петри. После определенных процедур селекции полученный штамм может быть использован для предпосевной инокуляции при выращивании культуры.
Со времени открытия клубеньковых бактерий проведены масштабные научные исследования принципов и генетических механизмов возникновения и функционирования бобово-ризобиального симбиоза, выявлены и описаны участвующие в этом процессе компоненты как со стороны растения, так и со стороны бактерий (5-8). Так, теперь известно, что за образование симбиоза с растением у бактерий отвечают многочисленные гены, обозначаемые как sym -гены, продукты которых вовлечены в микробно-растительное взаимодействие на разных стадиях этого процесса. К sym -генам относятся ответственные за фиксацию азота nif -гены, кодирующие синтез и регуляцию фермента нитрогеназы, nod -гены, которые кодируют синтез Nod-факторов (НФ), отвечающих за инициацию и специфичность образуемого симбиоза, а также fix -гены, также необходимые для азотфиксации, которые часто сцеплены с nif -генами, но не гомологичны им (9, 10).
Известно, что ризобии обладают высокой пластичностью генома, которая связана с их рекомбинационной активностью и участием в интенсивном горизонтальном переносе генов. Вследствие этого в ризосфере растений образуется большое число различных штаммов клубеньковых бактерий, обладающих разными симбиотическими активностями (11). В зоне умеренного климата, где присутствует смена сезонов, бобовые растения каждый свой жизненный цикл начинают с выбора своих микросимбионтов, проводя их селекцию. В дикой природе этот выбор подчинен большому количеству различных факторов: эдафических, климатических, биологических и абиотических. В результате образуется мутуалистическое взаимодействие, эффективность которого соизмерима с уровнем возможности растения обеспечить в клубеньках фиксацию азота, что позволяет ему, в конечном счете, конкурировать с другими организмами и оставлять себе потомство. Это в итоге приводит к образованию симбиотического взаимодействия разной эффективности и соответственно к взаимодействию с клубеньковыми бактериями, обладающими разными симбиотическими характеристиками.
У дикорастущих бобовых растений симбиоз возникает со штаммами ризобий, имеющими разную азотфиксирующую активность. Но в сельском хозяйстве для получения высоких урожаев требуются наиболее эффективные варианты клубеньковых бактерий, способные максимально обеспечивать растение фиксированным азотом. Следовательно, возникает необходимость отбора из большого количества штаммов, образующих клубеньки на корнях бобовых растений, тех вариантов, которые бы обладали наибольшей эффективностью и при предпосевной обработке в высоких концентрациях обеспечивали бы формирование азотфиксирующих клубеньков, образованных преимущественно ими, а не аборигенными вариантами ризобий. Эта проблема по сей день остается актуальной, поскольку складываются новые условия выращивания растений и появляются новые сорта, которые могут по-другому реагировать на штаммы бактерий, применявшиеся ранее для инокуляции.
В настоящей работе, сравнив азотфиксирующую активность клу- беньков на разных стадиях развития растения у представителей трех видов бобовых, мы выявили ее различия. На этом основании впервые сформулировано предположение, что поиск штаммов клубеньковых бактерий с наибольшими азотфиксирующими возможностями целесообразнее вести на начальном этапе развития растения.
Цель работы заключалась в том, чтобы выяснить, в какой период вегетации растения поиск высокоэффективных штаммов клубеньковых бактерий будет наиболее продуктивным.
Методика. Симбиотические бактерии были выделены из клубеньков растений лядвенца рогатого ( Lotus corniculatus L.), клевера гибридного ( Trifoliuт hybridum L.) и козлятника восточного ( Galega orientalis Lam.). С каждого растения получили по 30 изолятов. Клубеньки собирали на разных стадиях вегетации растения-хозяина: весной (во время набухания почек, апрель-май), летом (в период формирования бутонов, июнь) и осенью (после закладки растениями почек на зиму с первыми заморозками). Клубеньковые бактерии изолировали методом пункций ткани клубенька из зоны размножения микроорганизмов с последующим рассевом до отдельных колоний на питательной среде YM (0,1 % дрожжевой экстракт, 1 % маннит, 0,05 % К 2 НРО 4 , 0,05 % MgSO 4 , 0,01 NaCl, 1,5 % агар) (12). В исследование брали по одному изоляту, полученному из каждого клубенька.
Бактериальную ДНК выделяли лизированием клеток в 1 % Triton X-100 и 1 % суспензии Chelex 100 («Bio-Rad», США). Для этого небольшое количество бактериальной массы помещали в пробирки со 100 мкл 1 % Triton X-100 и 1 % суспензией Chelex 100, тщательно ресуспендировали и инкубировали при 95 ° С в течении 10 мин. Суспензию центрифугировали при 12000 g в течение 3 мин. Надосадочную жидкость использовали в качестве матрицы для PCR.
Генетическое разнообразие исследуемых штаммов оценивали с помощью RAPD-анализа (random amplified polymorphic DNA) (13) со случайными праймерами LMBD 5´-gggcgctg-3´, AFK1 5´-caggcccatc-3´ и OPA 5´-gcgtccattc-3´ на приборе iCycler («Bio-Rad», США) при режиме: денатурация — 95 ° С, 30 с, отжиг праймера — 33 ° С, 40 с, элонгация — 72 ° С, 1 мин 20 с, 35 циклов.
Для PCR-RFLP-анализа (restriction fragment length polymorphism) (14) гена 16S рРНК использовали мелкощепящие эндонуклеазы рестрикции Kzo91 и HaeIII. Ген 16S рРНК был амплифицирован с помощью универсальных праймеров fD1 5´-cccgggatccaagcttaaggaggtgatccagcc-3´, rD1 5´-ccgaa-ttcgtcgacaacagagtttgatcctggctcag-3´, фланкирующих фрагмент гена размером около 1500 п.н. (15). Для амплификации гена recA использованы праймеры RecAF 5´-ggcagttcggcaagggctcgat-3´ и RecAR 5´-atctggttgatgaagatcaccat-3´ (16).
Нуклеотидные последовательности определяли на автоматическом секвенаторе Applied Biosystems 3500 («Applied Biosystems, Inc.», США) с использованием наборов Big Dye Terminator v.3.1 («Thermo Fisher Scientific», США) в соответствии с протоколом производителя. Анализ нуклеотидных последовательностей проводили с помощью пакета компьютерных программ LaserGene («DNAStar, Inc.», США). Нуклеотидные последовательности для сравнительного анализа были взяты из базы данных GenBank .
Филогенетический анализ исследуемых штаммов осуществляли на основании множественного выравнивания (ClustalW) секвенированных фрагментов генов 16S рРНК и recA . Филогенетические деревья строили методом neighbor-joining (NEIGHBOR) с помощью программы Megalign из пакета 866
программ LaserGene. Статистическую достоверность ветвления (bootstrap-анализ) оценивали с использованием соответствующей функции программы Megalign на основе 1000 альтернативных деревьев.
Азотфиксирующую эффективность клубеньковых бактерий оценивали по редукции ацетилена (17). Для этого получали инокулированные растения, далее от побега отделяли корни, промывали их стерильной водой и помещали в стеклянные флаконы объемом 15 мл (в одну емкость корни от одного растения). Флаконы закрывали резиновыми пробками и вводили ацетилен (10 % по объему). Флаконы с образцами и контрольными пробами (с ацетиленом и без него) помещали в темное место. Через 1 ч определяли содержание ацетилена и этилена (по времени выхода каждого газа) на газовом хроматографе с пламенным ионизационным детектором (GC-2014, «Shimadzu», Япония) по стандартному протоколу, рассчитывая количество ацетилена и этилена по калибровочной кривой. Величину азотфиксирую-щей активности вычисляли по формуле: X = C э/ 3, где C э — концентрация этилена в исследуемом образце, 3 — коэффициент пересчета от редукции ацетилена к азотфиксации.
Каждый штамм анализировали в трех биологических повторностях. Вычисляли средние значения ( М ) и стандартные ошибки средних (±SEM).
Результаты. В почве в естественных условиях содержится большое разнообразие штаммов ризобий, имеющих разную симбиотическую эффективность. Бобовое растение при прорастании из семени либо после пробуждения весной, если речь идет о многолетнем виде, начинает взаимодействовать с клубеньковыми бактериями, что приводит к образованию азот-фиксирующих клубеньков, в которых непосредственно и происходит в дальнейшем фиксация атмосферного азота (2, 18, 19). Формирование этого взаимодействия подчинено генетически запрограммированному как со стороны растения, так и со стороны бактерии ( nod -гены) процессу, в ходе которого бобовые и микроорганизмы обмениваются биохимическими сигналами. Последние в конечном итоге запускают процессы проникновения бактерий в корень и образования структуры клубенька (20-22). При этом растение не может оценить азотфиксирующую активность штамма, поскольку за нее отвечают nif -гены (в большей степени) совместно с другими генами ризобий, которые так или иначе влияют на процесс фиксации азота.
Таким образом, бобовые растения могут вступать в симбиоз с разными по эффективности штаммами, причем формирование клубеньков будет происходить в течение всего вегетационного периода, но с разной интенсивностью. Для того чтобы понять, в какой момент своего развития бобовые взаимодействуют с наиболее активно фиксирующими азот штаммами ризобий, мы собрали клубеньки с корней лядвенца рогатого ( Lotus cornicul-atus L.), клевера гибридного ( Trifoliuт hybridum L.) и козлятника восточного ( Galega orientalis Lam.). на разных стадиях их вегетации. Из клубеньков, собранных с корней растений, произрастающих в одной и той же точке, были выделены чистые культуры клубеньковых бактерий.
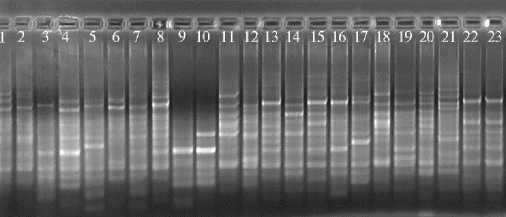
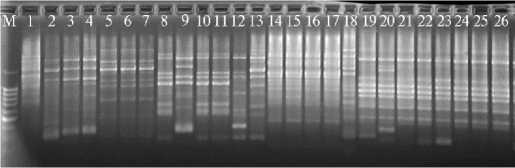
Анализ генетического полиморфизма методом RAPD показал, что бактерии, образующие клубеньки на корнях исследуемых растений, имеют разную степень полиморфности в зависимости от растения-хозяина. Наиболее гетерогенными оказались бактерии клевера гибридного, наименее — козлятника восточного (рис. 1). Эта закономерность наблюдалась как у штаммов, полученных из весенних клубеньков, так и у штаммов из клубеньков, собранных на последующих стадиях развития растений.
Ризобии клевера гибридного Trifolium hybridum L.
Ризобии лядвенеца рогатого Lotus corniculatus L.
Ризобии козлятника восточного Galega orientalis Lam.
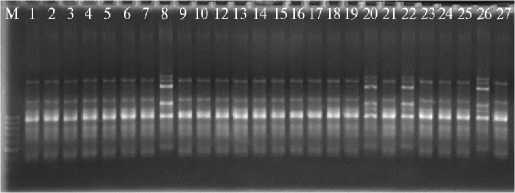
Рис. 1. Примеры электрофореграмм RAPD-профилей изолятов бактерий, полученных из клубеньков бобовых растений в начале вегетации. Цифрами обозначены номера изолятов; М — 100 п.н. маркер длин ДНК (ЗАО «Евроген», Россия).
С целью определения видового состава бактерий мы провели PCRRFLP-анализ, в ходе которого были выявлены филогенетически однородные группы микроорганизмов. Далее у представителей таких групп были секвенированы гены 16S рРНК и recA .
Методом сравнительного анализа определенных нуклеотидных последовательностей с аналогичными последовательностями из базы данных GenBank мы выявили филогенетическое положение исследуемых штаммов микроорганизмов (рис. 2). Установлено, что все изолированные штаммы ри-зобий из клубеньков лядвенца рогатого по последовательности как гена 16S рРНК, так и гена recA принадлежат к роду Mesorhizobium , бактерии из клубеньков клевера гибридного относятся к виду Rhizobium leguminosarum , а микроорганизмы из клубеньков козлятника восточного — к виду Neo-rhizobium galegae .
Нуклеотидные последовательности изученных штаммов зарегистрированы в базе данных GenBank под следующими номерами:
ген 16S рРНК: ON810504, ON819719, ON892022, ON834569-ON834571, OQ443231, OQ281287, OQ281289, OQ281290, OQ291567-OQ291569, OQ443237, OQ443238, OQ443243 OL872741, OL884458, OL884630, OL884456, OL884437, OM914882, OM914885, OM914886, OL884438, OL884442, OL884446;
recA : ON932443, ON932444, ON932446, ON932448-ON932450, OP899408, OQ102258, OQ102259, OQ102262-OQ102265, OQ111928-OQ111930, OM752310, OM811972, OM811974, OM811975, OM888662, OM888663, OM913901, OM913902, OM942752-OM942754.
КПО
52.7
63.4rTSp4
26,lp-TSpG9 "4.4-TSpA9 ;..;rlSp5.<1 «.8 LTSpl.3
83 2^TSA3.3
62,7
97,2
70,1
48,1
TS3.5
А
Б
67,6|GS1.1
В
77,0| LS2.6
29,3
57,4
1TSL1
: J TA3.8
г 1 TA2.13
lTA3.1
E Rhizobium leguminosarum bv. trifolii (CP050I03) Rhizobium leguminosarum bv. viciae (U2938) TSp9.3
TS3.2
— Rhizobium galegae (DI 1343)
100,0
94.6
02,2
62,6
CS2.1 GSp9.3 GSp7.1 GSp2.17 GSp4.2 GA3.15
GA4.17 GAI 1.8
99 J
52.3-бЛрЗ.!
*— Dhi-oki;
Rhizobium galegae (DI 1343)
Sinorhizobium meliloli (X67222) 1Q0.0j— Mesorhizobium deed (U07934) *— Mesorhizobium loti (X67229)
l4 ^ Bradyrhizobium japonicum (X66024)
14 12 10 8 6 4 2 6
Nucleotide Substitutions (xlOO)
Bootstrap Trials = 1000, seed = 100
10D.
12,0.
10 8 6 4 2 6
--------Rhizobium leguminosarum bv. viciae (U2938)
Sinorhizobium meiiloti (X67222)
—— Sinorhizobium medicae (L39882)
100.0 |— Mesorhizobium loti (X67229)
Mesorhizobium ciceri (U07934)
Ц Bradyrhizobium betae (AY372184)
Bradyrhizobium japonicum (X66024)
Nucleotide Substitutions (xlOO)
Bootstrap Trials = 1000, seed = 100
99,9
96,5
20, St-
82,1
96.6
70,9
33,0
94,4
57,8
34,3
LS1.5
LAS.12
LA2.22
LSp3,15
LS3.1
LSL8
Mesorhizobium ciceri (U07934)
Mesorhizobium loti (X67229)
LSp2.7
г LSA4.1
Г LAI.10
4- LA3.3
U LSA4.3
.5L3

100,1
64.3|~
*— LSp3
LS4.5
LSA4.1
Mesorhizobium amorphae (AF041442)
Mesorhizobium septentrionale (AF508207)
LSA3.1
Sinorhizobium medicae (L39882)
Sinorhizobium meliloti (X67222)
Rhizobium galegae (Dl 1343)
"" Rhizobium leguminosarum bv. viciae (U2938)
JQtUQ]--- Bradyrhizobium betae (AY372I84)
Bradyrhizobium japonicum (X66024)
10 5 0
Nucleotide Substitutions (xlOO)
Bootstrap Trials = 1000, seed = 100
Рис. 2. Филогенетический анализ клубеньковых бактерий у изученных видов бобовых на основании сравнительного анализа последовательностей гена 16S рРНК: А — клевер гибридный ( Trifolium hybridum L.), Б — козлятник восточный ( Galega orientalis Lam.), В — лядвенец рогатый ( Lotus corniculatus L.). Жирным шрифтом отмечены штаммы микроорганизмов, исследованные в настоящей работе.
Для выявления различий по эффективности штаммов клубеньковых бактерий мы сравнили их азотфиксирующую активность (табл.). В анализ взяли по 10 штаммов для каждого вида растений, которые были выделены из клубеньков, собранных в каждый из периодов развития. Установлено, что в среднем азотфиксирующая активность изолятов из клубеньков, которые были собраны в весенний период, выше по сравнению с летними изо-лятами (см. табл.). Такая тенденция была обнаружена при анализе ризобий у всех исследованных растений. К середине вегетационного периода азот-фиксирующая активность клубеньковых бактерий снижается, а у микроорганизмов, формирующих осенние клубеньки, она варьирует в зависимости от растения-хозяина.
Азотфиксирующая эффективность штаммов ризобий, выделенных из клубеньков, собранных на разных этапах вегетации растения-хозяина (N 2 •растение -1 •ч -1 , среднее из 3 повторностей, M ±SEM)
|
Весна |
Лето |
Осень |
|||
|
штамм |
азотфиксирую-щая эффективность |
штамм |
азотфиксирую-щая эффективность |
штамм |
азотфиксирую-щая эффективность |
|
Ризобии |
лядвенеца |
р о г ато го Lotus corniculatus L. |
|||
|
LSp1 |
3,17±0,61 |
LS1.5 |
10,21±0,60 |
LA1.10 |
4,01±0,34 |
|
LSp2.7 |
19,10±0,92 |
LS1.8 |
9,18±0,83 |
LA1.12 |
7,13±0,45 |
|
LSp3 |
32,70±1,71а |
LS2.1 |
10,49±0,82 |
LA2.22 |
6,62±0,62 |
|
LSp3.8 |
12,24±0,34 |
LS2.6 |
19,13±0,88 |
LA3.3 |
15,19±0,75 |
|
LSp3.10 |
11,53±0,81 |
LSA3.1 |
8,15±0,45 |
LA5.2 |
16,30±0,37 |
|
LSp3.15 |
23,97±0,98 |
LS3.3 |
8,42±0,76 |
LA5.7 |
6,64±0,85 |
|
LSp4.1 |
10,85±0,23 |
LSA4.1 |
9,56±0,65 |
LA5.12 |
10,12±0,77 |
|
LSp4.3 |
9,34±0,46 |
LSA4.3 |
8,34±0,73 |
LA6 |
5,54±0,65 |
|
LSp4.8 |
10,34±0,34 |
LS4.4 |
6,35±0,43 |
LA6.3 |
4,99±0,46 |
|
LSp4.11 |
7,85±0,45 |
LS4.5 |
7,06±0,54 |
LA6.4 |
5,54±0,53 |
|
Р из о б ии ко злятника в о с точн о го Galega orientalis Lam. |
|||||
|
GSp1.5 |
15,03±0,89 |
GS1 |
23,47±0,98 |
GA3.11 |
23,21±1,34 |
|
GSp2.17 |
29,56±1,21 |
GS1.1 |
15,51±0,76 |
GA3.15 |
20,35±1,23 |
|
GSp3.1 |
24,31±1,01 |
GS1.6 |
19,13±0,56 |
GA4.3 |
21,01±1,54 |
|
GSp3.3 |
19,27±0,78 |
GS2.1 |
21,45±0,87 |
GA4.9 |
20,99±1,02 |
|
GSp4.2 |
10,09±0,65 |
GS2.8 |
17,17±0,65 |
GA4.17 |
25,39±0,98 |
|
GSp7.1 |
26,76±1,34 |
GS3 |
17,20±0,98 |
GA6.2 |
20,41±0,67 |
|
GSp7.4 |
11,42±0,76 |
GS3.3 |
19,23±1,03 |
GA7 |
22,13±1,06 |
|
GSp9.3 |
17,65±0,98 |
GS3.4 |
16,40±0,78 |
GA9.5 |
19,45±0,89 |
|
GSp9.7 |
30,75±1,34а |
GS3.7 |
16,67±1,13 |
GA11.8 |
18,81±0,77 |
|
GSp9.9 |
12,78±0,24 |
GS3.8 |
18,11±0,99 |
GA11.9 |
20,71±1,23 |
|
Ризобии |
кл ев е р а ги бр ид н о г о Trifolium hybridum L. |
||||
|
TSpA4 |
25,17±0,34 |
TS1.1 |
20,53±1,08 |
TA1.2 |
25,61±1,01 |
|
TSp1.3 |
12,26±0,98 |
TS2.2 |
16,70±0,98 |
TA1.7 |
16,76±0,99 |
|
TSpA9 |
13,42±1,06 |
TS2.3 |
17,51±0,79 |
TA2.3 |
12,92±1,03 |
|
TSp2.4 |
32,42±1,90а |
TS3 |
13,73±0,56 |
TA2.5 |
19,24±0,67 |
|
TSp3.1 |
28,61±1,05 |
TS3.2 |
15,38±0,89 |
TA2.13 |
16,16±0,97 |
|
TSp4 |
27,18±1,35 |
TS3.3 |
13,20±0,67 |
TA3.1 |
14,56±0,89 |
|
TSp5.6 |
30,24±0,98 |
TS3.4 |
14,51±0,89 |
TA3.2 |
20,02±1,22 |
|
TSpV1 |
12,48±0,56 |
TS3.5 |
12,34±0,78 |
TA3.6 |
12,31±0,95 |
|
TSpG9 |
14,27±0,78 |
TS4.1 |
13,91±0,79 |
TA3.8 |
11,56±0,68 |
|
TSp9.3 |
9,91±0,52 |
TS4.2 |
11,61±0,98 |
TA3.9 |
12,46±0,78 |
Пр им еч ан и е. Буквой а отмечены наибольшие значения.
Так, азотфиксирующая эффективность бактерий лядвенца рогатого, полученных из клубеньков, собранных в весенний период, в среднем составляет 14,11 мкг N2•растение-1•ч-1, из летних клубеньков — 9,59 мкг N2•растение-1•ч-1, а из осенних — 98,19 мкг N2•растение-1•ч-1. Для ризо-бий клевера гибридного эти показатели равны соответственно 20,61; 14,94 и 16,16 мкг N2•растение-1•ч-1, для микроорганизмов козлятника восточного — 19,76; 18,40 и 21,24 N2•растение-1•ч-1. При рассмотрении по отдельности изолятов, полученных из весенних, летних и осенних клубеньков, обнаруживается любопытная закономерность. Бактерии из весенних клубеньков характеризуются высоким разбросом по азотфиксирующей актив- ности. Так, у лядвенца рогатого верхние и нижние показатели составляют в среднем соответственно 37,7 и 3,17 мкг N2•растение-1•ч-1, тогда как микроорганизмы из летних клубеньков демонстрируют более выравненные значения (см. табл.). То же оказалось характерно для ризобий растений других исследованных видов. А вот изоляты, выделенные из осенних клубеньков, начинают различаться по этим параметрам. Очевидно, что растения при взаимодействии со значительным разнообразием штаммов клубеньковых бактерий в начале вегетации реализуют шанс отобрать для себя наиболее подходящие варианты микроорганизмов.
Применение ризобий для повышения урожайности бобовых остается приоритетом для биологической науки. Некоторые исследователи подчеркивают, что использование местных штаммов Rhizobium более предпочтительно, поскольку они лучше приспособлены к изменениям окружающей среды (23). Способность аборигенных штаммов положительно взаимодействовать с резидентной микробиотой почвы и их адаптируемость к местным агроэкологическим климатическим условиям часто объясняют их превосходство над экзотическими коммерческими штаммами (24, 25). Известно, что эффективность штаммов ризобий зависит не только от вида растения, но и от его сорта, поэтому для каждого сорта в идеале необходимо подбирать свои штаммы клубеньковых бактерий (26). В этой связи проблема поиска высокоэффективных штаммов ризобий не потеряет своей актуальности в обозримом будущем.
На сегодняшний день одним из самых распространенных способов поиска высокоэффективных штаммов клубеньковых бактерий является отбор наиболее продуктивных растений с последующим выделением из их крупных клубеньков микроорганизмов. Такой подход вполне функционален, но, на наш взгляд, не лишен недостатков. Дело в том, что к тому моменту, когда растения уже можно отбирать по фенотипу, они оказываются в той стадии вегетации, когда, по полученным нами данным, у них уже прошла селекция наиболее подходящих вариантов клубеньков. При этом растение, вероятно, выбрало клубеньки с оптимальной для него азотфик-сирующей активностью — не максимальной, но достаточной для нормального роста. Но для растениеводства необходимо получать сверхвысокие урожаи, чему может поспособствовать искусственная инокуляция бобовых, при которой растение можно заставить использовать высокоэффективные штаммы для формирования большей части клубеньков. Чем выше эффективность бактерий, тем выше урожайность бобовых. Как мы предполагаем, в обычных условиях растения в ходе своего развития предпочитают избавляться от единичных сверхактивных клубеньков, которые у них образовались в самом начале вегетации, поскольку такие клубеньки не выгодны самому растению, особенно если условия произрастания для него не совсем благоприятны. К таким условиям можно отнести эдафические, климатические факторы, а также факторы окружающей среды. Поэтому наиболее продуктивным, по нашему мнению, будет поиск высокоэффективных штаммов в клубеньках, образовавшихся в самом начале вегетации растения-хозяина. В этом случае есть вероятность обнаружить микроорганизмы с наибольшей азотфиксирующей активностью, которые к середине вегетационного периода уже просто будут утрачены. Кроме того, удачным, возможно, будет поиск эффективных ризобий в осенних клубеньках у многолетних растений. В этом случае растение скорее всего обеспечивает увеличение численности ризобий, чтобы они, перейдя в почву из своих структур, в новом сезоне стали кандидатами на следующее взаимодействие. При этом, поскольку трофические связи уже не играют значимой роли, в клубеньках могут оказаться бактерии с разной эффективностью азотфиксации, и есть вероятность обнаружить среди них весьма перспективные формы.
Итак, у трех изученных нами видов бобовых — лядвенеца рогатого ( Lotus corniculatus L.), козлятника восточного ( Galega orientalis Lam.) и клевера гибридного ( Trifolium hybridum L.) в начале вегетации клубеньки сформированы наиболее разнообразными штаммами ризобий с высоким разбросом значений азотфиксирующей активности. В этот период среди изолятов чаще всего встречаются высокоэффективные штаммы. В середине вегетации бактерии имеют относительно выравненную эффективность фиксации азота, при этом их азотфиксирующая активность ниже, чем у штаммов, выделенных в начале вегетации. В конце жизненного цикла растения состав ризобиальных изолятов достаточно разнообразен, но по эффективности фиксации азота они уступают штаммам из клубеньков молодых растений. Таким образом, мы впервые показали, что для наиболее продуктивного поиска высокоэффективных штаммов клубеньковых бактерий важен не только фенотип (значение этого параметра нами абсолютно не оспаривается), но и стадия развития растения. По нашему мнению, больше всего шансов обнаружить искомые штаммы именно в начале развития бобового растения среди первых сформировавшихся клубеньков.
Список литературы Оптимизация поиска высокоэффективных штаммов клубеньковых бактерий для инокуляции бобовых растений
- Терещенко H.1I. Биоудобрения на основе микроорганизмов. Томск, 2003.
- Онищук О.П., Курчак О.Н., Кимеклис А.К., Аксенова Т.С., Андронов Е.Е., Проворов Н.А. Биоразнообразие симбиозов, образуемых клубеньковыми бактериями Rhizobium leguminosarum c бобовыми растениями галегоидного комплекса. Сельскохозяйственная биология, 2023, 58(1): 87-99 (doi: 10.15389/agrobiology.2023.1.87rus).
- Ульянич П.С., Белимов А.А., Кузнецова И.Г., Сазанова А.Л., Юзихин О.С., Лактионов Ю.В., Карлов Д.С., Вишнякова М.А., Сафронова В.И. Эффективность азотфиксирующего симбиоза гуара (Cyamopsis tetragonoloba) со штаммами Bradyrhizobium retamae RCAM05275 и Ensifer aridi RCAM05276 в вегетационном опыте. Сельскохозяйственная биология, 2022, 57(3): 555-565 (doi: 10.15389/agrobiology.2022.3.555rus).
- Проворов Н.А., Тихонович И.А. Сельскохозяйственная микробиология и симбиогенетика: синтез классических идей и конструирование высокопродуктив ных агроценозов (обзор). Сельскохозяйственная биология, 2022, 57(5): 821-831 (doi: 10.15389/agrobiology.2022.5.821rus).
- Проворов Н.А., Воробьев Н.И. Генетические основы эволюции растительно-микробного симбиоза. СПб, 2012.
- Ferguson B.J., Mens C., Hastwell A.H., Zhang M., Su H., Jones C.H., Chu X., Gresshoff P.M. Legume nodulation: the host controls the party. Plant Cell Environ, 2019, 42(1): 41-51 (doi: 10.1111/pce.13348).
- Lindström K., Mousavi S.A. Effectiveness of nitrogen fixation in rhizobia. Microb. Biotechnol., 2020, 13(5): 1314-1335 (doi: 10.1111/1751-7915.13517.
- Ledermann R., Schulte C.C.M., Poole P.S. How Rhizobia adapt to the nodule environment. J. Bacteriol., 2021, 203(12): e0053920 (doi: 10.1128/JB.00539-20).
- Проворов Н.А. Эволюция генетических систем симбиоза у клубеньковых бактерий. Генетика, 1996, 32(8): 1029-1040.
- Franche C., Lindström K., Elmerich C. Nitrogen-fixing bacteria associated with leguminous and non-leguminous plants. Plant Soil, 2009, 321: 35-59 (doi: 10.1007/s11104-008-9833-8).
- Sachs J.L., Ehinger M.O., Simms E.L. Origins of cheating and loss of symbiosis in wild Bradyrhizobium. Journal of Evolutionary Biology, 2010, 23(5): 1075-1089 (doi: 10.1111/j.1420-9101.2010.01980.x).
- Баймиев Ан.Х., Птицын К.Г., Баймиев Ал.Х. Влияние интродукции караганы древовидной на состав ее клубеньковых бактерий. Микробиология, 2010, 79(1): 123-128 (doi: 10.1134/S0026261710010157).
- Williams J.G., Kubelik A.R., Livak K.J., Rafalski J.A., Tingey, S.V. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Research, 1990, 18(22): 6531-6535 (doi: 10.1093/nar/18.22.6531).
- Laguerre G., Mavingui P., Allard M.R., Charnay M.P., Louvrier P., Mazurier S.I., Rigottrier- Gois L., Amarger N. Typing of rhizobia by PCR DNA fingerprinting and PCR-restriction fragment length polymorphism analysis of chromosomal and symbiotic gene regions: application to Rhizobium leguminosarum and its different biovars. Applied and Environmental Microbiology, 1996, 62(6): 2029-2036 (doi: 10.1128/aem.62.6.2029-2036.1996).
- Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study. Journal of bacteriology, 1991, 173(2): 697-703 (doi: 10.1128/jb.173.2.697-703.1991).
- Баймиев Ан.Х., Иванова Е.С., Гуменко Р.С., Чубукова О.В., Баймиев Ал.Х. Анализ симбиотических генов клубеньковых бактерий бобовых растений Южного Урала. Генетика, 2015, 51(12): 1359-1367 (doi: 10.1134/S1022795415110034).
- Умаров М.М. Ассоциативная азотфиксация. М., 1989.
- Boivin S., Ait Lahmidi N., Sherlock D., Bonhomme M., Dijon D., Heulin-Gotty K., Le- Queré A., Pervent M., Tauzin M., Carlsson G., Jensen E., Journet E.P., Lopez-Bellido R., Seidenglanz M., Marinkovic J., Colella S., Brunel B., Young P., Lepetit M. Host-specific competitiveness to form nodules in Rhizobium leguminosarum symbiovar viciae. New Phytol., 2020, 226(2): 555-568 (doi: 10.1111/nph.16392).
- Sijilmassi B., Filali-Maltouf A., Boulahyaoui H., Kricha A., Boubekri K., Udupa S., Kumar S., Amri A. Assessment of genetic diversity and symbiotic efficiency of selected Rhizobia strains nodulating lentil (Lens culinaris Medik.). Plants, 2020, 10(1): 15 (doi: 10.3390/plants10010015).
- Lalitha S., Immanuel S.P. Biochemical characterization of Rhizobium and its impact on black gram and green gram plants. International Journal of Current Science, 2013, 9: 1-6.
- Yang J., Lan L., Jin Y., Yu N., Wang D., Wang E. Mechanisms underlying legume-rhizobium symbioses. J. Integr. Plant Biol., 2022, 64(2): 244-267 (doi: 10.1111/jipb.13207).
- Pervent M., Lambert I., Tauzin M., Karouani A., Nigg M., Jardinaud M.F., Severac D., Colella S., Martin-Magniette M.L., Lepetit M. Systemic control of nodule formation by plant nitrogen demand requires autoregulation-dependent and independent mechanisms. J. Exp. Bot., 2021, 72(22): 7942-7956 (doi: 10.1093/jxb/erab374).
- Mwangi, S.N., Karanja N.K., Boga H., Kahindi J.H.P., Muigai A., Odee D., Mwenda G.M. Genetic diversity and symbiotic efficiency of legume nodulating bacteria from different land use systems in Taita Taveta, Kenya. Tropical and Subtropical Agroecosystems, 2011, 13(1): 109-118.
- Meghvansi M.K., Prasad K., Mahna S.K. Symbiotic potential, competitiveness and compatibility of native Bradyrhizobium japonicum isolates to three soybean genotypes of two distinct agro-climatic regions of Rajasthan, India, Saudi. Journal of Biological Science, 2010, 17: 303-310 (doi: 10.1016/j.sjbs.2010.06.002).
- Sethi D., Mohanty S., Pattanayak S.K. Acid and salt tolerance behavior of Rhizobium isolates and their effect on microbial diversity in the rhizosphere of redgram (Cajanus cajan L.). Indian Journal of Biochemistry and Biophysics, 2019, 56(3): 245-252 (doi: 10.56042/ijbb.v56i3.27652).
- Румянцева М.Л., Владимирова М.Е., Мунтян В.С., Степанова Г.В., Саксаганская А.С., Кожемяков А.П., Орлова А.Г., Becker А., Симаров Б.В. Высокоэффективные штаммы клубеньковых бактерий люцерны (Medicago varia L.): молекулярно-генетическая характеристика и использование в сопряженной селекции. Сельскохозяйственная биология, 2019, 54(6): 1306-1323 (doi: 10.15389/agrobiology.2019.6.1306rus).


