Оптимизация процесса создания моделей кровеносных сосудов человека
Автор: Доль А.В., Иванов Д.В., Фомкина О.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Анатомия человека
Статья в выпуске: 2 т.15, 2019 года.
Бесплатный доступ
Цель: оптимизировать процесс биомеханического моделирования кровеносных сосудов на примере создания моделей артериального круга большого мозга. Материал и методы. Для выполнения биомеханического моделирования требуется создание пациент-ориентированной трехмерной твердотельной геометрической модели исследуемого объекта. Эта задача может быть решена при помощи компьютерной обработки данных компьютерной (КТ) или магнитно- резонансной (МРТ) томографии. Разработана программа, реализующая построение контуров кровеносных сосудов по отдельным срезам МРТ в полуавтоматическом режиме. Данные контуры в виде сохраненных в определенном формате кривых экспортируются в систему SolidWorks, где используются для создания трехмерных моделей кровеносных сосудов. Полученные таким образом модели учитывают персональные особенности строения сосудистого русла конкретного пациента и могут быть использованы в процессе биомеханического моделирования. Результаты. Приводятся результаты программной реализации рекурсивного метода фронтального роста для обработки двумерных срезов томограмм. Заключение. Разработанное программное обеспечение позволяет в полуавтоматическом режиме загружать DICOM- изображения и получать на их основе плоские сечения сосудов, а также передавать их для дальнейшей обработки в системы автоматизированного проектирования.
Артериальный круг мозга, артерии головного мозга, биомеханическое моделирование
Короткий адрес: https://sciup.org/149135303
IDR: 149135303 | УДК: 611.13(045)
Текст научной статьи Оптимизация процесса создания моделей кровеносных сосудов человека
или иной вариант оперативного пособия [1]. Для его выполнения требуется создание пациентоориентированной трехмерной твердотельной геометрической модели исследуемого объекта. Такая модель, в отличие от поверхностной, несущей информацию лишь о точках, ограничивающих объем тела, переда-
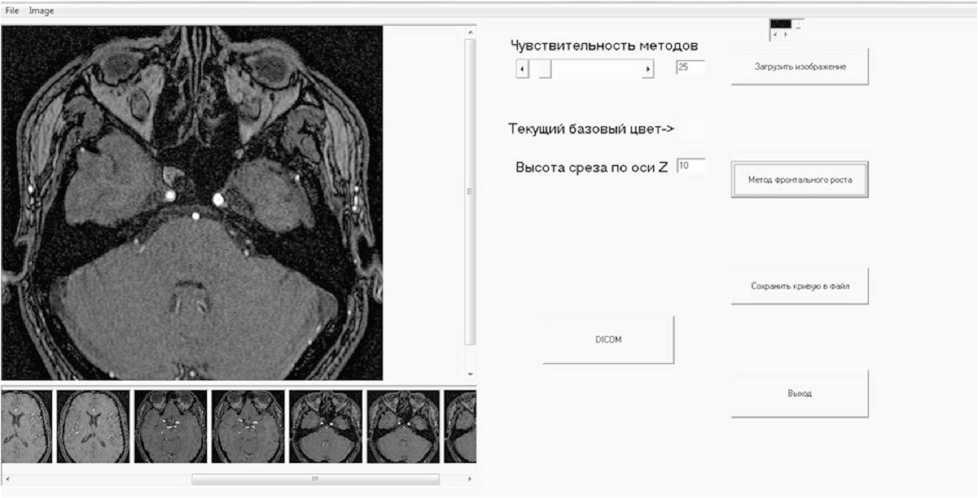
Рис. 1. Интерфейс разработанной программы
ет данные о каждой точке поверхности и внутреннего объема тела. В качестве исходных данных для этого, как правило, используют серии изображений, полученных с помощью магнитно-резонансной (МРТ) и компьютерной томографии (КТ).
Ранее нами рассматривалась и успешно применялась методика ручного построения твердотельных моделей артерий, основанная на использовании данных КТ с введением контрастного вещества и сведений о биомеханических свойствах, полученных в эксперименте на растяжение образцов артерий. Эта методика позволила создавать гладкие твердотельные модели, которые можно редактировать [2, 3]. Однако при необходимости выполнения серий численных расчетов данный процесс существенно тормозит исследовательский процесс [4].
Вопрос об автоматизации процесса построения трехмерных твердотельных геометрических моделей исследуемых биологических объектов на данный момент является одним из наиболее проблемных в области биомеханики, так как при автоматизации создания трехмерных моделей существенно снижается вероятность возникновения ошибок, которые могут появиться при ручном режиме обработки данных КТ и МРТ и привести к неверной трактовке результатов моделирования.
Исследователям в полной мере доступен лишь ручной способ создания твердотельных моделей, требующий серьезных затрат по времени и достаточно высокой квалификации исполнителя (как правило, инженера, а не медицинского работника) [5]. Частичная автоматизация процесса построения 3D-моделей биологических объектов доступна лишь для создания поверхностных образов [6].
При обработке данных КТ и МРТ чаще всего используются метод активного контура и метод фронтального роста [7, 8]. Есть коммерческие программные пакеты типа Mimics [9], которые имеют очень широкий функционал и в которых в том или ином виде данные методы реализуются. При этом их стоимость довольно высока, а аналогичные бесплатные пакеты (3D Slicer, VMTK, ITK Snap) имеют более узкую специализацию [10–12]. В основе этих пакетов лежат: метод активных контуров (ITK Snap), метод фронтального роста и метод определения уровня [13].
Таким образом, все доступные современные программы в полуавтоматическом режиме позволяют создавать только поверхностные модели, чаще всего STL. Подобные модели должны проходить последующую процедуру доработки, которая требует значительных временных ресурсов и, как было указано, специфических инженерных навыков. Результат таких доработок целиком и полностью зависит от квалификации пользователя, а вероятность возникновения ошибок и неточностей довольно высока.
Цель: оптимизировать процесс биомеханического моделирования кровеносных сосудов на примере создания моделей артериального круга большого мозга.
Материал и методы. В среде Delphi разработана программа, реализующая описанный метод, а также позволяющая пользователю подгружать отдельные изображения (срезы) томограммы для дальнейшей обработки, строить плоскую замкнутую кривую, соответствующую контуру определенного просвета сосуда, сохранять данные о построенной кривой в файл, формат которого соответствует формату хранения кривых в программном комплексе SolidWorks (рис. 1).
Метод рекурсивного двумерного фронтального роста позволяет отсекать (за счет выбора стартовой точки) все «лишние» срезы сосудов, которые наряду с интересующим сечением могут попадать на обрабатываемый срез. Если граница объекта определена, то алгоритм не подразумевает дальнейших проверок оставшихся пикселей для снижения числа операций и оптимизации использования ресурсов компьютера. При этом чувствительность метода (числовое значение для критерия подобия пикселей) может меняться пользователем вручную.
Последовательно обрабатывая с помощью данной программы срезы КТ с контрастным веществом пациента с виллизиевым кругом «классического» строения, получили набор кривых, которые далее были импортированы в программный комплекс SolidWorks. Здесь с применением инструмента «Бобышка по сечениям» были построены участки сосудов, которые далее соединялись инструментами «Бобышка по траектории» и «Скомбинировать тела». Следует отметить, что, так как не все сечения сосудов на срезах оказывались перпендикулярными к плоскости среза КТ, построить модель виллизиевого круга целиком одним инструментом «Бобышка по сечениям» на базе полученных кривых построить не удалось. В связи с этим потребовалась дополнительная доработка моделей, заключающаяся в объединении отдельных сосудистых участков в единую трехмерную твердотельную модель.
Исходные данные об изображении (каждом срезе томограммы) в ходе работы программы загружаются в виде двумерного массива пикселей, каждая ячейка которого содержит информацию о цвете, а индексы ячейки определяют ее положение на рисунке. При этом цвет пикселя хранится в формате RGB: в каждой ячейке содержится информация об интенсивности красного, зеленого и синего оттенков в диапазоне от 0 до 255. В качестве исходных данных использовались снимки КТ-исследования сосудов головного мозга, выполненного с контрастированием. Снимки содержались в файлах формата DICOM, и в ходе работы была реализована процедура выбора пользователем необходимого среза [14].
Алгоритм метода фронтального роста описан нами ранее, поэтому его математическое описание в данном исследовании будет пропущено [8]. В ходе его реализации в рамках нашей работы алгоритм реализован в виде рекурсивной процедуры. В качестве критерия подобия пикселей используется критерий близости среднего значения интенсивностей оттенка серого цвета текущего пикселя и стартового пикселя.
Перед началом работы алгоритма пользователь самостоятельно путем наведения курсора мыши указывает на изображении стартовый пиксель, который заведомо принадлежит объекту (в нашем случае — срезу сосуда). Для хранения информации об объекте и о просмотренных пикселях используется массив объекта. В качестве ячеек в нем используется запись, одно поле которой принимает значения 0, 1 или 2 (пиксель лежит снаружи объекта, внутри или на границе соответственно), а второе поле типа boolean принимает значение true, если пиксель был просмотрен, и false — если нет.
Таким образом, отметив стартовый пиксель как просмотренный, а также отметив, что данный пиксель относится к объекту (в соответствующем поле в ячейке массива объекта указывается 1), начинаем просматривать соседние по ребрам пиксели (т. е. пиксели, лежащие по диагонали от текущего, не просматриваются). Если критерий подобия удовлетворен, то переходим в соседний пиксель и из него запускаем метод фронтального роста. Если критерий подобия не срабатывает, то соответствующему полю массива объекта присваиваем значение true (пиксель просмотрен) и переходим к следующему соседу. Выход из рекурсии происходит тогда, когда у текущего пикселя не остается не просмотренных соседей.
Для поиска точек кривой, ограничивающей объект, пройдем по всем ячейкам массива объекта. Если в текущей ячейке содержится 1 (точка внутри области), а в одном из соседей по ребрам содержится 0, т. е. у пикселя есть сосед, лежащий вне объекта, то меняем значение в ячейке на 2: пиксель лежит на границе.
В случае, когда изображение имеет размерность NxN пикселей, необходимо будет совершить 4*N*N
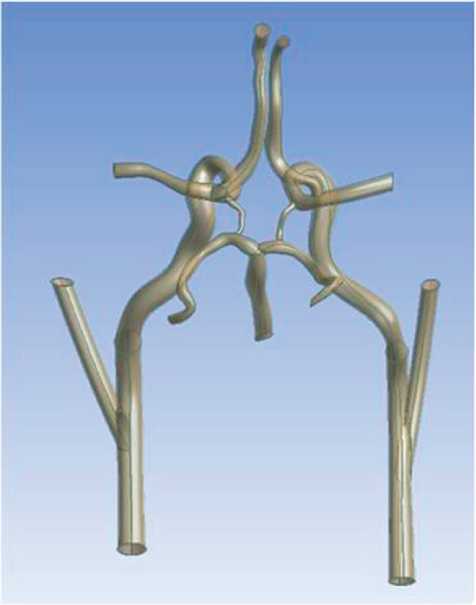
Рис. 2. Трехмерная модель артериального круга большого мозга классического строения операций проверки, так как у каждого пикселя есть 4 соседа по ребрам. Таким образом, сложность алгоритма составит O (N2).
Результаты. Результат моделирования вилли-зиева круга классического строения представлен на рис. 2.
Построение этой модели позволило провести моделирование данного участка сосудистого русла с наличием различных патологических изменений как в сонных артериях, так и с самом виллизиевом круге.
Разомкнутый виллизиев круг, в котором отсутствуют задние соединительные или передняя соединительная артерии, строился путем удаления соответствующих участков сосудистого русла в программном комплексе SolidWorks посредством инструментов «Разделить» и «Удалить твердое тело».
Поражение сонных артерий атеросклерозом моделировалось с помощью инструмента «Повернутая бобышка» путем построения профиля бляшки и поворота его вокруг оси сосуда.
На рис. 3–6 представлены модели с различными патологиями, построенные в рамках апробации описанного подхода к моделированию.
Обсуждение. Разработка и внедрение полуавтоматического режима создания твердотельных моделей позволит сделать процесс постановки и решения задачи биомеханики значительно проще и быстрее. Автоматизация снизит требования к квалификации исполнителя в аспекте технических наук, что даст возможность представителям медицинских специальностей проводить биомеханическое моделирование без помощи инженеров.
Кроме того, сокращение времени, требующегося на обработку данных медицинского диагностического оборудования, и возможность построения пациентоориентированных моделей участков сосудистого
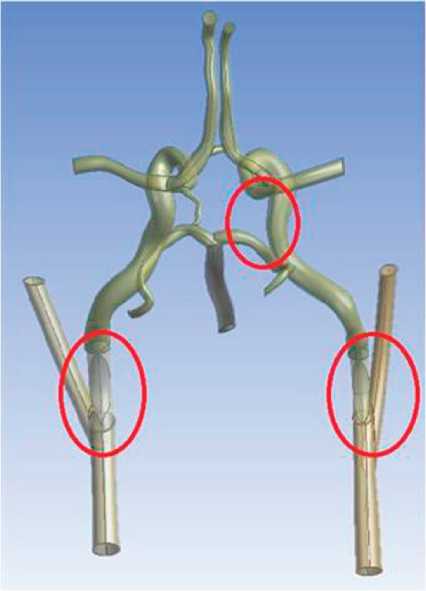
Рис. 3. Трехмерная модель варианта артериального круга большого мозга со стенозом внутренних сонных артерий и отсутствием правой задней соединительной артерии
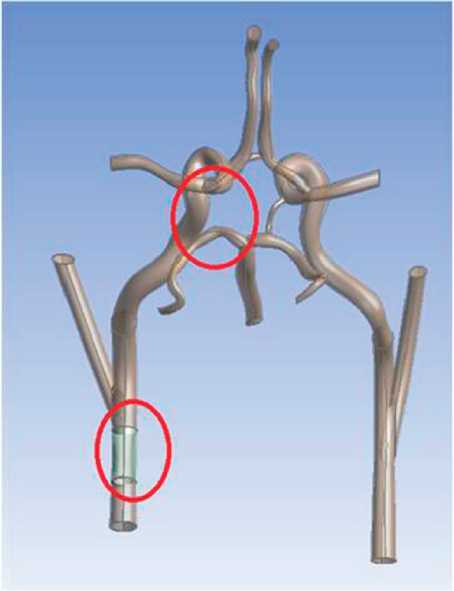
Рис. 5. Трехмерная модель варианта артериального круга большого мозга со стенозом левой внутренней сонной артерии и отсутствием левой задней соединительной артерии
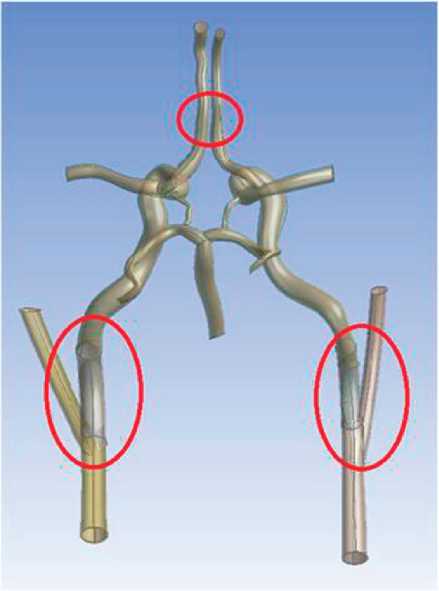
Рис. 4. Трехмерная модель варианта артериального круга большого мозга со стенозом внутренних сонных артерий и отсутствием передней соединительной артерии
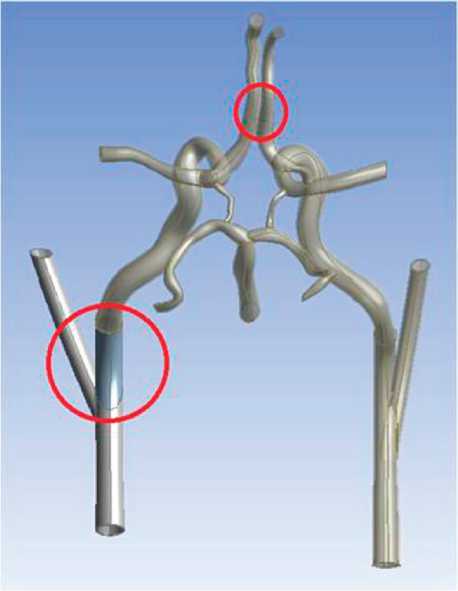
Рис. 6. Трехмерная модель варианта артериального круга большого мозга со стенозом левой внутренней сонной артерии и отсутствием передней соединительной артерии
русла в сжатые сроки позволят применять биомеханическое моделирование в процессе предоперационного планирования хирургических вмешательств.
Планируется использовать построенные твердотельные модели сосудов виллизиева круга при биомеханическом моделировании, нацеленном на выявление и обоснование возможных связей между стенозом сонных артерий и ассоциированных с ним аневризм сосудов головного мозга. Предположение о наличии такой связи содержится в медицинских статьях, посвященных клиническим исследованиям [15–17].
Биомеханическое моделирование с использованием персонифицированных моделей, как этап предоперационного планирования, активно внедряется не только в области сосудистой хирургии, но и в других областях медицины, например в травматологии и ортопедии [18, 19]. Авторы отмечают, что включение этапа биомеханических расчетов на стадии планирования операции позволит сократить количество осложнений и, как следствие, повысить качество медицинского обслуживания.
Заключение. В рамках работы программно реализован метод фронтального роста. Созданное приложение позволяет на основе данных медицинского диагностического оборудования в полуавтоматическом режиме создавать трехмерные твердотельные модели участков сосудистого русла. Такой подход позволяет существенно сократить время выполнения численного моделирования гемодинамики кровеносных сосудов.
В дальнейшем планируется провести серию численных расчетов, направленных на исследование гемодинамики виллизиева круга при наличии патологических изменений на данном участке сосудистого русла.
Список литературы Оптимизация процесса создания моделей кровеносных сосудов человека
- Трушель Н. А., Мансуров В. А. Математическое моделирование кровотока в области разветвления внутренней сонной артерии на конечные ветви. В кн.: Морфология - наука и практическая медицина: сборник научных трудов, посвященный 100-летию Витебского государственного медицинского университета им. Н. Н. Бурденко. Витебск, 2018; с. 377-83
- Фомкина О. А., Иванов Д. В., Кириллова И. В., Николенко В. Н. Биомеханическое моделирование артерий головного мозга при разных вариантах конструкции внутричерепных артерий вертебробазилярной системы. Саратовский научно-медицинский журнал 2016; 12 (2): 118-27
- Фомкина О. А. Закономерности индивидуально- типологической изменчивости морфометрических и биомеханических параметров артерий головного мозга: дис. … д-ра мед. наук. Саратов, 2017; 240 с.
- Ivanov D, Dol A, Pavlova O, Aristambekova A. Modeling of human circle of Willis with and without aneurisms. Acta Bioeng Biomech 2014; 16 (2): 121-9
- Shao H, Qin H, Hou Y, et al. Reconstructing 3D Model of Carotid Artery with Mimics and Magics. Advances in Information Technology and Education 2011; 201: 428-33
- Drapikowski P, Domagala Z. Semi-automatic segmentation of CT / MRI images based on active contour method for 3d reconstruction of abdominal aortic aneurysms. Image Processing & Communication 2014; 19 (1): 13-20
- Fresno M, Venere M, Clausse A. A combined region growing and deformable model method for extraction of closed surfaces in 3D CT and MRI scans. Computerized Medical Imaging and Graphics 2009; 33: 369-76
- Матвеенко В. П., Шардаков И. Н., Шестаков А. П. Алгоритм создания трехмерных образов органов человека по томографическим данным. Российский журнал биомеханики 2011; 15 (4): 20-32
- Jermyn M, Ghadyani H, Mastanduno MA, et al. Fast segmentation and high-quality three-dimensional volume mesh creation from medical images for difuse optical tomography. J Biomed Opt 2013; 18 (8): 86007
- Fedorov A, Beichel R, Kalpathy-Cramer J, et al. 3D Slicer as an Image Computing Platform for the Quantitative Imaging Network. Magnetic Resonance Imaging 2012; 30: 1323- 41
- Antiga L, Piccinelli M, Botti L, et al. An image-based modeling framework for patient-specifc computational hemodynamics. Med Biol EngComput 2008; 46 (11): 1097-112
- Yushkevich PA, Piven J, Hazlett HC, et al. User-guided 3D active contour segmentation of anatomical structures: Signifcantly improved efciency and reliability. NeuroImage 2006; 31: 1116-28
- Cao J, Wu X. A novel level set method for image segmentation by combining local and global information. Journal of Modern Optics 2017; 64 (21): 2399-412
- Bidgood WD, Horii SC, Prior FW, Van Syckle DE. Understanding and Using DICOM, the Data Interchange Standard for Biomedical Imaging. J Am Med Inform Assoc 1997; 4 (3) 199-212
- Suh BY, Yun WS, Kwun WH. Carotid artery revascularization in patients with concomitant carotid artery stenosis and asymptomatic unruptured intracranial artery aneurysm. Ann Vasc Surg 2011; 25 (5): 651-5
- Heman LM, Jongen LM, Van Der Worp HB, et al. Incidental intracranial aneurysms in patients with internal carotid artery stenosis. Stroke 2009; 40 (4): 1341-6
- Radak D, Sotirovic V, Tanaskovic S, Isenovic ER. Intracranial aneurysms in patients with carotid disease: not so rare as we think. Angiology 2014; 65 (1): 12-6
- Кудяшев А. Л., Хоминец В. В., Теремшонок А. В. и др. Биомеханические предпосылки формирования проксимального переходного кифоза после транспедикулярной фиксации поясничного отдела позвоночника. Российский журнал биомеханики 2017; 21 (3): 313-23
- Кудяшев А. Л., Хоминец В. В., Теремшонок А. В. и др. Биомеханическое моделирование при хирургическом лечении пациента с истинным спондилолистезом поясничного позвонка. Хирургия позвоночника 2018; 15 (4): 87-94.


