Оптимизация протокола интрамиокардиальной трансплантации с использованием люминесценции кардиальных мезенхимальных клеток, маркированных экспрессией люциферазы
Автор: Милевская Е.А., Немудрый А.А., Чепелева Елена Васильевна, Малахова А.А., Павлова С.В., Докучаева А.А., Сергеевичев Д.С., Закиян С.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Экспериментальные статьи
Статья в выпуске: 4-2 т.19, 2015 года.
Бесплатный доступ
Использование кардиальных мезенхимальных клеток - перспективное направление в терапии ишемических поражений миокарда. Успех клеточной терапии зависит от эффективности способа доставки целевых клеток и их приживления в пораженной зоне. Применение биолюминесценции для мониторинга хоуминга трансплантированных клеток позволяет наблюдать их в динамике нами одном животном. Показана линейная зависимость активности люциферазы от количества клеток, что позволит проводить количественную оценку эффективности трансплантации и приживления люминесценции культуры кардиальных мезенхимальных клеток в зависимости от активности люциферазы в клетках. Проведено сравнение различных способов интрамиокардиальной трансплантации клеток и показано, что инъекция клеток в составе фибринового геля способствует более эффективному закреплению клеток в месте трансплантации.
Кардиальные мезенхимальные клетки, кардиальные стволовые клетки, фибриновый гель, инфаркт миокарда, биолюминесценция
Короткий адрес: https://sciup.org/142140719
IDR: 142140719
Текст научной статьи Оптимизация протокола интрамиокардиальной трансплантации с использованием люминесценции кардиальных мезенхимальных клеток, маркированных экспрессией люциферазы
Оценка активности люциферазы в белковых лизатах клеток
Активность люциферазы определяли в белковых лизатах трех типов: КМК-Luc, культивировавшихся in vitro; КМК-Luc, культивировавшихся in vitro, заключенных в фибриновый сгусток; в белковом экстракте миокарда, изолированного через 60 мин после трансплантации КМК-Luc. Регистрировали люминесценции на приборе Wallac 1420 Multilabel Counter Victor-3 с использованием набора Luciferase Assay Reporter System (Promega). Получали клеточный лизат и проводили детекцию активности люциферазы в клетках согласно рекомендациям Promega с небольшими модификациями. После добавления лизирующего буфера (25 мМ Трис pH 7,8; 2 мМ ЭДТА; 2 мМ ДТТ; 10% глицерола; 1% Тритон Х-100) клетки разрушали методом замораживания в жидком азоте и размораживания на водяной бане при температуре 37 °С. Ткань миокарда в небольшом количестве азота измельчали в пудру и лизировали в равном объеме двукратного лизирующего буфера с добавлением ингибиторов протеаз Complete Mini, EDTA Free (Roche) в течение 15 мин; замораживали, размораживали, центрифугировали при 10 000 g 5 мин и собирали супернатант [5]. К осадку добавляли 0,5 мл двукратного лизирующего буфера, процедуру лизиса клеток повторяли. Второй супернатант смешивали с первым и хранили при температуре –70 °С до определения активности люциферазы.
Плазму крови для формирования фибринового сгустка получали из цельной крови крыс (с добавлением 0,2% цитрата натрия) методом последовательного центрифугирования при 400 и 1 000 g. Сгусток формировался при добавлении к плазме крови равного объема среды DMEM в течение 2–4 мин [6]. Подобранное время позволяет проводить инъекции клеток и плазмы так, чтобы фибриновый сгусток с целевыми клетками формировался непосредственно в миокарде.
Трансплантация люминесценции культуры кардиальных мезенхимальных клеток в миокард крыс линии WAG
Проводили эксперименты на лабораторных животных в соответствии с «Правилами работ с использованием экспериментальных животных» (приказ Министерства здравоохранения СССР от 12.08.1977 № 755 и приложение к приказу МЗ СССР № 565 от 04.10.1977) и принципами Хельсинкской декларации, разработанной Всемирной медицинской ассоциацией (2000). Животные содержались на стандартной диете и имели свободный доступ к воде. Эксперимент выполняли на 5–6-месячных крысах-самцах линии WAG массой 250–300 г. Крыс наркотизировали смесью золетила (130 мг/кг) и ксилазина (16 мг/кг) интраперитонеально, за 15 мин до наркоза проводили премедикацию сульфатом атропина (0,1 мг/кг) подкожно. Крыс интубировали, проводили искусственную вентиляцию легких кислородом при помощи аппарата Harvard Apparatus 683 Rodent Ventilator. Доступ в грудную клетку осуществляли латерально слева между IV и V ребрами. Инфаркт миокарда моделировался постоянной окклюзией передней нисходящей ветви левой коронарной артерии на 1–2 мм ниже выхода артерии из-под ушка левого предсердия атравматичной иглой размером 6-0 и кривизной 3/8 круга [4]. Инфаркт диагностировали по показателям электрокардиограммы (поднятие зубца ST) и бледности миокарда ниже места окклюзии. Вводили клетки инсулиновым шприцем со встроенной иглой 30G BD Microfine. Иглу ограничивали фиксатором, сделанным из носика для автоматической пипетки, и загибали под углом 45° для удобства и стандартизации процедуры трансплантации. Трансплантировали
Количество лизированных клеток в 10 мкл
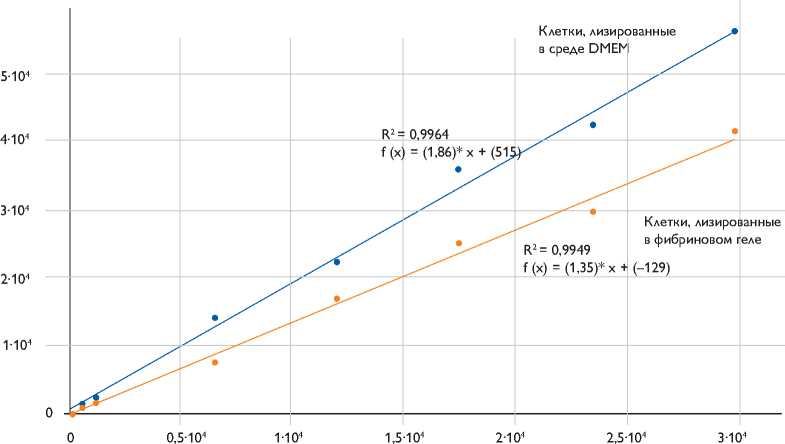
Рис. 1. Зависимость люминесценции лизата КМК-Luc в фибриновом геле и суспензии DMEM от количества клеток в образце
КМК-Luc 20 крысам, разделенным на 4 группы. Первой и второй группам (инфаркт миокарда и ложная операция) вводили суспензию 106 клеток в культуральной среде DMEM объемом 100 мкл, третьей и четвертой группам (инфаркт миокарда и ложная операция) – смесь 50 мкл среды DMEM с 106 клеток и 50 мкл плазмы крови. Отметили клетки дополнительно митохондриальным красителем MitoTracker Deep Red FM (abs/em ~644/665 nm) для последующей визуализации зоны трансплантации. Крыс выводили из эксперимента инъекцией 1 мл KСl 7,5% в сердце. На приборе Kodak In-Vivo Imaging System выделяли зону миокарда с введенными клетками. Образцы ткани быстро замораживали в жидком азоте и хранили при температуре –70 °С до момента проведения последующего анализа. Для каждого опыта отбирали и хранили при температуре –70 °С контрольную аликвоту КМК-Luc для определения и расчета люминесценции клеток. Аликвота – известное количество клеток в среде DMEM или фибриновом геле в зависимости от условий эксперимента на животном.
Для каждого опыта рассчитывали значение люминесценции одной клетки в контроле и по значению люминесценции опытного образца определяли абсолютное количество клеток, которое нормировалось в ответ на количество введенных клеток.
Определение биолюминесценции живых клеток
Оценку биолюминесценции КМК-Luc проводили на приборе Kodak In-Vivo Imaging System. Суспензию клеток в культуральной среде помещали в лунку 96-ячеечного планшета (S = 0,32 см2). Регистрировали излучения сразу после добавления к клеткам люциферина (d-luciferin 0,15 мг/мл) [7].
Согласно рекомендациям производителя, пометили клетки митохондриальным красителем MitoTracker Deep Red FM для сопоставления данных люминесценции и флуоресценции красителя.
После определения биолюминесценции in vivo из клеток приготовили белковый экстракт для определения активности люциферазы на приборе Wallac Multilabel Counter Victor-3 по вышеописанному протоколу.
Определение биолюминесценции in vivo клеток, трансплантированных в скелетную мышцу мышей линии SCID
Трансплантировали клетки КМК-Luc, дополнительно помеченные MitoTracker Deep Red FM, в мышцы тазовой конечности мышей линии SCID. Вводили клетки в состав фибринового геля, служащего для них матриксом. Вводимая смесь состояла из 50 мкл плазмы крови
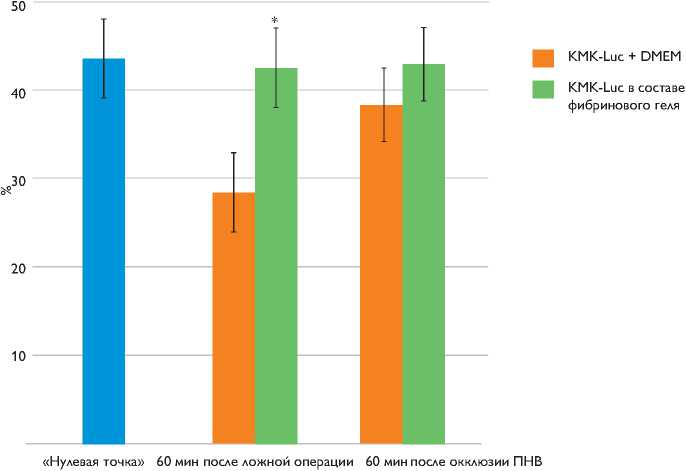
Рис. 2. Процент обнаруживаемых КМК-Luc от введенного количества в зависимости от состава введенной смеси и условий операции. ПНВ – передняя нисходящая ветвь левой коронарной артерии. * р ≤ 0,05; t-test
и 50 мкл суспензии 106 клеток КМК-Luc в культуральной среде. На 5-е сутки наркотизировали мышей смесью золетила (130 мг/кг) и ксилазина (16 мг/кг) внутримышечно, в хвостовую вену вводили раствор люциферина 30 мг/кг [7, 8]. Фиксировали биолюминесценцию на приборе Kodak In-Vivo Imaging System.
Статистический анализ
Статистическую обработку полученных данных проводили с помощью программного пакета Statistica 6.0. Для выявления различий между группами использовали двухвыборочный t-критерий Стьюдента. Различия между группами считали достоверными при p<0,05. Данные представляли в виде среднее значение ± ошибка среднего.
Результаты и обсуждение
Оценка люминесценции в белковом экстракте культуры клеток
После трансдукции конструкции pLenti PGK V5-Luc Neo в составе лентивирусных частиц в КМК для получения однородной культуры, экспрессирующей ген люциферазы, клетки инкубировали в присутствии антибиотика G418 в течение недели. В белковых экстрактах клеток культуры КМК-Luc определяли активность люциферазы и строили калибровочные прямые. Показана линейная зависимость между количеством лизированных клеток и регистрируемым свечением, которая воспроизводится на разных пассажах КМК-Luc. Таким образом, культура КМК-Luc однородна, и каждая клетка экспрессирует ген люциферазы. Поскольку мы планировали проводить трансплантацию КМК-Luс в миокард крыс в составе фибринового матрикса, необходимо было оценить его влияние на метод детекции люциферазы. При проведении одновременной детекции люциферазы в лизатах КМК-Luc в фибриновом матриксе и клеток в суспензии мы обнаружили, что значения регистрируемого свечения отличаются в среднем в 1,5 раза. Мы предположили, что это связано с влиянием фибринового матрикса на лизис клеток и/или диффузию фермента из матрикса (рис. 1).
Определение люминесценции в белковом экстракте миокарда крысы после трансплантации люминесценции культуры кардиальных мезенхимальных клеток
Для оценки качества трансплантации клеток в миокард провели эксперимент по выявлению люминесценции в белковом экстракте, полученном из клеток
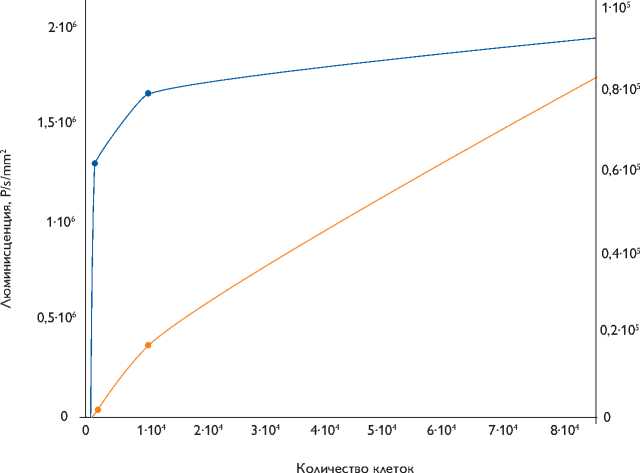
Рис. 3. Зависимость люминесценции живых клеток (левая ось) и люминесценции белкового экстракта клеток (правая ось) от количества КМК-Luc
миокарда крысы после трансплантации КМК-Luc. Ранее мы наблюдали присутствие трансплантированных КМК, меченных MitoTracker Deep Red FM в изолированном сердце крысы [4]. Однако данный краситель сохраняется в тканях после гибели трансплантированных клеток и не позволяет судить о количестве выживших клеток. Активность люциферазы выявляется исключительно в живых клетках, так как этот фермент взаимодействует со своим субстратом d-люциферином только в присутствии аденозинтрифосфата. Также в случае естественной гибели клетки фермент деградирует, поэтому использование КМК, меченных люциферазой, позволяет оценить количество жизнеспособных клеток после трансплантации. В первую очередь необходимо было разработать методику количественного определения клеток КМК-Luc в миокарде и оценить ошибку метода при определении активности люциферазы в экстрактах клеток миокарда. В миокард крыс сделали инъекции клеток КМК-Luc в суспензии (5 образцов) и фибриновом матриксе (5 образцов). Сразу после инъекции из образцов выделяли белковые экстракты, в которых определяли активность люциферазы (нулевая точка). В контрольных образцах определяли активность люциферазы в пересчете на одну клетку и рассчитывали ожидаемое значение активности для введенных в опыте клеток. Отношение наблюдаемого значения активности фермента к ожидаемому значению являлось показателем чувствительности метода. В белковых экстрактах миокарда обеих групп в нулевой точке мы зарегистрировали активность люциферазы, соответствующую активности в 43,50±4,45% введенных клеток. Таким образом, при определении активности люциферазы в белковых экстрактах ткани миокарда максимальное значение, определяемое в опытных образцах, соответствует в среднем 43% теоретического значения, рассчитанного на основании контрольных аликвот клеток.
Для определения эффективности процедуры трансплантации клеток в ишемизированный и неишемизированный миокард мы определяли активность люциферазы в экстрактах ткани миокарда через 60 мин после введения КМК-Luc. Клетки инъецированы в количестве 106 в 100 мкл среды DMEM (5 крыс с инфарктом миокарда, 5 крыс с ложной операцией) и в 100 мкл смеси DMEM/плазма крови (1:1) (5 крыс с инфарктом миокарда, 5 крыс с ложной операцией).
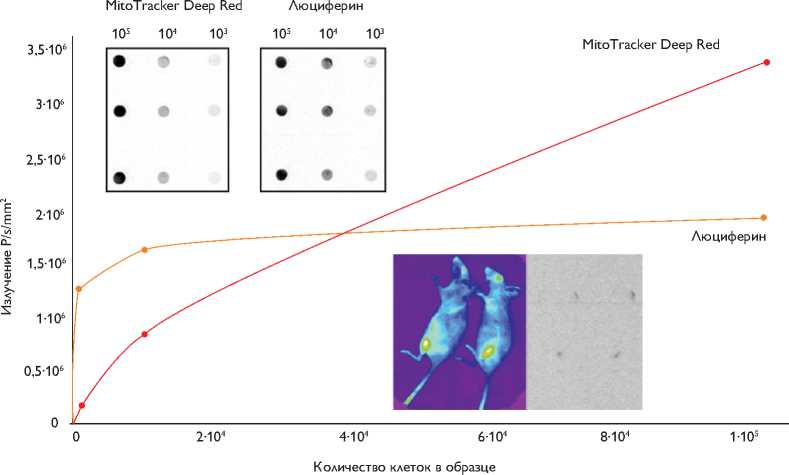
Рис. 4. Зависимость интенсивности флуоресценции MitoTracker Deep Red FM и биолюминесценции люциферина от количества КМК-Luc в образце. Трансплантация КМК-Luc в мышцы тазовой конечности и холку мыши линии SCID. Визуализация флуоресценции (слева) и биолюминесценции (справа) клеток КМК-Luc, меченных MitoTracker Deep Red FM
В неишемизированном миокарде группы ложно оперированных крыс через 60 мин после трансплантации исследуемых клеток обнаружили 42,52±4,38% КМК-Luc, введенных в фибриновом матриксе, и 28,48±4,42% КМК-Luc, введенных в культуральной среде. В ишемизированном миокарде через 60 мин после окклюзии передней нисходящей ветви левой коронарной артерии и трансплантации клеток в периинфарктную зону выявили 42,9±4,63% КМК-Luc, введенных в фибриновом матриксе, и 38,31±4,16% КМК-Luc, введенных в культуральной среде (рис. 2). Предположительно, различие между количеством клеток, обнаруженных через 60 мин после введения в ишемизированный и интактный миокард без применения фибринового геля, можно объяснить тем, что окклюзия одной из коронарных артерий значительно снизила объемную перфузию зоны, в которую вводили клетки, тем самым способствовала уменьшению количества клеток, вымываемых в системный кровоток. Фибриновый гель, вероятно, влиял на задержание клеток в месте инъекции.
Таким образом, при трансплантации суспензии КМК-Luc в культуральной среде в неишемизированный миокард у ложно оперированных крыс через 60 мин заре- гистрировали достоверно меньшее количество клеток по сравнению с количеством клеток, трансплантированных в фибриновом матриксе. При трансплантации клеток в периинфарктную зону после ишемического поражения миокарда в обеих группах обнаружили высокую степень задержки КМК-Luc в ткани сердца. В дальнейшем полученные данные можно использовать для оптимизации протоколов трансплантации клеток в организм реципиента.
Определение биолюминесценции клеток in vitro
Люминесценцию живых клеток КМК-Luc in vitro регистрировали на приборе In-Vivo Imaging System сразу после добавления в культуральную среду люциферина в концентрации 15 мг/мл. Сигнал наблюдали при плотности КМК-Luc не менее 3 000 кл/см2 (103 клеток и более чем в одной лунке 96-ячеечного культурального планшета). После завершения измерения определяли активность люциферазы биохимическим методом в лизатах клеток (рис. 3).
Дополнительно клетки пометили митохондриальным красителем MitoTracker Deep Red FM, конъюгиро- ванным с флуорохромом для сравнения преимуществ визуализации целевых клеток. На рис. 3 и 4 видно, что интенсивность флуоресценции клеток, меченных с помощью митохондриального красителя, так же как и биолюминесценции модифицированных клеток, прямо пропорциональна их количеству, и в диапазоне от 104 до 105 клеток эту зависимость можно считать линейной. Недостатком биолюминесценции является ограниченный период свечения. После добавления к клеткам субстрата d-люциферина свечение регистрировали не более 15 мин, в то время как клетки, меченные MitoTracker Deep Red FM, флуоресцировали продолжительное время. Однако, как было сказано выше, этот краситель не позволяет определить жизнеспособность клеток.
Визуализация клеток, трансплантированных в скелетную мышцу мышей линииSСID, методом биолюминесценции
Для тестирования метода прижизненной визуализации трансплантированных клеток в тканях животных провели инъекции клеток КМК-Luc в составе фибринового геля в мышцы тазовой конечности мышей линии SСID. Клетки дополнительно пометили MitoTracker Deep Red FM для удобства их обнаружения в тканях мыши. Визуализацию проводили на приборе Kodak In Vivo Imaging System в наркотизированных мышах, которым системно ввели препарат люциферина. Флюоресценцию и биолюминесценцию трансплантированных клеток в области тазовой конечности наблюдали на 5-е сутки после инъекции (рис. 4). Совпадение областей флуоресцентного и люминесцентного сигналов подтверждает, что введенные клетки сохраняют жизнеспособность, а наш метод подходит для прижизненной регистрации и отслеживания динамики введенных клеток.
Выводы
-
1. При использовании вышеперечисленных методов регистрации люминесценции в белковых экстрактах КМК-Luc степень излучения находилась в прямой зависимости от количества клеток.
-
2. Фибриновый гель – оптимальный матрикс для фиксации клеток в образце с целью определения интенсивности люминесценции исследуемой культуры.
-
3. Степень приживаемости клеток в миокарде следует оценивать исходя из интенсивности люминесценции, наблюдаемой после имплантации клеток в миокард в нулевой момент времени.
-
4. Перфузия миокарда влияет на эффективность трансплантации суспензии КМК-Luc в культуральной среде в неишимизированный миокард (28,48±4,42% клеток). При трансплантации КМК-Luc в фибриновом матриксе в неишимизированный миокард выявили 42,52±4,38% клеток.
-
5. При трансплантации клеток в периинфарктную зону после ишемического поражения миокарда в обеих группах обнаружили высокую степень задержки КМК-Luc в ткани сердца (42,9±4,63% КМК-Luc в фибриновом матриксе и 38,31±4,16% КМК-Luc в суспензии).
Полученные данные можно использовать для оптимизации протоколов трансплантации клеток в организм реципиента.
Работа поддержана программой «Молекулярная клеточная биология» (проект № 6.15).
Список литературы Оптимизация протокола интрамиокардиальной трансплантации с использованием люминесценции кардиальных мезенхимальных клеток, маркированных экспрессией люциферазы
- Leri A., Anversa P. Stem cells and myocardial regeneration: cooperation wins over competition//Circulation. 2013. Vol. 127. № 2. P. 165-8.
- Чернявский А.М., Бондарь В.И., Бочарова А.В., Субботин Д.В., Сергеевичев Д.С., Новрузов Р.Б., Караськов А.М. Регенерация перирубцовой зоны миокарда при комбинированной реваскуляризации (лазер плюс клетки) на модели хронической ишемической болезни сердца//Патология кровообращения и кардиохирургия. 2009. № 3. С. 83-86.
- Close D.M., Xu T., Sayler G.S., Ripp S. In vivo bioluminescent imaging (BLI): noninvasive visualization and interrogation of biological processes in living animals//Sensors (Basel). 2011. Vol. 11. № 1. P. 180-206.
- Чепелева Е.В., Павлова С.В., Малахова А.А., Милевская Е.А., Русакова Я.Л., Подхватилина Н.А., Сергеевичев Д.С., Покушалов Е.А., Караськов А.М., Сухих Г.Т., Закиян С.М. Терапия хронического кардиосклероза у крыс линии WAG культурами кардиоваскулярных клеток, обогащенными стволовыми клетками сердца//КТБМ. 2015. № 3. С. 191-200.
- Manthorpe M., Cornefert-Jensen F., Hartikka J., Felgner J., Rundell A., Margalith M., Dwarki V. Gene therapy by intramuscular injection of plasmid DNA: studies on firefly luciferase gene expression in mice//Hum. Gene Ther. 1993. Vol. 4. № 4. P. 419-31.
- Cheng K., Shen D., Smith J., Galang G., Sun B., Zhang J., Marbán E. Transplantation of platelet gel spiked with cardiospherederived cells boosts structural and functional benefits relative to gel transplantation alone in rats with myocardial infarction//Biomaterials. 2012. Vol. 33. № 10. P. 2872-9.
- Keyaerts M., Verschueren J., Bos T.J., Lea O., Peleman C., Breckpot K., Van Hove C., Caveliers V., Bossuyt A., Lahoutte. T. Dynamic bioluminescence imaging for quantitative tumour burden assessment using IV or IP administration of D-luciferin: effect on intensity, time kinetics and repeatability of photon emission//Eur. J. Nucl. Med. Mol. Imaging. 2008. Vol. 35. № 5. P. 999-1007.
- Inoue Y., Kiryu S., Watanabe M., Tojo A., Ohtomo K. Timing of imaging after d-luciferin injection affects the longitudinal assessment of tumor growth using in vivo bioluminescence imaging//Int. J. Biomed. Imaging. 2010. Vol. 2010. P. 471-408.


