Оптимизация режима адъювантной интерферонотерапии у больных раком почки
Автор: Дыхно Ю.А., Зуков Р.А., Куртасова Л.М., Шкапова Е.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (17), 2006 года.
Бесплатный доступ
Оптимизация режима адъювантной интерферонотерапии проведена у 55 больных местнораспространенным раком почки на основании результатов исследования клеточной чувствительности нейтрофильных гранулоцитов крови к реафе-рону in vitro. Сравнительный анализ показал, что указанный режим адъювантной реаферонотерапии позволяет провести более адекватную иммунореабилитацию пациентов, уменьшить токсичность проводимого лечения, а также повысить эффективность комбинированного лечения больных местнораспространенным раком почки.
Короткий адрес: https://sciup.org/14054244
IDR: 14054244
Текст научной статьи Оптимизация режима адъювантной интерферонотерапии у больных раком почки
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИfl
ОПТИМИЗАЦИfl РЕЖИМА АДЪfiВАНТНОЙ ИНТЕРФЕРОНОТЕРАПИИ У БОЛЬНЫХ РАКОМ ПОЧКИ
fi.А. Дыхно1, Р.А. Зуков1, Л.М. Куртасова1, Е.А. Шкапова2
ГОУ ВПО «Красноярская государственная медицинская академия»1
Краевой онкологический диспансер, г. Красноярск2
Оптимизация режима адъювантной интерферонотерапии проведена у 55 больных местнораспространенным раком почки на основании результатов исследования клеточной чувствительности нейтрофильных гранулоцитов крови к реафе-poнy in vitro. Сравнительный анализ показал, что указанный режим адъювантной реаферонотерапии позволяет провести более адекватную иммунореабилитацию пациентов, уменьшить токсичность проводимого лечения, а также повысить эффективность комбинированного лечения больных местнораспространенным раком почки.
OPTIMIZATION OF REGIMEN OF ADJUVANT INTERFERONOTHERAPY IN PATIENTS
WITH RENAL CELL CARCINOMA
Yu.A. Dykhno1, R.A. Zukov1, L.M. Kurtasova1, E.A.Shkapova2
Krasnoyarsk State Medical Academy, Health Ministry of RFRegional oncological clinic, Krasnoyarsk 2
Optimization of regimen of adjuvant interferonotherapy in 55 patients with locally advanced renal cell carcinoma on the basis of results of cellular sensitivity analysis of neutrophils to reaferon in vitro was carried out. The comparative analysis showed, that the optimization of regimen of adjuvant reaferonotherapy allowed to carry out more adequate immunorehabilitation in patients, to reduce toxicity of treatment, and also to increase efficiency of the combined treatment in patients with renal cell carcinoma.
Почечно-клеточный рак (ПКР) относится к числу наиболее тяжелых онкоурологических заболеваний. На его долю приходится 90‒97 % опухолей почек и 3,5 % всех злокачественных новообразований у взрослых [2, 4]. Рак почки обладает выраженной тенденцией к диссеминации. Уже при первом обращении у 25‒30 % больных диагностируются отдаленные метастазы, у 25 % ‒ местнораспространенный ПКР и только у 45 % пациентов выявляется локализованная опухоль [3, 6].
Резистентность ПКР к лучевой терапии, низкая эффективность гормоно- и химиотерапии определяют широкие показания к хирургическому лечению [5, 7]. Однако даже после оперативного лечения еще у 40‒50 % больных ПКР появляются метастазы, причем у 80 % пациентов они возникают в течение первого года [6]. Эти факты свидетельствуют о необхо- димости разработки новых комбинированных и комплексных схем лечения данного заболевания.
На сегодняшний день, по мнению многих авторов, стандартом лечения распространенного ПКР является адъювантная иммунотерапия с использованием интерферона-альфа (ИФН- а ) [5,9,11]. Противоопухолевое действие ИФН-а опосредуется несколькими механизмами: антипролиферативным эффектом, регуляцией клеточной дифференцировки, ингибированием онкогенов и ангиогенеза, противовирусной и иммуномодулирующей активностью [1, 8].
Эффективность интерферонотерапии при раке почки, по сведениям разных авторов, составляет от 10 до 40 %, что определяется отсутствием единых подходов к оценке показаний к проведению адъювантной иммунотерапии и выбору доз, режимов и путей введения препарата [5, 8].
Учитывая вышесказанное, становится понятной необходимость поиска новых режимов использования ИФН- " с целью повышения эффективности лечения данной категории больных.
Целью работы явилось улучшение результатов комбинированного лечения больных местнораспространенным раком почки за счет оптимизации режима адъювантной интерферонотерапии.
Материалы и методы исследования
В исследование включен 81 больной с гистологически верифицированным местнораспространенным ПКР, находившийся на лечении в урологическом отделении Красноярского краевого онкологического диспансера. Всем пациентам на первом этапе комбинированного лечения выполнялось хирургическое вмешательство в объеме радикальной нефрэктомии, затем на втором этапе, через 4 нед после операции, проводилась иммунотерапия. В зависимости от используемой методики интерферонотерапии больные были разделены на 2 группы. Первую (основную) составили 55 пациентов, получавшие реа-ферон с учетом индивидуальной клеточной чувствительности к препарату (табл. 1).
Таблица 1
Дозы реаферона, используемые при проведении адъювантной терапии с учетом индивидуальной клеточной чувствительности
|
Цикл/ число Больных |
Доза р еаф е рана |
||
|
3 млн ME |
5 млн ME |
8 млн ME |
|
|
И>55) |
16 |
29 |
10 |
|
II (п=49) |
20 |
22 |
7 |
|
П1 (м=42) |
20 |
16 |
6 |
|
IV(if3Q |
26 |
7 |
3 |
Во вторую (контрольную) вошли 26 больных, у которых клеточная чувствительность in vitro отсутствовала и лечение осуществлялось по стандартной схеме: 3 млн МЕ реаферона внутримышечно, ежедневно. Количество инъекций на цикл в исследуемых группах ‒ 12, количество циклов ‒ 4. Сравниваемые группы были сопоставимы по возрасту и полу (табл. 2), характеру выполняемого оперативного вмешательства, стадиям опухолевого процесса (табл. 3), гистологическому варианту ПКР (табл. 4) и течению послеоперационного периода (без осложнений).
Таблица 2
Распределение больных по полу и возрасту
|
Возраст |
Пол |
Ко ЛИТЕ С ИЗ О Б ОЛЬ НЫХ, 11 (%) |
|
|
Основная грушв. (^55) |
Группа контроля (п=26) |
||
|
40-49 лет |
Муж |
10(185) |
3(115) |
|
Жен |
12(215) |
5(195) |
|
|
50-59 лет |
Муж |
9(16,4) |
3(115) |
|
Жен |
16(29,1) |
7(275) |
|
|
60-69 лет |
Муж |
3(55 |
4(15,4) |
|
Жен |
5(9,0) |
4(15,4) |
|
Таблица 3
Распределение больных по стадиям опухолевого процесса
|
Стадия |
Количество больных, п(%) |
||||
|
Основная группа |
Контрол ънал группа |
||||
|
п |
% |
п |
% |
||
|
Ш |
™.М„ |
4 |
7,3 |
||
|
та,Ми |
33 |
60(0 |
16 |
61,6 |
|
|
там, |
6 |
10,9 |
3 |
11,5 |
|
|
IV |
там.. |
4 |
7,3 |
3 |
11,5 |
|
тд,м„ |
5 |
9,1 |
2 |
7,7 |
|
|
тд.м„ |
3 |
54 |
2 |
7,7 |
|
Гистологическая характеристика опухолей у наблюдаемых больных
Гистологи-
Копичвстео Больных, и (%)
|
вариант ПКР |
Основная группа (1^55 |
Катаральная трупгв (1^26) |
||
|
11 |
% |
11 |
% |
|
|
Светло-кпеточный |
39 |
70(9 |
17 |
654 |
|
Темноклеточный |
5 |
9,1 |
2 |
7,7 |
|
Смешанный |
11 |
20(0 |
7 |
259 |
Оценку индивидуальной клеточной чувствительности к реаферону in vitro проводили, исследуя хемилюминесцентный ответ нейтрофильных гранулоцитов периферической крови по методу P. De Sole et al. (1983) [10].
Сравнительное исследование параметров иммунного статуса в ходе интерферонотерапии проведено у 28 пациентов основной и 20 больных контрольной группы. Популяционный и субпопуляционный со- став лимфоцитов крови оценивали с помощью метода проточной цитофлюориметрии, используя FACS-Calibur (Becton Dickinson, USA) и реагенты Simul Test IMK-lymphocyte Kit (USA). Концентрацию иммуноглобулинов класса A, M и G в сыворотке определяли методом радиальной иммунодиффузии в геле. Содержание циркулирующих иммунных комплексов (ЦИК) в сыворотке определяли турбидиметрическим методом. Клиническая оценка результатов лечения в сравниваемых группах проводилась с использованием шкалы токсичности (критерии CTC-NCIC) и показателей общей и безрецидивной выживаемости (метод Каплана ‒ Мейера). Статистическую обработку данных проводили с помощью компь- ютерной программы Statistica 6,0. О достоверности различий в группах судили на основании критериев Манна ‒ Уитни, Пирсона, Гехана ‒ Вилкоксона, Кокса ‒ Ментела, Пето ‒ Вилкоксона.
Результаты и обсуждения
Результаты проведенного исследования показали, что изменения параметров иммунного статуса у пациентов основной группы после первого цикла лечения реафероном характеризовались увеличением количества лейкоцитов, а также абсолютного содержания зрелых Т-лимфоцитов и цитотоксических
Таблица 5
Параметры клеточного и гуморального иммунитета боль н ых основной группы в ходе адъювантной реаферонотерапии ( Х ±m)
|
Показатели |
До лечения (n=28) |
Послe I циклa (n=28) |
Послe II циклa (n=25) |
Послe III циклa (n=21) |
Послe IV циклa (n=20) |
|
Лeйкоциты (10 9 /л) |
4,55±0,81 |
6,00±0,29 p 1 <0,05 |
3,89±0,78 p 2 <0,05 |
5,04±1,09 |
4,72±1,54 |
|
Лимфоциты (%) |
24,02±3,13 |
26,74±3,51 |
24,97±3,68 |
28,44±3,56 p 1 <0,05 |
29,64±2,86 p 1 <0,05 |
|
Лимфоциты (10 9 /л) |
0,92±0,15 |
1,47±0,28 |
0,84±0,31 |
1,75±0,29 p 1 <0,05 |
1,50±0,33 p 1 <0,05 |
|
CD3 + (%) |
44,57±2,38 |
50,07±1,88 |
48,39±3,67 |
61,23±4,49 p 1 <0,05 |
55,23±3,18 p 1 <0,05 |
|
CD3 + (10 9 /л) |
0,40±0,07 |
0,93±0,08 p 1 <0,05 |
0,78±0,20 |
1,24±0,19 p 1,2 <0,05 |
1,12±0,09 p 1 <0,05 |
|
CD4 + (%) |
24,83±1,56 |
27,68±1,24 |
25,52±1,69 |
32,50±1,78 |
35,87±1,59 p 1 <0,05 |
|
CD4 + (10 9 /л) |
0,25±0,06 |
0,38±0,04 |
0,30±0,06 |
0,64±0,09 p 1 <0,05 |
0,45±0,05 p 1 <0,05 |
|
CD8 + (%) |
21,86±1,89 |
28,66±0,76 |
26,58±1,09 |
26,63±2,04 |
22,75±2,17 |
|
CD8 + (10 9 /л) |
0,28±0,05 |
0,52±0,04 p 1 <0,05 |
0,34±0,13 |
0,39±0,09 p 1,2 <0,05 |
0,36±0,07 |
|
CD16 + (%) |
30,12±1,85 |
25,33±1,09 |
37,04±5,78 |
25,18±2,87 |
25,57±3,76 |
|
CD16 + (10 9 /л) |
0,24±0,05 |
0,25±0,05 |
0,30±0,07 |
0,39±0,09 p 1 <0,05 |
0,40±0,13 p 1 <0,05 |
|
CD19 + (%) |
22,38±2,77 |
20,44±4,12 |
18,85±2,71 |
12,98±2,96 p 1 <0,05 |
19,36±1,22 p 4 <0,05 |
|
CD19 + (10 9 /л) |
0,25±0,06 |
0,36±0,08 |
0,31±0,05 |
0,28±0,07 |
0,32±0,06 |
|
HLA-DR + (%) |
40,79±2,95 |
45,19±1,86 |
47,12±5,03 |
49,18±2,48 p 1 <0,05 |
45,02±1,27 p 4 <0,05 |
|
HLA-DR + (10 9 /л) |
0,42±0,08 |
0,54±0,06 |
0,48±0,05 |
0,68±0,08 p 1 <0,05 |
0,65±0,08 p 1 <0,05 |
|
CD4 + /CD8 + |
1,14±0,21 |
0,90±0,05 p 1 <0,05 |
1,01±0,15 |
1,38±0,11 p 1,2,3 <0,05 |
1,46±0,15 p 1,2,3 <0,05 |
|
IgA (г/л) |
2,84±0,22 |
4,50±0,63 |
8,96±2,08 p 1 <0,05 |
3,67±0,56 |
3,17±0,78 p 3 <0,05 |
|
IgM (г/л) |
1,35±0,23 |
1,63±0,78 |
3,54±0,31 p 1 <0,05 |
1,80±0,72 |
1,45±0,69 p 3 <0,05 |
|
IgG (г/л) |
14,66±0,74 |
15,14±1,32 |
9,60±1,13 p 1 <0,05 |
12,54±1,28 |
13,76±0,99 |
Примечание: р 1 ‒ статистически значимые различия с показателями больных ПКР до начала иммунотерапии, р 2 ‒ статистически значимые различия с показателями больных ПКР после 1-го цикла иммунотерапии, р 3 ‒ статистически значимые различия с показателями больных ПКР после 2-го цикла иммунотерапии, р 4 ‒ статистически значимые различия с показателями больных ПКР после 3-го цикла иммунотерапии.
Т-лимфоцитов (CD8+-клеток), что объясняет снижение величины иммунорегуляторного индекса (ИРИ), который рассчитывается как отношение CD4+/CD8+, относительно соответствующего параметра до начала интерферонотерапии (табл. 5). После второго цикла лечения рекомбинантным ИФН-"2а у пациентов наблюдаются значительные изменения в гуморальном звене иммунной системы на фоне стабильных параметров, характеризующих состояние клеточного иммунитета. Установлена повышенная концентрация IgA и IgM и сниженный уровень IgG в сыворотке крови больных по сравнению с показателями до начала иммунотерапии. У больных, получивших третий цикл интерферонотерапии, установлено повышение содержания лимфоцитов и Т-лимфоцитов (CD3+-клеток) в периферической крови. Следует отметить увеличение абсолютного количества хелпер-но-индукторной субпопуляции (CD4+) лимфоцитов на фоне снижения абсолютного содержания CD8+-клеток и повышение показателя ИРИ. Обнаружена тенденция к повышению абсолютного количества клеток, экспрессирующих антиген CD16+ (естественные киллерные клетки), и клеток, несущих на своей поверхности активационный маркер HLA-DR. Количество В-лимфоцитов значительно снижено относительно показателей в группе больных ПКР до начала иммунотерапии, однако концентрация иммуноглобулинов классов A, M и G в сыворотке крови сохраняется на таком же уровне, как до начала интерферо-нотерапии. Состояние параметров иммунной системы через 3 нед после четвертого цикла иммунотерапии в целом остается таким же, как после третьего. В то же время необходимо отметить повышение содержания в периферической крови В-лимфоцитов и снижение количества клеток, экспрессирующих активационный маркер HLA-DR.
Таблица 6
Параметры клеточного и гуморального иммунитета больны х контрольной группы в ходе адъювантной реаферонотерапии ( Х ±m)
|
Показатели |
До лечения (n=20) |
Послe I циклa (n=20) |
Послe II циклa (n=20) |
Послe III циклa (n=18) |
Послe IV циклa (n=18) |
|
Лeйкоциты (10 9 /л) |
4,02±0,74 |
3,84±0,52 |
3,65±0,58 |
4,23±0,57 |
4,65±0,80 |
|
Лимфоциты (%) |
26,12±2,51 |
28,90±4,18 |
29,15±3,65 |
26,65±2,67 |
29,72±2,04 p 1 <0,05 |
|
Лимфоциты (10 9 /л) |
1,07±0,11 |
1,16±0,18 |
1,10±0,28 |
1,24±0,21 p 1 <0,05 |
1,21±0,37 p 1 <0,05 |
|
CD3 + (%) |
38,74±2,45 |
40,36±2,39 |
45,19±3,61 |
50,08±4,13 p 1 <0,05 |
51,75±3,80 p 1 <0,05 |
|
CD3 + (10 9 /л) |
0,48±0,06 |
0,83±0,14 |
0,57±0,09 |
0,90±0,12 p 1 <0,05 |
1,02±0,16 p 1 <0,05 |
|
CD4 + (%) |
24,86±1,34 |
28,56±1,12 |
23,63±2,20 |
29,17±2,30 |
25,44±1,95 |
|
CD4 + (10 9 /л) |
0,28±0,08 |
0,36±0,06 |
0,36±0,10 |
0,41±0,07 |
0,33±0,05 |
|
CD8 + (%) |
24,13±1,66 |
26,12±0,94 |
25,29±0,70 |
31,17±1,54 p 1 <0,05 |
35,23±2,50 p 1 <0,05 |
|
CD8 + (10 9 /л) |
0,27±0,03 |
0,31±0,09 |
0,32±0,04 |
0,51±0,05 p 1 <0,05 |
0,46±0,10 p 1 <0,05 |
|
CD16 + (%) |
29,06±1,02 |
27,47±0,93 |
37,04±3,86 |
30,81±2,54 |
31,29±2,67 |
|
CD16 + (10 9 /л) |
0,37±0,05 |
0,27±0,08 |
0,34±0,10 |
0,29±0,05 |
0,35±0,09 |
|
CD19 + (%) |
25,15±1,44 |
22,16±2,07 |
22,43±1,70 |
20,65±2,36 |
19,84±3,01 |
|
CD19 + (10 9 /л) |
0,31±0,06 |
0,28±0,09 |
0,31±0,04 |
0,29±0,08 |
0,32±0,07 |
|
HLA-DR + (%) |
38,22±1,08 |
40,94±1,28 |
42,08±1,88 |
56,14±1,67 p 1 <0,05 |
54,38±1,22 p 1 <0,05 |
|
HLA-DR + (10 9 /л) |
0,42±0,08 |
0,45±0,09 |
0,52±0,09 |
0,66±0,07 p 1 <0,05 |
0,69±0,05 p 1 <0,05 |
|
CD4 + /CD8 + |
1,10±0,25 |
0,92±0,06 |
1,04±0,13 |
0,85±0,09 p 1 <0,05 |
0,83±0,12 p 1 <0,05 |
|
IgA (г/л) |
3,17±0,40 |
2,93±0,87 |
7,34±0,99 p 1 <0,05 |
7,69±0,82 p 1 <0,05 |
6,03±1,12 p 1 <0,05 |
|
IgM (г/л) |
1,24±0,15 |
1,60±0,13 |
2,43±0,76 p 1 <0,05 |
3,96±1,07 p 1 <0,05 |
4,24±1,01 p 1 <0,05 |
|
IgG (г/л) |
13,56±0,98 |
12,81±0,82 |
9,06±1,14 p 1 <0,05 |
10,20±1,46 p 1 <0,05 |
9,42±1,36 p 1 <0,05 |
Примечание: р 1 ‒ статистически значимые различия с показателями больных ПКР до начала иммунотерапии.
Что же касается состояния иммунной системы больных в контрольной группе, то наиболее выраженные изменения в клеточном звене иммунитета, так же как и в основной группе, наблюдались после третьего цикла реаферонотерапии (табл. 6). Установлено увеличение абсолютного числа лимфоцитов, процентного и абсолютного содержания Т-лимфоцитов (CD3+) в периферической крови относительно соответствующих параметров до начала иммуноте-рaпии. Кроме того, выявлено повышение количества CD8+-клеток и понижение величины ИРИ в этой группе обследуемых пациентов. При анализе показателей гуморального звена иммунитета больных ПКР контрольной группы, получивших два цикла реафе-ронотерапии, отмечены однонаправленные с основной группой изменения: повышенная концентрация IgA и IgM и сниженный уровень IgG в сыворотке крови обследуемых по сравнению с показателями перед первым циклом иммунотерапии. Однако eсли в основной группе пациентов после третьего цикла иммунотерапии показатели концентраций IgA, IgM и IgG в сыворотке крови восстанавливаются до нормативных параметров, то в контрольной группе они остаются на прежнем уровне даже после четвертого цикла терапии реафероном. Необходимо также отметить, что после четвертого цикла у больных контрольной группы повышается относительное содержание лимфоцитов и снижается процентное количество активированных клеток относительно соответствующих параметров после третьего цикла интер-феронотерапии.
Из показателей негематологической токсичности наиболее значимым в обеих группах была лекарственная лихорадка (табл. 7). Частота и степень выраженности гипертермии в ходе первых двух циклов лечения в основной группе были ниже, чем в контрольной (р < 0,05).
Гематологическая токсичность реаферона проявлялась лейкопенией (табл. 8), влияния препарата на эритро- и тромбоцитопоэз не выявлено. При этом III степень лейкопении встречалась чаще в контрольной группе в ходе первых двух циклов лечения (р <0,05). В то же время частота лейкопении была ниже в основной группе при проведении III и IV циклов иммунотерапии (р<0,05).
Таблица 7
Частота гипертермии в исследуемых группах (%)
|
Степень пияорадки |
Основная группа |
Контрольная группа |
||||||
|
I ЦЕПГП |
II ЦЕТИЛ |
ш ЦЕНЗЕ |
IV цикл |
I ЦЕП'Л |
II ЦЕПЕ Л |
ш цензе |
IV ЦЕНЗЕ |
|
|
I |
9,1 |
14,3 |
23,8 |
22,2 |
3,8 |
3,8* |
15,4 |
23,8 |
|
п |
63,6 |
55,1 |
50,0 |
47,2 |
76,9* |
73^1* |
57,6 |
343 |
|
ш |
316 |
— |
— |
— |
15^4* |
7,7 |
3,8 |
— |
|
Всего |
76,4 |
69,4 |
73,8 |
69,4 |
96,1* |
84,6* |
76,9 |
75,0 |
Примечание: * ‒ статистически значимые различия с показателями основной группы (p<0,05).
Таблица 8
Частота лейкопении в исследуемых группах (%)
|
С те тень лейкопении |
Основная группа |
К агор оль ная ipi угли |
||||||
|
I ЦЕП'Л |
II цензе |
ш щпзе |
IV ЦЕП'Л |
I ЦЕПО1 |
п ЩП01 |
1П ЩП!Л |
IV ЦЕН'Л |
|
|
I |
58,2 |
57,2 |
52,4 |
44,4 |
42,4* |
42,4* |
53,8 |
50,0 |
|
II |
29,1 |
30,6 |
23,8 |
22,2 |
38,4 |
34,6 |
30,8 |
29,2 |
|
ш |
1,8 |
2,1 |
- |
- |
11,5* |
11,5* |
3^8 |
4^ |
|
Всего |
89,1 |
89,9 |
762 |
66^6 |
92,3 |
88^5 |
88^4* |
83,4* |
Примечание: * ‒ статистически значимые различия с показателями основной группы (p<0,05).
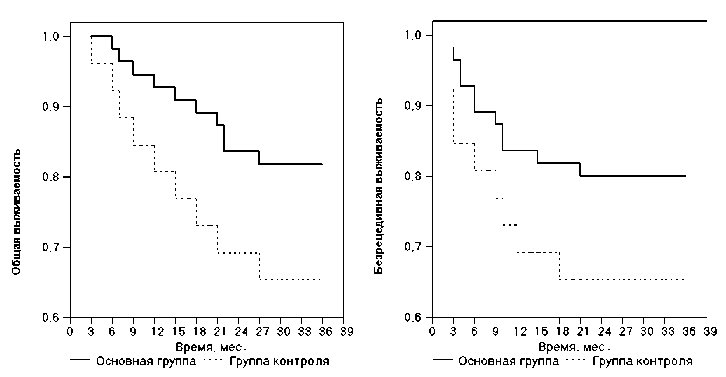
Pиc. 1. Общая и безрецидивная выживаемость в исследуемых группах
Наиболее четко эффективность используемых иммунотерапевтических подходов демонстрируют кривые общей и безрецидивной выживаемости (рис. 1). По результатам проведенного анализа 3-летняя общая выживаемость в основной группе составила 81,8 + 4,13 %, в контрольной ‒ 65,4 + 8,6% (различия между показателями 0,05 < p < 0,1); безрецидивная ‒ 80,0 + 3,2% и 65,4 + 8,6% соответственно, 0,05 < p < 0,1.
Таким образом, указанный режим адъювантной реаферонотерапии позволяет провести более адекватную иммунореабилитацию пациентов, уменьшить токсичность проводимого лечения, а также повысить эффективность комбинированного лечения больных местнораспространенным раком почки.


