Оптимизация состава природных сахаросодержащих сред для биосинтеза лизина микробными продуцентами
Автор: Гнеушева И.А., Лушников А.В., Солохина И.Ю., Ермакова Н.В., Воронкова М.В.
Журнал: Биология в сельском хозяйстве @biology-in-agriculture
Рубрика: Актуальные вопросы зоотехнии и ветеринарии
Статья в выпуске: 4 (49), 2025 года.
Бесплатный доступ
Лизин – аминокислота, которая необходима человеку и животному для питания, используется в физиологических процессах. В настоящее время наблюдается значительный объем промышленного производства лизина. Его получают путем гидролиза отходов птицеперерабатываемых производств с применением микробиологического синтеза. Сырьевыми источниками для производства лизина являются меласса, кукурузный экстракт, подсолнечный шрот, отруби, мясокостная и рыбная мука, рапс. Важный критерий по поиску снижения издержек на производство L-лизина – это разработка питательных сред для культивирования продуцентов, способных обеспечить максимальный выход аминокислот. В данной работе проведено исследование по оптимизации питательной сахаросодержащей среды для культивирования микробных продуцентов аминокислот Corynebacterium, Brevibacterium и Bacillus. Оптимизацию питательных сред проводили методом Бокса-Уилсона с применением полного факторного эксперимента с варьированием факторов концентрации питательной среды: пептона, дрожжевой экстракта, редуцирующих веществ. В качестве объектов исследования использовали микробные продуценты аминокислот Corynebacterium glutamicum B-1085, Corynebacterium glutamicum В-11609, Bacillus subtilis B-4828, Bacillus subtilis AJ11779, Brevibacterium flavum В-11404, Brevibacterium flavum В-11635. Для отбора продуктивных микробных продуцентов лизина проводили скрининг бактериальных штаммов на оптимизированной питательной среде с пептоном, дрожжевым экстрактом и ферментолизатом соломы пшеницы как источника редуцирующих веществ. Установлено, что перспективным штаммом – продуцентом лизина является C. glutamicum B-1085. В результате проведенных исследований определен состав питательной среды для культивирования Corynebacterium glutamicum B-1085: пептон – 20,4 г/л; дрожжевой экстракт – 6,7 г/л; ферментолизат соломы пшеницы – 28,2 г/л. Концентрация лизина в конечном продукте составила 11,9 г/л.
Лизин, микробный продуцент, биосинтез, питательная среда, полный факторный эксперимент, оптимизация
Короткий адрес: https://sciup.org/147252731
IDR: 147252731 | УДК: 66.075.33:579.26
Текст научной статьи Оптимизация состава природных сахаросодержащих сред для биосинтеза лизина микробными продуцентами
Введение. Лизин является незаменимой аминокислотой, жизненно необходимой для питания, как человека, так и сельскохозяйственного животного, производство которого в мировой экономике уже давно стало крупнотоннажным [1].
Лизин используется организмом в различных физиологических процессах. Недостаток лизина в питании вызывает негативные нарушения иммунной, мышечной и нервной систем. Включение лизина в рацион животных, включая сельскохозяйственных птиц, существенно повышает их продуктивность. Научные исследования показывают, что добавление этой аминокислоты в корма приводит к увеличению среднесуточных привесов крупного рогатого скота и других животных на 10–25%. У кур-несушек также наблюдается рост продуктивности на аналогичную величину. Кроме того, у коров отмечается повышение молочной продуктивности на 12%. Это свидетельствует о положительном влиянии лизина на метаболические процессы и репродуктивные функции животных [6].
В настоящее время данную аминокислоту получают гидролизом отходов птицеперерабатываемых производств путем переработки пера, пуха, крови и других белковосодержащих компонентов энзиматическим или микробиологическим синтезом [5]. В промышленности синтез лизина осуществляется микроорганизмами при глубинном культивировании. В промышленном производстве лизина применяются следующие основные сырьевые компоненты: меласса, кукурузный экстракт, соляная кислота, аммиачная вода, витамины, отруби, подсолнечный шрот, рыбная мука, мясокостная мука и рапс [3].
Одно из наиболее активно разрабатываемых направлений по поиску средств снижения издержек на производство L-лизина предусматривает разработку и применение более совершенных питательных сред культивирования продуцентов, наиболее полно учитывающих потребности штаммов в питательных веществах, и их способность обеспечивать оптимальную концентрацию целевого продукта в культуральной жидкости [4].
Широко распространенными продуцентами аминокислот из моносахаров являются Corynebacterium, Brevibacterium и Bacillus [4]. Указанные бактерии представляют собой ценные штаммы, полученные с помощью мутаций в их геноме. Эти изменения направлены на увеличение продуктивности по производству аминокислот. История их развития охватывает длительный период, начиная с момента открытия и заканчивая созданием практически пригодных штаммов [4].
Таким образом, исходя из вышесказанного, целью данной работы являлось оптимизация состава природных сахаросодержащих сред для продуктивного биосинтеза и удельного выхода лизина при использовании микробных продуцентов.
Объекты и методы исследования. Исследования проводились в научно-исследовательской испытательной лаборатории биотехнологии и молекуляр- ной экспертизы кафедры Биотехнологии и химии имени профессора Н.Е. Павловской ФГБОУ ВО Орловский ГАУ, в лаборатории аналитических и регистрационных испытаний ФИЦ «Немчиновка».
В качестве объектов исследования использовали следующие микробные продуценты аминокислот - Corynebacterium glutamicum B-1085, Corynebacterium glutamicum В-11609, Bacillus subtilis B-4828, Bacillus subtilis AJ11779, Brevibacterium flavum В-11404, Brevi-bacterium flavum В-11635 из коллекций БРЦ ВКПМ НИЦ «Курчатовский институт» (ГосНИИгенетика) и кафедры биотехнологии и химии имени профессора Н.Е. Павловской.
Питательная сахаросодержащая среда для микробиологического синтеза лизина. Солому злаковых культур, являющуюся ценным источником органических компонентов, измельчали (до 3-5 мм), затем подвергали ультразвуковой дезинтеграции на приборе Soniprep («MSE», UK), используя «пальчиковый» преобразователь, с интервальным режимом чередования импульсов по 30 секунд, частота 23 кГц, пауз по 20 секунд. Амплитуда колебания звуковода составила 20 мкм, число циклов дезинтеграции равно 15.
Пробы гидролизатов после дезинтеграции фильтровали через микрофильтрационную мембрану для удаления частиц дисперсной фазы [3] и соединяли с композицией ферментов «ЦеллоЛюкс-F» + «ФидБест VGPro G». Смесь для реакции выдерживали в течение 36 часов при температуре 45°C [4]. В полученном ферментолизате концентрация РВ, г/л: для соломы пшеницы составляет 28,2; для соломы гречихи – 27,1 [4]. К ферментолизату добавляли питательные компоненты согласно стандартной рецептуре среды «L», г/л: пептон – 15; натрий хлористый – 5; дрожжевой экстракт – 5[ mikroorganizmov/].
Инокулят для дальнейших манипуляций подготавливали из суточной агаровой культуры микроорганизмов-продуцентов. Первоначально культуру пересевали в колбы Эрленмейера, содержащие жидкую питательную среду «L», исключающую углеводные компоненты. Затем, бактериальную суспензию на стадии поздней логарифмической фазы роста, использовали для инокуляции питательной среды, предназначенной для микробиологического синтеза лизина, в объеме 0,5% от общего объема среды.
В ходе культивирования контролировали и поддерживали на заданном уровне температуру +30±0,5°С, рН7,0±0,2 и рО 2 ≥20±0,5%, частота вращений мешалки 200 мин-1. Корректировка текущих параметров производилась программным обеспечением IRIS 2.0 автоматически.
Составы питательных сред оптимизировали методом Бокса-Уилсона , для чего реализовывали полный факторный эксперимент по плану N =2 k , где факторы варьирования: пептон, г/л ( X 1 ); дрожжевой экстракт, г/л ( X 2 ); редуцирующие вещества, г/л ( X 3 ). Распределение уровней факторов в таблице 1.
Таблица 1. Распределение уровней факт оров варьирования в полноф акторном эксперименте
|
Уровень |
Фактор |
||
|
X 1 |
X 2 |
X 3 |
|
|
x i ° |
15 |
5 |
27 |
|
Δ x i |
5 |
2,5 |
7,5 |
|
min x i |
10 |
2,5 |
19,5 |
|
max x i |
20 |
7,5 |
34,5 |
Получение готовой формы продукта. Полученный раствор пропускали через мембраны с целью отделения лизина от других компонентов среды. Очистку продукта проводили рафинацией, концентрирование – упариванием. Кристаллический продукт был получен из концентрированного раствора лизина путем высушивания.
Исследования проводились с трехкратной повторностью в рамках трех серий экспериментов. Статистический анализ данных был выполнен с исполь- зованием программы Microsoft Office Excel 10. В таблицах представлены средние значения с указанием стандартного отклонения.
Результаты и их обсуждение. Для отбора микробных продуцентов лизина проводили скрининг коллекционных штаммов при культивировании на оригинальной сахаросодержащей питательной среде. Определяли концентрацию лизина в культуральной жидкости и биомассе (см. рис. 1).
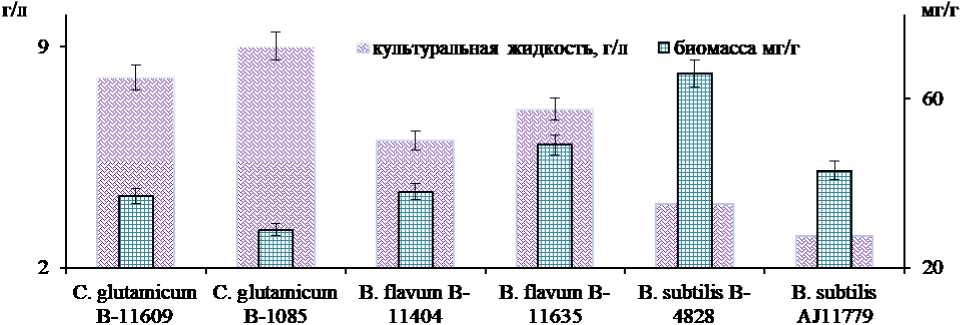
Рис. 1 – Концентрация лизина в культуральной жидкости и биомассе при культивировании коллекционных штаммов на оригинальной питательной среде
Наибольшая концентрация лизина в культуральной жидкости определяется у C. glutamicum B-1085 и составила 9,1±0,45 г/л; тогда как в биомассе наибольшая концентрация лизина в эксперименте с B. subtilis B-4828 - 66±3,3мг/г. Таким образом, в качестве мик- робного продуцента для микробиологического синтеза лизина в нашем исследовании был выбран C. glu-tamicum B-1085, параметры его культивирования представлены на рисунке 2.
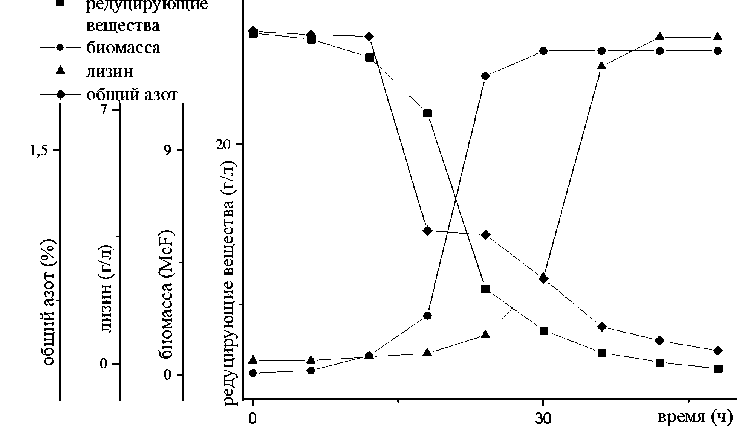
Рис. 2 – Параметры культивирования C. glutamicum B-1085, микробного продуцента лизина на оригинальной питательной среде
I 26 1
Для достижения наибольшей продуктивности C. glutamicum B-1085 при глубинном культивировании изучали влияние пептона ( X 1 ), дрожжевого экстракта ( X 2 ), редуцирующих веществ ( X 3 ) питательной среды на концентрацию лизина в культуральной жидкости, г/л ( y ) (рисунок 3).
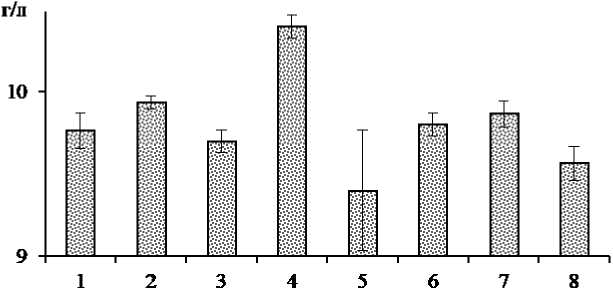
Рис. 3 - Концентрация лизина в культуральной жидкости C. glutamicum B-1085 при варьировании компонентного состава питательной среды
Результаты определения концентрации лизина в культуральной жидкости воспроизводимы, так как критерий Кохрена: р G = 0,17 меньше т G 0,95;8;9 = 0,29. Рассчитаны коэффициенты регрессионного уравнения, отличие от нуля которых проверяли по критерию Стьюдента: t 0,95;64 = 1,99. При подстановке числовых выражений значимых коэффициентов математическая модель приобрела вид:
y = 9,3 + 0,12 X 1 + 0,08 X 2 – 0,15 X 3 – 0,1 Х 1 Х 3 – 0,15 Х 1 Х 2 Х 3 .
Модель адекватно описывает изучаемый процесс и может быть использована в процедуре оптимизации биосинтеза лизина исследуемым микробным продуцентом, что подтверждается значением критерия Фишера:
-
р F = 0,03 меньше т F 0,95;3;64 = 0,12. В таблице 2 представлены рассчитанные факторы оптимизации процесса биосинтеза лизина C. glutamicum B-1085 по типу крутого восхождения.
Таблица 2. Оптимизация по типу крутого восхождения
|
параметры |
факторы |
|||
|
X 1 |
X 2 |
X 3 |
||
|
Расчётный интервал, λ i |
0,6042 |
0,1979 |
-1,094 |
|
|
Расчётный интервал округлённый, °λ i |
0,6 |
0,2 |
1,1 |
|
|
Пропорциональность, θ |
0,54 |
0,33 |
1 |
|
|
Шаг по градиенту, δ x i |
2,7 |
0,8 |
-7,5 |
|
|
Эксперимент |
оптимизация №1 |
17,7 |
5,8 |
19,5 |
|
оптимизация №2 |
20,4 |
6,7 |
11,9 |
|
|
оптимизация №3 |
23,0 |
7,5 |
4,4 |
|
Оптимизация признаётся эффективной, так как при реализации активного эксперимента было до- на в культуральной жидкости 11,9 г/л, составившее 110% от спрогнозированного (см. рис. 4).
стигнуто максимальное значение концентрации лизи-
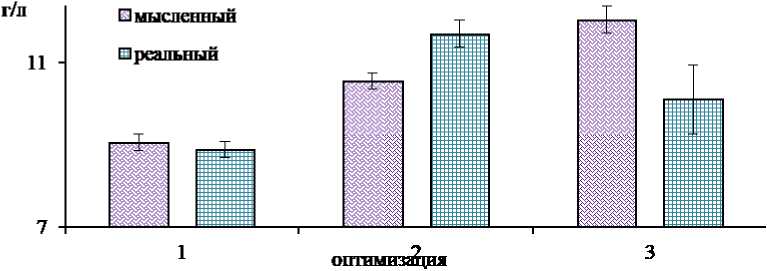
Рис. 4 - Концентрация лизина в культуральной жидкости C. glutamicum B-1085 при реализации активного эксперимента по оптимизации процесса биосинтеза лизина
На основании полученных результатов эксперимента определен состав питательной среды для культивирования C. glutamicum B-1085, г/л: пептон – 20,4; дрожжевой экстракт – 6,7; сахарный раствор редуцирующих веществ (ферментолизат соломы пшеницы) –
-
28,2. Концентрация лизина в конечном продукте – 11,9 г/л.
Выводы. Таким образом, в процессе выполнения данной научной задачи нами показано, что в результате оптимизации состава природных сахаросодер- жащих сред методом Бокса-Уилсона с целью продуктивного биосинтеза и удельного выхода лизина при использовании C. glutamicum B-1085, получен концентрированный раствор лизина с концентрацией 11,9 г/л. Определен оптимальный состав оригинальной сахаросодержащей питательной среды для культивирования C. glutamicum B-1085, г/л: пептон – 20,4; дрожжевой экстракт – 6,7; сахарный раствор редуцирующих веществ (ферментолизат соломы пшеницы) – 28,2.
Заключение. В подобранных условиях культивирования микробный продуцент аминокислоты ли- зина C. glutamicum B-1085 характеризуется как продуктивный, технологичный, с благоприятными биологическими свойствами.
Полученные в ходе исследования данные послужили основой для разработки технологии получения лизинсодержащего кормового препарата, где одним из компонентов питательной среды служит сахарный раствор, полученный из целлюлозосодержащих отходов для микробного продуцента лизина — бактерий Corynebacterium glutamicum B-1085 .


