Опухоль-ассоциированные мезенхимные стволовые клетки при химически индуцированном раке молочной железы у крыс Wistar
Автор: Лыков Александр Петрович, Кабаков Алексей Васильевич, Бондаренко Наталья Анатольевна, Повещенко Ольга Владимировна, Райтер Татьяна Владимировна, Казаков Олег Васильевич, Стрункин Дмитрий Николаевич, Суровцева Мария Александровна, Повещенко Александр Федорович, Коненков Владимир Иосифович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.18, 2019 года.
Бесплатный доступ
Цель исследования - сравнить морфофункциональные свойства мезенхимных стволовых клеток из тканей молочной железы и ткани химически-индуцированной опухоли молочной железы. материал и методы. У 20 крыс-самок Wistar после синхронизации эструса хорионическим гонадотропином, интрамаммарным введением N-метил-N-нитрозомочевины индуцирована аденокарцинома молочной железы, контрольную группу составили 5 крыс. Верификацию опухоли проводили гистологически и иммуногистохимически. Принадлежность выделенных клеток из ткани молочной железы и опухоли молочной железы к мезенхимным стволовым клеткам верифицировали на основании морфологии и фенотипирования на проточном цитофлуориметре FACS Canto II. Функциональные свойства мезен-химных стволовых клеток оценивали в МТТ-тесте и по уровню продукции оксида азота в норме и при индукции перекисью водорода окислительного стресса. Уровни пролактина, лютеинизирующего гормо-на и эстрадиола Е2 в моче исследовали твердофазным иммуноферментным анализом. Результаты. Химически индуцированная опухоль молочной железы по данным гистологического и иммуногистохи-мического исследования соответствовала люминальному В1 типу рака молочной железы у человека. Уровни пролактина в моче после синхронизации эструса у животных с развившейся опухолью были повышены, а у животных с неразвившейся опухолью молочной железы снижены уровни пролактина и лютеинизирующего гормона, но повышены уровни эстрадиола Е2. Из ткани опухоли молочной железы получено большее количество мезенхимных стволовых клеток с фенотипом CD45-/CD90+. Мезен-химные стволовые клетки из ткани опухоли проявляли повышенный пролиферативный потенциал и были более устойчивы к окислительному стрессу. заключение. Из ткани химически индуцированной опухоли молочной железы получены опухоль-ассоциированные мезенхимные стволовые клетки, кото-рые имеют высокий пролиферативный потенциал и устойчивы к окислительному стрессу. Выявленные морфофункциональные различия мезенхимных стволовых клеток из тканей молочных желез и ткани опухоли молочной железы требуют дальнейшего исследования.
Опухоль молочной железы, мезенхимные стволовые клетки, пролиферация, оксид азота, половые гормоны, моча
Короткий адрес: https://sciup.org/140254438
IDR: 140254438 | УДК: 612.062:612.086.2:616-006.66 | DOI: 10.21294/1814-4861-2019-18-1-56-64
Текст научной статьи Опухоль-ассоциированные мезенхимные стволовые клетки при химически индуцированном раке молочной железы у крыс Wistar
Химически индуцированный N‑метил‑N‑нитро‑ зомочевиной рак молочной железы у лабораторных животных является аналогом рака молочной желе‑ зы у человека [1]. При интрамаммарном введении N‑метил‑N‑нитрозомочевины развитие опухоли молочной железы индуцируется в 92 %, механизмы резистентности в индукции опухолевой транс‑ формации при таком способе инициации опухоли молочной железы мало исследованы. В патогенезе рака молочной железы существенная роль отводит‑ ся гормонам, в том числе и половым [2], в частно‑ сти образованию эстрогенов из андрогенов in situ как следствие повышенной экспрессии ароматазы в тканях молочных желез [3]. Не менее важная роль в патогенезе рака молочной железы отводится и клеточному составу опухолевого микроокружения, включая и клетки стромы опухоли. Показано, что нормальные фибробласты стромы молочных желез подавляют рост опухоли, в то же время опухоль‑ ассоциированные фибробласты усиливают канце‑ рогенез [4]. О наличии проонкогенного действия мезенхимных стволовых/стромальных клеток (МСК) при раке молочной железы сообщается в литературе [5–6].
Цель исследования – изучение морфофунк‑ циональных свойств МСК крыс‑самок Wistar, выделенных из ткани химически индуцированной опухоли молочной железы, контралатеральной молочной железы и ткани молочной железы ин‑ тактных животных.
Материал и методы
Эксперименты на лабораторных животных проведены с соблюдением принципов гуманного обращения с животными, изложенных в дирек‑ тивах Европейского сообщества (86/609/ЕСС) и Хельсинкской декларации, в соответствии с «Пра‑ вилами проведения работ с использованием экспе‑ риментальных животных». Эксперимент выполнен на 25 крысах‑самках Wistar массой 300–350 г. Опухоль молочной железы у 20 крыс‑самок Wistar после синхронизации эструса (3 МЕ/крысу хо‑ рионического гонадотропина внутрибрюшинно, Гонадотропин хорионический, Московский эндо‑ кринный завод, Россия) индуцировали введением N‑метил‑N‑нитрозомочевины (30 мг/кг, Sigma‑ Aldrich, США) 5 раз с интервалом в 7 дней под‑ кожно в область одной и той же молочной железы (2‑я молочная железа справа).
Спустя 6 мес выделяли ткань опухоли молочной железы, ткань из контралатеральной молочной железы и ткань молочной железы от интактных животных, измельчали ножницами и подвергали ферментативной диссоциации инкубацией при 37 ºС с 0,05 % раствором коллагеназы I типа (Sig‑ ma‑Aldrich, США) в течение 4 ч. После отмывки диссоциированных клеток из тканей молочной железы и тканей опухоли молочной железы клетки рассеивали в пластиковые флаконы (ТРР, Швей‑ цария) в питательной среде DMEM, дополненной 80 мкг/мл гентамицина сульфата, 2 мM L‑глютамина (ICN, США) и 15 % фетальной телячьей сыворот‑ ки, и растили при 37 ºС в атмосфере 5 % СО2. Через 48 ч не прикрепленные к пластику клетки удаляли, а прилипающую фракцию клеток куль‑ тивировали до получения конфлюэнтного слоя. Снятие МСК осуществляли с использованием 0,25 % раствора трипсина и 0,02 % раствора ЭДТА (ICN, США). Пролиферацию МСК в присутствии и в отсутствие 100 μМ H2O2 оценивали через 72 ч спектрофотометрически (длина волны 492 нм) по включению 3‑(4,5‑диметилтиазол‑2‑ил)‑2,5‑ дифенил‑2Н‑тетразолиум бромида (МТТ‑тест). В кондиционных средах от МСК, росших в при‑ сутствии и в отсутствие 100 μМ H2O2 в течение 72 ч, спектрофотометрически определяли уровни оксида азота (NO) с использованием реактива Грисса. Фенотип МСК от 3‑го пассажа исследовали на проточном цитофлуориметре FACS Canto II с использованием FITC‑конъюгированных монокло‑ нальных антител к CD45 и PE‑конъюгированных моноклональных антител к CD90 (Sony, Япония). Гистологическое исследование опухолевой ткани проводили по общепринятой методике с окраской гематоксилином и эозином и последующим ана‑ лизом на микроскопе Olympus BX41. Иммуно‑ гистохимически (ИГХ) определяли экспрессию эстрогеновых рецепторов α, прогестероновых рецепторов, Her2/neu рецепторов и интенсивность пролиферации по Ki67. ИГХ проводили на автома‑ тической платформе для окрашивания Autostainer Link48 (Dako, Дания): образцы помещали Target Retrieval Solution buffer (Dako, Дания) с использо‑ ванием PreTreament Link Platform (Dako, Дания). Далее срезы отмывали смесью TBS/0,05 % Tween buffer в течение 5 мин с EnVision FLEX Peroxidase‑ Blocking Reagent для блокирования эндогенной пероксидазной активности. Далее срезы отмывали смесью TBS/0,05 % Tween buffer и инкубировали с первичными антителами: к α‑рецептору эстрогена (кроличьи антитела, клон Е115, рН 9,0 и рабочее разведение 1:100, Novus Biologicals, Германия); к рецептору прогестерона (кроличьи антитела, Polyclonal, рН 9,0 и рабочее разведение 1:100, No‑ vus Biologicals, Германия); к Her2/neu рецептору (кроличьи антитела, клон SP3, рН 6,0 и рабочее разведение 1:300, Labvision, Швеция); к Ki67 (мы‑ шиные антитела, клон MIB‑5, pH 6,0 и рабочее раз‑ ведение 1:25, Dako, Дания). Далее срезы отмывали смесью TBS/0,05 % Tween buffer в течение 20 мин при комнатной температуре с EnVision FLEX/ horseradish peroxidase (HRP)‑conjugated (вторичные меченные пероксидазой хрена антитела, Dako, Дания). После этого субстрат пероксидаза диами‑ нобензидина (Dako, Дания) наносился на срезы, инкубация 10 мин при комнатной температуре. Да‑ лее срезы прокрашивали гематоксилином Майера, дегидратировали в спиртах (70 %; 96 %; 99,8 %) и ксилоле, после чего оценивали реакцию имму‑ ногистохимии под микроскопом (Leica DM 750, Германия). Уровни гормонов в моче определяли иммуноферментным анализом с использованием коммерческих наборов: «ГонадотропинИФА‑ЛГ», «ИФА‑Пролактин‑01» производства ООО «Компа‑ ния Алкор Био» (СПб., Россия) и «Estradiol ELISA» (DRG Diagnostics, Германия).
Статистическую обработку данных проводили с использованием программы Statistica 6.0, меры центральной тенденции и рассеяния описаны ме‑ дианой (Ме), нижним (LQ) и верхним (UQ) квар‑ тилями; достоверность различия рассчитывалась по U‑критерию Манна – Уитни и принималась при значениях p≤0,05.
Результаты
Химически индуцированная опухоль молочной железы у крыс‑самок Wistar развивалась в 90 %, макроскопически характеризовалась очаговыми образованиями с фиброзной оболочкой, нечеткими контурами, а у части животных с изъязвлениями и обызвествлением кожи над очагом опухолевого роста. В случаях несформировавшейся химически
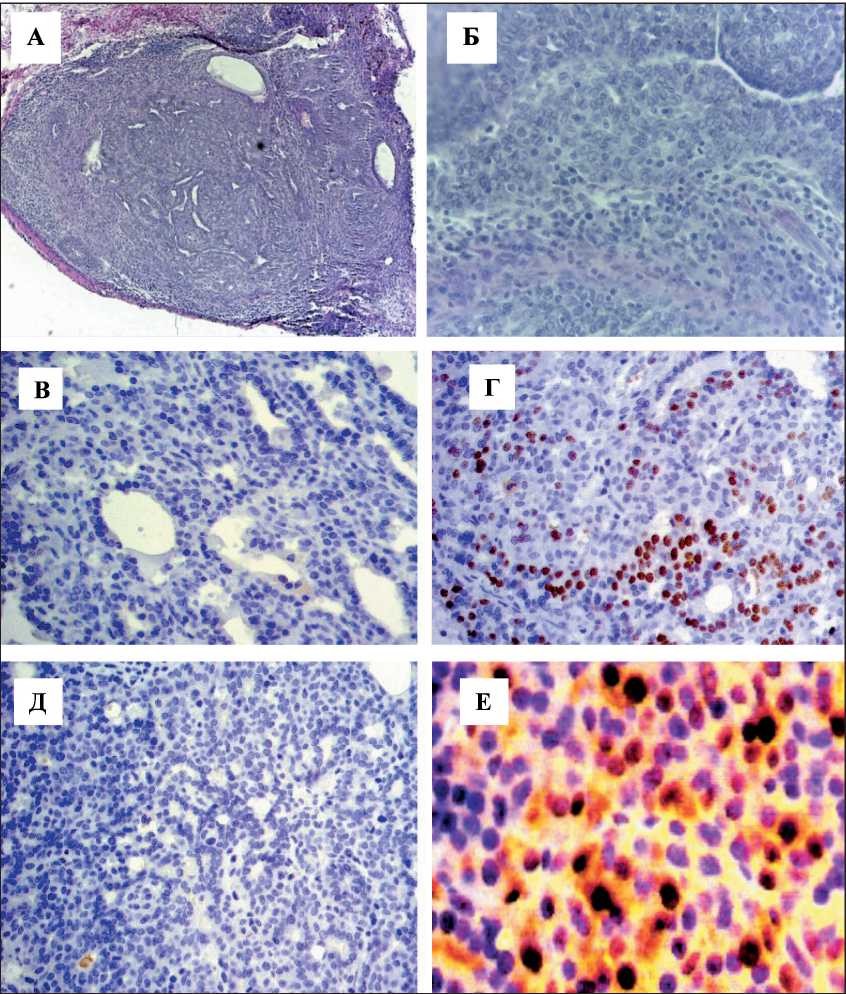
Рис. 1. Микрофото. Умереннодифференцированная аденокарцинома с инфильтрирующим характером роста: А – окраска гематоксилином и эозином, ×100; Б – окраска гематоксилином и эозином, ×400; В – негативная по экспрессии α-рецепторов к эстрогену кроличьи антитела, клон Е115, Novus Biologicals, Германия, ×400; Г – позитивная по экспрессии рецепторов к прогестерону, кроличьи антитела, Polyclonal, Novus Biologicals, Германия, ×400;
Д – негативная по экспрессии рецептора Her-2/neu кроличьи антитела, клон SP3, Labvision, Швеция, ×400; Е – позитивная по Ki67 мышиные антитела, клон MIB-5, Dako, Дания, ×1000
индуцированной опухоли молочной железы ма‑ кроскопически ткань молочной железы состояла из фиброзных тяжей с небольшими включениями жировой ткани. Гистологическая и гистохимиче‑ ская характеристика химически индуцированной опухоли молочной железы у крыс‑самок Wistar представлена на рис. 1.
Микроскопически опухоль молочной железы характеризовалась наличием протоковых, желе‑ зистых, криброзных структур, выстланных уме‑ ренно полиморфным эпителием с вариабельной митотической активностью; тубулярные структуры преобладали, отдельные участки ткани опухоли представлены перемешанными гнездами, цугами и группами отдельных клеток с менее оформленны‑ ми протоками вплоть до их полного исчезновения, что соответствует умереннодифференцированной аденокарциноме молочной железы (рис. 1А, Б). Более того, клетки умереннодифференцированной карциномы молочной железы не несли рецепторы к эстрогену (рис. 1В) и к эпидермальному ростовому фактору человека Her‑2/neu (рис. 1Д), но были по‑ зитивны по наличию рецепторов к прогестерону (рис. 1Г) и обладали высоким пролиферативным потенциалом по данным исследования Ki67 (рис.
-
1Е) . Все это в совокупности позволяет нам рас‑ сматривать данную аденокарциному как аналог люминального В1 типа рака молочной железы человека, что согласуется с данными других ис‑ следователей [7].
С учетом вовлеченности половых гормонов в патогенез опухолей молочных желез нами ис‑ следованы уровни гормонов в моче крыс‑самок Wistar после синхронизации эструса и спустя 6 мес после индукции опухоли молочной железы (табл. 1). Показано, что уровни пролактина в моче жи‑ вотных с развившейся опухолью молочной железы сразу после синхронизации эструса были выше, чем в контроле (p≤0,05). Уровни пролактина и лютеинизирующего гормона в моче мышей с не‑ развившейся опухолью были ниже, чем в контроле и у животных с развившейся опухолью молочной железы, а уровни в моче эстрадиола Е2 были выше по сравнению с контролем (p≤0,05).
Спустя 6 мес после синхронизации эстру‑ са и индукции N‑метил‑N‑нитрозомочевиной опухоли молочной железы только у животных с неразвившейся опухолью молочной железы вы‑ явлены повышенные уровни в моче пролактина по сравнению с контролем и повышенные уровни таблица 1
Уровни гормонов в моче исследуемых групп крыс-самок wistar (Me; lQ-uQ)
|
Параметры |
Контрольная |
Группы животных С опухолью |
Без опухоли |
|
37,9 |
275,36 |
26,5 |
|
|
Пролактин (мМЕ/мл) |
37,5–39,2 |
253,36–282,7* |
25,75–27,25* ** |
|
После син‑ |
|||
|
Лютеинизирующий гормон |
2,32 |
2,88 |
0,92; |
|
хронизации (мМЕ/мл) |
2,23–2,35 |
2,09–4,74 |
0,71–1,13* ** |
|
эструса |
139,4 |
220,83 |
202,8 |
|
Эстрадиол Е2 (пг/мл) |
127,5–143,4 |
179,77–254,8 |
198,32–207,38* |
|
120,91 |
204,35 |
273,3 |
|
|
Пролактин (мМЕ/мл) |
116,7–133,7 |
156,5–252,2 |
224,1–322,5* |
|
Через 6 мес по‑ Лютеинизирующий гормон |
2,27 |
2,62 |
2,34 |
|
сле синхрони‑ (мМЕ/мл) |
2,15–2,66 |
2,48–2,8 |
1,32–3,36 |
|
зации эструса |
215,6 |
142,28 |
220,83 |
|
Эстрадиол Е2 (пг/мл) |
206,23–218,66 |
134,39–150,2* |
209,47–232,2** |
Примечания: * – различия статистически значимы по сравнению с контролем (p≤0,05); ** – различия статистически значимы по сравнению с группой животных с опухолью молочной железы (p≤0,05).
эстрадиола Е2 по сравнению с животными с раз‑ вившейся опухолью молочной железы (p≤0,05). Кроме этого, уровни в моче эстрадиола Е2 у крыс‑ самок с опухолью молочной железы были ниже, чем в контроле (p≤0,05).
Необходимо отметить тот факт, что между уров‑ нями лютеинизирующего гормона и эстрадиола Е2 в моче животных сразу после синхронизации эстру‑ са, у которых разовьется опухоль молочной железы, была выявлена обратная и сильная сопряженность (r=‑0,89, p≤0,05). В то же время в группе животных, у которых не развилась опухоль молочной железы, сразу после синхронизации эструса уровни про‑ лактина в моче находились в прямой и сильной сопряженности с лютеинизирующим гормоном (r=0,92, p≤0,05) и сильной и обратной взаимосвязи с эстрадиолом Е2 через 6 мес (r=‑0,92, p≤0,05). Кроме этого, в этой группе выявлена прямая и сильная связь уровней лютеинизирующего гормона в моче сразу после синхронизации эструса с эстрадиолом Е2 (r=0,92, p≤0,05) в эти же временные рамки на‑ блюдалась обратная и сильная сопряженность с пролактином и лютеинизирующим гормоном спу‑ стя 6 мес (r=‑0,92, p≤0,05). Исходные уровни в моче эстрадиола Е2 находились в обратной и сильной взаимосвязи с уровнями эстрадиола Е2 в моче этих животных спустя 6 мес (r=‑0,92, p≤0,05). Установле‑ но, что уровни эстрадиола Е2 в моче животных без опухоли спустя 6 мес после синхронизации эструса и индукции опухоли молочной железы N‑метил‑N‑ нитрозомочевиной находились в прямой и сильной связи с пролактином и лютеинизирующим гормо‑ ном (r=0,92, p≤0,05).
Культуры клеток МСК, выделенных из тканей молочной железы и тканей опухоли молочной железы, были фибробластоподобной морфологии (рис. 2). В группе животных с опухолью молоч‑ ной железы из ткани опухоли выделено большее количество МСК по сравнению с остальными ис‑ точниками получения МСК (p≤0,05). Более того, именно в этой группе в ткани опухоли молочной железы большее количество МСК с фенотипом CD45‑/CD90+, чем в остальных образцах тканей молочных желез (p≤0,05). Кроме этого, МСК, вы‑ деленные из ткани опухоли, имели повышенный пролиферативный потенциал и были более устой‑ чивы к окислительному стрессу in vitro , чем МСК, полученные из других источников (p≤0,05). МСК,
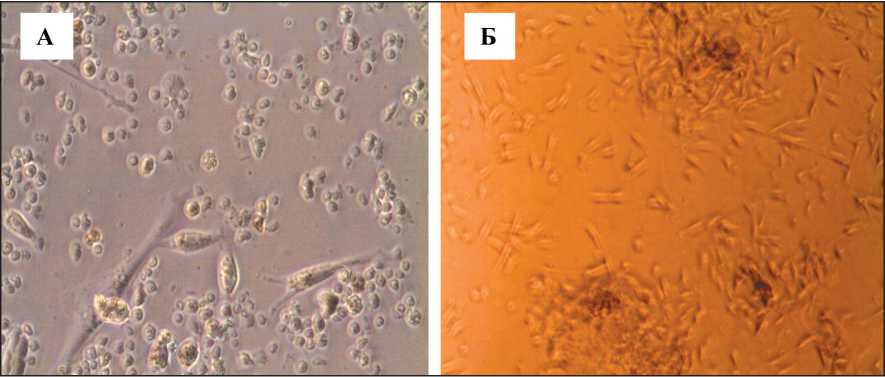
Рис. 2. Фибробластоподобная морфология опухоль-ассоциированных мезенхимных стромальных клеток (нативный препарат): А – единичные опухоль-ассоциированные МСК (вытянутые клетки) среди клеток опухоли молочной железы (округлые клетки), ×200; Б – формирование колоний опухоль-ассоциированными МСК, ×40
таблица 2
Морфофункциональная характеристика мезенхимных стволовых клеток ткани молочной железы и химически индуцированной n-метил-n-нитрозомочевиной опухоли молочной железы у крыс-самок wistar (Me; lQ-uQ)
|
Параметры |
Источник выделения мезенхимных стромальных клеток |
||||
|
Молочные железы контрольной группы |
Опухоль молочной железы группы с опухолью |
Контралатеральная молочная железа группы с опухолью |
Молочные железы группы без опухоли |
Контралатеральная молочная железа группы без опухоли |
|
|
Выход клеток (106) |
1,75; 1,75–1,87 |
6,0; 5,5–6,5* |
2,75; 2,62–2,87* ** |
2,37; 2,31–2,43** *** |
1,75; 1,37–2,12** *** |
|
CD45+/CD90‑ |
0,1; 0,1–0,1 |
4,26; 3,53–4,99* |
0,005; 0,0025– 0,008* ** |
0,96; 0,49–1,42* |
0,04; 0,03–0,05* |
|
CD45+/CD90+ |
0,05; 0,05–0,05 |
3,88; 3,84–3,92* |
0,015; 0,00750,022* |
0,085; 0,047– 0,122** |
0,0; 0,0–0,0* ** # |
|
CD45‑/CD90+ |
10,24; 10,24–10,243 |
25,99; 25,28–26,69* |
15,23; 14,08–16,38* ** |
5,84; 5,75–5,92* |
10,89; 9,9–11,85** *** # |
|
Пролиферация |
0,374; 0,373–0,374 |
0,69; 0,61–0,77* |
0,47; 0,42–0,53* ** |
0,32; 0,3–0,34* ** *** |
0,424; 0,379–0,469* ** |
|
Пролиферация + H 2 O 2 |
0,386; 0,367–0,393 |
0,56; 0,54–0,58* |
0,43; 0,4–0,47* |
0,41; 0,35–0,46** |
0,4; 0,38–0,43** |
|
Продукция NO |
19,58; 18,9–21,65 |
18,1; 18,05–18,15* |
38,55; 32,25–44,87* ** |
15,5; 13,9–17,1* *** |
21,95; 21,53–22,4** *** # |
|
Продукция NO + H 2 O 2 |
25,42; 24,6–27,9 |
26,2; 26,2–26,2 |
31,45; 30,87–32,02* ** |
18,9; 17,75–20,05** |
28,0; 27,0–29,1# |
Примечания: CD – кластер дифференцировки; H2O2 – наличие в питательной среде 100 μМ H2O2; NO – оксид азота; * – различия статистически значимы по сравнению с контролем (p≤0,05); ** – различия статистически значимы по сравнению с группой с опухолью молочной железы (p≤0,05); *** – различия статистически значимы по сравнению с контралатеральной молочной железой в группе с опухолью молочной железы (p≤0,05); # – различия статистически значимы по сравнению с группой без опухоли молочной железы (p≤0,05).
выделенные из ткани опухоли молочной железы и из ткани неразвившейся опухоли молочной железы, в меньшей степени продуцировали NO (p≤0,05).
У крыс‑самок с опухолью молочной железы показано наличие сильной и обратной связи ко‑ личества клеток с фенотипом CD45+/CD90+ с пролиферативной активностью МСК в условиях окислительного стресса и уровнями продукции NO, а также с исходными уровнями пролактина в моче после синхронизации эструса (r=‑0,92; r=‑0,91 и r=‑0,97, p≤0,05 соответственно). В группе животных с неразвившейся опухолью молочной железы количество клеток с фенотипом CD45+/ CD90+ и количество клеток с фенотипом CD45‑/ CD90+ находились в обратной и сильной связи с уровнями в моче сразу после синхронизации эструса лютеинизирующего гормона (r=‑0,917, p≤0,05) и в прямой и сильной связи с уровнями в моче спустя 6 мес эстрадиола Е2 (r=0,92, p≤0,05). Пролиферативный потенциал МСК в присутствии и в отсутствие перекиси водорода находился в об‑ ратной и сильной связи с уровнями в моче спустя 6 мес эстрадиола Е2 (r=‑0,917, p≤0,05). Уровни продукции МСК оксида азота в отсутствие пере‑ киси водорода находились в обратной и сильной связи с уровнями эстрадиола Е2 спустя 6 мес после синхронизации эструса (r=‑0,917, p≤0,05), а в при‑ сутствии перекиси водорода – в прямой и сильной связи (r=0,917, p≤0,05).
Обсуждение
Известно, что опухоль‑ассоциированное микроокружение, в том числе и МСК, играет су‑ щественную роль в канцерогенезе [5]. Показано, что опухоль‑ассоциируемые фибробласты и МСК инициируют провоспалительное микроокружение в области роста опухолевых клеток и тем самым по типу хронического воспаления инициируют условия для злокачественной трансформации кле‑ ток молочных желез [8]. Известно также, что МСК обладают тропизмом к опухолям, способствуют их росту и метастазированию [9]. В основе данного эффекта МСК лежит паракринное влияние секре‑ тируемых МСК факторов, приводящее к снижению экспрессии Е‑кадгерина и повышению экспрес‑ сии протеинов, необходимых для эпителиально‑ мезенхимного перехода (N‑кадгерин, виментин, фибронектин) [9]. О роли секретируемых МСК, выделенных из опухолей молочных желез, сви‑ детельствуют данные L. Usha et al. [10], которые показали, что кондиционная среда от МСК активи‑ рует пролиферативный и миграционный потенциал МСК. In vitro авторы обнаружили антипролифера‑ тивное влияние кондиционных сред на опухолевые клеточные линии как следствие задержки в G0/G1 фазе клеточного цикла, но данный эффект не уста‑ новлен in vivo . Также показано, что МСК из тканей молочных желез способствуют пенетрации ком‑ понентов внеклеточного матрикса опосредованно через экспрессию ММП‑1 и МПП‑3, тем самым способствуя инвазии опухолевых клеток [11].
Полученные нами результаты исследования фенотипа МСК, выделенных из тканей молочных желез и тканей опухоли молочных желез, согласу‑ ются с результатами исследований других авторов, которые также отметили экспрессию МСК из тка‑ ней опухоли человека поверхностных маркеров, характерных для мезенхимных стволовых клеток, и были способны к цитодифференцировке в остео‑ генном и адипогенном направлении [6].
Заключение
Из ткани опухоли молочной железы, химически индуцированной интрамаммарным введением N‑метил‑N‑нитрозомочевины, получены опухоль‑
Список литературы Опухоль-ассоциированные мезенхимные стволовые клетки при химически индуцированном раке молочной железы у крыс Wistar
- Чочиева А.Р. Исследование влияния летрозола на некоторые показатели гормонально-метаболического статуса при экспериментальном раке молочной железы. Сибирский онкологический журнал. 2008; 1: 100-102. .
- Лыков А.П., Кабаков А.В., Казаков О.В., Бондаренко Н.А., Повещенко О.В., Райтер Т.В., Повещенко А.Ф., Стрункин Д.Н., Коненков В.И. Уровни микроРНК и гормонов в лимфе грудного протока крыс на модели рака молочной железы, индуцированной N-метил-N-нитрозомочевиной. Бюллетень экспериментальной биологии и медицины. 2016; 162 (9): 374-377. .
- Farhat G.N., Cummings S.R., Chlebowski R.T., Parimi N., Cauley J.A., Rohan T.E., Huang A.J., Vitolins M., Hubbell F.A., Manson J.E., Cochrane B.B., Lane D.S., Lee J.S. Sex hormone levels and risks of estrogen receptor-negative and estrogen receptor-positive breast cancers. J Natl Cancer Inst. 2011 Apr 6; 103 (7): 562-70. DOI: 10.1093/jnci/djr031
- Al-Rakan M.A., Colak D., Hendrayani S.F., Al-Bakheet A., Al-Mohanna F.H., Kaya N., Al-Malik O., Aboussekhra A. Breast stromal fibroblasts from histologically normal surgical margins are pro-carcinogenic. J Pathol. 2013 Dec; 231 (4): 457-65. DOI: 10.1002/path.4256
- Cuiffo B.G., Campagne A., Bell G.W., Lembo A., Orso F., Lien E.C., Bhasin M.K., Raimo M., Hanson S.E., Marusyk A., El-Ashry D., Hematti P., Polyak K., Mechta-Grigoriou F., Mariani O., Volinia S., Vincent-Salomon A., Taverna D., Karnoub A.E. MSC-regulated microRNAs converge on the transcription factor FOXP2 and promote breast cancer metastasis. Cell Stem Cell. 2014 Dec 4; 15 (6): 762-74. DOI: 10.1016/j.stem.2014.10.001


