Опухолевые клетки по краю хирургического разреза после попытки радикального лечения больных местнораспространенной уротелиальной карциномой: обзор литературы и описание клинических наблюдений
Автор: Волкова М.И., Гриднева Я.В., Аль-акел И.С., Рябинин Р.И.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзоры и аналитика
Статья в выпуске: 2 т.14, 2024 года.
Бесплатный доступ
Опухоль по краю разреза после радикального хирургического лечения местнораспространенного уротелиального рака (R+) выявляется примерно в 10 % препаратов и ассоциирована с повышением риска локорегионарного рецидива, метастазов и смерти. Пациенты с R+ - неоднородная группа больных, подход к лечению которых должен быть индивидуальным. Стандартного метода ведения пациентов с R+ нет, допустимые опции включают наблюдение, удаление резидуальной опухоли, послеоперационную химиотерапию (ХТ), иммунотерапию (ИТ), лучевую терапию (ЛТ) и химиолучевую терапию (ХЛТ). На выбор лечебной тактики влияют локализация и характеристики первичной опухоли, проведенная неоадъювантная химиотерапия (НХТ), до операции и ответ на неё, степень лечебного патоморфоза, наличие определяемой резидуальной опухоли, а также потенциальная переносимость немедленного послеоперационного лечения.
Уротелиальная карцинома, положительный хирургический край после хирургического лечения
Короткий адрес: https://sciup.org/140306980
IDR: 140306980 | DOI: 10.18027/2224-5057-2024-002
Текст обзорной статьи Опухолевые клетки по краю хирургического разреза после попытки радикального лечения больных местнораспространенной уротелиальной карциномой: обзор литературы и описание клинических наблюдений
Уротелиальная карцинома (УК) — третье по частоте злокачественное новообразование мочевой и мужской половой систем, способное развиваться из уротелия любой локализации. Чаще всего уротелиальный рак поражает мочевой пузырь (85%), гораздо реже — слизистую оболочку верхних мочевыводящих путей (15%) и казуистически редко —уретру (< 1%). Принципиальным для выбора лечебной тактики является выделение немышечно-инвазивных, неметастатических мышечно-инвазивных (местнораспространенных) и распространенных (неоперабельных неметастатических и диссеминированных) форм заболевания. Стандартным подходом к лечению неметастатического мышечно-инвазивного уротелиального рака является хирургическое вмешательство с периоперационной системной терапией. При раке мочевого пузыря (РМП) предпочтительной опцией является назначение комбинированной неоадъювантной химиотерапии (НХТ), основанной на цисплатине, с последующей радикальной цистэктомией (РЦЭ). Адъювантная химиотерапия (АХТ) с включением цисплатина резервируется для пациентов, по тем или иным причинам не получавших НХТ [1,2]. Адъювантная иммунотерапия (АИТ) ниволумабом является опцией, доказавшей свою эффективность у пациентов группы высокого риска прогрессирования УК (yрT2–4 и/или yрN+ для пациентов, получивших НХТ; pT3–4 и/или pN+ после РЦЭ на первом этапе) независимо от статуса экспрессии PD-L1 в опухоли и проведения НХТ [3], однако зарегистрированной в РФ только для больных с экспрессией PD-L1 > 1% опухолевыми клетками [4]. Для пациентов с неметастатической УК верхних мочевыводящих путей (ВМП) стандартным подходом является выполнение радикальной нефруретерэктомии (РНУЭ) с последующей АХТ с включением препаратов платины или АИТ ниволумабом в случае наличия факторов риска прогрессирования (> pT2 и/или pN +). У тщательно отобранных больных уротелиальным раком ВМП с Ta– T1 low-grade или поражением нижней трети мочеточника допустимо применение органосохраняющего хирургического лечения [5]. Эффективность всех опций периопера-ционного лечения изучалась у пациентов, подвергнутых радикальному хирургическому вмешательству. Стандартная тактика ведения больных с опухолевыми клетками по краю операционного разреза (R+) не определена.
По данным мета-анализа, включившего данные 38384 пациентов из 36 клинических исследований (КИ), частота R+ в препаратах после РЦЭ составляет 11,3%. Доля микроскопически (R1) и макроскопически определяемого (R2) положительного хирургического края не анализировалась [6]. Частота R+ существенно колеблется от 0% до 25% в разных сериях наблюдений, что, вероятно, связано со значительными различиями характеристик пациентов. Факторами риска R+ в крупном одноцентро- вом ретроспективном КИ (n = 1589) являлись женский пол (p = 0,04), категория pT > Т2 (p < 0,001), сосудистая инвазия (р = 0,001), метастазы в лимфоузлах (p < 0,001) и количество метастатически пораженных лимфоузлов (р = 0,002), а также вариантная гистологическая форма УК (р = 0,001) [7]. В многоцентровом КИ YAU Urothelial Group, включившем индивидуальные данные 394 больных РМП с опухолевыми клетками по краю хирургического разреза после РЦЭ, положительный край локализовался в мягких тканях у 72 %, мочеточниках — у 18,5%, уретре — у 16,5% пациентов и был мультифокальным в 16% наблюдений [8].
Согласно результатам анализа объединенной базы данных 472 больных УК ВМП, подвергнутых РНУЭ, частота R+ составляет 9,3%. Факторами риска обнаружения опухолевых клеток по краю хирургического разреза являются высокая категория pT (p = 0,002), high-grade (p < 0,001), лимфоваскулярная инвазия (p < 0,001) и локализация опухоли (p < 0,001) [9].
Положительный хирургический край ассоциирован с ухудшением прогноза. По данным метаанализа 36 КИ, обнаружение опухолевых клеток по краю хирургического разреза является фактором, значимо снижающим безре-цидивную (БРВ) (отношение рисков (HR) 1,63; 95% доверительный интервал (CI) 1,46–1,83), специфическую (СВ) (HR 1,82; 95% CI 1,63–2,04) и общую (ОВ) (HR 1,68; 95% CI 1,58–1,80) выживаемость больных УК мочевого пузыря, подвергнутых РЦЭ [6]. В ретроспективной многоцентровой серии наблюдений за пациентами с R+ после РЦЭ (n = 394) YAU Urothelial Group не удалось выявить предикторы местного и системного прогрессирования [8]. У больных, подвергнутых НУЭ при УК ВМП (n = 472), однофакторный анализ также продемонстрировал неблагоприятное влияние положительного хирургического края на БРВ (р = 0,003), СВ (р = 0,04) и выживаемость без метастазов (ВБМ) (р < 0,001); многофакторный анализ подтвердил независимую прогностическую значимость R+ для ВБМ (HR 2,7; p = 0,001).
Единственной работой, изучавшей роль дополнительного лечения больных с положительным хирургическим краем, является ретроспективное когортное исследование медицинских данных пациентов с РМП, подвергнутых РЦЭ с R+ в 10 клинических центрах (n 394), и включившем 69 (17,5%) случаев, в которых назначалась послеоперационная химиотерапия (ХТ). Медиана наблюдения за всеми больными составила 44 месяца. Послеоперационная ХТ являлась независимым фактором благоприятного прогноза выживаемости без местного рецидива (HR 0,58; 95% CI: 0,40–0,84; р = 0,004), ВБМ (HR 0,65; 95% CI: 0,45–0,93; р = 0,02), БРВ (HR 0,59; 95% CI: 0,41–0,83; р = 0,003) и ОВ (HR 0,58; 95% CI: 0,40–0,83; р = 0,003) [8]. Эти данные созвучны результатам мета-анализа Advanced Bladder Cancer (2022), основанного на индивидуальных данных
1183 больных, вошедших в РКИ АХТ после РЦЭ у пациентов с факторами риска (pT3–4 и/или N+), и продемонстрировавшего значимое преимущество адъювантного лечения по сравнению с динамическим наблюдением в отношении ОВ (HR 0,82; 95% CI: 0,70–0,96), БРВ (HR 0,71; 95% CI: 0,60–0,83), выживаемости без локорегионарного рецидива (HR 0,68; 95% CI: 0,55–0,85) и ВБМ (HR 0,79; 95% CI: 0,65–0,95) [10].
Роль послеоперационной ИТ у оперированных больных уротелиальным раком с R+ не изучалась, однако АИТ ниволумабом после радикальной операции (R0) при УК T2–4 и/или N+ после НХТ или T3–4 и/или N+ без НХТ в РКИ III фазы CheckMate 274 достоверноувеличивала БРВ (HR 0,71; 95% СI: 0,58–0,86), ВБМ (HR 0,72; 95%CI: 0,58– 0,89) и выживаемость без рецидива за пределами мочевыводящих путей (HR 0,72; 95% CI: 0,58–0,89) [3]. Можно предположить, что на сходные результаты можно рассчитывать и при категории R+.
КИ, направленных на изучение роли ЛТ при положительном хирургическом крае у больных УК мочевого пузыря, не проводилось. Одно из трех завершенных к настоящему времени РКИ АЛТ после РЦЭ, не включавших пациентов с R+ , не выявило влияния адъювантного облучения на частоту локального контроля, ОВ и БРВ [11]. Второе РКИ (n = 236), сравнивавшее наблюдение, конвенциональную АЛТ и АЛТ в гиперфракционированном режиме с использованием традиционных методик облучения, выявило значимое преимущество АЛТ в отношении 5-летней СВ (44%, 49% и 25% соответственно) и 5-летнего локального контроля (93 %, 87 % и 50% соответственно) [12]. Третье РКИ, включившее 72 больных УК мочевого пузыря, преимущественно — плоскоклеточного строения, с ≥ 1 фактором риска (pT3–T4а или N+ или high-grade), сравнивало АХТ (гемцитабин, цисплатин (GC), 4 цикла) и адъювантную ХЛТ (1 цикл GC — ЛТ в суммарной очаговой дозе 45 Гр — 1 цикл GC). Авторами продемонстрировано значимое увеличение 2-летней выживаемости без локоре-гионарного рецидива (HR 0,08; 95% CI: 0,02–0,39; P < 0,01), но не ВБМ, БРВ и ОВ в группе ХЛТ [13]. Ряд ретроспективных КИ свидетельствует о снижении риска местного рецидива после РЦЭ у пациентов, получивших АЛТ, однако влияние облучения на выживаемость в опубликованных сериях крайне сомнительно [14–16]. Тем не менее, в ретроспективной серии наблюдений Lewis G. (2018), включившей данные из 1646 больных РМП, подвергнутых РЦЭ после НХТ и находившихся под последующим наблюдением (n = 1587) или получившихАЛТ (n = 59), послеоперационное облучение пациентов с R+ значимо увеличивало медиану ОВ с 13,1 до 20,3 месяца (p = 0,03) [17].
Эффективность послеоперационной терапии у больных раком ВМП с положительным хирургическим краем после НУЭ не изучена. Единственное РКИ, сравнивавшее АХТ, основанную на препаратах платины, и наблюдение после радикальной операции при УК почечной лоханки и мочеточника pT3–4 и/или N+ , продемонстрировало значимое увеличение 2-летней БРВ в группе активного лечения с 54% до 71 % (HR 0,49; 95% CI: 0,31–0,76;
р = 0,001) во всей популяции пациентов. В небольшой когорте больных с категорией R + (n = 31), вошедших в исследование, разница результатов в пользу АХТ не достигла статистической значимости (HR 0,56; 95% CI: 0,19–1,71; р = 0,31) [18].
РКИ, направленных на изучение роли АЛТ при раке ВМП, не проводилось. За исключением двух ретроспективных КИ [19,20], ни в одной из работ, опубликованных в доступных нам источниках, не отмечено преимуществ выживаемости у радикально оперированных пациентов, получивших АЛТ. В нескольких КИ отмечены позитивные результаты адъювантной ХЛТ после радикального лечения УК верхних мочевых путей [21,22]. Так, по данным Czito B., 5-летняя ОВ пациентов, получавших адъювантную ХЛТ, составила 67% по сравнению с 27% у больных, которым проводилась АХТ (р = 0,01) [21].
В сетевом мета-анализе адъювантная ХЛТ не продемонстрировала благоприятного влияния на прогноз радикальной оперированных больных с УК ВМП. К сожалению, субанализ данных пациентов с категорией R+ авторами не проводился [23].
В связи с отсутствием доказательной базы ни в одних рекомендациях не приведено стандартов лечения больных УК с R+ после попытки радикального хирургического лечения. Не входя в противоречие с существующими стандартами, у данной категории пациентов представляется допустимым применение нескольких тактических подходов, имеющих свои преимущества и недостатки:
-
1. Динамическое наблюдение, дающее шанс избежать перелечивания больных без опухолевых клеток в оставшихся тканях и обеспечивающее возможность проводить терапию с объективной оценкой эффекта после реализации радиологически подтвержденного прогрессирования;
-
2. Хирургическая эрадикация резидуальной опухоли;
-
3. Послеоперационная ХТ или иммунотерапия (ИТ), обеспечивающая потенциальное предотвращение диссеми-нации и увеличение интервала до реализации местного рецидива;
-
4. Послеоперационная лучевая терапия (ЛТ), теоретически способная отсрочить развитие местного рецидива;
-
5. Послеоперационная ХЛТ, потенциально направленная на снижение риска местного и системного прогрессирования УК.
Основанием для перечисленных тактических подходов являются результаты ретроспективных КИ. Категория R+ являлась критерием исключения изо всех исследований адъювантного лечения оперированных больных инвазивной УК [3,10–13]. Однако, принимая во внимание тот факт, что положительный хирургический край часто сочетается с другими общепризнанными факторами риска (T3–4 и/или N +), можно попробовать экстраполировать данные об адъювантном лечении на популяцию больных с опухолевыми клетками по краю разреза.
Пациенты с R+ — неоднородная группа больных, подход к лечению которых должен быть индивидуальным. Выбор тактики может определяться в зависимости
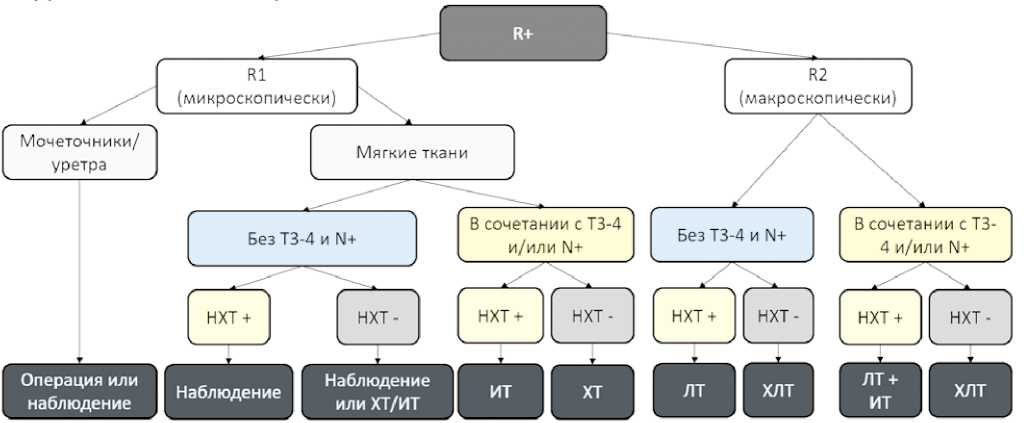
R+ — опухолевые клетки по краю хирургического разреза; R1 — микроскопически определяемые опухолевые клетки по краю хирургического разреза; R2 — макроскопически определяемая остаточная опухоль; НХТ — неоадъювантная химиотерапия; ХТ — химиотерапия; ИТ — иммунотерапия; ЛТ — лучевая терапия; ХЛТ — химиолучевая терапия
Рисунок 1. Возможный алгоритм ведения пациентов с R+ после попытки радикального хирургического лечения местнораспространенного уротелиального рака
Picture 1. A possible algorithm for the management of patients with R+ after an attempt at radical surgical treatment of locally advanced urothelial cancer от локализации и характеристик первичной опухоли, НХТ и ответа на нее, наличия определяемой резидуальной опухоли, а также потенциальной переносимости немедленного послеоперационного лечения (рис. 1). Иллюстрацией персонализированного подхода к ведению пациентов с R+ могут служить следующие клинические наблюдения.
Клинический случай 1: динамическое наблюдение при отсутствии убедительных данных о сохранении опухоли с обеих сторон от края резекции.
У пациентки Д. 78 лет с тяжелым коморбидным фоном, в котором доминировали сердечно-сосудистые и легочные заболевания, диагностирован рак нижней трети правого мочеточника, острый обструктивный пиелонефрит, карбункул правой почки, сепсис (рис. 2, А-Б). По экстренным показаниям больная подвергнута нефруретерэктомии справа с резекцией устья мочеточника, расширенной забрюшинной лимфаденэктомии. Гистологически верифицирована УК pT4N0M0 high-grade, в биоптате края резекции, проходившего по адвентиции правой общей подвздошной артерии,
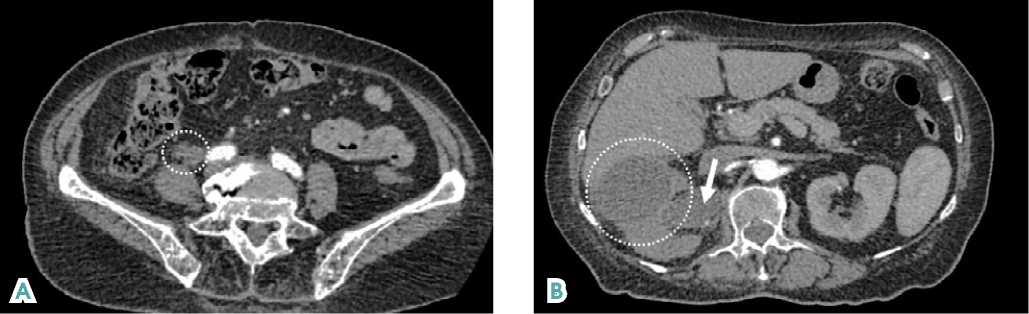
Рисунок 2. Компьютерная томография пациентки Д. 78 лет (артериальная фаза). А — опухоль нижней трети правого мочеточника, инвазирующая парауретеральную клетчатку (пунктир). В — гидронефроз справа (стрелка), карбункул правой почки (пунктир)
Figure 2. Computed tomography of patient D., 78 years old (arterial phase). A — tumor of the lower third of the right ureter, invading paraureteral tissue (dotted line). B — hydronephrosis on the right (arrow), carbuncle of the right kidney (dotted line)
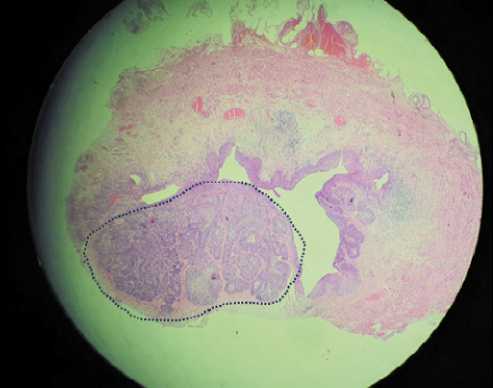
Рисунок 3. Микропрепарат края разреза левого мочеточника (окрашивание гематоксилином и эозином, увеличение 100 ×): в подслизистом слое — комплексы уротелиальной карциномы low-grade, не распространяющейся на слизистую (нет визуально определяемых характерных для рака папиллярных структур)
Figure 3. Microscopic specimen of the cut edge of the left ureter (stained with hematoxylin and eosin, magnification 100 ×): in the submucosal layer there are complexes of low-grade urothelial carcinoma that does not extend to the mucosa (there are no visually detectable papillary structures characteristic of cancer)
обнаружены отдельные опухолевые клетки (R1). В связи с отсутствием убедительных данных, свидетельствующих о сохранении УК в забрюшинном пространстве, а также сомнительной переносимостью адъювантного лечения в полном объеме пациентка оставлена под динамическим наблюдением. Через 6 месяцев после операции радиологических признаков прогрессирования не выявлено.
Клинический случай 2: положительный хирургический край при технической возможности выполнения радикальной ре-резекции мочевых путей.
Пациентке В. 61 года выполнена лапароскопическая резекция левого мочеточника с тазовой лимфодиссекцией по поводу опухоли диаметром 1 см, расположенной в его нижней трети. Гистологически верифицирована уротелиальная карцинома pT2aN0. По краю разреза левого мочеточника, в подслизистом слое выявлены комплексы УК low-grade, не распространяющейся на слизистую, без визуально определяемых папиллярных структур (категория R1) (рис. 3). В связи с высоким риском продолженного роста УК больной выполнена повторная операция — ре-резекция левого мочеточника. Гистологически элементов опухоли в иссеченном фрагменте мочеточника не выявлено. Больная находится под динамическим наблюдением в течение 12 месяцев, рецидива УК не зарегистрировано.
Клинический случай 3: послеоперационная химиотерапия при положительном хирургическом крае для предотвращения быстрой диссеминации агрессивной УК.
Пациенту Г., 67 лет, с мышечно-инвазивным раком мочевого пузыря, не имеющему клинически значимых сопутствующих заболеваний, выполнена робот-асси-стированная РЦЭ, операция Бриккера. Гистологически верифицирована УК high-grade, инфильтрирующая всю толщу стенки мочевого пузыря, паравезикальную клетчатку и основание предстательной железы (pT4a), в двух из пяти удаленных лимфоузлов выявлены метастазы (N2), в мягких тканях по краю хирургического разреза обнаружены комплексы опухолевых клеток (R1). В связи с высоким риском диссеминации опухолевого процесса больному, не имеющему противопоказаний к цисплатину, назначена послеоперационная ХТ (4 цикла GC). Пациент жив без признаков рецидива УК в течение 9 месяцев после операции.
Клинический случай 4: послеоперационная ХЛТ при макроскопически определяемой резидуальной опухоли
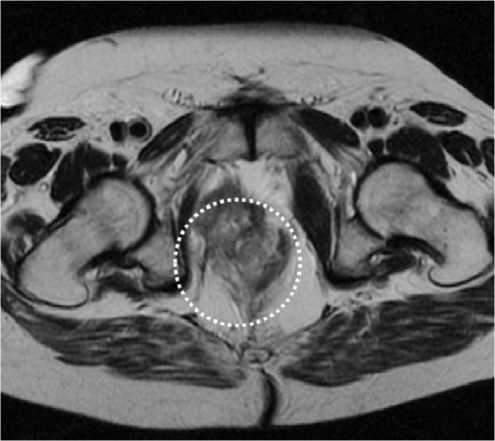
Рисунок 4. Резидуальная опухоль после цистэктомии у пациента А. (магнитно-резонансная томография).
Figure 4. Residual tumor after cystectomy in patient A. (magnetic resonance imaging)
и высоком риске диссеминации опухолевого процесса.
В связи с некупируемой гематурией, обусловленной массивной опухолью мочевого пузыря, пациенту А., 63 лет, с раком мочевого пузыря по экстренным показаниям в стационаре урологического профиля выполнена цистэктомия, операции Бриккера. Полностью удалить опухоль не удалось. Гистологически верифицирована УК pT3bN1M0R2 high-grade. При радиологическом обследовании после операции выявлена резидуальная опухоль в ложе удаленного мочевого пузыря 3 × 4 см (рис. 4), данных за диссеминацию опухолевого процесса не получена. Больному проведено 4 цикла послеоперационной ХТ в режиме GC с последующей ЛТ на область резидуального опухолевого очага с радиомодифицирующей ХТ цисплатином с частичным эффектом. Пациенту запланирована поддерживающая иммунотерапия авелумабом.
ЗАКЛЮЧЕНИЕ
Опухоль по краю разреза после радикального хирургического лечения местнораспространенного уротелиального рака выявляется в ≈ 10% препаратов и ассоциирована с повышением риска локорегионарного рецидива, метастазов и смерти. Пациенты с R+— неоднородная группа больных, подход к лечению которых должен быть инди- видуальным. Стандартного подхода к ведению пациентов с R+ нет, допустимые опции включают наблюдение, удаление резидуальной опухоли, послеоперационную ХТ, ИТ, ЛТ и ХЛТ. На выбор лечебной тактики влияют локализация и характеристики первичной опухоли, НХТ до операции и ответ на нее, наличие определяемой резидуальной опухоли, а также потенциальная переносимость немедленного послеоперационного лечения.
Список литературы Опухолевые клетки по краю хирургического разреза после попытки радикального лечения больных местнораспространенной уротелиальной карциномой: обзор литературы и описание клинических наблюдений
- Гладков О.А., Булычкин П.В., Волкова М.И. и соавт. Практические рекомендации по лекарственному лечению рака мочевого пузыря. Практические рекомендации RUSSCO, часть 1. Злокачественные опухоли 2023;13(3s2):620-639. Gladkov О. A., Bulychkin P.V., Volkova M.I. et.al. Practical recommendations for drug treatment of bladder cancer. Zlokachestvennie opuholi = Malignant Tumors 2023;13(3s2):620-639. https://doi.org/10.18027/2224-5057-2023-13-3s2-l-620-639. (In Russ.)
- Клинические рекомендации. Рак мочевого пузыря, 2023. Доступно по: https://cr.minzdrav.gov.ru/schema/ll_3 Clinical Guidelines. Bladder Cancer, 2023. Available at: https://cr.minzdrav.gov.ru/schema/ll_3. (In Russ.)
- Bajorin D.F., Witjes J.A., Gschwend J.E. et.al. Adjuvant nivolumab versus placebo in muscle-invasive urothelial carcinoma. N Engl J Med 2021;384(22):2102-2114. https://doi.org/10.1056/NEJMoa2034442.
- Листок-вкладыш — информация для пациента Опдиво, 10 мг/кг. Доступно по: https://grls.rosminzdrav.ru/ln-strImg/2023/05/16/1493561/173eab27-c014-41e6-bd7b-al65ca84aac3.pdf
- Клинические рекомендации. Уротелиальный рак верхних мочевыводящих путей, 2023. Доступно по: https:// cr.minzdrav.gov.ru/recomend/526_2 Clinical Guidelines. Urothelial cancer of the upper urinary tract, 2023. Available at: https://cr.minzdrav.gov.ru/ recomend/526_2. (In Russ.)
- Hong Xuwei, Li Tieqiu, Ling F., et al. Impact of surgical margin status on the outcome of bladder cancer treated by radical cystectomy: a meta-analysis. Oncotarget 2017;8(10):17258-17269. https://doi.org/10.18632/oncotarget.12907
- Dotan Z.A., Kavanagh K., Yossepowitch O., et al. Positive surgical margins in soft tissue following radical cystectomy for bladder cancer and cancer specific survival. J Urol 2007;178(6):2308-12. https://doi.Org/10.1016/j.juro.2007.08.023
- Marcq G., Afferi L., Neuzillet Y., et al. Oncological outcomes for patients harboring positive surgical margins following radical cystectomy for muscle-invasive bladder cancer: A retrospective multicentric study on behalf of the yau urothelial group. Cancers (Basel) 2022;14(23):5740. https://doi.org/10.3390/cancersl4235740
- Colin P., Ouzzane A., Yates D.R., et al. Influence of positive surgical margin status after radical nephroureterectomy on upper urinary tract urothelial carcinoma survival. Ann Surg Oncol 2012;19(ll):3613-3620. https://doi.org/10.1245/ sl0434-012-2453-9
- Advanced Bladder Cancer (ABC) Meta-analysis Collaborators Group. Adjuvant chemotherapy for muscle-invasive Bladder Cancer: A systematic review and meta-analysis of individual participant data from randomised controlled trials. Eur Urol 2022;81(1):50-61. https://doi.Org/10.1016/j.eururo.2021.09.028
- El-Monim H.A., El-Baradie M.M., Younis A., Ragab Y, Labib A, El-Attar I. A prospective randomized trial for postoperative vs. preoperative adjuvant radiotherapy for muscle-invasive bladder cancer. Urol Oncol 2013;31(3):359-65. https://doi.Org/10.1016/j.urolonc.2011.01.008
- Zaghloul M.S., Awwad H.K., Akoush H.H. et.al. Postoperative radiotherapy of carcinoma in bilharzial bladder: improved disease free survival through improving local control. Int J Radiat Oncol Biol Phys 1992;23(3):511-7. https:// doi.org/10.1016/0360-3016(92)90005-3
- Zaghloul M.S., Christodouleas J.P., Smith A., et al. Adjuvant sandwich chemotherapy plus radiotherapy vs adjuvant chemotherapy alone for locally advanced bladder cancer after radical cystectomy: a randomized phase 2 trial. JAMA Surg 2018;153(l):el74591. https://doi.org/10.1001/jamasurg.2017.4591
- Shariat S.F., Karakiewicz P.I., Palapattu G.S., et al. Outcomes of radical cystectomy for transitional cell carcinoma of the bladder: a contemporary series from the Bladder Cancer Research Consortium. J Urol 2006;176(6 pt l):2414-22. https://doi.Org/10.1016/j.juro.2006.08.004
- Zaghloul M.S., El Baradie M., Nouh, et al. Prognostic index for primary adenocarcinoma of the urinary bladder. Gulf J Oncol 2007;(2):47-54
- Raheem A. MA., Hameed D. A, ElGanainy E. O, et al. Can Bcl-XL expression predict the radio sensitivity of Bilharzial related squamous bladder carcinoma? A prospective comparative study. BMC Cancer 2011;11:16. https://doi. org/10.1186/1471-2407-11-16
- Lewis G.D., Haque W., Verma V., et al. The role of adjuvant radiation therapy in locally advanced bladder cancer. Bladder Cancer 2018;4(2):205-213. https://doi.org/10.3233/BLC-180163
- Birtle A., Johnson M., Chester J., et al. Adjuvant chemotherapy in upper tract urothelial carcinoma (the POUT trial): a phase 3, open-label, randomized controlled trial. Lancet 2020;395(10232):1268-1277. https://doi.org/10.1016/S0140-6736(20)30415-3
- Chen B., Zeng Z.-C., Wang G.-M., et al. Radiotherapy may improve overall survival of patients with T3/T4 transitional cell carcinoma of the renal pelvis or ureter and delay bladder tumour relapse. BMC Cancer 2011;11:297. https://doi. org/10.1186/1471-2407-11-297
- Jwa E., Kim Y.S., Ahn H., et al. Adjuvant radiotherapy for stage III/IV urothelial carcinoma of the upper tract. Anticancer Res 2014;34(l):333-8. PMID: 24403484
- Czito B., Zietman A., Kaufman D. et.al. Adjuvant radiotherapy with and without concurrent chemotherapy forlo-cally advanced transitional cell carcinoma of the renal pelvis andureter. J Urol 2004;172(4 Pt l):1271-5. https://doi. org/10.1097/01.ju.0000137910.38441.8a
- Vassilakopoulou M., Rouge T.D., Colin P., et al. Outcomes after adjuvant chemotherapy in the treatment of high-risk urothelial carcinoma of the upper urinary tract (UUT-UC): results from a large multicenter collaborative study. Cancer 20U;117(24):5500-8. https://doi.org/10.1002/cncr.26172
- Yang X., Li P., Deng X., et al. Perioperative treatments for resected upper tract urothelial carcinoma: a network me-ta-analysis. Oncotarget 2017;8(2):3568-3580. https://doi.org/10.18632/oncotarget.12239.


