Опыт контрастирования структур периферических нервов для прикладных анатомических исследований
Автор: Ништ Алексей Юрьевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Методы исследования
Статья в выпуске: 2 т.30, 2022 года.
Бесплатный доступ
Прикладные анатомические исследования строения и топографии периферических нервов и экспериментальные оперативные вмешательства на них с использованием лабораторных животных являются важным этапом разработки новых и совершенствования существующих методов реконструктивной микрохирургии периферической нервной системы. Целью настоящей работы явился поиск эффективных способов контрастирования структуры периферических нервов для точных морфологических исследований и топографо-анатомического обоснования внутриствольных реконструктивных вмешательств на нервах. На анатомическом материале, включавшем 18 фиксированных верхних конечностей трупов людей и 10 нефиксированных трупов лабораторных животных (кроликов) апробированы приемы контрастирования основных структур нервных стволов. Ключевыми техническими приемами являлись субпериневральное и субэпиневральное введение фотоконтрастной смеси и установка в ствол нерва рентгенконтрастной метки для исследования особенностей скелетотопии нервного ствола на разных уровнях в целостном блоке тканей без препарирования. Разработанный метод позволил расширить возможности точных топографо-анатомических исследований и качественно улучшить демонстративность препаратов. Наилучшие результаты инъецирования отдельных периневральных футляров отмечались при использовании нефиксированного анатомического материала. На фиксированном и слабо фиксированном материале инъекции подкрашивающего состава под наружный эпиневрий способствовали повышению качества анатомических методов исследования, что особенно важно при изучении внутриствольной микротопографии пучков нервного ствола. Введение внутрь нервов тончайшего металлического проводника через вскрытый периневральный пучок с последующим рентгенологическим исследованием препаратов, исходя из нашего опыта, является технически выполнимым и демонстративным методом исследования топографии нервных стволов, включая приемы оценки степени их смещаемости при различных положениях сегментов конечностей. Таким образом, разработанный метод контрастирования структур периферических нервов расширяет возможности прикладных морфологических исследований их внутриствольной топографии, а использование нефиксированного анатомического материала позволяет выполнить контрастирование отдельных периневральных футляров жидкими составами.
Периферические нервы, анатомическая техника, топографическая анатомия, рентгеновское контрастирование, анатомические препараты
Короткий адрес: https://sciup.org/143178738
IDR: 143178738 | DOI: 10.20340/mv-mn.2022.30(2).620
Текст научной статьи Опыт контрастирования структур периферических нервов для прикладных анатомических исследований
Ништ АЮ. Опыт контрастирования структур периферических нервов для прикладных анатомических исследований. Морфологические ведомости. 2021;30(2):620 (2).620
Nisht AYu. The experience of the contrasting of peripheral nerves structures for applied anatomical researches. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(2):620 (2).620
Введение. Прикладные анатомические исследования строения и топографии периферических нервов и экспериментальные оперативные вмешательства на них с использованием лабораторных животных являются важным этапом разработки новых и совершенствования существующих методов реконструктивной микрохирургии периферической нервной системы [1–4]. Возможности современной диагностической аппаратуры позволяют выполнять высокоинформативные исследования прижизненной морфологии сосудисто-нервных пучков как на этапе предоперационного планирования, так и в ходе хирургического вмешательства, что предоставляет возможность реализовать на практике индивидуализированный подход в лечении пациентов с травмами и заболеваниями периферических нервов [5–7]. Вместе с тем, традиционные методы исследования особенностей строения, топографии и индивидуальной анатомической изменчивости нервов, наряду с ранее указанными, не утрачивают своей значимости в решении фундаментальных вопросов и прикладных задач современных медицинских исследований.
Целью исследования настоящей работы являлся поиск эффективных способов контрастирования структуры периферических нервов для прецизионных морфологических исследований и топографо-анатомического обоснования внут-риствольных реконструктивных вмешательств на нервах.
Материалы и методы исследования. Для решения прикладных топографо-анатомических задач применялись различные приемы контрастирования нервов. Контрастирование отдельных периневральных футляров седалищного нерва выполняли на 10 трупах лабораторных животных (кроликов). Визуализацию нервов выполняли через латеральный доступ с использованием 2,5-кратного оптического увеличения (бинокулярная лупа с налобным осветителем Heine ML4-LED, Германия). Заполнение отдельных периневральных футляров фотоконтрастной смесью выполняли через катетер для внутривенных инъекций. Катетер устанавливали субпериневрально в больше- берцовый или общий малоберцовый пучок седалищного нерва на уровне подколенной ямки и ориентировали в краниальном направлении. Контрастную смесь для инъекций готовили на основе жидкого силикона с добавлением пигмента черного цвета. На 18 верхних конечностях фиксированных трупов людей для исследования особенностей скелетотопии нервов предплечья и кисти выполняли введение в состав нервного ствола проволочного проводника для ангиографического катетера. В состав исследуемого нерва проксимально ориентированный проволочный проводник вводили через мобилизованный, и вскрытый периневральный футляр одного из пучков дистальной ветви нервного ствола. Исследование проекции нервных стволов на костные ориентиры проводили на рентгенограммах конечностей, выполненных с помощью цифрового рентгенологического аппарата Philips Mobail Diag-nost Opta (Италия-Нидерланды). На последующих этапах исследования особенностей внутриствольной топографии нервов перед препарированием отдельных периневральных футляров выполняли инъекции шприцем под наружный эпи-неврий подкрашивающей смеси на основе глицерина.
Результаты исследования и обсуждение. Контрастирование структуры для повышения демонстративности анатомических исследований нервов является продолжительным и трудоемким технологическим процессом. Распространение контрастной массы внутри нервных стволов происходит крайне медленно, окрашивание структур нервов не всегда равномерно. Основное значение для выполнения фотоконтрастных инъекций нервов имеет качество анатомического материала и степень фиксации тканей. По результатам наших пробных опытов было выяснено, что введение контрастного состава внутрь периневральных футляров нервов с окрашиванием расположенных в них структур технически возможно при работе с любым материалом, но наилучших результатов удается добиться только при работе со свежим нефиксированным. Так, при работе с периневральными футлярами седалищного нерва кроликов, тотчас после выведения экспериментальных животных из опыта введение подкрашивающей смеси субпериневрально позволяло контрастировать отдельные пучки на всем протяжении сегмента (рис. 1).
берцовым периневральными футлярами было подтверждено на последующем этапе прецизионного препарирования. Эти данные были использованы при выполнении экспериментальных исследований с
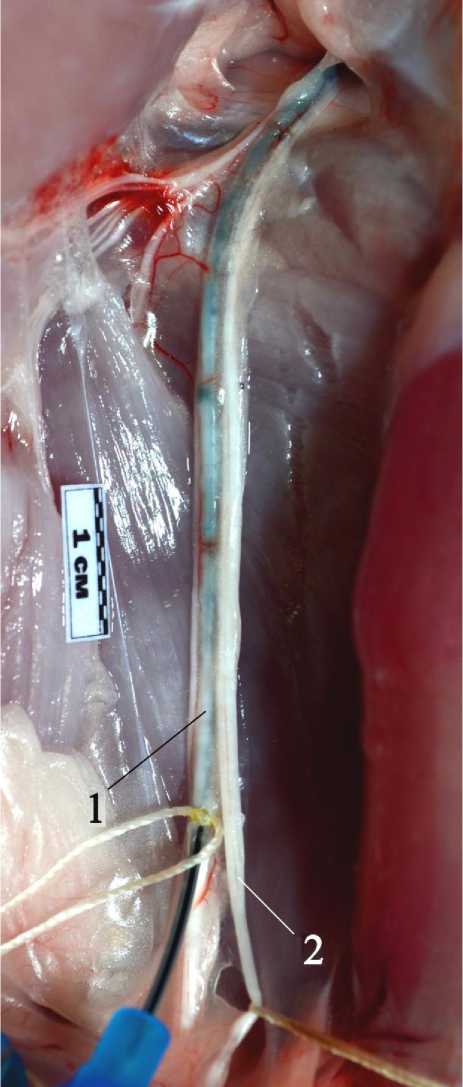
Рис. 1. Вид седалищного нерва кролика после введения контрастной массы в периневральный футляр большеберцового нерва. Обозначения: 1 – большеберцовый нерв, 2 – общий малоберцовый нерв.
Выявленное по результатам инъекционных исследований отсутствие связей между большеберцовым и общим мало-
моделированием внутриствольных реконструктивно-пластических манипуляций на нервах лабораторных животных.
Во избежание повреждения пери-неврия установку катетера необходимо выполнять под визуальным контролем с использованием оптического увеличения. Фиксация катетера лигатурой должна выполняться до момента извлечения проводника из просвета во избежание перекрытия его просвета. Введение контрастной массы внутрь периневрального футляра является самым ответственным и продолжительным этапом всего процесса. Мы не использовали специальных механических нагнетателей и непосредственно инъекцию смеси выполняли шприцем объемом 10 мл. Выбор данного объема шприца был обусловлен стремлением снизить давление смеси на периневрий по сравнению с использованием шприцев меньшего объема. Введение контрастной массы производилось под визуальным контролем, медленно, не развивая при этом значительного давления на поршень шприца. Избыточное давление на поршень может привести к разрыву перинев-рия, определяемого по резкому уменьшению сопротивления введению контрастной массы и выходу ее за пределы футляра, что становится причиной порчи препарата. При возникновении сопротивления движению поршня необходимо приостановить введение вещества на 2–3 минуты для постепенного распределения массы внутри периневрального пучка. По окончанию паузы введение контраста следует возобновить с постепенным увеличением давления на поршень.
На фиксированных и слабо фиксированных конечностях трупов введение контрастной смеси субпериневрально в отдельные пучки нервов даже после правильной установки и закрепления катетера приводило к разрывам периневральной оболочки и выходу инъекционной массы за пределы контрастируемого пучка. По этой причине от субпериневрального вве- дения смеси на фиксированном материале мы отказались в пользу субэпиневральных инъекций, позволяющих селективно окрашивать внутренний эпиневрий на ог- субэпиневральное введение массы выполняли через несколько доступов, при этом каждую последующую инъекцию для введения смеси производили на уровне гра-
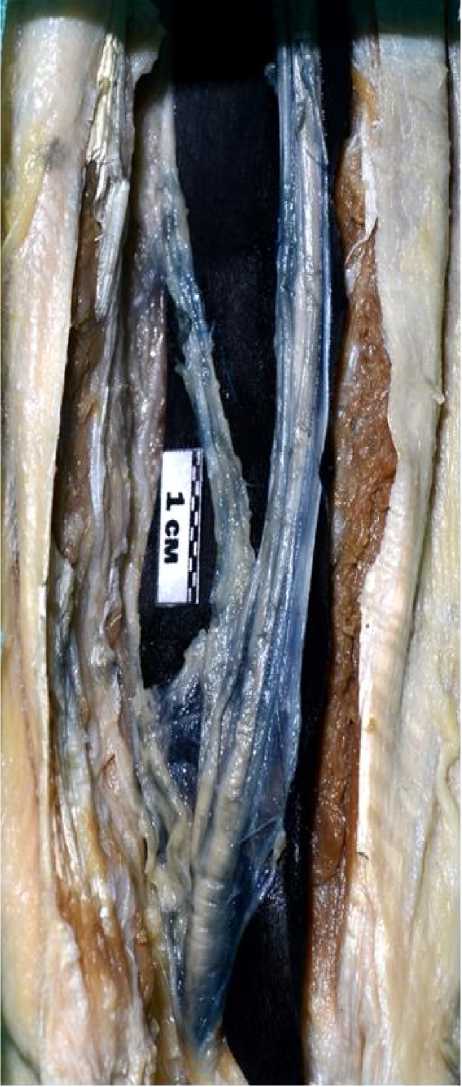
Рис. 2. Этап препарирования ветвей локтевого нерва к локтевому сгибателю запястья после субэпиневрального введения подкрашивающего состава.
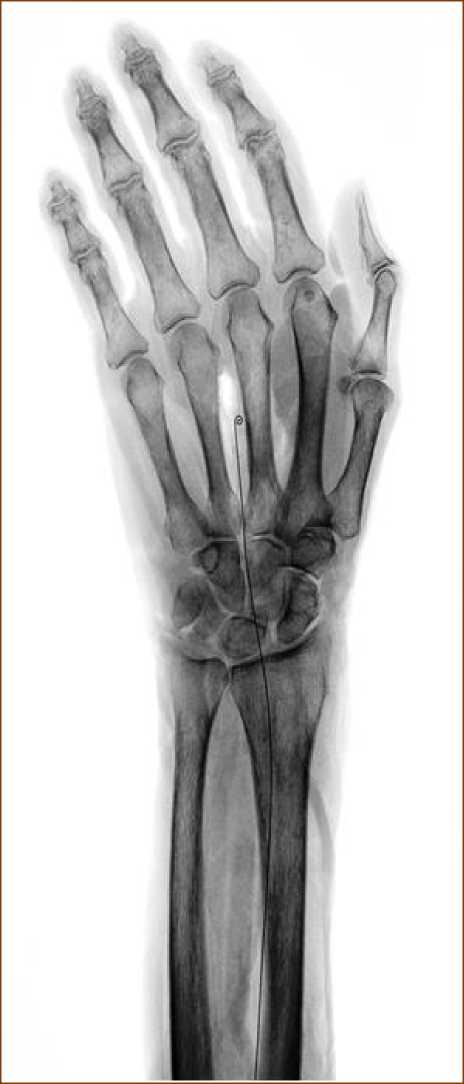
Рис. 3. Рентгенограмма верхней конечности. Проекция на костные ориентиры металлического проводника, введенного в ствол срединного нерва.
раниченном по протяженности участке исследуемых нервов (рис. 2).
При необходимости контрастиро вания протяженного сегмента нерва ницы уже окрашенного участка. Введение подкрашивающего состава под наружный эпиневрий создавало благоприятные условия для выполнения внутриствольной препарирования с использованием средств оптического увеличения. Предварительное контрастирование внутреннего эпиневрия способствовало более аккуратному разъединению структур нерва, что позволяло избегать повреждений межпучковых соединительных ветвей.
Для исследования скелетотопии нервных стволов на различных уровнях сегментов конечностей опробован способ, позволяющий определять проекцию нервов по рентгенологическим ориентирам. В качестве рентгенконтрастной метки использовался тонкий металлический проводник от ангиографического катетера (рис. 3-4).
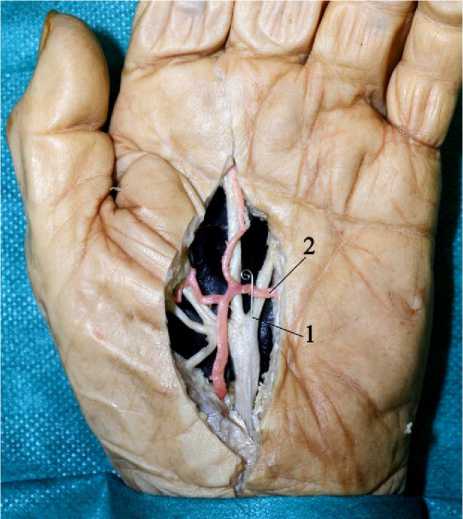
Рис. 4. Исследование скелетотопии срединного нерва. Внешний вид рентген-контрастного проводника (1) в месте установки и его положение относительно поверхностной артериальной ладонной дуги (2).
Введение проводника в состав исследуемого нерва осуществляли через один из периневральных футляров нервного ствола. На этапе установки контрастной метки важным моментом считали придание конечности позиции, способствующей прямолинейному расположению контрастируемого нерва. Контрольные исследования с препарированием нервных стволов свидетельствовали о повреждении в нескольких случаях целост- ности периневральных футляров и выходе проводника за пределы первоначально использованного футляра. Вместе с тем, во всех случаях контрастная метка оставалась внутри исследуемого нервного ствола, что подтверждало эффективность данного метода контрастирования нервов для оценки их проекции в тотальном анатомическом блоке тканей.
Заключение. Таким образом, разработанный метод контрастирования структур периферических расширяет возможности прикладных морфологических исследований их внутриствольной топографии. Использование нефиксированного анатомического материала позволяет выполнить контрастирование отдельных периневральных футляров жидкими составами. Инъекции подкрашивающей смеси под наружный эпиневрий на фиксированном и слабо фиксированном материале способствуют повышению качества анатомических методов исследования, что особенно важно при изучении внутриствольной микротопографии пучков на уровне формирования ветвей нервного ствола. Введение внутрь нервов металлического проводника через вскрытый периневральный пучок с последующим рентгенологическим исследованием препаратов является технически выполнимым методом исследования особенностей топографии нервных стволов, включая приемы оценки степени их смещаемо-сти при различных положениях сегментов конечностей.
Список литературы Опыт контрастирования структур периферических нервов для прикладных анатомических исследований
- Soubeyrand M, Melhem R, Protais M et al. Anatomy of the median nerve and its clinical applications. Hand Surg. Rehabil. 2020;39(1):2-18. DOI: 10.1016/j.hansur.2019.10.197
- Vela FJ, Martinez-Chacn G, Ballestin A et al. Animal models used to study direct peripheral nerve repair: a systematic review. Neural Regen Res. 2020;15(3):491-502. DOI: 10.4103/1673-5374.266068
- Jia X, Chen C, Yang J, Yu C. End-to-side neurotization with the phrenic nerve in restoring the function of toe extension: an experimental study in a rat model. J Plast Surg Hand Surg. 2018;52(3):185-188. DOI: 10.1080/2000656X.2017.1408017
- Tateshita T, Ueda K, Kajikawa A. End-to-end and end-to-side neurorrhaphy between thick donor nerves and thin recipient nerves: an axon regeneration study in a rat model. Neural Regen Res. 2018;13(4) 699-703. DOI: 10.4103/1673-5374.230296
- Saltykova VG, Mit'kova MD. Rol' ekhografii v issledovanii perifericheskikh nervov konechnostey. Ul'trazvukovaya i funktsional'naya diagnostika. 2011;3:93-106. In Russian.
- Zhurbin EA, Gajvoronskij AI, Dekan VS i dr. Diagnosticheskaya effektivnost' ul'trazvukovogo issledovaniya pri povrezhdeniyakh perifericheskikh nervov. Rossiyskiy neurokhirurgichesky zhurnal imeni professora A.L. Polenova. 2019;11(1):23-29. In Russian.
- Franco CD, Sala-Blanch X. Functional anatomy of the nerve and optimal placement of the needle for successful (and) safe nerve blocks. Curr Opin Anaesthesiol. 2019;32(5):638-642. DOI: 10.1097/ACO.0000000000000776


