Опыт лечения больных с неспецифическим кокситом методом двухэтапного эндопротезирования
Автор: Николаев Н.С., Карпухин А.С., Максимов А.Л., Степанов Е.Г., Пчелова Н.Н., Малюченко Л.И.
Журнал: Кафедра травматологии и ортопедии @jkto
Статья в выпуске: 4 (42), 2020 года.
Бесплатный доступ
Актуальность. Одной из редких патологий тазобедренного сустава является его воспаление, вызванное неспецифической микрофлорой. В литературе часто указывается на сложность диагностики и лечения этого состояния. Возникающие необратимые изменения в суставе требуют радикального вмешательства. Цель исследования - оценить эффективность одного из вариантов лечения в виде двухэтапного эндопротезирования с установкой артикулирующего спейсера на первом этапе, с демонстрацией клинических примеров. Материалы и методы. В статье изложен опыт лечения 18 пациентов методом двухэтапного эндопротезирования (19 случаев, в том числе один пациент - с двусторонним процессом). Всем пациентам выполнена установка артикулирующих спейсеров с антибиотиками различной конфигурации как с использованием компонентов протеза, так и изготовленных ручным способом. Второй этап выполнен у 15 пациентов через 121±21,1 дня. Результаты. Отмечено улучшение функционального состояния пораженного тазобедренного сустава к моменту второго этапа лечения (с 19,1±2,6 до 30,5±5,6 балла по шкале Харриса). Вторым этапом выполнена установка тотального эндопротеза бесцементной (n=11) или гибридной (n=4) фиксации. На отдаленном сроке наблюдения 35,2±6,1 мес. в 86,7% случаев отмечена эрадикация инфекционного процесса; средний функциональный результат по шкале Харриса 82,2±4,0 балла. Выводы. Таким образом, использование двухэтапного эндопротезирования при лечении неспецифического коксита позволяет достичь удовлетворительных результатов.
Неспецифический коксит, артикулируюший спейсер, двухэтапное эндопротезирование
Короткий адрес: https://sciup.org/142229992
IDR: 142229992 | УДК: 617-089.844 | DOI: 10.17238/issn2226-2016.2020.4.5-13
Текст научной статьи Опыт лечения больных с неспецифическим кокситом методом двухэтапного эндопротезирования
К кокситам относится этиологически разнородная группа воспалительных заболеваний тазобедренного сустава, в том числе специфический (туберкулезный, гонорейный, дизентерийный и др.), неспецифический (или септический, гнойный коксит, чаще вызываемый кокковой флорой) и асептический коксит (например, при ревматоидном артрите, болезни Бехтерева) [1].
Неспецифический коксит у взрослых - остро возникающее состояние, трудно поддающееся лечению, имеющее склонность к быстрому прогрессированию и рецидивирующее течение, ведущее к необратимой потере функции тазобедренного сустава. Иногда это заболевание становится опасным для жизни, приводя к развитию сепсиса [2-5].
Ежегодно количество случаев септического артрита в США составляет около 8 на 100 тыс. пациентов, в Западной Европе и Австралии показатель является сопоставимым - от 4 до 10 случаев на 100 тыс. пациентов в год [6].
Из-за большого разнообразия микроорганизмов, являющихся причиной заболевания, частого развития подострого и хронического течения процесса, индивидуальных клинических особенностей отмечаются трудности диагностики септического артрита. Нередко сопровождающие это состояние изменения со стороны других органов могут маскировать основное заболевание [5,6]. В литературе имеются существенные разногласия в вопросах диагностики септического артрита, поскольку четкий алгоритм диагностики септического артрита отсутствует [6]. Обязательными лабораторными критериями являются наличие лейкоцитоза, увеличение уровня СРБ и СОЭ в анализе крови [7]. «Золотым стандартом» диагностики является выделение возбудителя при микробиологическом исследовании синовиальной жидкости тазобедренного сустава. Однако, зачастую предшествующая антибиотикотерапия способствует получению отрицательных результатов исследования. В последнее время все чаще используется подсчет общего количества полиморфноядерных нейтрофилов и лейкоцитов в синовиальной жидкости сустава, а также исследование биохимических маркеров инфекционного процесса (пресепсин, прокальцитонин, эстераза лейкоцитов). Это особенно важно в условиях отрицательного результата микробиологического исследования. Сложность диагностики, частота диагностических ошибок, время ожидания результатов обследования обуславливают длительный срок от момента начала заболевания до постановки диагноза [5]. От ранней диагностики и своевременно начатого лечения зависят исходы заболевания, так как микроорганизмы и продуцируемые ими токсины могут необратимо повредить хрящ и субхондральную кость всего за несколько дней. По разным оценкам, от 25% до 50% случаев септического артрита заканчиваются необратимой потерей функции суставов [8].
Лечение неспецифического коксита зачастую является длительным процессом и требует неоднократных оперативных вмешательств. В литературе описаны различные методы лечения: консервативный (антибиотикотерапия), пункционный, артроскопический дебридмент, санационная артротомия, резекци- онная артропластика [7,9-12]. Резекционная артропластика, как правило, выполняется при необратимых изменениях в суставе с последующим выполнением тотального эндопротезирования [13].
Малое количество публикаций, невысокая частота встречаемости заболевания, нетипичная клиническая картина, трудности диагностики, отсутствие единой тактики лечения, сложность и уникальность каждого конкретного случая септического артрита обусловливают актуальность изучения данного заболевания [14,5].
Целью нашего исследования явилось изучение вопросов диагностики и результатов лечения пациентов с кокситом методом двухэтапного эндопротезирования с установкой различных артикулирующих спейсеров на первом этапе лечения.
Материалы и методы
В ФГБУ «Федеральный центр травматологии, ортопедии и эндопротезирования» Минздрава России (г. Чебоксары), далее – Центр, с марта 2009 по декабрь 2018 года по поводу неспецифического коксита пролечено 18 пациентов (19 случаев, в том числе 1 пациент прооперирован с обеих сторон). Доля операций по поводу кокситов за этот период составила 0,03%. В исследуемой группе – 12 мужчин (66,7%) и 6 женщин (33,3%). Средний возраст пациентов 47,8±3,8 года (от 27 до 72 лет).
При поступлении на 1 этап двухэтапного эндопротезирования пациенты проходили стандартный клинический осмотр. При сборе анамнеза оценивали возможную причину развития заболевания, предшествующее инвазивное вмешательство. Оценка функционального состояния пораженного тазобедренного сустава (ТБС) осуществлялась по шкале Харриса. При необходимости проводилось дополнительное обследование с использованием лабораторных и лучевых методы диагностики. В общеклиническом анализе крови (ОАК) оценивали общее количество лейкоцитов, наличие нейтрофи-леза, повышение СОЭ, в коагулограмме – уровень Д-димера, в биохимическом анализе крови – уровень прокальцитонина, пресепсина, С-реактивного белка (СРБ). Лучевые методы диагностики включали проведение компьютерной томографии (КТ), рентгенографии и ультразвукового исследования (УЗИ) ТБС.
До операции выполняли пункцию ТБС с подсчетом общего количества клеток в 1 мкл, процентного содержания нейтрофилов в них. Проводилось микробиологическое исследование пункционного биоматериала, полученного до операции. Полученный аспират помещали в аэробный и анаэробный флаконы анализатора Bact/Alert с инкубацией до 14 суток.
Повторно пункцию ТБС проводили также интраоперационно, непосредственно перед вскрытием капсулы сустава, для более точной верификации диагноза. Осуществлялся забор тканевых биоптатов (из 4–6 различных точек, объемом до 1 см3) и аспирата из полости сустава. Полученный биоматериал помещали в кровяной агар, шоколадный агар, агар Шедлера и бульонную среду.
С целью оценки санации костной и мягких тканей на 2 этапе лечения исследовали изъятые интраоперационно компонен- ты спейсеров после их обработки в УЗ-машине BRANSON 8510 (США) в течение 5 мин при частоте 40±2 Кгц и мощности 0,22±0,04 Вт/см2 с дальнейшим посевом полученных смывов.
Учитывая необратимые анатомические изменения в ТБС и острый воспалительный процесс во всех случаях, выполняли этапное лечение с установкой артикулирующего спейсера на 1 этапе и проведением тотального эндопротезирования ТБС в последующем. Двухэтапный метод лечения был предпочтительным, посколькувыполнение тотального эндопротезирования в один этап при наличии острого инфекционного процесса в суставе сопряжено с высокими рисками инфекционных осложнений. В случае резекционной артропластики без установки временного спейсера имеется риск краниального смещения бедренной кости с развитием значительного укорочения конечности, а также опасность развития массивного рубцово-спаечного процесса на месте удаленных тканей. Все это, а также потенциальная возможность развития остеопороза вследствие отсутствия нагрузки на пораженную конечность, могло осложнить выполнение последующего эндопротезирования и ухудшить результаты лечения.
Все операции выполнялись в положении пациента на боку под спинномозговой анестезией с использованием переднебокового доступа Хардинга. Вертлужный компонент спейсера изготавливали в 16 случаях из 19 (84,2%), причем в 14 случаях - полностью из костного цемента (трижды – с использованием специальной пресс-формы), в 2 – с использованием вертлужного компонента на основе цементной чашки. Бедренный компонент в 57,9% случаев (11 из 19) изготавливали ручным способом из костного цемента (в том числе 10 - с армированием спицами для большей прочности фиксации), в остальных 8 случаях использовалась цементная ножка. В 80% случаев армирующие спицы не проникали в канал бедренной кости и фиксировались в зоне эпифиза и метафиза. Во всех случаях в цемент добавляли 2-7 г ванкомицина, в зависимости от количества цемента, при этом доля ванкомицина в цементе составляла 5-10% (от 2 до 4 г ванкомицина на порцию цемента в 40 г).
В большинстве случаев дренаж устанавливали не более чем на 2 суток. В 4 случаях, при отсутствии большой кровопотери и обширных гнойных затеков, рана не дренировалась.
После операции пациенты получали длительную антибио-тикотерапию (6-8 недель): в период пребывания в стационаре использовали парентеральный путь введения комбинации двух антибиотиков, амбулаторно прием препаратов продолжался перорально. Средний срок госпитализации на 1 этапе лечения составил 9,8±0,7 суток.
2 этап хирургического лечения выполняли в срок от 50 до 371 дня после 1 этапа (в среднем 121±21,1 дня). Длительный промежуток между этапами был обусловлен наличием противопоказаний к оперативному лечению у пациентов. Перед 2 этапом проводилось повторное клинико-лабораторное обследование. Сроки антибиотикотерапии после 2 этапа также составляли 6-8 недель. Средний срок госпитализации на 2 этапе лечения составил 8,7±0,5 суток. На момент написания статьи 2 этап не выполнен у 4 пациентов.
Статистическая обработка полученных данных проводилась с помощью пакета анализа программы Microsoft Excel 2007. Соответствие значений выборки нормальному распределению в MS Excel подтверждали графическим методом, что позволило отражать результаты в виде средней арифметической (М) и стандартного отклонения (SD).
Результаты
У пациентов отмечен разный срок от начала заболевания до поступления в Центр (от 6 дней до 6 лет, средний срок составил 595±127 дней). Основной жалобой служило появление болевого синдрома разной интенсивности. Повышение температуры тела выше 38°С в анамнезе отмечено в 11 случаях. По данным анамнеза, в 16 случаях из 19 отсутствовало какое-либо предшествующее инвазивное вмешательство (84,2%), коксит развился гематогенно. Отмечено, что 4 из 16 пациентов указали на предшествующую травму (падение на область сустава), 2 –на тяжелую физическую нагрузку, 1 –на переохлаждение. У 9 пациентов выявить факторы риска развития заболевания не удалось. В остальных 3 случаях из 19 причинами развития коксита явились внутрисуставное введение глюкокортикостероидов (n=1), колотая рана в области ТБС (n=1) и последствия перенесенной флегмоны бедра в виде хронического остеомиелита бедренной кости (n=1).
Клиническое обследование всех пациентов выявило тяжелое нарушение функции ТБС с выраженным болевым синдромом, хромотой, укорочением конечности, ограничением объема движений и использованием дополнительной опоры при ходьбе (средний балл по шкале Харриса 19,1±2,6).
При лабораторном обследовании всех пациентов в ОАК лейкоцитоз выявлен в 7 случаях (36,8%), нейтрофилез - в 8 случаях (42,1%). Повышение СОЭ более 30 мм/час отмечено в 17 случаях (89,5%).
Прокальцитонин (3,4; М=3,3, SD=8,8) и пресепсин (618,7; М=84,5, SD=223,7) определялись в 7 случаях, все результаты -с превышением нормы (0,05 нг/мл и 365 пг/мл соответственно), в том числе у одного пациента уровень прокальцитонина (23,34 нг/мл) соответствовал септическому состоянию (Таблица 1). СРБ (109,2; М=34,2, SD=96,9) исследовали в 8 случаях, все результаты превышали допустимый уровень 5 мг/л. Повышение Д-димера (1216,5; М=297,6, SD=1152,5) свыше 500 нг/мл отмечено в 12 случаях из 18 (66,7%), свыше5000 нг/мл – у 3 пациентов (16,7%).
Дополнительные методы диагностики (КТ, рентгенография, УЗИ), подтверждали диагноз коксита с характерными изменениями в виде лизиса головки бедренной кости и стенок вертлужной впадины, формирования костных дефектов, краниального смещения головки, нечеткости контуров суставных поверхностей, кистозной перестройки, локального остеопороза, наличия жидкости в суставе, истончения суставной щели и дна вертлужной впадины, синовита, бурсита, признаков остеомиелита.
Пункция ТБС до 1 этапа операции выполнена в 14 случаях из 19. В 50% (7 пунктатов) обнаружен рост Staphylococcus aureus, в 1 случае – Salmonella enteritidis, в 6 случаях (42,9%) результаты посевов были отрицательными (Таблица 2).
Таблица 1.
Результаты лабораторных исследований перед 1 этапом реэндопротезирования
|
№ |
Л, х109/л |
Н, х109/л |
СОЭ, мм/ч |
Прес, пг/мл |
СРБ, мг/л |
Д, нг/мл |
|
|
1 |
6,93 |
4,43 |
16 |
Н/д |
Н/д |
Н/д |
1110 |
|
2 |
3,35 |
2,96 |
32 |
0,17 |
536 |
78,9 |
4024 |
|
3 |
9,43 |
6,75 |
47 |
Н/д |
Н/д |
Н/д |
Н/д |
|
4 |
7,25 |
5,26 |
45 |
23,34 |
425 |
15,6 |
2809 |
|
5 |
8,01 |
3,99 |
25 |
Н/д |
Н/д |
Н/д |
425 |
|
6 |
15,23 |
11,79 |
68 |
Н/д |
Н/д |
Н/д |
>5000 |
|
7 |
6,8 |
3,76 |
19 |
0,064 |
Н/д |
67,5 |
328 |
|
8 |
7,25 |
5,78 |
70 |
Н/д |
Н/д |
Н/д |
915 |
|
9 |
6,35 |
4,29 |
92 |
0,055 |
Н/д |
111 |
2304 |
|
10 |
4,56 |
2,27 |
7 |
Н/д |
Н/д |
Н/д |
41 |
|
11 |
6,89 |
4,45 |
115 |
0,13 |
849 |
74,4 |
>5000 |
|
12 |
8,17 |
4,93 |
14 |
Н/д |
Н/д |
Н/д |
190 |
|
13 |
11,01 |
8,01 |
45 |
Н/д |
512 |
256,9 |
1221 |
|
14 |
11,01 |
8,01 |
45 |
Н/д |
512 |
256,9 |
1221 |
|
15 |
10,58 |
8,43 |
115 |
0,116 |
1019 |
Н/д |
>5000 |
|
16 |
9,08 |
6,1 |
30 |
0,062 |
478 |
Н/д |
1272 |
|
17 |
10,05 |
7,5 |
16 |
Н/д |
Н/д |
Н/д |
105 |
|
18 |
8,98 |
4,78 |
4 |
Н/д |
Н/д |
Н/д |
195 |
|
19 |
5,38 |
3,13 |
64 |
Н/д |
Н/д |
12,1 |
2087 |
Примечание:
Сокращение: Л-лейкоциты, Н-нейтрофилы, Прок-прокальцитонин, Прес-пресепсин, Д-д-димер Н/д – нет данных
Подсчет количества клеток в синовиальной жидкости (n=12) до операции выявил повышенный цитоз (свыше 2000 в 1 мкл) в 41,7% (n=5). Нейтрофилез (свыше 65%) наблюдался в 7 случаях из 9 (77,8%).
Интраоперационно повышенный цитоз (свыше 2000 клеток в 1 мкл) выявлен в 7 из 11 исследований (63,6%).
По результатам посева интраоперационного материала, в 10 из 19 случаев обнаружен рост Staphylococcus aureus (52,6%), у одного пациента подтвердилось присутствие Salmonella enteritidis. В одном случае отрицательного дооперационного результата интраоперационно выявлен рост Pseudomonas aeruginosa. Еще в одном случае диагностирована микст-инфекция Staphylococcus aureus + Escherichia coli. Получен один отрицательный результат при предыдущем положительном результате исследования (до операции отмечался рост Staphylococcus aureus).
Положительные результаты посева пунктата до операции составили 57,1% (8 из 14), изъятого во время операции материала – 68,4% (13 из 19), что свидетельствует о более высокой чувствительности микробиологического исследования интраоперационного биоматериала. Связать наличие грамотрицатель-ной флоры с заболеваниями органов пищеварения или другими факторами не удалось.
Таким образом, в целом инфекционный генез заболевания подтвердился данными микробиологического исследования бо- лее чему 2/3 больных. У остальных пациентов с культуронегативным результатом наличие инфекционного процесса подтверждено другими клинико-лабораторными методами, при этом морфологические исследования биоматериала не проводились.
2 этап эндопротезирования проведен в 15 (78,9%) из 19 случаев. Один пациент на 2 этап лечения не явился. Два пациента до проведения 2 этапа умерли по причинам, не связанным с основным заболеванием. Одной пациентке со стабильным, хорошо фиксированным спейсером, выполненным на основе цементируемых компонентов протеза, с хорошим функциональным статусом, было решено сохранить спейсер в качестве постоянного эндопротеза. При дальнейшем наблюдении данной пациентки в течение 3,5 года положение компонентов спейсера остается стабильным, пациентка результатами лечения довольна, оценка по шкале Харриса 85 баллов.
К моменту 2 этапа лечения у пациентов отмечено улучшение функционального состояния оперированного ТБС (средний балл по шкале Харриса 30,5±3,6). Помимо купирования воспалительного процесса, этому способствовало сохранение артикуляции в суставе.
При лабораторном обследовании перед 2 этапом незначительный лейкоцитоз и повышение СОЭ выявлено в 20%, увеличение Д-димера – в 73,3% случаев, увеличение СРБ (7,7 мг/л) – в одном случае.
Результаты микробиологического исследования биоматериала на 1 этапе реэндопротезирования
Таблица 2.
|
№ п/п |
Аспират до 1 этапа реэндопротезирования |
+/- |
Интраоперационный материал |
+/- |
|
1 |
Сulturenegative |
Сulturenegative |
||
|
2 |
Staphylococcus aureus |
+ |
Staphylococcusaureus |
+ |
|
3 |
Staphylococcus aureus |
+ |
Staphylococcusaureus |
+ |
|
4 |
Salmonella enteritidis |
- |
Salmonella enteritidis |
- |
|
5 |
Нет данных |
Staphylococcus aureus |
+ |
|
|
6 |
Staphylococcusaureus |
+ |
Staphylococcusaureus |
+ |
|
7 |
Сulturenegative |
Сulturenegative |
||
|
8 |
Staphylococcus aureus |
+ |
Staphylococcus aureus |
+ |
|
9 |
Сulturenegative |
Staphylococcus aureus |
+ |
|
|
10 |
Нет данных |
Сulturenegative |
||
|
11 |
Staphylococcus aureus |
+ |
Staphylococcus aureus |
+ |
|
12 |
Сulturenegative |
Pseudomonas aeruginosa |
- |
|
|
13 |
Нет данных |
Staphylococcus aureus |
+ |
|
|
14 |
Staphylococcus aureus |
+ |
Сulturenegative |
|
|
15 |
Сulturenegative |
Staphylococcusaureus |
+ |
|
|
16 |
Staphylococcus aureus |
+ |
Staphylococcus aureus |
+ |
|
17 |
Нет данных |
Staphylococcus aureus, Escherichia coli, Staphylococcus epidermidis, Citrobacter freundii |
+/- |
|
|
18 |
Сulturenegative |
Сulturenegative |
||
|
19 |
Нет данных |
Сulturenegative |
Примечание: +/- грамположительные/грамотрицательные культуры
Результаты всех пункций ТБС перед 2 этапом были отрицательными. Цитоз был значительно повышен (до 77500 клеток в 1 мкл) в 1 случае из 10. По нашему мнению, это может быть вызвано сохранением локального воспалительного процесса в суставе после 1 этапа. Поскольку в динамике другие клиниколабораторные показатели регрессировали до нормальных значений, был проведен 2 этап эндопротезирования в соответствии со стандартной схемой. В течение первого года после 2 этапа реинфицирования эндопротеза не отмечено, на отдаленном сроке наблюдения 2 года 3 мес. функциональный результат по шкале Харриса составил 87 баллов, пациент лечением удовлетворен.
Результаты интраоперационного посева перед 2 этапом лечения были отрицательными в 100% исследований (n=12).
Во всех 15 случаях на 2 этапе установлен постоянный эндопротез, в том числе с бесцементной (n=11) и гибридной (бес-цементная чашка, цементная ножка) фиксацией компонентов (n=4). С учетом возраста, а также состояния стенок впадины во всех случаях использована бесцементная фиксация вертлужного компонента. Из-за отсутствия плотной посадки «press-fit», наличия костных дефектов, истончения дна и локального остеопороза чашка эндопротеза дополнительно фиксировалась винтами в 13 случаях, в том числе в 5 случаях использовано более трех винтов для фиксации специальных чашек с большим количеством отверстий (multihole).
Отдаленные результаты лечения оценены у всех пациентов, прошедших 2 этап лечения (n=15). Средний срок наблюдения составил 35,2±6,1 мес. Функциональный результат по шкале Харриса составил 82,2±4,0 балла.
Осложнения
В раннем послеоперационном периоде в одном случае после установки цементного спейсера, армированного спицами, произошел вывих спейсера, смещение бедренного компонента. Это потребовало переустановки спейсера на 6 сутки после операции. Повторный спейсер изготовлен на основе компонентов эндопротеза.
В одном случае при поступлении пациента на 2 этап отмечена нестабильность цементного бедренного компонента спейсера с переломом армирующих спиц, что не потребовало дополнительных манипуляций и не повлияло на результаты лечения.
В одном случае во время выполнения 2 этапа произошел продольный незавершенный раскол диафиза бедренной кости, для остеосинтеза использовали проволочный серкляж. На отдаленном сроке через 2 года эндопротез стабилен.
В двух случаях (в одном после 1 этапа, в другом - после 2) в области послеоперационного рубца образовались лигатурные свищи, проводилось консервативное лечение.
Повторное инфицирование после выполнения 2 этапа лечения возникло в двух случаях - на сроках 680 и 900 дней. В одном случае этому предшествовала травма (падение с велосипеда), в другом – перенесенная ОРВИ. Обоим пациентам выполнено двухэтапное эндопротезирование с установкой спейсера на 1 этапе.
Обсуждение
В литературе имеется малое количество публикаций о диагностике и лечении септического артрита тазобедренного сустава. Отмечается сложность диагностики коксита, отсутствие четких согласованных критериев постановки диагноза. Редкость патологии, существующие трудности диагностики и лечения неспецифического коксита явились причиной настоящего исследования.
Помимо неспецифических маркеров воспаления (лейкоцитоз, увеличение СОЭ, СРБ, Д-димера), все большую значимость приобретают тесты на наличие локального воспаления в суставе (подсчет количества клеток синовиальной жидкости с определением процентного содержания нейтрофилов, определение лейкоцитарной эстеразы, альфа-дефензиновый тест, непосредственное выделение микроорганизма при микробиологическом исследовании), что обусловлено их высокой чувствительностью и специфичностью.
Использование тест-полосок на лейкоцитарную эстеразу хорошо зарекомендовало себя в урологической практике и в последнее время все чаще применяется при диагностике перипротезной инфекции. Ряд авторов отмечает возможность их использования при диагностике септических артритов. Colvin с соавт. в своем исследовании заключили, что этот тест может являться ценным инструментом для исключения септического артрита [15]. Omar с соавт. при сравнении 19 случаев септических и 127 асептических артритов подтвердили наличие повышенного количества клеток с преобладанием полиморфноядерных нейтрофилов в случае инфекционного процесса, а также предложили использование тест-полосок на лейкоцитарную эстеразу совместно с тест-полосками на концентрацию глюкозы в качестве диагностического теста на наличие септического артрита [5].
Приводятся данные об исследовании биохимических маркеров сепсиса в пораженном суставе. Imagama T . с соавт. сравнивали содержание пресепсина и прокальцитонина у двух групп пациентов - с септическим артритом, включая перипротезную инфекцию суставов (n=18), и с остеоартритом (n=28). Обнаружено значительно более высокое содержание данных маркеров как в крови, так и в синовиальной жидкости у первой группы пациентов. В этой же группе пресепсин в синовиальной жидкости проявлял как 100% чувствительность, так и 100% специфичность, что превысило аналогичные показатели пресепсина и прокальцитонина крови. Отметив заметное повышение пре-сепсина синовиальной жидкости в случае септического артрита, авторы подчеркнули потенциальную возможность использования пресепсина в качестве нового биомаркера септического артрита [16].
Рассматривая методы лечения, можно отметить, что консервативный применяется чаще при лечении специфической инфекции сустава (например, гонококковой), а также на начальных стадиях заболевания и при невозможности оперативных методов лечения [6].
При лечении коксита многократными пункциями сустава получены хорошие результаты, сопоставимые с санационной артротомией [17]. Тем не менее, при использовании этого метода лечения отмечается более высокий уровень смертности и прогрессирования заболевания [6].
Систематический обзор артроскопического дебридмента, выполненный de SA D. с соавт., показал его высокую эффективность на начальных стадиях коксита без анатомических изменений и при отсутствии остеомиелита. Средний срок наблюдения составил 19 месяцев. В 1 случае из 65 потребовалась повторная артроскопия. В 2 случаях отмечено развитие артроза [18].
Другим вариантом оперативного лечения коксита является резекционная артропластика, и этот метод также не является идеальным. Двухэтапное лечение септического артрита изначально выполнялось в виде резекционной артропластики на 1 этапе без установки временной конструкции. Chen с соавт. сообщили о 28 пациентах с септическим артритом ТБС, которым была выполнена резекционная артропластика с последующим эндопротезированием ТБС через 3,6 месяца со средним периодом наблюдения 77 месяцев. Средний балл по шкале Харриса составил 80,9 балла. У четверых пациентов (14%) развилась рецидивирующая инфекция, у троих - перипротезный перелом, у двоих – вывих, и у одного пациента диагностирован перелом ножки протеза [19].
Diwanji был одним из первых авторов, сообщивших о применении пропитанного антибиотиками цементного спейсера при септическом артрите тазобедренного сустава. Девяти пациентам были проведены поэтапные операции со средним интервалом 6 мес. (от 1,5 до 12 мес.), при этом функциональные показатели ТБС по Харрису улучшились с 38 баллов до операции до 57 после 1 этапа и до 97 баллов после тотального эндопротезирования. У одного пациента развилась рецидивирующая инфекция, еще одному потребовалась переустановка спейсера. У обоих пациентов подтвердилась метициллинрезистентная инфекция S. aureus (MRSA) [20].
Romano с соавт. при использовании двухэтапного эндопротезирования с установкой спейсера на 1 этапе у 19 пациентов (20 суставов) с септическим артритом отметил 1 случай реинфекции на сроке наблюдения 56,6 мес. [10].
Результаты нашего исследования показали необходимость дополнительного обследования пациентов для диагностики коксита. При этом определение пресепсина, прокальцитонина в крови и цитоза в пунктате с подсчетом процентного содержания нейтрофилов более специфично, что особенно важно при отрицательных результатах микробиологического исследования синовиальной жидкости из сустава.
С учетом развития при коксите необратимых изменений в суставе мы считаем целесообразным проведение эндопротезирования в два этапа с установкой спейсера на 1 этапе.
Клинические примеры
Пациент М., 69 лет, поступил с диагнозом левостороннего коксита. Заболел остро, за 9 мес. до госпитализации без видимой причины появились боли в левом ТБС, лихорадка до 38°С. Лечился консервативно (антибактериальная терапия) по месту жительства с временным положительным эффектом. При поступлении - выраженное нарушение функции левого ТБС (22 балла по шкале Харриса). В ОАК: СОЭ=92 мм/ч, СРБ -111мг/л, прокальцитонин - 0,055 нг/мл, Д-димер - 2304 нг/мл, остальные показатели без изменений. Выявлены рентгенологические признаки левостороннего коксита, локальный остеопороз. Выполнена установка артикулирующего спейсера на основе ножки CPT фирмы «Zimmer» с покрытием поверхности ионами серебра. Вертлужный компонент изготовлен из костного цемента в специальной пресс-форме с внутренним диаметром 28 мм под соответствующую головку. При микробиологическом исследовании трех образцов интраоперационного биоматериала в одном обнаружен Staphylococcus aureus. В период госпитализации пациент 6 дней получал антибиотикотерапию (цефуроксим по 1,5 г 4 раза в день + амикацин по 1,5 г 1 раз в день внутривенно). На амбулаторном этапе назначен прием бисептола 0,96 г 3 раза в день в течение 6 нед.
2 этап эндопротезирования выполнен через 3 мес. При госпитализации отмечены улучшение функции ТБС в динамике (48 баллов по шкале Харриса), нормализация лабораторных показателей. Установлен протез фирмы «Zimmer» гибридной фиксации (бесцементная чашка Trilogy с 5 винтами, цементная ножка Muller). При осмотре через 1 год после 2 этапа лечения пациент жалоб не предъявляет, ходит без средств опоры, функциональный результат по шкале Харриса 92 балла (Рис.1).
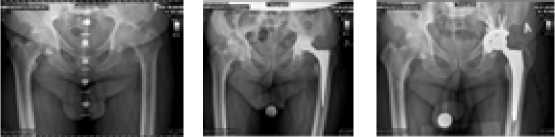
б
в
Рис.1. Рентгенограммы пациента М. при поступлении (а), перед (б) и после (в) выполнения 2 этапа лечения
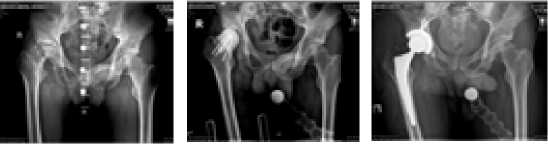
б
в
Рис.2. Рентгенограммы пациента М. при поступлении (а), перед (б) и после (в) выполнения 2 этапа лечения
Заключение
По итогам нашего исследования, доля пациентов с подтвержденным диагнозом коксита составляет малую часть случаев, поступающих на оперативное лечение в стационар ортопедического профиля: 0,03% пациентов за период с марта 2009 по декабрь 2018 года. Отмечена сложность диагностики коксита при отсутствии признаков острого инфекционного процесса. Стандартное клинико-лабораторное обследование при госпитализации не всегда позволяет выявить данное заболевание. Часть диагностических методов дает отрицательные результаты, в том числе микробиологическое исследование интраоперационного материала. Диагноз коксита можно установить на основе дополнительного обследования, включающего сбор анамнеза (острое начало, связь с травмой, предшествующее инвазивное вмешательство в области ТБС, повышение температуры тела), результаты лучевых методов диагностики (при этом результаты томографии более убедительны), лабораторного и микробиологического обследования на всех этапах диагностики. В сравнении с изменениями в общеклинических исследованиях большую значимость имеют следующие диагностические тесты: определение пресепсина, прокальцитонина в биохимическом анализе крови, цитоза в пунктате сустава с подсчетом процента нейтрофилов.
Локализация инфекционного процесса в суставе позволяет санировать очаг без вскрытия костно-мозгового канала (для профилактики распространения инфекции). Используемый при этом бедренный компонент спейсера, изготовленный из костного цемента, легко и менее травматично удаляется на 2 этапе, однако, имеет больший риск расшатывания и вывиха из-за слабости фиксации и менее точной артикуляции в суставе. Это может потребовать использованияв послеоперацион- ном периоде дополнительных средств фиксации (ортез на ТБС, кокситная гипсовая повязка), а также привести к повторным оперативным вмешательствам. Спейсер на основе компонентов протеза подразумевает более инвазивное вмешательство, но лишен указанных недостатков. В нашем исследовании из 11 бедренных компонентов, изготовленных из цемента вручную, отмечен один случай вывиха и один случай расшатывания спейсера, повторная операция при этом выполнена в первом случае.
В случае относительных противопоказаний к оперативному лечению (возраст, тяжелая сопутствующая патология), а также стабильного правильного положения спейсера на основе компонентов протеза, при купировании инфекционного процесса и хорошей функции сустава возможно сохранение спейсера в качестве постоянного протеза с целью снижения риска послеоперационных осложнений.
Изменения в области вертлужной впадины при коксите (костные дефекты, кистозная перестройка, истончение и протрузия дна) требуют, как правило, установки бесцементного вертлужного компонента на 2 этапе эндопротезирования с дополнительной фиксацией винтами.
Использование двухэтапного эндопротезирования с применением артикулирующих спейсеров различной конфигурации при лечении неспецифического коксита позволяет добиться удовлетворительных результатов лечения. На отдаленном сроке наблюдения 35,2±6,1 месяцев эрадикация инфекционного процесса (излечение) достигнута в 13 из 15 случаев (86,7%); функциональный результат по шкале Харриса составил 82,2±4,0 балла.
Финансирование: исследование не имело спонсорской поддержки
Funding: the study had no sponsorship
Список литературы Опыт лечения больных с неспецифическим кокситом методом двухэтапного эндопротезирования
- Исмаилов Х.Г., Маздыков А.Ф., Шушания Б.А. Опыт двух-этапного хирургического лечения гнойного коксита. Казанский медицинский журнал. 2014;95(1):112-115. https://doi.org/10.17816/ KMJ1469 [Ismailov KhG, Mazdykov AF, Shushaniya BA. Experience of two-stage surgical treatment of purulent coxitis. Kazanskiy meditsinskiy zhurnal. 2014;95(1):112-115. https://doi.org/10.17816/KMJ1469 (In Russ).]
- Huang TW. Encouraging outcomes of staged, uncemented arthroplasty with short-term antibiotic therapy for treatment of recalcitrant septic arthritis of the native hip. J. Trauma. 2010;68(4):965-969. https://doi.org/10.1097 / TA.0b013e3181af6e70
- Li W. [et al.] Comparison of efficacy and complications between two types of staging arthroplasty in treating chronic septic hip arthritis: A retrospective clinical study Exp. Ther. Med. 2019;17(5):4123-4131. https://doi.org/10.3892/etm.2019.7430
- Nolla JM. [et al.] Pyogenic arthritis of native joints due to Bacteroides fragilis: Case report and review of the literature. Medicine (Baltimore). 2016;95(25): e3962. https://doi.org/10.1097 / MD.0000000000003962
- Omar M. [et al.] Preliminary results of a new test for rapid diagnosis of septic arthritis with use of leukocyte esterase and glucose reagent strips. J. Bone Joint Surg.Am. 2014;96(24):2032-2037. https://doi.org/10.2106 / JBJS.N.00173
- Lum ZC, Shieh AK, Meehan JP. Native Adult Hip with Bacterial Septic Arthritis. J. Bone Joint Surg. Reviews.2018;6(10): e2. https://doi.org/10.2106/JBJS.RVW.17.00211
- Hunter JG. [et al.] Risk factors for failure of a single surgical debridement in adults with acute septic arthritis. J. Bone Joint Surg. Am. 2015;97(7):558-564. https://doi.org/10.2106 / JBJS.N.00593
- Bauer TW. Causes and Conditions Associated with Septic Arthritis. J. Bone Joint Surg Case Connect. 2018;8(4)e103. https:// doi.org/10.2106/JBJS.CC.18.00456
- Bauer T. [et al.] Arthroplasty following a septic arthritis history: a 53 cases series. Orthop. Traumatol. Surg. Res. 2010;96(8):840-843. https://doi.org/10.1016 / j.otsr.2010.06.009
- Nord KD. [et al.] Evaluation of treatment modalities for septic arthritis with histological grading and analysis of levels of uronic acid, neutral protease, and interleukin-1. J. Bone Joint Surg. Am. 1995;77(2):258-265. https://doi.org/10,2106 / 00004623-199502000-00013
- Romanò CL. [et al] Two-stage revision surgery with preformed spacers and cementless implants for septic hip arthritis: a prospective, non-randomized cohort study [eCollection] BMC Infect. Dis. 2011;11:129. https://doi.org/10.1186/1471-2334-11-129
- Shen H. [et al.] Novel articulating medullary-sparing spacer for the treatment of infectious hip arthritis. Orthopedics. 2013;36(4):404-408. https://doi.org/10.3928 / 01477447-20130327-13
- Diwanji SR. [et al.] Two-stage reconstruction of infected hip joints. J. Arthroplasty. 2008;23(5):656-661. https://doi.org/10.1016 / j.arth.2007.06.007
- Дзюба Г.Г. Современные методы лечения хирургической инфек-ции тазобедренного сустава. Современные проблемы науки и образования. 2016;5.[Электронный ресурс] Доступно по: https://science-education.ru/ru/ article/view?id=25235. Ссылка активна на 22.12.2020. [Dzyuba GG. Modern methods of treatment of surgical infection of the hip joint. Sovremennye problem nauki i obrazovaniya. 2016;5. [Electronic resource] Available from: https://science-education.ru/ru/article/view?id=25235. Link active on 22.12.2020 (In Russ).]
- Colvin OC, Kransdorf MJ, Roberts CC, Chivers FS, Lorans R, Beauchamp CP, Schwartz AJ. Leukocyte esterase analysis in the diagnosis of joint infection: can we make a diagnosis using a simple urine dipstick? Skeletal Radiol. 2015;May;44(5):673-7. https://doi.org/10.1007/s00256-015-2097-5
- Imagama T, Tokushige A, Seki K, Seki T, Nakashima D, Ogasa H, Sakai T, Taguchi T. Early diagnosis of septic arthritis using synovial fluid presepsin: A preliminary study. J Infect Chemother. 2019;Mar;25(3):170-174. https://doi.org/10.1016/j.jiac.2018.10.015
- Givon U, Liberman B, Schindler A, Blankstein A, Ganel A. Treatment of septic arthritis of the hip joint by repeated ultrasound-guided aspirations. J Pediatr Orthop. 2004;May-Jun;24(3):266-70. https://doi.org/10,1097 / 00004694-200405000-00006
- de SA D, Cargnelli S, Catapano M, Peterson D, Simunovic N, Larson CM, Ayeni OR. Efficacy of Hip Arthroscopy for the Management of Septic Arthritis: A Systematic Review. Arthroscopy. 2015;Jul;31(7):1358-70. https://doi.org/10.1016/j.arthro.2014.12.028
- Chen CE, Wang JW, Juhn RJ. Total hip arthroplasty for primary septic arthritis of the hip in adults. Int Orthop. 2008;Oct;32(5):573-80. https://doi.org/10.1007 / s00264-007-0366-1
- Diwanji SR, Kong IK, Park YH, Cho SG, Song EK, Yoon TR. Two-stage reconstruction of infected hip joints. J Arthroplasty. 2008;Aug;23(5):656-61. https://doi.org/10.1016/j.arth.2007.06.007


