Опыт лечения прогрессирующего невуса хориоидеи с помощью транспупиллярной термотерапии
Автор: Гурко Т.С.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 1 т.17, 2021 года.
Бесплатный доступ
Цель: оценить эффективность применения транспупиллярной термотерапии (ТТТ) в лечении прогрессирующего невуса хориоидеи. Материал и методы. Проведен анализ диагностики и лечения 29 человек (29 глаз) с прогрессирующим невусом хориоидеи. Сроки наблюдения составили от 4 месяцев до 3 лет. В диагностике новообразования особое внимание уделялось ультразвуковому В-сканированию, оптической когерентной томографии (ОКТ), ОКТ с функцией ангиографии. По данным ультразвукового В-сканирования высота новообразования до лечения варьировалась от 0,78 до 3,64мм (1,60 (1,40; 1,84), протяженность от 1,30 до 14,05мм (6,41 (5,12; 7,54). Для лечения применялась лазерная установка IRIS MEDICAL IQ 810 "IRIDEX" в режиме LONGPULSE. Результаты. После лечения проминенция в зоне невуса по данным В-сканирования не определялась в 14 случаях (48,3%). Уменьшение высоты и протяженности образования после ТТТ отмечено у 15(51,7%) пациентов, средняя высота проминенции составила 1,40 (1,20; 1,50), а протяженность — 6,10 (4,69; 7,30). У 28 (96,5%) пациентов острота зрения после лечения не изменилась. Заключение. Метод лечения прогрессирующего невуса с помощью ТТТ показал свою эффективность, безопасность, хорошую переносимость пациентами.
Транспупиллярная термотерапия, офтальмоонкология, невус хориоидеи
Короткий адрес: https://sciup.org/149134976
IDR: 149134976 | УДК: 617.7
Текст научной статьи Опыт лечения прогрессирующего невуса хориоидеи с помощью транспупиллярной термотерапии
-
1 Введение. Офтальмоонкология является важной медицинской специальностью, которая использует инновационные методы лечения с минимальной местной и общей токсичностью. Основоположниками в изучении этой проблемы были Джерри и Кэрол Шилдсы [1].
Новообразования хориоидеи подразделяются на две группы: злокачественные — ретинобластома, меланома, метастатические опухоли хориоидеи
и другие, и доброкачественные — вазопролиферативная опухоль сетчатки, невус хориоидеи, ограниченная форма гемангиомы хориоидеи, диффузная форма при синдроме Стерджа — Вебера, капиллярная гемангиома (болезнь Гиппеля — Линдау) и др. [2].
Меланоцитарный невус хориоидеи — часто встречающаяся первичная внутриглазная опухоль. По мнению многих авторов, невус хориоидеи является источником большинства меланом сосудистой оболочки [3–5]. Частота развития меланомы из невуса хориоидеи математически определяется как 1 на 8845. Обычно невус хориоидеи выявляется во взрослом возрасте. Он может быть амеланотическим, но чаще пигментным, плоским или минимально проминирующим. Невус хориоидеи гистологически образован высокодифференцированными веретеновидными, овоидными или округлыми меланоцитами с различной степенью выраженности пигментации цитоплазмы [6]. Специфическим клинико-гистологическим вариантом невуса является меланоцитома. Факторами риска перехода в злокачественный процесс являются толщина опухоли более 2 мм, локализация невуса в 3 мм от диска зрительного нерва или ближе, скопление субретинальной жидкости, появление на поверхности невуса оранжевого пигмента, увеличение размера невуса, акустическая пустота при ультразвуковом исследовании. В 80% случаев невусы хориоидеи, которые подвержены озлокачествлению, располагаются в заднем полюсе глаза. По данным Д. К. Шилдса с соавт., озлокачест-вление невуса в ближайшие 5 лет после его обнаружения, происходит в 3% случаев. При наличии одного фактора риска вероятность перерождения возрастает до 38%, а при наличии 2 и более признаков угроза озлокачествления возрастает до 50% [7]. Среди злокачественных внутриглазных первичных новообразований увеальная меланома занимает 80-90%, хориоидея поражается в 85% случаев. Так как меланома хориоидеи не является изолированной глазной патологией, приводящей к снижению или потере зрительных функций, она может привести к гибели пациента от метастатического процесса. Офтальмологи всего мира постоянно совершенствуют методы лечения злокачественных новообразований, стремясь к их раннему радикальному излечению.
Для диагностики новообразований хориоидеи применяются следующие диагностические исследования: ультразвуковое В-сканирование, флуоресцентная ангиография, ангиография с индоцианином зеленым, дуплексное УЗ-сканирование в сочетании с цветовым допплеровским картированием, микропериметрия с цветным фотографированием глазного дна, ОКТ, ОКТангиография [8]. В сложных диагностических случаях применяется тонкоигольная аспирационная биопсия.
Для лечения сосудистых новообразований глаз применяются различные методы: лазеркоагуляция, ТТТ, фотодинамическая терапия, брахитерапия, радиотерапия протоновым излучением, микроволновая термотерапия, хирургическая резекция, криодеструкция, энуклеация.
При обнаружении невуса за ним ведется динамическое наблюдение, сроки повторной явки определяет врач. При появлении признаков прогрессирования, наличия двух и более факторов риска озлокачест-вления или метастазирования выполняется ТТТ, поскольку такое новообразование может оказаться ранней стадией меланомы [9].
Опыт лечения внутриглазной опухоли методом фотокоагуляции впервые был опубликован в 50-е годы прошлого столетия, где сделан вывод о том, что полная регрессия увеальной меланомы возможна при ее достаточной пигментации и проминенции до 2 мм. В 1995 г. J.A. Oosterhuis, H. G. Journée-de Korver и J. E. Keunen впервые описали методику лечения хориоидальной меланомы с помощью ТТТ [10]. В качестве источника инфракрасного излучения использовали диодный лазер с длиной волны 810 нм. Экспериментально установлено повышение температуры опухоли от 45 до 60 градусов при проведении ТТТ. Данный температурный режим обеспечивает клеточный некроз глубиной до 3,9 мм [11]. Большой вклад в диагностику и лечение различных новообразований хориоидеи внесли Л. Ф. Линник и Д. А. Магарамов [11]. Авторы рекомендовали изолированное применение ТТТ при опухолях высотой до 3,5 мм, особенно при центральном и юкстапапиллярном их расположении. Морфологические и клинические исследования глаз после проведения локальной термотерапии показали отсутствие признаков повреждения близлежащих к опухоли тканей и структур. Авторы выявили, что лазерное излучение 810 нм инфракрасного спектра не поглощается макулярным пигментом ксантофиллом и не повреждает нейроэпителиальный слой сетчатки, но проникает в глубокие слои хориоидеи. Это важно учитывать при лечении различных новообразований с центральной локализацией. Таким образом, метод ТТТ является достаточно эффективным, органосохранным, щадящим. Может быть использован после брахитерапии в качестве дополнительного воздействия на очаги остаточной проминенции и участки продолженного роста опухоли.
Цель: оценить эффективность применения транспупиллярной термотерапии в лечении прогрессирующего невуса хориоидеи.
Материал и методы. Проанализированы результаты диагностики и лечения 29 человек (29 глаз) с прогрессирующим невусом хориоидеи по данным Тамбовского филиала ФГАУ «НМИЦ “МНТК ‘Микрохирургия глаза’ им. акад. С. Н. Фёдорова”» Минздрава России. Сроки наблюдения составляли от 4 месяцев до 3 лет. Средний возраст был равен 70,3 года. Среди них было 4 мужчин и 25 женщин. У 12 (41,4%) пациентов прогрессирующий невус локализовался на средней и частично крайней периферии; у 2 (6,9%) — в макулярной зоне; в 5 (17,3%) случаях — по ходу сосудистых аркад; у 10 (34,5%) пациентов — на крайней периферии.
Проведенные диагностические исследования включали в себя: визо-, пневмотонометрию, биомикро-, контактную офтальмоскопию, ультразвуковое В-сканирование, периметрию, ОКТ, ОКТангиография. Метод ОКТ-ангиографии особенно важен для сканирования хориоретинальных структур, визуализации функционирующих кровеносных сосудов и выявления патологических изменений.
Острота зрения до применения транспупиллярной термотерапии составляла от 0,2 до 1,0 (в среднем 0,7±2,1). По данным ультразвукового исследования (В-сканирования) высота новообразования до лечения варьировалась от 0,78 до 3,64 мм (1,60 (1,40; 1,84), протяженность от 1,30 до 14,05 мм (6,41 (5,12; 7,54). Внутриглазное давление до лечения варьировало от 11,4 до 17,9 мм рт. ст. (в среднем составило 14,80 ± 0,86 мм рт. ст.).
Для проведения ТТТ применялась лазерная установка IRIS MEDICAL IQ 810 “IRIDEX” в режиме LONGPULSE. В некоторых случаях при проведении барьерной лазерной коагуляции с маловыраженной пигментацией глазного дна применялся режим CW-PULSE с диаметром пятна 200 мкм. При проведении ТТТ использовалась линза Гольдмана со специальным антилазерным покрытием и контактная панфун-дус линза REICHEL–MAINSTER IX. Преимуществом диод-лазерного излучения с длиной волны 810 нм является необходимая глубина проникновения, отсутствие повреждающего действия на окружающие внутриглазные структуры, не поглощается макулярным пигментом, меньше рассеивается, не повреждает нейроэпителиальный слой сетчатки, может выполняться амбулаторно. Мощность излучения подбирали индивидуально, в зависимости от про-
Динамика высоты и протяженности невуса до и после проведения транспупиллярной термотерапии
|
Признак |
Me (Q25; Q75), мм |
Значимость различий с исходным состоянием |
|
Высота невуса до лечения |
1,60 (1,40; 1,84) |
Z =2,42 |
|
Высота невуса после лечения |
1,40 (1,20; 1,50) |
P =0,016 |
|
Протяженность невуса до лечения |
6,41 (5,12; 7,54) |
Z =3,11 |
|
Протяженность невуса после лечения |
6,10 (4,69; 7,30) |
P =0,002 |
зрачности сред, степени пигментации опухоли, выраженности экссудативной реакции, степени пигментации глазного дна, наличия или отсутствия атрофии пигментного эпителия. Используемая мощность колебалась от 220 до 1100 мВт. Количество аппликаций зависело от площади опухоли; коагуляты наносили по всей ее поверхности черепицеобразно. Диаметр пятна лазерного излучения составлял от 1 до 3 мм.
При прогрессирующем невусе вначале выполнялась ограничительная лазерная коагуляция в пределах здоровых тканей до 1–2 мм, для профилактики распространения атипичных клеток, отека Количество сеансов ТТТ определяли динамикой резорбции облучаемой ткани, в среднем выполнялось 2–3 сеанса.
Статистическую обработку полученных данных осуществляли с помощью пакетов программ «Statistica 10.0» (Dell Inc., США). Поскольку распределение большинства признаков отличалось от нормального (проверяли по критерию Шапиро — Уилка), данные представлены в виде медианы и 25 и 75% квартилей (Me (Q25; Q75)). Статистическую значимость различий оценивали с использованием непараметрического критерия Вилкоксона. Различия принимались достоверными при уровне значимости p <0,05.
Результаты. После проведения ТТТ у пациентов с прогрессирующим невусом в 1 (3,5%) случае острота зрения снизилась с 0,8 до 0,5 в связи с увеличением отслойки нейроэпителия при локализации новообразования в макулярной зоне. У 28 (96,5%) пациентов острота зрения после использования транспупиллярной термотерапии не изменилась. В одном случае после ТТТ появился преретинальный фиброз без тракционного компонента, однако острота зрения осталась прежней. Внутриглазное давление после лечения сохранилось в пределах нормы: составило от 10,5 до 18,6 мм рт. ст. (в среднем 15,1±0,88).
По данным В-сканирования после лечения про-миненция в зоне невуса не определялась в 14 случаях (48,3%). Офтальмоскопически в зоне локализации невуса определялся хорошо выраженный хориоретинальный рубец. У 15 (51,7%) пациентов наблюдалось уменьшение высоты и протяженности образования: высота проминенции была равна 1,40 (1,20; 1,50), варьируясь от 0,70 до 3,10 мм, протяженность от 1,30 до 7,50 мм (6,10 (4,69; 7,30) (таблица).
Изменения высоты и протяженности являются статистически значимыми.
В зоне невуса определялись атрофические хориоретинальные очаги, исчезновение микрогеморрагий, оранжевого пигмента, отсутствие отслойки пигментного эпителия, нейроэпителия, частичная или полная резорбция отека.
Критерием положительного эффекта при лечении прогрессирующего невуса считали: уменьшение высоты опухоли с последующим формированием хориоретинального рубца, резорбцию отека, исчезновение отслоек пигментного эпителия, нейроэпителия;
микрогеморрагий и оранжевого пигмента на поверхности новообразования.
Пациентам было рекомендовано проведение динамического наблюдения, сроки определялись индивидуально — от 1 до 6 месяцев с контролем В-сканирования и ОКТ. Далее решался вопрос о проведении повторного сеанса ТТТ у пациентов с остаточной проминенцией, сохранением признаков прогрессирования новообразования, неполной резорбцией отека.
Всем пациентам рекомендована консультация онколога с проведением ультразвукового исследования брюшной полости, при необходимости компьютерной томографии органов брюшной полости. Для женщин обязательным является проведение маммографии.
Клинический пример. Пациентка П. 1950 г. р., 03.05.2018 обратилась с жалобами на низкое зрение правого глаза с детства, плавающее помутнение в левом глазу в течение месяца. После проведенного обследования и осмотра поставлен диагноз:
OD гиперметропия высокой степени, амблиопия высокой степени.
OS прогрессирующий невус хориоидеи, задняя отслойка стекловидного тела.
OU начальная возрастная катаракта, гипертоническая ангиопатия.
При поступлении: острота зрения правого глаза = 0,04 н/к. Острота зрения левого глаза = 0,5 н/к. Внутриглазное давление OD 13,6 мм рт. ст.; OS 15,8 мм рт. ст.
По результатам В-сканирования обнаружено: на правом глазу единичные помутнения в стекловидном теле, оболочки прилежат. На левом глазу незначительные помутнения в стекловидном теле, задняя отслойка стекловидного тела, в наружном сегменте проминенция высотой 1,96 мм (рис. 1).
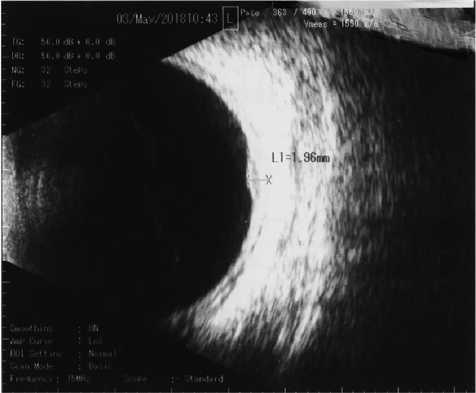
Рис. 1. Результат В-сканирования левого глаза пациентки П. от 03.05.2018. Стрелкой указана проминенция высотой 1,96 мм
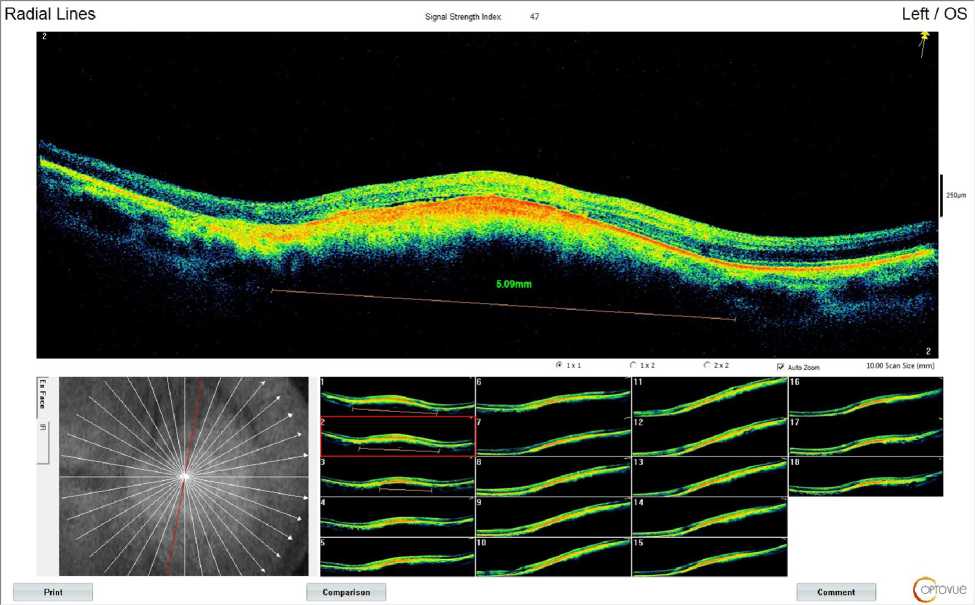
Рис. 2. Результат проведения оптической когерентной томографии левого глаза пациентки П. от 03.05.2018. В височных отделах левого глаза определяется обширная проминенция с плоской отслойкой нейроэпителия над ней. Протяженность новообразования на снимке — 5,09 мм
При осмотре: биомикроскопия — оба глаза спокойны, веки без изменений, роговица прозрачная, передняя камера средней глубины, влага передней камеры прозрачная, радужка спокойна, структурна, медикаментозный мидриаз; в хрусталиках начальные кортикальные помутнения, OD стекловидное тело прозрачное, OS — задняя отслойка стекловидного тела.
Глазное дно — OD ДЗН бледно-розового цвета, контуры четкие, макулярная зона и периферия без изменений. Артерии сужены, склерозированы, синдром Салюса — Гунна II степени. OS ДЗН бледно-розового цвета, контуры четкие, фовеа без изменений, кнаружи от фовеа определяется пигментированное проминирующее образование с друзами на поверхности, контуры слегка размыты, размером 2 диаметра ДЗН с плоской отслойкой нейроэпителия, средняя и крайняя периферия без изменений, артерии сужены, склерозированы, синдром Салюса — Гунна II степени.
Общее состояние удовлетворительное, из сопутствующих заболеваний: гипертоническая болезнь II степени, хронический холецистит, маммография без изменений. УЗИ брюшной полости — признаки некалькулезного холецистита.
Рекомендовано: транспупиллярная термотерапия левого глаза.
Выполнена ТТТ 22.05.2018, 21.06.2018.
22.05.2018 — 1-й сеанс ТТТ. Под ретробульбарной анестезией с помощью линзы панфундус выполнена барьерная лазерная коагуляция зоны новообразования и через трое суток нанесены лазерные аппликации по поверхности образования. Операция выполнялась на установке IRIS MEDICAL IQ810 “IRIDEX” в режиме LONGPULSE. Использовались следующие параметры: мощность 0,17–0,19 Вт, диаметр луча
-
1,8 мкм, время воздействия 1,3 мин. Острота зрения после лечения не изменилась, Vis OS = 0,5 н/к. Пациентке рекомендован повторный осмотр через месяц.
21.06.2018 — 2-й сеанс ТТТ OS
. Лазерные аппликации нанесены по поверхности невуса. Рекомендован повторный осмотр через 3 месяца.
19.09.2018 осмотр.
Острота зрения не изменилась.
16.03.2020 осмотр.
Зрение правого глаза 0,05 н/к. Зрение левого глаза 0,5 с+0,5; cyl -0,5 ax 65°=0,7.
Осмотр 21.06.2018 . Зрение правого глаза 0,05 н/к. Зрение левого глаза 0,5 н/к.
OCT OS — наблюдалось уменьшение проминен-ции с формированием хориоретинального рубца без отслойки нейроэпителия. В-сканирование OS сохраняется проминенция высотой 1,7 мм.
Офтальмоскопически на левом глазу ДЗН бледно-розового цвета, контуры четкие, фовеа без изменений, кнаружи от фовеа пигментированные очаги с зонами атрофии в зоне невуса, сохраняется проми-ненция. Рекомендован дополнительный сеанс ТТТ OS.
На OCT OS наблюдалось увеличение плотности хориоретинального рубца. Максимальная протяженность рубца 2,36 мм (рис. 3). При проведении В-сканирования отмечено уменьшение высоты про-миненции до 1,54 мм.
Пациентке проводится динамическое наблюдение за состоянием сетчатки в зоне пигментного невуса хориоидеи с контролем В-сканирования и ОСТ каждые 5–6 месяцев.
OCT OS: в зоне невуса сформирован атрофический хориоретинальный рубец.
В-сканирование: в наружном сегменте локальное утолщение оболочек, высота 1,41 мм.
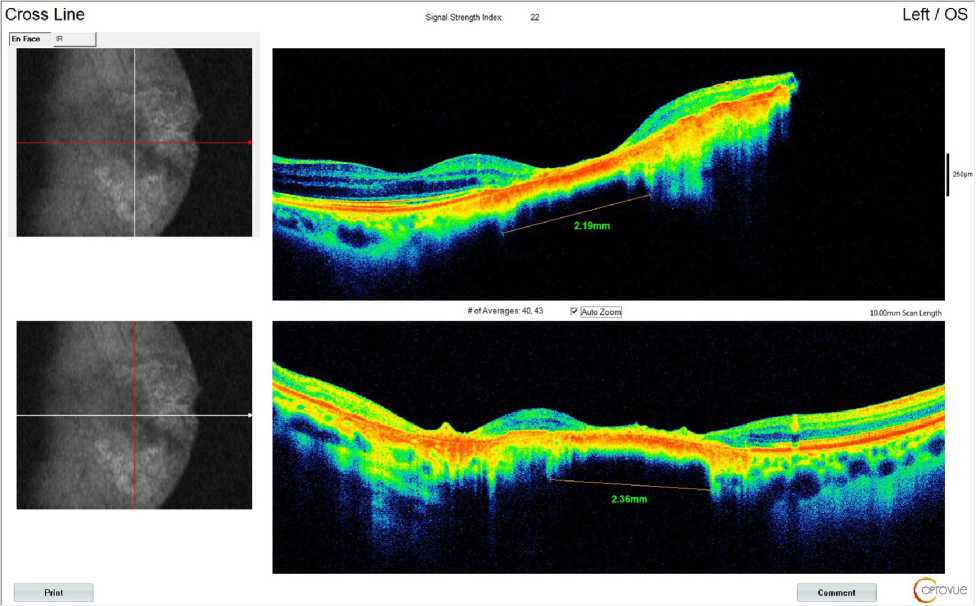
Рис. 3. Результат оптической когерентной томографии пациентки П. после проведения двух сеансов транспупиллярной термотерапии. В зоне новообразования сформирован хориоретинальный рубец протяженностью 2,36 мм
Офтальмоскопически: OS ДЗН бледно-розового цвета, контуры четкие; фовеа без изменений, кнаружи от фовеа атрофические очаги без видимой про-миненции. Периферия без изменений .
Рекомендовано продолжить динамическое наблюдение состояния пациентки 1 раз в 6 месяцев с контрольным проведением OCT и В-сканирования, наблюдение у онколога.
Обсуждение. Учитывая экспериментальные данные и гистологические исследования безопасности инфракрасного излучения диодного лазера длиной волны 810 нм мы его применяли при различной локализации, в том числе макулярном расположении прогрессирующего невуса.
Ряд авторов трактуют прогрессирование хориоидального невуса: скопление субретинальной жидкости, появление оранжевого пигмента, геморрагий на его поверхности, появление отслойки пигментного или нейроэпителия над ним, рост новообразования как начало развития увеальной меланомы [2, 9, 11]. В большинстве случаев для лечения применяют метод ТТТ.
Согласно исследованию Л. Ф. Линника и Д. А. Ма-гарамова, полный регресс новообразования достигнут в 23% случаев при максимальной высоте новообразования 3,5 мм и средней протяженности опухоли 8,22 мм, а морфологические исследования энуклеированных глаз показали в зоне термотерапевтического воздействия очаги некротизированной ткани глубиной до 2,2 мм [11].
По нашим данным, отсутствие проминенции при В-сканировании отмечено в 48,3% случаев; мы считаем, что большее количество пациентов с положительным результатом связано с меньшими размерами новообразования (средняя высота новообразования до лечения 1,60 (1,40; 1,84) мм и протяженность 6,41 (5,12; 7,54). Наличие более высокой остроты зрения после лечения также установлено в наших исследованиях (у 96,5% случаев острота зрения не изменилась, у авторов — в 65% случаев). Это связано с локализацией патологического процесса. В наших клинических наблюдениях только у 6,9% очаг располагался в макулярной зоне, что привело к снижению остроты зрения после лечения в связи с увеличением отслойки нейроэпителия.
Проведенный клинический анализ показал убедительные положительные результаты лечения пациентов с прогрессирующим невусом.
Заключение. Опыт применения лазерной установки IRIS MEDICAL IQ 810 “IRIDEX” в режиме LONGPULSE для выполнения транспупиллярной термотерапии по данным Тамбовского филиала ФГАУ «НМИЦ “МНТК ‘Микрохирургия глаза’ им. акад. С. Н. Фёдорова”» Минздрава России показал высокую эффективность при различной локализации прогрессирующего невуса хориоидеи. Данная методика является безопасной, хорошо переносится пациентами и позволяет в большинстве случаев сохранить исходную остроту зрения с минимальным количеством осложнений.
Список литературы Опыт лечения прогрессирующего невуса хориоидеи с помощью транспупиллярной термотерапии
- Шилдс Дж.А., Шилдс К.Л. Внутриглазные опухоли: атлас и справочник. М.: Изд-во Панфилова, 2018; 608 с.
- Магарамов Д.А., Яровой А.А., Соломин В. А. Оптимизация методов диагностики и лазерных методов лечения хориоретинальных новообразований. Современные технологии в офтальмологии 2016; (3): 111-5.
- Shields CL, Furuta M, Mashayekhi A, et al. Clinical spectrum of choroidal nevi based on age at presentation in 3422 consecutive eyes. Ophthalmology 2008; 115 (3): 546-52.
- Shields CL, Shields JA, Kiratli H, et al. Risk factors for metastasis of small choroidal melanocytic lesions. Ophthalmology 1995; (102): 1351-61.
- Singh AD, Kalyani P, Topham A. Estimating the risk of malignant transformation of a choroidal nevus. Ophthalmology 2005; (112): 1784-9.
- Naumann GO, Hellner K, Naumann LR. Pigmented nevi of the choroid. Clinical study of secondary changes in the overlying tissue. Trans Am Acad Ophthalmol Otolaryngol 1971; (75): 110-23.
- Zaldivar RA, Aaberg TM, Sternberg P, et al. Clinicopathologic findings in choroidal melanomas after failed transpupillarythermotherapy. American Journal of Ophthalmology 2003; 135 (5): 657-63.
- Магарамов Д.А., Яровой А.А., Логинов PA., Соломин В. А. Отдаленные результаты лазерных методов лечения гемангиомы хориоидеи. Современные технологии в офтальмологии 2017; (1): 176-8.
- Shields CL, Furuta М, Berman EL, et al. Choroidal nevus transformation into melanoma: analysis of 2514 consecutive cases. Arch Ophthalmol 2009; 127 (8): 981-7.
- Oosterhuis JA, Journee-de Korver HG, Keunen JE. Transpupillary thermotherapy: results in 50 patients with choroidal melanoma. Arch Ophthalmol 1998; 116 (2): 157-62.
- ЛинникЛ.Ф., Магарамов Д.А. Трехлетний опыт использования транспупиллярной диодлазерной термотерапии как самостоятельного метода лечения увеальных меланом. Офтальмохирургия 2003; (4): 17-24.


