Опыт применения анти-PD-1-терапии при MMR-дефицитном раке эндометрия
Автор: Чам К.Г., Раскин Г.А., Андабеков Т.Т., Родина М.К., Руткин И.О., Кондрачук Д.М., Винокуров В.Л.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 2 т.8, 2018 года.
Бесплатный доступ
В настоящее время все больше исследований показывают эффективность анти-PD-1-терапии при опухолях с дефицитом системы репарации неспаренных нуклеотидов ДНК (MMR). По разным источникам, дефицит MMR в опухолях при раке бэндометрия определяется в 20-30 % случаев. В данной работе представлен опыт успешного применения иммунотерапии (анти-PD-1) у пациентки с метастатической формой эндометриоидной аденокарциномы тела матки с дефицитом MMR.
Эндометриоидная аденокарцинома, иммунотерапия, анти-pd-1
Короткий адрес: https://sciup.org/140243789
IDR: 140243789 | DOI: 10.18027/2224-5057-2018-8-2-60-63
Текст научной статьи Опыт применения анти-PD-1-терапии при MMR-дефицитном раке эндометрия
Рак тела матки является одним из наиболее распространенных видов злокачественных опухолей в мире, занимая шестое место в структуре онкологической заболеваемости женского населения (4,8%) и первое место – среди всех онкогинекологических опухолей [1]. В 2012 г. было диагностировано 320 тыс. новых случаев этого заболевания, из них 53% приходилось на развитые страны (по данным Globocan 2012, IARC). Его наиболее распространенным гистологическим подтипом является эндометриоидная аденокарцинома, которая относится к I типу рака эндометрия и составляет 70–80% всех случаев рака эндометрия [1, 2]. Ко II типу относятся серозная, светлоклеточная аденокарцинома и карциносаркомы.
Специфические молекулярные генетические изменения были идентифицированы в нескольких исследованиях этих двух разных типов карциномы эндометрия [3–5]. Одним из таких генетических изменений является ми-кросателлитная нестабильность (MSI), которая указывает на дефекты в системе репарации неспаренных нуклеотидов ДНК (MMR) и встречается в 20–30% случаев, связанных с эндометриоидным типом рака эндометрия. Дефицит MMR может выступать как предиктивный биомаркер для использования иммунотерапии, включая ингибиторы контрольных точек [6–8].
Клиническое наблюдение
Пациентка Л. 53 лет, впервые была госпитализирована в отделение радиохирургической гинекологии в декабре 2016 г. с диагнозом: рак тела матки IIIСI стадии (T2CN1MxG3). После обследования выполнен первый
(хирургический) этап лечения в объеме расширенной пангистерэктомии с резекцией большого сальника. По результату гистологического исследования подтвержден низкодифференцированный эндометриоидный рак эндометрия с инвазией в верхнюю треть цервикального канала и метастазами в лимфатические узлы.
После хирургического этапа оперативного лечения больной проведен курс сочетанно-лучевой терапии до СОД=30 Гр на область регионарных лимфоузлов и СОД=70 Гр на слизистую влагалища.
Затем пациентке проведено три курса химиотерапии по схеме паклитаксел 250 мг и карбоплатин 650 мг с интервалом в 21 день (апрель, май, июнь 2017 г.), которые прошли без осложнений. Отмечалось снижение Са-125 с 20,4 до 12,3; РЭА=1,86, а также уменьшение в объеме лимфокисты в левом параметрии.
Через четыре месяца после последней химиотерапии у пациентки возник рецидив в области культи влагалища, других метастатических очагов выявлено не было. Проведен курс брахитерапии двумя овоидами на глубине 0,5 см в дозе 5 Гр; СОД=30 Гр. При цитологическом исследовании после пятого сеанса брахитерапии опухолевых элементов не выявлено. Химиотерапия не проводилась.
Через пять месяцев у пациентки возникло прогрессирование заболевание – внеорганный метастаз. По данным ПЭТ/КТ выявлено забрюшинно в проекции подпеченочного пространства образование, патологически накапливающее РФП, размерами до 6 см в диаметре, SVV=16,4. Пациентке проведено комбинированное лечение: видеолапороскопия, ревизия брюшной полости, удаление внеорганной опухоли с резекцией брыжейки поперечно-ободочной кишки, большого сальника и два курса СХТ-препаратами (дуксиробуцин 60 мг и оксало-платин 150 мг).
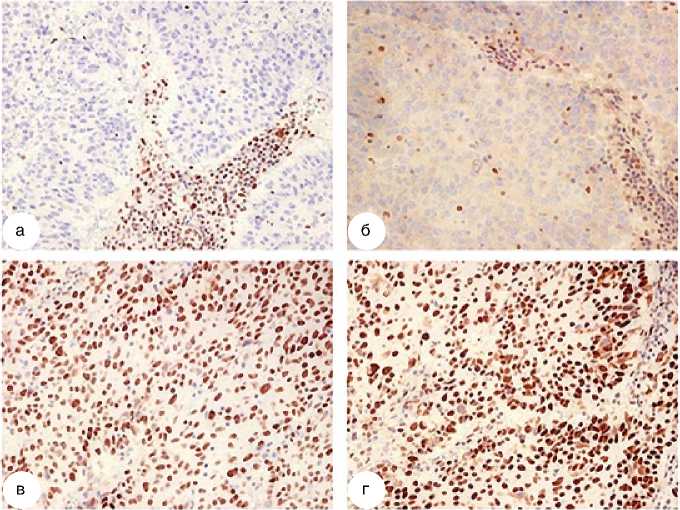
Рисунок 1. Иммуногистохимическое исследование экспрессии генов репарации неспаренных нуклеотидов ДНК (MMR) при эндометриоидной аденокарциноме, х 200
При контрольной компьютерной томографии обнаружено прогрессирование заболевания: выявлено образование в брюшной полости размером 25 мм в максимальном измерении.
После получения результата гистологического заключения внеорганного метастаза обнаружена эндометриоидная аденокарцинома, пациентке проведено иммуноги- стохимическое исследование на предмет состояния генов репарации неспаренных нуклеотидов ДНК (MSH2, MSH6, PMS2, MLH1). В результате исследования выявлен дефицит MMR в виде потери экспрессии опухолевыми клетками MLH1 и PMS2 (рис. 1а, б).
Выявлено выпадение экспрессии PMS2 (рис. 1а) и MLH1 (рис. 1б), сохранная реакция на MSH2, MSH6 (рис. 1в, г).
После шести курсов анти-PD-1-терапии (пембролиз-умаб) по стандартной схеме при контрольной компью-
б
а
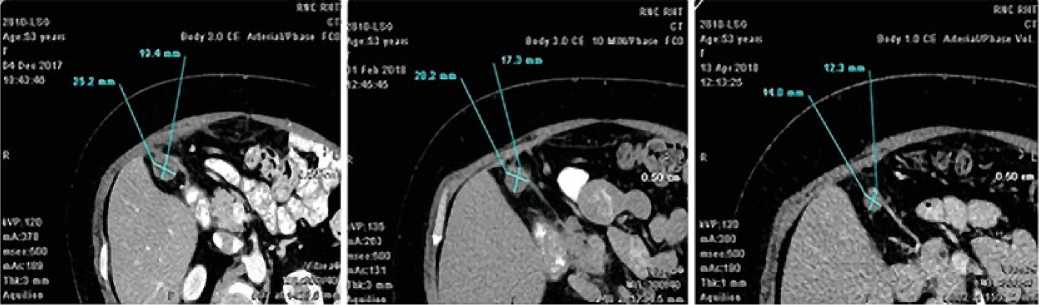
в
Рисунок 2. Компьютерная томография до анти-PD-1-терапии (а); после трех курсов иммунотерапии (б); после шестого курса иммунотерапии (в)
терной томографии размер опухоли уменьшился с 25,2 мм (рис. 2а) до 14,0 мм (рис. 2в), появление новых очагов не отмечено.
Обсуждение
Первоначально молекулярный фенотип MSI был обнаружен в наследственном неполипозном раке толстой кишки (HNPCC), также известном как синдром Линча [9–12]. Наиболее распространенным видом рака, связанным с синдромом Линча, является наследственная колоректальная карцинома, которая составляет 1–3% от всех колоректальных раков, а второй наиболее распространенный тип – наследственный рак эндометрия, на долю которого приходится 2% всех карцином эндометрия [13, 14]. В настоящее время MMR-тестирование используется при выявлении опухолей, связанных с синдромом Линча, поскольку более 90% таких опухолей имеют высокий уровень микросателлитной нестабильности. MSI хорошо зарекомендовала себя как эффективный генетический маркер для выявления синдрома Линча [15].
Многочисленные исследования показывают, что MMR-дефицитные опухоли отличаются высокой чув- ствительностью к иммунотерапии вне зависимости от гистологического типа и локализации опухоли [16, 17]. Данное показание уже зарегистрировано FDA для иммунотерапии любой MMR-дефицитной опухоли и NCCN во второй линии лечения колоректального рака. Однако в России данное показание к иммунотерапии в настоящее время не зарегистрировано. Пациенты, имеющие опухоли и потенциально чувствительные к иммунотерапии, лишены возможности получать эффективное лечение.
Заключение
Таким образом, описанный клинический случай подтверждает необходимость исследования системы репарации неспаренных нуклеотидов ДНК при эндометриоидном раке эндометрия, что позволяет обосновать индивидуализацию и выбор эффективного лечения в случаях прогрессирования опухолевого процесса после стандартных методов лечения. Наличие нарушений MMR может выступать предиктивным фактором для проведения иммунотерапии.
Список литературы Опыт применения анти-PD-1-терапии при MMR-дефицитном раке эндометрия
- Weiderpass E., Labreche F. Malignant tumors of the female reproductive system. Saf. Health Work. 2012. Vol. 3. P. 166-180.
- Bray F., Loos A. H., Oostindier M., Weiderpass E. Geographic and temporal variations in cancer of the corpus uteri: incidence and mortality in pre-and postmenopausal women in Europe. Int. J. Cancer. 2005. Vol. 117. P. 123-131.
- Liu F. S. Molecular carcinogenesis of endometrial cancer. Taiwan J. Obstet. Gynecol. 2007. Vol. 46. P. 26-32.
- Tinelli A., Mezzolla V., Leo G., Pisano M., Storelli F., Alemanno G. et al. Microsatellite instability (MSI) as genomic markers in endometrial cancer: toward scientific evidences. Mini Rev. Med. Chem. 2010. Vol. 10. P. 1356-1365.
- Weigelt B., Banerjee S. Molecular targets and targeted therapeutics in endometrial cancer. Curr. Opin. Oncol. 2012. Vol. 24. P. 554-563.
- Haruko K., Kouji B. et al. New use of microsatellite instability analysis in endometrial cancer (Review). Oncol. Lett. 2017. Vol. 14 (3). P. 3297-3301. Published online on: July 20, 2017.
- Karamurzin Y., Rutgers J. K. DNA mismatch repair deficiency in endometrial carcinoma. Int. J. Gynecol. Pathol. 2009. Vol. 28. P. 239-255.
- Murali R., Soslow R. A., Weigelt B. Classification of endometrial carcinoma: More than two types. Lancet Oncol. 2014. Vol. 15. P. e268-e278.
- Аксель Е. М. Статистика злокачественных новообразований женских половых органов//Опухоли женской репродуктивной системы. 2012. № 1-2. С. 76-80.
- Aksel’ E. M. Statistika zlokachestvennykh novoobrazovanii zhenskikh polovykh organov (Statistics of malignant new growths of female genitals). Opukholi zhenskoi reproduktivnoi sistemy (Tumors of female reproductive system). 2012. No. 1-2. P. 76-80 (In Russ.)
- Meyer L. A., Broaddus R. R., Lu K. H. Endometrial cancer and Lynch syndrome: clinical and pathologic considerations. Cancer Control. 2009. Vol. 16. P. 14-22.
- Zaanan A., Meunier K., Sangar F., Flejou J. F., Praz F. Microsatellite instability in colorectal cancer: from molecular oncogenic mechanisms to clinical implications. Cell. Oncol. (Dordr.). 2011. Vol. 34. P. 155-176.
- Karamurzin Y., Zeng Z., Stadler Z. K., Zhang L., Ouansafi I., Al-Ahmadie H. A. et al. Unusual DNA mismatch repair-deficient tumors in Lynch syndrome: a report of new cases and review of the literature. Hum. Pathol. 2012. Vol. 43. P. 1677-1687.
- Leenen C. H., van Lier M. G., van Doorn H. C., van Leerdam M. E., Kooi S. G., de Waard J. et al. Prospective evaluation of molecular screening for Lynch syndrome in patients with endometrial cancer 70 years. Gynecol. Oncol. 2012. Vol. 125. P. 414-420.
- Van Lier M. G., Wagner A., van Leerdam M. E., Biermann K., Kuipers E. J., Steyerberg E. W. et al. A review on the molecular diagnostics of Lynch syndrome: a central role for the pathology laboratory. J. Cell. Mol. Med. 2010. Vol. 14. P. 181-197.
- Schneider R., Schneider C., Kloor M., Furst A., Moslein G. Lynch syndrome: clinical, pathological, and genetic insights. Langenbecks Arch. Surg. 2012. Vol. 397. P. 513-525.
- Bartley A. N., Luthra R., Saraiya D. S., Urbauer D. L., Broaddus R. R. Identification of cancer patients with Lynch syndrome: clinically significant discordances and problems in tissue-based mismatch repair testing. Cancer Prev. Res. (Philadelphia). 2012. Vol. 5. P. 320-327.
- Le D. T., Uram J. N., Wang H., Bartlett B. R. et al. PD-1 Blockade in tumors with mismatch-repair deficiency. N. Engl. J. Med. 2015. Vol. 372 (26). P. 2509-2520.