Опыт применения ингибитора поли (АДФ-рибозо) полимеразы олапариба в поддерживающей терапии BRCA-ассоциированного рака яичников
Автор: Журман В.Н., Нечушкина В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Цель исследования - определить частоту мутаций генов BRCA1/2 , эффективность лечения рака яичников в зависимости от их наличия и эффективность применения олапариба в поддерживающей терапии BRCA-ассоциированного рака яичников. Материал и методы. В ретроспективный анализ включено 355 пациенток с серозным раком яичников high-grade, I-IV стадий. Обследование на мутацию в гене BRCA1/2 выполнялось в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения». Результаты. Мутации в генах BRCA1/2 выявлены у 98 из 355 (27,6 %) пациенток. Мутации гена BRCA1+ выявлены у 62 из 230 больных раком яичников IIIC-IV стадий (27,0 %), гена BRCA2 - у 9 из 230 (3,9 %). При раке яичников IIIС-IV стадий мутации генов BRCA отсутствовали у 159 из 230 (69,1 %) больных. Медиана времени до прогрессирования при IIIС-IV стадиях заболевания с мутацией в гене BRCA1 составила 22,0 мес, в гене BRCA2 - 27,0 мес, без мутаций в генах ВRCA1/2 - 17,0 мес, медиана продолжительности жизни - 70,0; 65,0 и 45,0 мес соответственно. Пациентки с серозной карциномой яичников high-grade I-IV стадий с мутацией в генах BRCA1/2 были разделены на две группы. Первую группу (6 из 26, 23,1 %) составили пациентки с серозной карциномой яичников high-grade IIIC-IV стадий, получавших олапариб в поддерживающем режиме после 1-й линии химиотерапии, вторую группу (20 из 26, 76,9 %) составили пациентки с серозной карциномой яичников high-grade I-IV стадий, получавших олапариб в поддерживающем режиме после 2-й и более линий химиотерапии. Заключение. Наличие мутаций генов BRCA1/2 значимо увеличило медиану продолжительности жизни пациенток с серозным раком яичников IIIC-IV стадий, а выполнение первичной циторедукции значимо улучшало общую выживаемость и выживаемость до прогрессирования. Поддерживающая терапия олапарибом более целесообразна после 1-й линии лечения, нежели после последующих.
Рак яичников, brca1/2 мутация, олапариб, общая выживаемость, выживаемость без прогрессирования
Короткий адрес: https://sciup.org/140297842
IDR: 140297842 | УДК: 618.11-006.6-08 | DOI: 10.21294/1814-4861-2023-22-1-35-42
Текст научной статьи Опыт применения ингибитора поли (АДФ-рибозо) полимеразы олапариба в поддерживающей терапии BRCA-ассоциированного рака яичников
Aim to study the frequency of BRCA1/2 gene mutations , the efficacy of ovarian cancer therapy depending on the presence of BRCA1/2 mutations as well as the efficacy of olaparib maintenance therapy in BRCA-associated ovarian cancer. Material and Methods. The retrospective analysis included 355 patients with high-grade, stage Ӏ–IV serous ovarian cancer. The examination for a mutation in the BRCA1/2 gene was carried out within the framework of the program “Improvement of molecular genetic diagnostics in the Russian Federation in order to increase the effectiveness of antitumor treatment”. Results. Mutations in the BRCA1/2 genes were detected in 98 out of 355 (27.6 %) patients. Mutations of the BRCA1+ gene were detected in 62 out of 230 patients with ovarian cancer of stages IIIC–IV (27.0 %), the BRCA2 gene – in 9 out of 230 (3.9 %). In ovarian cancer of stages III–IV, BRCA gene mutations were absent in 159 of 230 (69.1 %) patients. The median time to progression in stages III–IV of the disease with a mutation in the BRCA1 gene was 22.0 months, in the BRCA2 gene – 27.0 months, in patients without mutations in the BRCA1/2 genes – 17.0 months, median life expectancy – 70.0; 65.0 and 45.0 months, respectively. Patients with serous ovarian carcinoma of high-grade I–IV stages with the presence of mutations in the BRCA1/2 genes were divided into two groups. The first group (6 out of 26 patients, 23.1 %) consisted of patients with stage IIIC–IV high-grade serous ovarian carcinoma, who received olaparib as maintenance therapy after the 1st line of chemotherapy, the second group (20 out of 26 patients, 76.9 %) were patients with stage I–IV high-grade serous ovarian carcinoma, who received olaparib in maintenance mode after 2 or more lines of chemotherapy. Conclusion. The presence of BRCA1/2 gene mutations significantly increased the median life expectancy of patients with stage IIIC–IV serous ovarian cancer, and primary cytoreduction significantly improved both overall survival and survival to progression in this group of patients. Maintenance therapy with olaparib is more appropriate after the 1st line of treatment than after subsequent ones.
Введение. Несмотря на имеющийся арсенал противоопухолевых лекарственных препаратов, результаты лечения распространенных форм рака яичников остаются неудовлетворительными. Около 10–15 % больных раком яичников имеют мутацию в генах BRCA1/2, при серозной карциноме высокой степени злокачественности (high-grade) – до 50 % [1, 2]. В нормально функционирующей клетке продукты этих генов задействованы в синтезе белков, контролирующих репарацию двухцепочечных повреждений ДНК для стабильного состояния генома и предотвращения накопления ошибок. Изменение функциональности генов BRCA приводит к сбою контроля клеточного деления и перерождению клетки в злокачественную. Наиболее чувствительными к таким изменениям экспрессии генов являются клетки молочной железы и яичников [3, 4]. Большинство из более чем 9000 полиморфизмов генов BRCA не оказывают значительного влияния на вероятность развития рака. К вызывающим малигнизацию клеток относят более 3500 однонуклеотидных полиморфизмов (Single Nucleotide Polymorphism, SNP) [5, 6]. Мутации в генах BRCA могут быть соматическими или герминальными. Носители герминальных мутаций BRCA1/2 имеют повышенный риск развития рака молочной железы, яичников и некоторых других новообразований [7–9]. При соматических мутациях нарушение функции генов BRCA проявляется на уровне одной клетки, которая впоследствии может дать начало опухоли. ПАРП-ингибиторы лишают опухолевые клетки механизма восстановления одноцепочечных разрывов ДНК, что способствует их гибели [10]. Клетки опухоли яичников, содержащие вариабельные гены BRCA, особенно чувствительны к ПАРП-ингибиторам, в частности к олапарибу [11–14].
Целью исследования является изучение частоты мутаций генов BRCA1/2 , эффективности лече-
Таблица 1/table 1
Частота мутаций генов BRCA1/2 при серозной карциноме яичников high-grade
Frequency of BRCA1/2 mutations in high-grade serous ovarian carcinoma
Материал и методы
В ретроспективный анализ включено 355 пациенток с гистологически подтвержденным серозным раком яичников high-grade I–IV стадий, получавших лечение в Приморском краевом онкологическом диспансере в период с 2016 по 2021 г. Обследование на мутацию в генах BRCA1/2 выполнялось в рамках программы «Совершенствование молекулярно-генетической диагностики в Российской Федерации с целью повышения эффективности противоопухолевого лечения» на базе референсной лаборатории (лаборатория фармакогеномики, Институт химической биологии и фундаментальной медицины СО РАН) методом секвенирования нового поколения (NGS – Next Generation Sequencing) и методом полимеразной цепной реакции (ПЦР) на базе лаборатории Приморского краевого онкологического диспансера. Методом NGS обследовано 322 (90,7 %) пациентки, методом ПЦР ‒ 33 (9,3 %) из 355 пациенток. Пациентки с серозной карциномой яичников high-grade I‒IV стадий с наличием мутации в генах BRCA1/2 были разделены на 2 группы:
‒ первую группу составили пациентки с серозной карциномой яичников high-grade III‒IV стадий, получавшие олапариб в поддерживающем режиме после 1-й линии платиносодержащей химиотерапии при полном или частичном ответе (6 из 26; 23,1 %);
‒ во вторую группу вошли пациентки с серозной карциномой яичников high-grade I‒IV стадий (20 из 26; 76,9 %), получавшие олапариб в поддерживающем режиме после 2-й и более линий лечения при полном или частичном ответе на платиносодержащую химиотерапию.
Полученные параметры обрабатывались с помощью стандартных методов статистического анализа с использованием программы «IBM SPSS Statistics 26».
Результаты
В период с 2016 по 2021 г. обследованы 355 пациенток с серозной карциномой яичников highgrade на наличие мутаций генов BRCA1/2 . Из них у 257 (72,4 %) мутаций не обнаружено, у 98 (27,6 %) мутации были выявлены. Рак яичников I стадии был диагностирован у 19,7 %, II стадии – у 8,2 %, III стадии – у 53,8 % и IV стадии – у 18,3 % (табл. 1). Таким образом, у 86 из 98 (87,8 %) пациенток с BRCA-ассоциированной серозной карциномой яичников high-grade определялась мутация гена BRCA1 , у 12 (12,2 %) – мутация гена BRCA2 . Наиболее частая мутация c.5266dupC отмечена у 46,5 % пациенток с мутацией гена BRCA1 . Частота мутаций c.4035delA, c.68_69delAG и с.1961delA составила 10,5; 5,8 и 4,6 % соответственно. У BRCA2-положительных носителей чаще всего встречалась делеция с.6174delT (41,7 % пациенток).
Наибольшую долю в исследовании составили пациентки с серозным раком яичников high-grade IIIС–IV стадией (n=229), из них мутации гена BRCA1 выявлены у 68 (29,7 %), гена BRCA2 – у 10 (4,4 %), отсутствовали мутации у 178 (77,7 %). Медиана времени до прогрессирования (ВДП) у пациенток с мутациями гена BRCA1 составила 22,0 ± 3,1 мес, гена BRCA2 – 27,0 ± 7,3 мес, без мутаций – 17,0 ± 1,1 мес (р>0,05; рис. 1). Медиана продолжительности жизни (ПЖ) пациенток с мутациями гена BRCA1 составила 70,0 ± 10,6 мес, гена BRCA2 – 65,0 ± 8,4 мес, без мутаций – 45,0 ± 5,2 мес (рис. 2). Отмечены значимые различия общей выживаемости пациенток с мутациями гена BRCA1 и без мутаций генов BRCA1/2 (р=0,004).
Если на первом этапе лечения рака яичников IIIС–IV стадий была проведена неоадъювантная химиотерапия, медианы ПЖ и ВДП составили при наличии мутации генов BRCA1/2 – 62,0 ± 6,0 и 16,0 ± 2,84 мес, в отсутствие мутаций – 35,0 ± 3,2 и 15,0 ± 1,5 мес. Выполнение первичной циторедукции значимо улучшало медианы ПЖ и ВДП при наличии мутаций генов BRCA1/2 – 107,0 ± 26,3 и 26,0 ± 2,1 мес соответственно (р=0,01, при сравнении с аналогичными показателями в группе неоадъювантной химиотерапии). Медианы ПЖ и
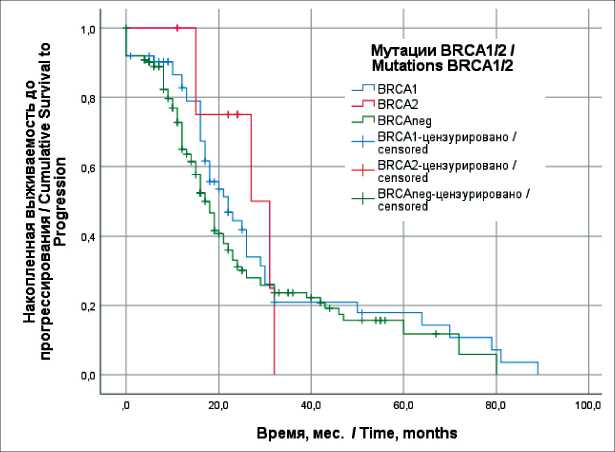
Рис. 1. Выживаемость до прогрессирования у пациенток с серозным раком яичников high-grade ІІІС–IV стадий в зависимости от наличия мутаций генов BRCA 1/2 (метод Каплана–Мейера)
Fig. 1. Survival to progression in patients with stage III–IV highgrade serous ovarian cancer according to BRCA 1/2 gene mutation status (Kaplan–Meyer method)
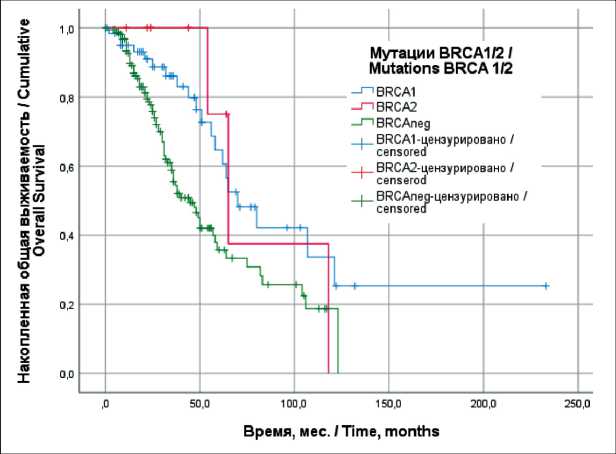
Рис. 2. Общая выживаемость пациенток с серозным раком яичников high-grade IIIС–IV стадий в зависимости от наличия мутаций генов BRCA 1/2 (метод Каплана–Мейера)
Fig. 2. Overall survival of patients with s stage III–IV high-grade serous ovarian cancer by BRCA 1/2 gene mutation status (Kaplan–Meyer method)
ВДП при раке яичников IIIC–IV стадий в отсутствие мутаций после первичной циторедукции составили 50,0 ± 7,2 мес и 19,0 ± 1,4 мес и значимо не отличались от аналогичных показателей в группе неоадъювантной химиотерапии (табл. 2).
При полной или оптимальной первичной циторедукции медиана ВДП была значимо выше (на 3 мес) только у пациенток с мутацией BRCA1 (p=0,04) по сравнению с больными без мутаций в генах BRCA1/2. Отмечается тенденция лучшей медианы продолжительности жизни у пациенток с наличием мутации BRCA1 – 121,0 мес, у пациенток без мутаций в генах BRCA1/2 – 59,0 мес, однако различия незначимы (р=0,12). У пациенток с первичной циторедукцией в неоптимальном объеме отмечаются значимо лучшие показатели медианы времени до прогрессирования при наличии мутации в гене BRCA1 – 25,0 мес, у пациенток без мутаций в генах BRCA1/2 – 18,0 мес (р=0,04). При полной/оптимальной первичной циторедукции отмечена тенденция к увеличению медианы ПЖ как в группе в целом, так и в подгруппах по сравнению с больными с неоптимальной первичной циторедукцией, однако различия незначимы. В то же время при анализе ВБП отмечено значимое ее улучшение при полной/оптимальной первичной циторедукции в группе в целом (24,0 ± 2,0 vs 18,0 ± 0,9 мес, р=0,02), а также у больных без мутаций генов BRCA1/2 (23,0 ± 2,6 vs 18,0 ± 2,2 мес, р=0,04) (табл. 3).
В табл. 4 представлены результаты анализа лечения пациенток с интервальной циторедукцией, большинству из них выполнена неоптимальная циторедукиция. Отмечено значимое увеличением медианы ВДП при полной/оптимальной первичной циторедукции в группе в целом (29,0 ± 9,0 vs 15,0 ± ± 1,6 мес, р=0,02), а также у больных без мутаций генов BRCA1/2 (20,0 ± 20,1 vs 13,0 ± 1,3 мес, р=0,03).
Из 98 пациенток с серозной карциномой яичников high-grade I‒IV стадий, у которых были выявле-
Таблица 2/table 2
Продолжительность жизни и время до прогрессирования при серозном раке яичников high-grade IIIС–IV стадий в зависимости от типа операции и мутации BRCA1/2
life expectancy and time to progression in patients with s stage III–IV high-grade serous ovarian cancer according to the type of surgery and BRCA1/2 mutation status
|
Мутации/ Mutations |
ПЦР/PCR |
ИЦР/ICR |
р |
||
|
Медиана ВДП, мес/ Median time to progress, month |
Медиана ПЖ, мес/ Median life expectancy, months |
Медиана ВДП, мес/ Median time to progress, month |
Медиана ПЖ, мес/ Median life expectancy, months |
||
|
Гены BRCA1/2 / BRCA1/2 genes |
26,0 ± 2,1 |
107,0 ± 26,3 |
16,0 ± 2,4 |
62,0 ± 6,0 |
0,01 (ВБП/PFS) 0,01 (ОВ/OS) |
|
Не выявлены/ Not identified |
19,0 ± 1,4 |
50,0 ± 7,2 |
15,0 ± 1,5 |
35,0 ± 3,2 |
0,14 (ВБП/PFS) 0,07 (ОВ/OS) |
|
Всего/Total |
21,0 ± 1,4 |
70,0 ± 13,3 |
16,0 ± 0,8 |
48,0 ± 9,2 |
0,01 (ВБП/PFS) 0,01 (ОВ/OS) |
Таблица 3/table 3
Продолжительность жизни и время до прогрессирования при серозном раке яичников high-grade IIIС–IV стадий в зависимости от вида первичной циторедукции и наличия мутаций генов BRCA1/2 life expectancy and time to progression in patients with s stage III–IV high-grade serous ovarian cancer according to the type of primary cytoreduction and the presence of BRCA1/2 gene mutations
|
Медиана ПЖ, мес/ Median life expectancy, months |
Медиана ВБП, мес/ |
||||
|
Мутации/Mutations |
n |
pª |
Median time without progression, months |
pª |
Первичная циторедукция полная и оптимальная/Primary cytoreduction is complete and optimal
Notes: ª – when comparing similar values in groups of full/optimal and non-optimal cytoreduction; ᵇ – values cannot be calculated due to the small number of uncensored observations.
Таблица 4/table 4
Продолжительность жизни и время до прогрессирования при серозном раке яичников high-grade IIIС–IV стадий в зависимости от вида интервальной циторедукции и наличия мутаций генов BRCA1/2 life expectancy and time to progression in patients with stage III–IV high-grade serous ovarian cancer according to the type of interval cytoreduction and the presence of BRCA1/2 gene mutations
|
Мутации/Mutations |
n |
Медиана ПЖ, мес/ Median life expectancy months |
pª |
Медиана ВБП, мес/ Median time without progression months |
pª |
|
Интервальная циторедукция |
полная и оптимальная/Interval cytoreduction is |
complete and optimal |
|||
|
Ген BRCA1+/ The BRCA1+ gene |
4 |
56,0 ± 9,2 |
0,49 |
16,0 ± 9,5 |
0,32 |
|
Ген BRCA2+/ The BRCA2+ gene |
1 |
–ᵇ |
–ᵇ |
–ᵇ |
–ᵇ |
|
Не выявлены/Not identified |
8 |
31,0 ± 21,9 |
0,22 |
20,0 ± 20,1 |
0,03 |
|
Всего/Total |
13 |
56,0 ± 9,0 |
0,17 |
29,0 ± 9,0 |
0,02 |
|
Интервальная циторедукция неоптимальная/Interval cytoreduction |
is suboptimal |
||||
|
Ген BRCA1+/ The BRCA1+ gene |
16 |
62,0 ± 19,9 |
0,49 |
13,0 ± 2,8 |
0,32 |
|
Ген BRCA2+/ The BRCA2+ gene |
5 |
65,0 ± 8,4 |
–ᵇ |
27,0 ± 13,1 |
–ᵇ |
|
Не выявлены/Not identified |
47 |
35,0 ± 3,1 |
0,22 |
13,0 ± 1,3 |
0,03 |
|
Всего/Total |
68 |
38,0 ± 8,8 |
0,17 |
15,0 ± 1,6 |
0,02 |
Список литературы Опыт применения ингибитора поли (АДФ-рибозо) полимеразы олапариба в поддерживающей терапии BRCA-ассоциированного рака яичников
- Lee M.V., Katabathina V.S., Bowerson M.L., Mityul M.I., Shetty A.S., Elsayes K.M., Balachandran A., Bhosale P.R., McCullough A.E., Menias C.O. BRCA-associated Cancers: Role of Imaging in Screening, Diagnosis, and Management. Radiographics. 2017; 37(4): 1005-23. https://doi.org/10.1148/rg.2017160144.
- Human Genome Variation Society [Internet]. [cited 2019 Sep 30]. URL: https://www.hgvs.org.
- Huang Y.W. Association of BRCA1/2 mutations with ovarian cancer prognosis: An updated meta-analysis. Medicine (Baltimore). 2018; 97(2): 9380. https://doi.org/10.1097/MD.0000000000009380.
- Tung N.M., Garber J.E. BRCA1/2 testing: therapeutic implications for breast cancer management. Br J Cancer. 2018; 119(2): 141-52. https://doi.org/10.1038/s41416-018-0127-5.
- Dalton H.J., Coleman R.L. New biologic frontiers in ovarian cancer: Olaparib and PARP inhibition. Am J Hematol Oncol. 2015; 11(5): 5-12.
- Kechin A.A., Boyarskikh U.A., Ermolenko N.A., Tyulyandina A.S., Lazareva D.G., Avdalyan A.M., Tyulyandin S.A., Kushlinskii N.E., Filipenko M.L. Loss of Heterozygosity in BRCA1 and BRCA2 Genes in Patients with Ovarian Cancer and Probability of Its Use for Clinical Classification of Variations. Bull Exp Biol Med. 2018; 165(1): 94-100. https://doi.org/10.1007/s10517-018-4107-9.
- Hamel N., Feng B.J., Foretova L., Stoppa-Lyonnet D., Narod S.A., Imyanitov E., Sinilnikova O., Tihomirova L., Lubinski J., Gronwald J., Gorski B., Hansen Tv., Nielsen F.C., Thomassen M., Yannoukakos D., Konstantopoulou I., Zajac V., Ciernikova S., Couch F.J., Greenwood C.M., Goldgar D.E., Foulkes W.D. On the origin and diffusion of BRCA1 c.5266dupC (5382insC) in European populations. Eur J Hum Genet. 2011; 19(3): 300-6. https://doi.org/10.1038/ejhg.2010.203.
- Huang K.L., Liu Y.L., Hsu Y.Y., Kuo W.L. Retrospective Analysis of Clinicopathological Features and Familial Cancer History of Synchronous Bilateral Breast Cancer. Healthcare (Basel). 2021; 9(9): 1203. https://doi.org/10.3390/healthcare9091203.
- Bateneva E.I., Meshcheryakov A.A., Krokhina O.V., Petrovskii A.V., Ragimov A.A., Kadochnikova V.V., Trofimov D.Yu., Lyubchenko L.N. Odnonukleotidnye polimorfizmy: rol' v razvitii raka molochnoi zhelezy i perspektivy klinicheskogo primeneniya. Malignant Tumours 2015; 2: 3-12. https://doi.org/10.18027/2224-5057-2015-2-3-12.
- Underhill C., Toulmonde M., Bonnefoi H. A review of PARP inhibitors: from bench to bedside. Ann Oncol. 2011; 22(2): 268-79. https://doi.org/10.1093/annonc/mdq322.
- Anastasia P.J. Olaparib in Epithelial Ovarian Cancer. J Adv Pract Oncol. 2016; 7(7): 756-61.
- Farmer H., McCabe N., Lord C.J., Tutt A.N., Johnson D.A., Richardson T.B., Santarosa M., Dillon K.J., Hickson I., Knights C., Martin N.M., Jackson S.P., Smith G.C., Ashworth A. Targeting the DNA repair defect in BRCA mutant cells as a therapeutic strategy. Nature. 2005; 434(7035): 917-21. https://doi.org/10.1038/nature03445.
- Bryant H.E., Schultz N., Thomas H.D., Parker K.M., Flower D., Lopez E., Kyle S., Meuth M., Curtin N.J., Helleday T. Specific killing of BRCA2-deficient tumours with inhibitors of poly(ADP-ribose) polymerase. Nature. 2005; 434(7035): 913-7. https://doi.org/10.1038/nature03443. Erratum in: Nature. 2007; 447(7142): 346.
- Evers B., Drost R., Schut E., de Bruin M., van der Burg E., Derksen P.W., Holstege H., Liu X., van Drunen E., Beverloo H.B., Smith G.C., Martin N.M., Lau A., O’Connor M.J., Jonkers J. Selective inhibition of BRCA2-deficient mammary tumor cell growth by AZD2281 and cisplatin. Clin Cancer Res. 2008; 14(12): 3916-25. https://doi.org/10.1158/1078-0432.CCR-07-4953.
- Tyulyandin S.A., Kolomiets L.A., Morkhov K.Yu., Nechushkina V.M., Pokataev I.A., Rumyantsev A.A., Tyulyandina A.S., Urmancheeva A.F., Khokhlova S.V. Prakticheskie rekomendatsii po lekarstvennomu lecheniyu raka yaichnikov, pervichnogo raka bryushiny i raka matochnykh trub. Zlokachestvennye opukholi: Prakticheskie rekomendatsii RUSSCO. 2021; 11(3s2): 164-76. https://doi.org/10.18027/2224-5057-202111-3s2-10.
- Tyulyandina A., Kekeeva T., Karaseva V., Gorbunova V., Kolomiets L., Filipenko M., Demidova I., Lyubchenko L., Imianitov E., Cherdyntseva N., Moliaka Y., Vodolazhky D., Andreev S., Statsenko G., Saevets V., Khokhlova S., Tkachenko S., Koroleva I., Lisyanskaya A., Tjulandin S. Comprehensive analysis of germline and somatic BRCA1/2 mutations in ovarian cancer population: Interim analysis of OVATAR prospective study. J. Clin. Oncol. 2017. 35(15).
- Tyulyandina A., Harrison D., Yin W., Stepanova E., Kochenkov D., Solomko E., Peretolchina N., Daeyaert F., Joos J.B., Van Aken K., Byakhov M., Gavrilova E., Tjulandin S., Tsimafeyeu I. Alofanib, an allosteric FGFR2 inhibitor, has potent effects on ovarian cancer growth in preclinical studies. Investigational new drugs. 2017; 35(2): 127-133. https://doi.org/10.1007/s10637-016-0404-1.
- Banerjee S., Moore K.N., Colombo N., Scambia G., Kim B.G., Oaknin A., Friedlander M., Lisyanskaya A., Floquet A., Leary A., Sonke G.S., Gourley C., Oza A., González-Martín A., Aghajanian C., Bradley W.H., Holmes E., Lowe E.S., DiSilvestro P. Maintenance olaparib for patients with newly diagnosed advanced ovarian cancer and a BRCA mutation (SOLO1/GOG 3004): 5-year follow-up of a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2021; 22(12): 1721-31. https://doi.org/10.1016/S1470-2045(21)00531-3. Erratum in: Lancet Oncol. 2021; 22(12): 539.
- Poveda A., Floquet A., Ledermann J.A., Asher R., Penson R.T., Oza A.M., Korach J., Huzarski T., Pignata S., Friedlander M., Baldoni A., Park-Simon T.W., Tamura K., Sonke G.S., Lisyanskaya A., Kim J.H., Filho E.A., Milenkova T., Lowe E.S., Rowe P., Vergote I., Pujade-Lauraine E.; SOLO2/ENGOT-Ov21 investigators. Olaparib tablets as maintenance therapy in patients with platinum-sensitive relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a final analysis of a doubleblind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol. 2021; 22(5): 620-31. https://doi.org/10.1016/S1470-2045(21)00073-5.
- Kaufman B., Shapira-Frommer R., Schmutzler R.K., Audeh M.W., Friedlander M., Balmaña J., Mitchell G., Fried G., Stemmer S.M., Hubert A., Rosengarten O., Steiner M., Loman N., Bowen K., Fielding A., Domchek S.M. Olaparib monotherapy in patients with advanced cancer and a germline BRCA1/2 mutation. J Clin Oncol. 2015; 33(3): 244-50. https://doi.org/10.1200/ JCO.2014.56.2728.
- Audeh M.W., Carmichael J., Penson R.T., Friedlander M., Powell B., Bell-McGuinn K.M., Scott C., Weitzel J.N., Oaknin A., Loman N., Lu K., Schmutzler R.K., Matulonis U., Wickens M., Tutt A. Oral poly(ADP-ribose) polymerase inhibitor olaparib in patients with BRCA1 or BRCA2 mutations and recurrent ovarian cancer: a proof-of-concept trial. Lancet. 2010; 376(9737): 245-51. https://doi.org/10.1016/S0140-6736(10)60893-8.


