Опыт применения нейрофизиологического мониторинга при нейрохирургических операциях
Автор: Васяткина Анна Геннадьевна, Левин Е.А., Кобозев В.В., Орлов К.Ю.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 3 т.20, 2016 года.
Бесплатный доступ
Цель Оценка эффективности методов нейромониторинга с точки зрения предотвращения послеоперационных неврологических дисфункций и прогностической значимости интраоцерационных изменений мониторируемых показателей. Методы В ретроспективном исследовании рассмотрено 240 пациентов, оперированных в 2014-2015 гг. с применением рнтраоперацронного нейромониторинга, из которых у 173 имелись объемные образования полушарий головного мозга, а у 67 - стволовой и парастволовой локализации. Соматосенсорные вызванные потенциалы мониторировались в 152, зрительные - 32, акустические стволовые - 22, транскраниальные моторные - 36 случаях. В 69 случаях проводилось стимуляционное картирование моторной коры, в 27 - идентификация черепных нервов; электрокортикограмма регистрировалась у 7 пациентов, 3 из них пробуждали во время операции для картирования речевых функций. Результаты Соматосенсорные вызванные потенциалы показали низкую чувствительность (33%), но достаточно высокую специфичность (82%) в отношении моторных дисфункций. Для зрительных и моторных вызванных потенциалов при соблюдении требуемых параметров анестезии эти характеристики приближалась к 100%. В отношении предотвращения послеоперационных дисфункций наиболее эффективными являлись методы стимуляционного картирования функционально значимых областей (моторных и речевых) и двигательных проводников. Заключение Интраоперационный нейромониторинг позволяет снизить число неврологических осложнений при нейрохирургических операциях. При вмешательствах, во время которых можно затронуть моторные центры и проводники, метод соматосенсорных вызванных потенциалов демонстрирует недостаточную чувствительность, вследствие чего необходим мультимодальный мониторинг, сочетающий соматосенсорные вызванные потенциалы с регистрацией моторных ответов при транскраниальной и/или прямой электрической стимуляции. Для успешности нейромониторинга необходимо отлаженное взаимодействие нейрофизиологов с нейрохирургами и анестезиологами.
Интраоперационный нейромониторинг, сенсорные вызванные потенциалы, моторные вызванные потенциалы, электроэнцефалография, электромиография
Короткий адрес: https://sciup.org/142140749
IDR: 142140749 | DOI: 10.21688-1681-3472-2016-3-108-117
Текст научной статьи Опыт применения нейрофизиологического мониторинга при нейрохирургических операциях
Интраоперационный нейромониторинг — непрерывное наблюдение за состоянием структур нервной системы для своевременного обнаружения опасных отклонений от исходного уровня функционирования во время оперативного вмешательства. Основной целью интраопера-
ционного нейромониторинга является предотвращение неврологического дефицита. Несмотря на достигнутый за последнее десятилетие прогресс в нейронавигацион-ных методиках [1], интраоперационный нейромониторинг сохраняет значимость, поскольку во многих случаях

Статья доступна по лицензии Creative Commons Attribution 4.0.
Таблица 1 Модальности интраоперационного нейромониторинга, применяемые при нейрохирургических операциях различной локализации.
|
Локализация операционного поля |
ССВП |
Модальности нейромониторинга |
ЭКоГ |
|||||||
|
ССВП РП |
ЭМГ |
МВП |
ПС |
TOF |
АСВП |
ЗВП |
ЭЭГ |
|||
|
Спинной мозг |
** |
** |
** |
** |
||||||
|
Ствол головного мозга |
* |
* |
* |
* |
* |
* |
* |
|||
|
Мостомозжечковый угол |
** |
* |
* |
** |
** |
* |
||||
|
Слуховые нервы |
** |
* |
||||||||
|
Лицевые нервы |
** |
* |
* |
** |
* |
|||||
|
Соматосенсорная кора |
** |
* |
* |
|||||||
|
Моторная кора |
* |
* |
* |
** |
** |
* |
* |
|||
|
Речевые зоны |
** |
* |
** |
|||||||
|
Зрительные нервы, область хиазмы |
** |
* |
||||||||
|
Вне функционально значимых зон |
* |
* |
* |
|||||||
Примечание. ССВП — соматосенсорные вызванные потенциалы; ССВП РП — кортикографические ССВП с реверсией паттерна; ЭМГ — электромиограмма; МВП — моторные вызванные потенциалы (транскраниальная электрическая стимуляция); ПС — прямая стимуляция коры и/или черепных нервов; TOF — тест «четырехкратная стимуляция» (train of four); АСВП — акустические стволовые вызванные потенциалы (коротколатентные); ЗВП — зрительные вызванные потенциалы; ЭЭГ — электроэнцефалограмма; ЭКоГ — электрокортикограмма. Использование нейромониторинга данной модальности при этой локализации нейрохирургического вмешательства:
** — необходимо; * — может потребоваться, в зависимости от особенностей конкретной операции
Таблица 2 Основные параметры регистрации при различных модальностях интраоперационного нейромониторинга.
Модальности нейромониторинга
|
Параметр |
ССВП (n. medianus) |
ССВП (n. tibialis) |
МВП |
ПС |
TOF |
АСВП |
ЗВП |
|
Число усреднений |
70–100 |
100–150 |
1–5 |
– |
– |
1 000 – 2 000 |
100 |
|
Макс. длительность стимуляции, с |
без ограничений |
без ограничений |
5 |
5 |
2 |
без ограничений |
без ограничений |
|
Частота стимуляции, Гц |
1–5 * |
1–4 * |
0,5–2 ** |
0,5–2 ** |
2 |
10–20 * |
0,7–1,3 * |
|
Интенсивность стимула, мА |
5–20 |
5–40 |
30–150 |
2–30 *** |
5–20 |
60–70 # |
|
|
Макс. напряжение между стимулир. электродами, В |
150 |
150 |
300 |
80 |
150 |
– |
– |
|
Длительность импульса, мкс |
200–500 |
200–500 |
200–500 |
200–500 |
200 |
– |
– |
|
Расположение стимулирующих электродов |
запястья (n. medianus) |
лодыжки (n. tibialis) |
C4/C3–Cz (руки), Cz–Fz, C2/ C1–Cz (ноги) |
в операционном поле |
запястья (n. medianus), лодыжки (n. tibialis) |
– |
– |
|
Регистрирующие электроды |
CP3, CP4 |
CPz, CP1, CP2 |
биполярные электроды ## |
A1, A2 |
O1/O2; O1/O2, Oz |
||
|
Референтный электрод |
Fz |
Fz |
Cz |
Fz; A1/A2 |
|||
|
Анализируемые пики ВП |
N20, P25 |
P40, N50 |
– |
– |
– |
III, V, V–III |
P100 |
Примечание. См. обозначения в табл. 1.
* — желательно, чтобы 50 Гц не было кратно выбранной частоте стимуляции; ** — приведена частота для серий импульсов; каждая серия состоит из 4–7 импульсов длительностью 200–500 мкс с интервалом между импульсами около 4 мс; *** — при прямой стимуляции нерва интенсивность стимуляции 2–6 мА, при прямой стимуляции коры — 5–30 мА; # — интенсивность звуковых стимулов приведена в децибелах над порогом слышимости (определяется до операции); ## — биполярные миографические электроды размещаются, в зависимости от задач мониторинга, в мышцах лица (orbicularis oculi и oris, zigomaticus), конечностей (abd. pollicis, abd. digiti minimi, biceps, triceps, abd. hallucis, tibialis anterior, gastrocnemius), сфинктерах и др.; для теста TOF, как правило, используются m. abd. pollicis и/или m. abd. hallucis
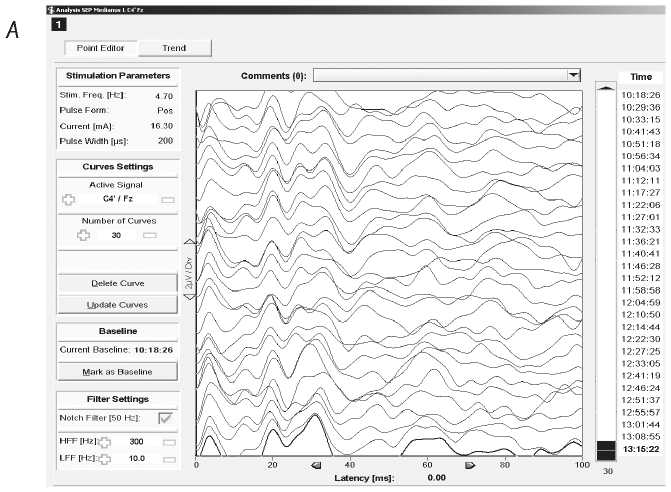
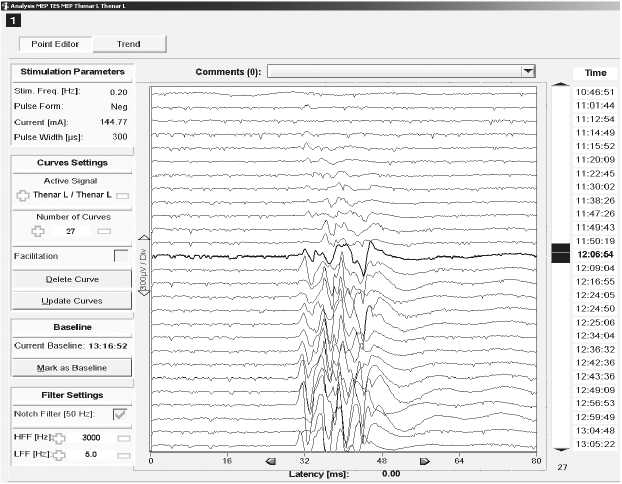
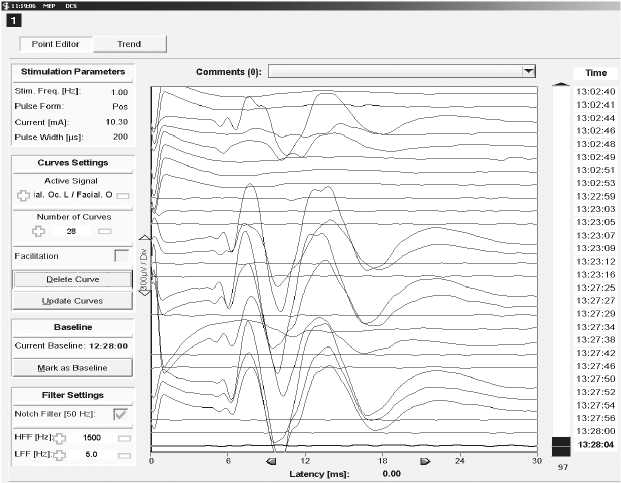
Рис. 1. Соматосенсорные (ССВП) и моторные (МВП) вызванные потенциалы, стимуляционная электромиография
Примечание. A, B — пациент В., 59 лет, удаление кавернозной мальформации в области правого таламуса. A — ССВП. Ток стимуляции 16 мА, длительность импульса 200 мкс, частота 4,7 Гц, 70 усреднений. Показаны ССВП с отведения C4'–Fz при стимуляции левой руки. B — МВП при транскраниальной стимуляции. Ток 145 мА, длительность импульса 300 мкс, импульсы подавались сериями по 5 с интервалом 4 мс внутри серии. Показан ответ m. abductor pollicis brevis слева на стимуляцию парой электродов C4–C3. Во время операции характеристики ССВП не отклонялись существенно от базовых, на МВП амплитуды ответов увеличивались по мере уменьшения глубины нервно-мышечной блокады. Моторных и сенсорных нарушений после операции не выявлено;
-
C, D — пациент Т., 39 лет, удаление невриномы левого мостомозжечкового угла. Ответы мышц orbicularis oculi, orbicularis oris, zygomaticus мониторировались при электрической стимуляции операционного поля с целью идентификации лицевого нерва (ток стимуляции 8–10 мА, длительность импульса 200 мкс, частота 0,5–1 Гц). C — ответы m. orbicularis oculi слева; D — уровень нервно-мышечной блокады контролировался с помощью теста TOF, стимулировался n. medianus, ответы регистрировались с m. abductor pollicis brevis. После идентификации лицевого нерва хирургическая тактика модифицирована с учетом его локализации, удаление опухоли субтотальное. Моторных и сенсорных нарушений после операции не выявлено
Fig. 1. Somatosensory (SSEP) and motor (MEP) evoked potentials, stimulation electromyography.
-
(C, D) Patient T., 39 years old, resection of neurinoma of the left cerebello-pontine angle. The responses of orbicularis oculi, orbicularis oris, zygomaticus muscles were monitored, with the surgical area stimulated electrically in order to identify the facial nerve (stimulation current 8-10 mA, pulse duration 200 µs, frequency 0.5 – 1 Hz. (C) m. orbicularis oculi responses on the left; (D) The level of myoneural block was monitored by using TOF test, n. medianus was stimulated, the responses were registered with m. abductor pollicis brevis). Following the identification of the facial nerve, surgical tactics was modified with allowance made for its localization, resection of the tumor was subtotal. There were no postoperative motor and sensory disorders.
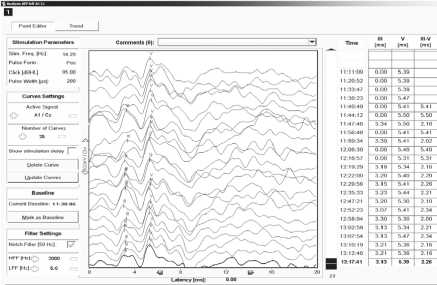
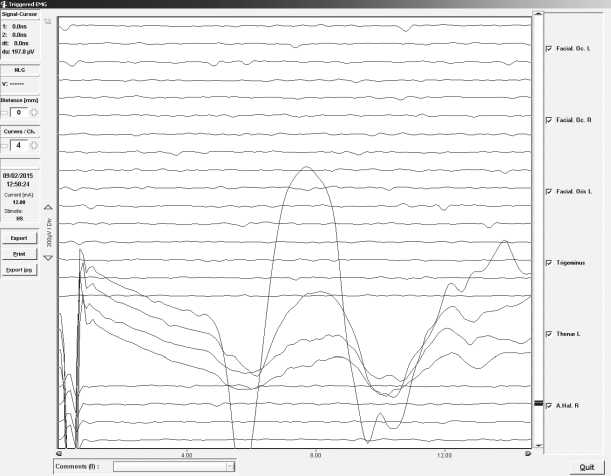
Рис. 2. Акустические стволовые вызванные потенциалы (АСВП)
B
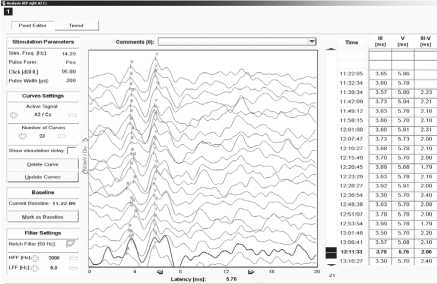
Примечание. A, B — пациент Д., 47 лет, удаление каверномы в правой медиальной области височной доли мозга. АСВП регистрировались с отведений A1–Cz, A1–Fz, A2–Cz, A2–Fz. Параметры стимуляции: интенсивность 95 дБ, длительность стимула 200 мкс, частота 14,3 Гц. Показаны ответы на стимуляцию левого (A) и правого (B) уха. Во время всех этапов операции характеристики АСВП не отклонялись существенно от базовых. Стволовых дисфункций и нарушений слуха после операции не выявлено
Fig. 2. Acoustic brainstem evoked potentials (ABEP).
-
(A, B) Patient D., 47 years old, resection of cavernoma in the right medial area of the temporal lobe of the brain. ABEP were registered at A1–Cz, A1–Fz, A2–Cz, A2–Fz leads. Stimulation characteristics: rate 95 dB, stimulus duration 200 µs, frequency 14.3 Hz. Shown are the responses to stimulation of the left (A) and the right (B) ear. No significant intraoperative deviations from the ABEP baseline values were observed. There were no postoperative brainstem dysfunctions and hearing impairment.
(диффузный характер опухоли, прохождение нерва в теле опухоли и так далее) нейронавигационной информации оказывается недостаточно для безопасного удаления новообразований; кроме того, во время операции возможно смещение мозговых структур (после вскрытия твердой мозговой оболочки, удаления части новообразования), снижающее точность нейронавигации.
Интраоперационные нейрофизиологические методики можно разделить на две группы: картирование и мониторинг [2]. Интраоперационное нейрофизиологическое картирование дает возможность во время операции идентифицировать нейрональные структуры посредством тестирования их нейрофизиологических функций. Это позволяет нейрохирургу избежать критического повреждения этих структур во время операции. Для картирования используются следующие методы: идентификация моторной коры с прямой стимуляцией; идентификация центральной борозды, двигательных ядер черепно-мозговых нервов в области IV желудочка и самих нервов при операциях в области мостомозжечкового угла; картирование кортикоспинального тракта субкортикально; картирование речевой зоны и так далее. Нейрофизиологический мониторинг — это методика, позволяющая в режиме реального времени оценить функциональную целостность нервных проводников. В первую очередь к нему относится мониторинг вызванных потенциалов (ВП): сенсорных, включая акустические стволовые, соматосенсорные и зрительные (АСВП, ССВП и ЗВП), и моторных (МВП), которые могут быть получены как при прямой, так и транскраниальной электрической стимуляции мозга. Кроме этого,
выполняется мониторинг спонтанной биоэлектрической активности мозга путем регистрации электроэнцефалограммы (ЭЭГ) или электрокортикограммы (ЭКоГ). Важным аспектом применения ЭКоГ является картирование очага эпилептической активности в процессе удаления опухолей, врожденных пороков развития — фокальных корковых дисплазий, артериовенозных мальформаций или кавернозных ангиом. Оптимальная защита нервных тканей может быть обеспечена одновременным применением нейромониторинга и картирования. Мультимодальный мониторинг (например, сочетание электромиограммы, ССВП и транскраниальных МВП) обеспечивает максимальную чувствительность без потери специфичности и в случаях, когда прямое картирование недоступно [3].
За прошедшие два года в центре ангионеврологии и нейрохирургии ФГБУ «ННИИПК им. акад. Е.Н. Ме-шалкина» Минздрава России более 60% открытых нейрохирургических операций проводилось с применением различных модальностей интраоперационного электрофизиологического нейромониторинга. Цель работы: обобщение этого опыта, оценка эффективности и систематизация методик мультимодального мониторинга; определение параметров и набора методик для оптимального интраоперационного нейромониторинга при различных видах нейрохирургического вмешательства.
Методы
В ретроспективное исследование включили 240 пациентов, оперированных в центре нейрохирургии и ангио-
неврологии ФГБУ «ННИИПК им. акад. Е.Н. Мешалкина» Минздрава России (Новосибирск, Россия) в 2014–2015 гг. Рассматривали случаи, при которых проводили интраоперационный нейрофизиологический мониторинг и оценку пред- и послеоперационного неврологического статуса. У 173 пациентов (72%) оперативное вмешательство выполняли по поводу объемных образований полушарий головного мозга, у 67 (28%) обнаружены объемные образования ствола и парастволовой локализации.
Во всех случаях для мониторинга использовалась система ISIS IOM (Inomed, Германия). Для регистрации биопотенциалов — сенсорных и моторных ВП, ЭЭГ и электромиограмм — применяли подкожные игольчатые либо спиральные (для записи с поверхности головы) электроды; ЭКоГ регистрировалась с помощью одноразовых кортикографических электродов. Стимуляция периферических нервов (n. medianus и n. tibialis) выполнялась игольчатыми подкожными электродами, транскраниальная стимуляция — спиральными подкожными электродами, прямая стимуляция коры и нервов — ручным моно-или биполярным стимулятором (выполняет нейрохирург).
Набор модальностей нейромониторинга выбирали в соответствии с локализацией оперируемой области
и доступом к ней (табл. 1). Основные параметры регистрации при мониторинге этих модальностей приведены в табл. 2.
Оценка исходных показателей ВП проводилась после индукции анестезии и укладки пациента, регистрация — непрерывно во время операции.
В качестве критерия подачи сигнала тревоги при записи соматосенсорных, зрительных и моторных вызванных потенциалов принималось увеличение латентности более чем на 10–15% и/или снижение амплитуды пиков более чем на 50% (в том числе исчезновение пиков). Для АСВП основной критерий подачи сигнала тревоги: снижение амплитуды пиков III и/или V на 50% и/или увеличение их латентности на 1 мс [4]. В этом случае нейрохирурги останавливали манипуляции, повторно записывали ВП, контролировали параметры анестезии и уровень нервномышечной блокады. Решение о дальнейших действиях принимали нейрохирурги.
При идентификации лицевого нерва на протяжении операции определялось расположение ствола нерва и контролировалась анатомическая целостность нерва методом интерференционной электромиограммы и стимуляции.
Моторные вызванные потенциалы не могут быть зарегистрированы при большой глубине нервно-мышечной блокады, поэтому выбор параметров анестезии должен по возможности учитывать это ограничение. Анестезиологическое обеспечение было модифицировано в соответствии с требованиями нейрофизиологической идентификации МВП (по возможности использовался миорелаксант средней продолжительности действия — рокурония бромид). Для соматосенсорных и акустических стволовых вызванных потенциалов характерно дозозависимое увеличение латентностей и снижение амплитуд при углублении анестезии (как ингаляционной, так и внутривенной), однако их регистрация при стандартных для нейрохирургических операций дозировках остается возможной, поэтому особых требований к режиму анестезии не предъявлялось [5].
При ретроспективном анализе результатов интраоперационного нейромониторинга соматосенсорные вызванные потенциалы разделялись на 4 группы по предсказательной ценности [6]: (1) истинно позитивные — значимые изменения сопровождались послеоперационным неврологическим дефицитом; (2) истинно негативные — мониторируемые показатели во время операции значимо не изменяются, неврологического дефицита нет; (3) ложнопозитивные — значительные изменения показателей без неврологического дефицита; (4) ложнонегативные — нормальные интраоперационные показатели, неврологический дефицит после операции. Чувствительность метода при этом определялась как частное численности группы (1) от суммарной численности групп (1) и (3), специфичность — как частное численности группы (2) от суммарной численности групп (2) и (4).
Результаты
Соматосенсорные вызванные потенциалы и мультимодальный нейромониторинг при операциях в области ствола мозга
При образованиях стволовой и парастволовой локализации во всех случаях регистрировались ССВП. В 50 случаях из 67 применялся мультимодальный мониторинг (помимо соматосенсорных записывались акустические стволовые и/или моторные вызванные потенциалы), идентификация лицевого нерва — в 27 случаях.
При мониторинге соматосенсорных вызванных потенциалов изменения отмечены в 21 случае из 67 (31%). В 16 случаях из 21 выявлено восстановление ССВП в конце операции. У 6 из 16 пациентов после операции наблюдалось появление либо нарастание гемипареза. Одновременно у части пациентов при регистрации МВП наблюдалось критичное снижение амплитуды М-от-
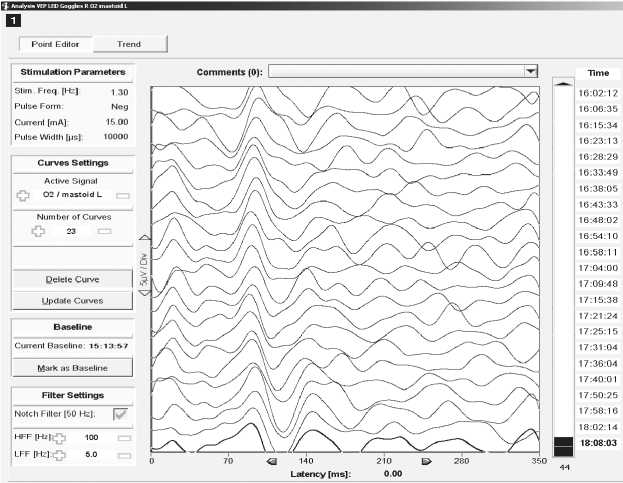
Рис. 3. Зрительные вызванные потенциалы (ЗВП)
B
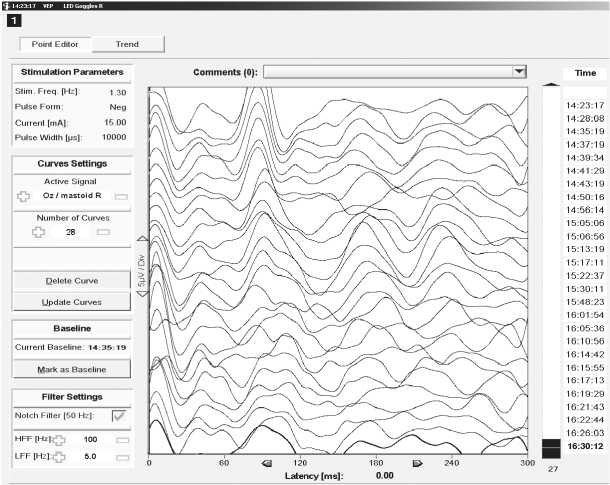
Примечание. ЗВП записывались при стимуляции левого и правого глаза (по отдельности) вспышкой света с помощью светодиодных очков. Регистрирующие электроды в отведениях O1, O2, и Oz, референтные электроды A1, A2 или Fz, заземляющий электрод Cz. Число усреднений 70–100, частота стимуляции 1,1–1,3 Гц, длительность вспышки 10 мс.
A — пациент М., 26 лет, удаление объемного образования супрахиазмальной области. Показаны ответы на стимуляцию правого глаза в отведении O2–A1. ЗВП стабильно регистрировались в течение всего периода мониторинга, существенных изменений амплитуд не зафиксировано, латентность во время операции сократились на 5–10%, вероятно, вследствие декомпрессии. Ухудшения зрительных функций после операции не выявлено;
B — пациент Л., 38 лет, удаление кавернозной мальформации в области хиазмы. Показаны ответы в отведении Oz–A2 на стимуляцию правого глаза. На этапе удаления мальформации отмечалось уменьшение амплитуды вызванных потенциалов ниже 50% и увеличение латентности на 10–15% от исходной величины. До окончания операции восстановления амплитуды и латетности ЗВП не отмечено. В отведении Oz–A1 аналогичные изменения менее выраженнны. После операции, в том числе на момент выписки, верхнеквадрантная гемианопсия слева
Fig. 3. Visual evoked potentials (VEP).
Note. VEP were recorded during separate stimulation of the left and the right eye by means of an illuminating flash from LED goggles. Registering electrodes in O1, O2, и Oz leads, reference electrodes in A1, A2 or Fz leads, grounding electrode Cz. The number of averages 70–100, stimulation frequency 1.1–1.3 Hz, flash duration 10 ms.
-
(A) Patient M., resection of a mass lesion in the suprachiasmatic region. Shown are the responses to stimulation of the right eye at O2 – A1 lead. VEP were regularly registered throughout the whole monitoring period, no significant amplitude changes were observed, intraoperative latency decreased by 5-10 %, probably due to decompression. There were no postoperative visual dysfunctions.
-
(B) Patient L., 38 years old, resection of a cavernous malformation in the chiasm area. Shown are the responses in Oz-A2 lead from stimulation of the right eye. Intraoperatively, a 50 % decrease in the amplitude of evoked potentials and an increase in latency by 10-15 % as compared to the baseline were observed. By the end of surgery, the amplitude and latency of VEP were not recovered. Similar changes in Oz-A1 lead are less pronounced. Postoperatively and at discharge, upper quadrantanopia on the left was registered.
ветов, сохранявшееся до конца операции. У 10 других пациентов, несмотря на снижение амплитуды соматосенсорных вызванных потенциалов до 50% и увеличение латентности более 10%, в послеоперационном периоде неврологического дефицита не выявлено. В оставшихся 5 случаях восстановления ССВП к концу операции не произошло. В трех из них после операции развился очаговый неврологический дефицит в виде гемипареза. У двух других пациентов (объемное образование на уровне продолговатого мозга) во время интраоперационного нейромониторинга амплитуды пиков ССВП снизились на 20–30% и не восстановились до ее окончания, однако в послеоперационном периоде не отмечено нарастания неврологического дефицита.
Во время мониторинга соматосенсорных вызванных потенциалов в 46 случаях мы не наблюдали значительных изменений их параметров (рис. 1, A). Амплитуды и латентности менялись незначительно, в пределах 10– 20%, и быстро возвращались к исходным значениям. В данной группе у 32 пациентов в послеоперационном периоде в неврологическом статусе изменений не отмечено. У 14 (30%) пациентов появился либо усилился неврологический дефицит. У 7 пациентов его развитие связано с повреждением различных стволовых структур — бульбарной и глазодвигательной группы черепно-мозговых нервов, а также пирамидного тракта. У 7 пациентов, несмотря на успешность, помимо мультимодального интраоперационного нейромониторинга, интраоперационной идентификации лицевого нерва, после операции развился либо усилился парез мимической мускулатуры. Это пациенты с невриномой слухового нерва 3-й градации, процедивом невриномы правого вестибулокохлеарного нерва.
Ложнонегативные результаты мониторинга ССВП составили 14 случаев (20,8%), ложнопозитивные — 11 (16,4%), истинно негативные — 32 (47,9%), истинно позитивные — 10 (14,9%). Таким образом, ССВП показали низкую чувствительность (48%) и недостаточно высокую специфичность (70%) с точки зрения выявления моторных дисфункций. Для увеличения этих показателей требуется мультимодальный мониторинг, с дополнением ССВП стимуляционным картированием моторных путей и/или регистрацией моторных вызванных потенциалов.
Критичные изменения МВП (при этом одновременно снижались амплитуды ССВП с последующим восстановлением либо без него) отмечены в 7 случаях, после операции у этих пациентов развился либо усилился неврологический дефицит. В остальных случаях совместного применения соматосенсорных и моторных вызванных потенциалов их параметры оставались стабильными (рис. 1, A, B ), послеоперационных неврологических осложнений не выявлено. Благодаря идентификации лицевого нерва (рис. 1, C ) и мониторингу АСВП (рис. 2) в большинстве случаев (20 пациентов из 27) удалось сохранить проводимость по лицевому и слуховому нервам, исключение составили упомянутые выше 7 пациентов.
Зрительные вызванные потенциалы при опухолях хиазмально-селлярной локализации
Всего проведен 21 интраоперационный нейромониторинг с использованием зрительных вызванных потенциалов. При использовании пропофола удалось достигнуть эффективной воспроизводимости ЗВП в 20 случаях. В одном случае из 21 при удалении кавернозной мальформации затылочной доли мы наблюдали значительное снижение амплитуды (более 50% от исходной; рис. 3, B ); в послеоперационном периоде возникла верхнеквадрантная гемианопсия. В одном случае отмечено грубое послеоперационное нарушение зрительной функции, несмотря на стабильность характеристик ЗВП во время операции (пациент 1 год, пилоцитарная астроцитома хиазмально-селлярной области).
В остальных 18 случаях зрительные вызванные потенциалы отличались стабильностью, изменений амплитудновременных характеристик не отмечалось (рис. 3, A ), послеоперационный период протекал без неврологических осложнений.
Вмешательства на больших полушариях (супратенториальные образования)
При операциях на больших полушариях интраоперационного нейромониторинга с картированием двигательной зоны применялся в 75 случаях. В 14 случаях во времясти-муляции коры получены М-ответы, в послеоперационном периоде у пациентов неврологического дефицита не выявлено. В 61 случае М-ответы зарегистрировать не удалось (в большей части случаев в результате отсутствия двигательных проводников в зоне стимуляции, реже вследствие глубокой нервно-мышечной блокады). Неврологический дефицит либо его нарастание в послеоперационном периоде наблюдалось у 8 пациентов, у которых не удалось получить М-ответы по причине значительной глубины нервно-мышечной блокады.
Операции в области речевых зон (краниотомия в сознании)
Проведено 3 мониторинга, во всех случаях удалось выявить области, при электрической стимуляции которых речевые функции нарушались. Хирургическая тактика построена так, чтобы избежать повреждения этих областей. В послеоперационном периоде новых неврологических нарушений, в том числе расстройств афатического спектра, у этих пациентов не наблюдалось.
Обсуждение
Интраоперационный мониторинг ССВП является обязательным минимумом при операциях на стволе головного мозга и задней черепной ямке. Кроме того, при данных видах операций обычно применяются АСВП для оценки функциональной целостности проводящих структур и контроля ишемии ствола головного мозга. Сочетанное применение акустических стволовых и соматосенсорных вызванных потенциалов значительно повышает информативность мониторинга за счет снижения частоты ложноотрицательных результатов. К сожалению, ССВП и АСВП позволяют оценить около 20% проводников ствола [7]. В связи с этим необходим мониторинг целостности кортикоспинального тракта и черепно-мозговых нервов. Стандартной методикой для этого является регистрация спонтанной электроми-ографической активности мышц, иннервируемых черепномозговыми нервами, и мышц конечностей. Для опухолей в области моста и среднего мозга ССВП имеют меньшую ценность в отношении анатомической локализации структур, но обеспечивают неспецифическую информацию об общей функциональной целостности ствола и предотвращение ишемических осложнений.
В литературе представлены различные, часто противоположные мнения об информативности амплитудно-временных параметров ССВП при оценке риска послеоперационного дефицита [6]. Наш опыт показывает, что изменения конфигурации соматосенсорных вызванных потенциалов при операциях на стволе, особенно в случаях, когда ССВП не восстанавливаются после прекращения хирургических манипуляций, имеют высокое прогностическое значение, становясь во многих случаях предикторами неврологического дефицита (высокая специфичность). В наибольшей мере это касается односторонних изменений, свидетельствующих в пользу локального характера проблемы. Выявление сходных изменений ответов для всех отведений чаще является признаком системных отклонений (увеличение глубины анестезии, изменения гемодинамики, снижение температуры тела пациента). В пользу системных причин изменений ССВП свидетельствуют такие изменения характеристик ЭЭГ, как ее подавление или появление высокоамплитудной медленноволновой активности. В этих случаях изменения характеристик соматосенсорных и/или моторных вызванных потенциалов, охватывающие все отведения, могут и не свидетельствовать о нарушениях в центральных соматосенсорных и/или моторных путях. В то же время отсутствие изменений ССВП не всегда гарантирует отсутствие неврологического дефицита (низкая чувствительность). В первую очередь это связано с тем, что в ССВП задействуется лишь часть стволовых проводников, в то время как особенностью нейрохирургических операций является возможность узко локализованных повреждений нервной ткани, не затрагивающих соседние области. Так, у пациентов, имевших послеоперационные неврологические осложнения при отсутствии изменений в ССВП, эти осложнения были вызваны повреждениями черепно-мозговых нервов или их ядер, которые не связаны с проведением сигналов от конечностей, мониторируемым при регистрации соматосенсорных вызванных потенциалов.
Для того чтобы избежать или минимизировать такие повреждения, при операциях стволовой и парастволовой локализации выполняется идентификация черепно-мозговых нервов методом прямой стимуляции. С помощью этого метода удалось успешно идентифицировать лицевой нерв у 27 пациентов. Несмотря на это, у некоторых из них после операции развились неврологические дисфункции, связанные с его повреждением. Во всех этих случаях опухоль имела крупные размеры, а лицевой нерв проходил через ложе опухоли, вследствие чего полностью избежать повреждений нерва при ее субтотальном удалении не удалось.
При операциях на больших полушариях с аналогичной целью сохранения моторных функций выполняется прямая электрическая стимуляция коры с регистрацией
М-ответов с мышц, которая дает возможность идентификации корковой моторной зоны, сохраняя ее в процессе удаления опухоли. Особенно важен мониторинг при удалении глиом, так как сдавление и дислокация структур мозга объемным образованием значительно изменяет их топографию. Идентификация корковой моторной зоны, как и черепно-мозговых нервов, требует отсутствия миорелаксантов, предпочтительно применение внутривенной анестезии (пропофол и фентанил, инфузионное, а не болюсное введение), а не ингаляционных анестетиков. К сожалению, соблюдение этих требований по различным причинам не всегда оказывается возможным, что может приводить к неинформативнос-ти метода прямой стимуляции. К числу таких причин относятся в частности аллергические реакции на внутривенные анестетики, спонтанное дыхание пациента, требующее введения миорелаксантов (дыхательные мышцы сохраняют возбудимость при более глубокой блокаде, чем мышцы конечностей), появление эпилептической активности, подавляемое ингаляционными анестетиками. Кроме того, метод стимуляционного картирования моторной коры не позволяет диагностировать, например ишемию пирамидного тракта вследствие вазоспазма, который может развиться уже на этапе гемостаза. В связи с этим некоторые авторы предлагают использовать одновременно как прямую стимуляцию, так и регистрацию моторных вызванных потенциалов при транскраниальной стимуляции коры [8].
Критерии изменения МВП, которые могут быть использованы для оценки повреждения проводников, являются предметом обсуждения. Так, для хирургии спинного мозга критерий наличия/отсутствия М-ответов коррелирует с постоперационным результатом, но не является определяющим при супратенториальных операциях. Увеличение латентности на 10–15% и снижение амплитуды от 50 до 80% коррелирует с постоперационным двигательным дефицитом, по мнению большинства авторов [9]. Однако стойкий дефицит наступает только при полной утрате МВП. Значимым является также и устойчивое снижение амплитуды, увеличение порога генерации МВП, несмотря на стабильные артериальное давление, уровень анестезии, температуры тела. Требования к анестезиологическому обеспечению, описанные для картирования моторной коры, в полной мере относятся и к моторным вызванным потенциалам.
Следует отметить, что ложноотрицательная информация при картировании моторной коры и идентификации черепно-мозговых нервов может иметь серьезные клинические последствия для пациента, поэтому при их проведении обязателен контроль уровня нервно-мышечной блокады. Для этого, как правило, используется тест «четырехкратная стимуляция» (TOF, рис. 1, D ) [10].
Интраоперационный мониторинг ЗВП является достаточно сложной задачей. Основной проблемой является то, что полисинаптические зрительные пути чувствительны к воздействию анестетиков. В результате рост латентности и снижение амплитуды пиков ЗВП до полного исчезновения возможности их записи вызывают как внутривенные, так и ингаляционные анестетики. В недавних работах [11] удалось достигнуть воспроизводимости ЗВП при использовании анестезии пропофолом и фентанилом; наши результаты согласуются с этими данными. Возможность регистрации зрительных вызванных потенциалов коррелирует с характеристиками фоновой ЭЭГ: при ее подавлении ЗВП отсутствуют, но их запись возможна при ЭЭГ-активности c амплитудой до 30 мкВ [12]; при паттерне «вспышка — подавление» ЗВП могут быть записаны только во время стадии вспышек [13]. Таким образом, с помощью фоновой ЭЭГ, записываемой одновременно с ЗВП с тех же отведений, можно разделить изменения ЗВП, связанные с воздействиями на зрительные пути, анестезией и другими системными параметрами. Аналогичную роль регистрация фоновой ЭЭГ может играть и при других модальностях интраоперационного нейромониторинга.
Заключение
Интраоперационный нейромониторинг — безопасный метод диагностики, позволяющий снизить процент неврологических осложнений при нейрохирургических операциях. Перспективным представляется комплексное применение разных модальностей мониторинга, позволяющих идентифицировать большинство структур нервной системы, находящихся в зонах хирургического вмешательства, и своевременно обнаружить изменения функций мозга для предотвращения его повреждения. Важным фактором, обеспечивающим успешность интраоперационного нейромониторинга, является эффективное взаимодействие нейрофизиологов, нейрохирургов и анестезиологов.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Опыт применения нейрофизиологического мониторинга при нейрохирургических операциях
- Гайтан А.С., Кривошапкин А.Л., Караськов А.М., Каныгин В.В., Валентик А.В. Результаты резекции глиобластом головного мозга с применением комбинированной флуоресцентой навигации//Патология кровообращения и кардиохирургия. 2014. Т. 18. № 2. С. 37-41.
- Sala F., Manganotti P., Tramontano V., Bricolo A., Gerosa M. Monitoring of motor pathways during brain stem surgery: what we have achieved and what we still miss?//Clinical Neurophysiology. 2007. Vol. 37. No. 6. P. 399-406 DOI: 10.1016/j.neucli.2007.09.013
- Stecker M.M. A review of intraoperative monitoring for spinal surgery//Surgical neurology international. 2012. Vol. 3. Suppl 3. P. S174-S187 DOI: 10.4103/2152-7806.98579
- Legatt A.D. Brainstem auditory evoked potentials (BAEPs) and intraoperative BAEP monitoring//Vertigo and Imbalance: Clinical Neurophysiology of the Vestibular System. Handbook of Clinical Neurophysiology. Vol. 9. Elsevier Science Ltd, 2009. pp. 282-302.
- Banoub M., Tetzlaff J.E., Schubert A. Pharmacologic and Physiologic Influences Affecting Sensory Evoked Potentials: Implications for Perioperative Monitoring//Anesthesiology. 2003. Vol. 99. No. 3. P. 716-737.
- Bejjani G.K., Nora P.C., Vera P.L., Broemling L., Sekhar L.N. The Predictive Value of Intraoperative Somatosensory Evoked Potential Monitoring: Review of 244 Procedures//Neurosurgery. 1998. Vol. 43. No. 3. P. 491-498.
- Koht A., Toleikis J.R., Sloan T.B. Standards for intraoperative neurophysiologic monitoring//Neurologic Outcomes of Surgery and Anesthesia. Oxford University Press, 2013. pp. 113-128.
- Motoyama Y., Kawaguchi M., Yamada S., Nakagawa I., Nishimura F., Hironaka Y., Park Y.S., Hayashi H., Abe R., Nakase H. Evaluation of combined use of transcranial and direct cortical motor evoked potential monitoring during unruptured aneurysm surgery//Neurol. Med. Chir. (Tokyo). 2011. Vol. 51. No. 1. P. 15-22.
- Kombos T., Suess O., Ciklatekerlio O., Brock M. Monitoring of intraoperative motor evoked potentials to increase the safety of surgery in and around the motor cortex//Journal of neurosurgery. 2001. Vol. 95. No. 4. P. 608-614.
- Lee C.M. Train-of-4 quantitation of competitive neuromuscular block//Anesthesia & Analgesia. 1975. Vol. 54. No. 5. P. 649-653.
- Kodama K., Goto T., Sato A., Sakai K., Tanaka Y., Hongo K. Standard and limitation of intraoperative monitoring of the visual evoked potential//Acta neurochirurgica. 2010. Vol. 152. No. 4. P. 643-648 DOI: 10.1007/s00701-010-0600-2
- Houlden D.A., Turgeon C.A., Polis T., Sinclair J., Coupland S., Bourque P., Corsten M., Kassam A. Intraoperative flash VEPs are reproducible in the presence of low amplitude EEG//Journal of clinical monitoring and computing. 2014. Vol. 28. No. 3. P. 275-285 DOI: 10.1007/s10877-013-9532-8
- Makela K., Hartikainen K., Rorarius M., Jäntti V. Suppression of F-VEP during isoflurane-induced EEG suppression//Electroencephalography and Clinical Neurophysiology. 1996. Vol. 100. No. 3. P. 269-272.


