Опыт применения ниволумаба у российских пациентов с метастатическим почечно-клеточным раком в рамках программы расширенного доступа. Подгрупповой анализ корреляции экспрессионных маркеров и эффективности терапии ниволумабом
Автор: Карпова Наталья В., Иванов Максим В., Милейко Владислав А., Румянцев Алексей А., Титова Татьяна А., Аракелян Геворг А., Оганесян Ани П., Каныгина Александра В., Шарова Елена И., Гафанов Рустем А., Калпинский Алексей С., Алексеев Борис Я., Семенова Анна И., Проценко Светлана А., Моисеенко Федор В., Матвеев Всеволод Б., Носов Дмитрий А., Степанова Мария Л.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.11, 2021 года.
Бесплатный доступ
В России ниволумаб был зарегистрирован в декабре 2016 года в качестве монотерапии распространенного почечно-клеточного рака (ПКР) и до сих пор остается препаратом выбора при проведении терапии второй линии у пациентов с прогрессированием процесса после использования тирозинкиназных ингибиторов. Несмотря на то, что иммунотерапия уже зарекомендовала себя в качестве эффективного подхода для лечения ПКР, предиктивные биомаркеры для рационального отбора пациентов по-прежнему не идентифицированы. В данное исследование было включено 75 пациентов с метастатическим почечно-клеточным раком (мПКР), получивших ниволумаб во 2-й и последующих линиях терапии с 2015 по 2020 года в рамках программы расширенного доступа к препарату. Частота объективного ответа составила 21,3 %. Медиана выживаемости без прогрессирования (ВБП) составила 5,5 мес. Медиана общей выживаемости (ОВ) не достигнута. С целью анализа молекулярных биомаркеров, коррелирующих с ответом на иммунотерапевтическое лечение, мы провели полнотранскриптомное РНК-секвенирование 16 образцов (FFPE) у 15 пациентов с оценкой уровня экспрессии отдельных генов (PDCD1, CD274, CD8A, CD8B, CD4) и генных сигнатур (Angio, Teff, Myeloid Inflammation). Частота контроля заболевания не отличалась в подгруппах пациентов с высоким и низким значением экспрессии какой-либо из исследованных сигнатур, а дальнейший анализ методом главных компонент не позволил выявить кластеризацию пациентов с наличием и отсутствием объективного ответа. Дальнейшие исследования на большей выборке пациентов помогут подтвердить или опровергнуть предиктивную роль выбранных для анализа биомаркеров в гетерогенной популяции больных ПКР
Почечно-клеточный рак, ниволумаб, анти-pd-1, иммунотерапия
Короткий адрес: https://sciup.org/140290746
IDR: 140290746 | DOI: 10.18027/2224-5057-2021-11-3-23-35
Текст научной статьи Опыт применения ниволумаба у российских пациентов с метастатическим почечно-клеточным раком в рамках программы расширенного доступа. Подгрупповой анализ корреляции экспрессионных маркеров и эффективности терапии ниволумабом
За последние 10 лет достигнуты большие успехи в лечении почечно-клеточного рака (ПКР) с внедрением в клиническую практику регуляторов контрольных точек иммунного ответа: анти-PD-1-, анти-PD-L1-, анти-CTLA-4-моноклональных антител. Противоопухолевое действие ингибиторов иммунных контрольных точек основано на блокаде сигнальных путей CTLA-4 и PD-1/PD-L1 и усилении противоопухолевой активности лимфоцитов. Препараты данной группы рекомендованы к клиническому использованию при раке почки, как в монорежиме, так и в комбинациях. В первой линии для лечения метастатического ПКР зарегистрированы комбинации ниволумаба (анти-PD-1) и ипилимумаба (анти-CTLA-4) [1], пембро-лизумаба (анти-PD-1) и акситиниба (антиангиогенный таргетный препарат, блокирующий рецепторы VEGF 1–3) [2], авелумаба (анти-PD-L1) и акситиниба [3].
Ниволумаб был одним из первых регуляторов контрольных точек иммунного ответа, зарегистрированных для лечения мПКР, и до сих пор остается препаратом выбора при проведении терапии второй линии у пациентов с прогрессированием процесса после использования тирозинкиназных ингибиторов. Ниволумаб является человеческим моноклональным антителом, которое блокирует взаимодействие между рецептором программируемой смерти (PD-1), экспрессируемого на Т-клетках, и его лигандами (PD-L1 и PD-L2), присутствующими на антигенпрезентирующих клетках и опухолевых клетках. Таким образом, происходит нарушение передачи сигналов PD-1/PD-L1, тем самым создаются условия для реализации иммунного ответа со стороны цитотоксических Т-лимфоцитов [4].
В регистрационном исследовании CheckMate-025 было продемонстрировано преимущество ниволумаба по сравнению со стандартной терапией ингибитором mTOR — эверолимусом. Медиана ОВ при терапии ниво-лумабом составила 25,0 месяцев, по сравнению с 19,6 месяцами при лечении эверолимусом, частота объективных ответов при применении ниволумаба была выше (25%), чем при применении эверолимуса (5%) (p < 0,001), при более благоприятном профиле безопасности [5]. По данным расширенного анализа результатов длительного наблюдения за пациентами, получавшим лечение в рамках протокола CheckMate-025, при минимальном наблюдении в течение 64 месяцев (медиана 72 месяца) ниволумаб сохранял преимущество в отношении ОВ по сравнению с эверолимусом: медиана 25,8 месяца [95% ДИ, 22,2–29,8 месяца] против 19,7 месяца [95% ДИ, 17,6–22,1 месяцев]; отношение рисков [ОР], 0,73; 95% ДИ, 0,62–0,85) с вероятностью 5-летней ОВ 26% и 18% соответственно. Это свидетельствует о более высоком качестве клинических эффектов в группе пациентов, получавших ниволумаб [6].
В России ниволумаб был зарегистрирован в декабре 2016 года в качестве монотерапии распространенного ПКР у взрослых пациентов после предшествующей систем-
ной терапии. Несмотря на то, что иммунотерапия уже зарекомендовала себя в качестве эффективного подходя для лечения ПКР, по-прежнему отсутствуют предиктивные биомаркеры для рационального отбора пациентов.
На данный момент в клинической практике продолжают использоваться 2 основные прогностические модели MSKCC и IMDC [7–8]. Обе модели отражают биологическое течении заболевания, а не его чувствительность к иммунотерапии. Такие маркеры, как уровень экспрессии PD-L1 или мутационная нагрузка, которые коррелируют с эффективностью иммунотерапии при других заболеваниях не показали своей значимости для отбора пациентов при ПКР [9–13]. Так, в клиническом исследовании CheckMate 025 (ниволумаб против эверолимуса) медиана ОВ была выше в подгруппе пациентов без экспрессии PD-L1 (< 1%, медиана ОВ 27,4 месяца) по сравнению с пациентами с положительным статусом PD-L1 (> 1 %, 21,8 месяцев), а преимущество в ОВ при использовании ниволумаба наблюдалось среди всех пациентов вне зависимости от статуса PD-L1 [14]. В исследовании CheckMate 214 в подгруппе пациентов с промежуточным и высоким риском по шкале IMDC комбинация ниволумаб с ипилимумабом демонстрировала свое преимущество над сунитинибом вне зависимости от уровня PD-L1 экспрессии, но при этом отмечалась тенденция к большей частоте объективных ответов у пациентов с наличием PD-L1 экспрессии (37% vs 58 %, [15]). Также в клиническом исследовании II фазы эффективность атезо-лизумаба не коррелировала ни с мутационной нагрузкой, ни с экспрессией PD-L1 [16].
В совокупности это может свидетельствовать о том, что требуются более комплексные и интегральные подходы к поиску молекулярных предикторов эффективности иммунотерапии при этом заболевании, такие как анализ транскриптомных данных. Ранее в исследованиях у пациентов с меланомой кожи, раком легкого и раком мочевого пузыря было показано, что такие биомаркеры, как уровень экспрессии PD-L1, определяемый иммуногистохимическим методом, а также экспрессия генетических сигнатур, ассоциированных с опухолевой инфильтрацией CD8 + Т-клетками и активностью интерферона гамма (IFN-γ), коррелируют с эффективностью иммунотерапии регуляторами контрольных точек иммунного ответа [17–20]. Более того, в исследованиях было показано, что Т-лимфоциты миелоидного происхождения вовлечены в подавление противоопухолевого иммунного ответа [21]. В соответствии с этими данными мы провели ретроспективный анализ корреляции экспрессионных маркеров и эффективности терапии ниволумабом в монорежиме у пациентов с метастатическим раком почки.
Материалы и методы
В исследование включено 75 пациентов с мПКР, которые получили хотя бы 1 введение ниволумаба в рамках программы расширенного доступа инициированной
ОПЫТ ПРИМЕНЕНИЯ НИВОЛУМАБА У РОССИЙСКИХ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ В РАМКАХ ПРОГРАММЫ РАСШИРЕННОГО ДОСТУПА. ПОДГРУППОВОЙ АНАЛИЗ КОРРЕЛЯЦИИ ЭКСПРЕССИОННЫХ
МАРКЕРОВ И ЭФФЕКТИВНОСТИ ТЕРАПИИ НИВОЛУМАБОМ
Собственные исследования в 2015 году в качестве второй или последующих линий терапии. Ниволумаб вводился внутривенно в дозе 3 мг/ кг каждые 2 недели до прогрессирования заболевания или неприемлемой токсичности.
В программу расширенного доступа включались пациенты, соответствующие следующим критериям: старше 18 лет, наличие гистологически подтвержденного метастатического почечно-клеточного рака (IV ст. по 7 версии AJCC), прогрессирование заболевания после хотя бы 1 линии лечения. Количество предшествующих линий лечения не было ограничено.
Программа расширенного доступа получила одобрение этического комитета 18 июля 2018 года. В исследовании участвовало несколько центров: НМИЦ онкологии им. Н. Н. Блохина, СПбКНПЦо, МНИОИ им. П. А. Герцена, НМИЦ Онкологии им. Н. Н. Петрова, ЦКБ УДП РФ, РНЦРР. Все представленные данные были проспективно собраны в электронной базе пациентов.
ВБП рассчитывали от момента первого введения ниво-лумаба до прогрессирования заболевания или смерти в зависимости от того, что произошло раньше. ОВ рассчитывалась с момента начала терапии ниволумабом до смерти (от основного заболевания). Ответ на терапию оценивался по критериям Response Evaluation Criteria in Solid Tumors 1.1 (RECIST 1.1). Нежелательные явления (НЯ), связанные с приемом ниволумаба, оценивались по критерию National Cancer Institute Common Terminology Criteria for Adverse Events 4.03.
Все собранные данные и переменные конечной точки обобщены с использованием описательной статистики в дополнение к статистическому моделированию. Для описания характеристик пациентов были использованы методы описательной статистики, для оценки ОВ и ВБП — метод Каплана–Мейера. Все статистические расчеты выполнены в программе IBM SPSS Statistics Professional 23.0.
Молекулярный анализ
Транскриптомный анализ проводили на образцах опухолевой ткани, фиксированной в формалине (FFPE), полученных после радикальной или циторедуктивной нефрэктомии до начала лекарственного лечения. ДНК и РНК выделяли набором Allprep DNA\RNA FFPE Kit (Qiagen) в соответствии с протоколом от производителя. При выделении добавляли 1,5-кратный избыток протеинкиназы K (Qiagen). Элюирование ДНК проводили с помощью 50 мкл DNAse\RNAse free water (Ambion). Элюирование РНК проводили с помощью 25 мкл DNAse\RNAse free water (Ambion). Концентрацию ДНК измеряли флуориметри-ческим методом с использованием набора Qubit DNA BR assay kit (Thermo Fisher) на приборе Qubit-2 (Thermo Fisher) в соответствии с протоколом от производителя. Концентрацию РНК измеряли флуориметрическим методом с использованием набора Qubit RNA BR assay kit (Thermo Fisher) на приборе Qubit-2 (Thermo Fisher).
Приготовление библиотек для секвенирования проводили с использованием наборов реагентов NEBNext® rRNA Depletion Kit (Human/Mouse/Rat) (NEB) и NEBNext Ultra II Directional RNA Library Prep Kit (NEB). Итоговый профиль распределения длин библиотеки определяли на приборе Bioanalyser (Agilent), концентрацию на приборе Qubit и набором Qubit DNA HS assay kit (Thermo Fisher). Очистку библиотек проводили с использованием Ampure Beads (Beckman Coulter).
Файлы формата fastq были получены после автоматического демультиплексировании образцов, полученных после секвенирования на платформе Novaseq. Удаление оставшихся фрагментов адапторов проводилось программой cutadapt (версия 3.3) и программой trimmomatic (версия 0.3). Затем проводилось картирование данных на последовательности рибосомальной ДНК для удаления рибосомальных чтений. Картирование оставшихся чтений на геномную сборку версии GRCh38 проводилось с помощью программного пакета STAR (версия 2.7.4a). Значения уровней экспрессии в метрике TPM (transcripts per million) были получены с использованием программы salmon (версия 1.4.0). Для создания индекса и последующего перевода уровня экспрессии на ген использовались аннотационные файлы Gencode37. Контроль качества полученных данных проводили с использованием пакетов PCATools и ISeqQC на основе значений TPM, полученных salmon.
Анализ экспрессии генов проводился как для отдельных генов, так и для генных сигнатур Angio, Teff и Myeloid Inflammation. Генные сигнатуры определялись следующим образом:
– Angio: VEGFA, KDR, ESM1, PECAM1, ANGPTL4, and CD34; – Teff: CD8A, EOMES, PRF1, IFNG, and CD274;
– Myeloid Inflammation: IL-6, CXCL1, CXCL2, CXCL3, CXCL8, and PTGS2.
Повышение или понижение экспрессии генных сигнатур может свидетельствовать об активации или деактивации соответствующего биологического процесса или сигнального каскада к клетке. Выбор состава генных сигнатур основан на ранее опубликованных данных. Сначала для определения уровня экспрессии каждого отдельного гена производится логарифмическая трансформация, после чего вычисляется среднее значение в рамках одной сигнатуры. В соответствии с полученными значениями пациенты делились на группы высокого (high) и низкого (low) значения сигнатуры на основании отношения (больше, меньше) к среднему значению.
Результаты
В исследование было включено 75 пациентов, которые получали лечение в рамках программы расширенного доступа, которая началась в России в 2015 году. В исследовании в основном преобладали пациенты со светлоклеточным вариантом почечно-клеточного рака после нефрэктомии, получившие 2 и более линий терапии. Основные характеристики пациентов представлены в табл. 1.
ОПЫТ ПРИМЕНЕНИЯ НИВОЛУМАБА У РОССИЙСКИХ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ В РАМКАХ ПРОГРАММЫ РАСШИРЕННОГО ДОСТУПА. ПОДГРУППОВОЙ АНАЛИЗ КОРРЕЛЯЦИИ ЭКСПРЕССИОННЫХ МАРКЕРОВ И ЭФФЕКТИВНОСТИ ТЕРАПИИ НИВОЛУМАБОМ
Собственные исследования
Таблица 1. Характеристика пациентов
|
n (%) |
||
|
Пол |
Мужской |
47 (62,7) |
|
Женский |
28 (37,3) |
|
|
Возраст |
Медиана (мин–макс) |
61 (38–72) |
|
ECOG |
0 |
18 (24,0) |
|
1 |
39 (52,0) |
|
|
2 |
17 (22,7) |
|
|
Гистологический вариант |
Светлоклеточный |
68 (90,7) |
|
Папиллярный |
5 (6,7) |
|
|
Хромофобный |
1 (1,3) |
|
|
Из собирательных трубочек |
1 (1,3) |
|
|
После нефрэктомии |
Да |
74 (98,7) |
|
Нет |
1 (1,3) |
|
|
Объем оперативного вмешательства |
Циторедуктивная нефрэктомия |
32 (42,7) |
|
Радикальная нефрэктомия |
42 (56,0) |
|
|
Предшествующие линии лечения (количество) |
1 |
31 (41,3) |
|
2 |
21 (28,0) |
|
|
3 и более |
23 (30,7) |
|
|
Предшествующая терапия |
Тирозинкиназные ингибиторы (Сунитиниб, Сорафениб, Пазопаниб, Акситиниб) |
1 линия — 59 (78,6) |
|
2 линия — 29 (38,6) |
||
|
3 линия — 12 (16,0) |
||
|
Ингибиторы m-TOR (Эверо-лимус, Темсиролимус) |
1 линия — 1 (1,3) |
|
|
2 линия — 13 (17,3) |
||
|
3 линия — 10 (13,3) |
||
|
Анти-VEGF МКА (Бевацизумаб + ИНФ) |
1 линия — 15 (20,0) |
|
|
2 линия — 0 |
||
|
3 линия — 0 |
||
|
Локализация метастазов |
Легкие |
61 (81,3) |
|
Кости |
22 (29,3) |
|
|
Печень |
20 (26,7) |
|
|
ЛУ |
41 (54,7) |
|
|
Головной мозг |
3 (4,0) |
|
|
Почки |
12 (16,0) |
|
|
Мягкие ткани |
7 (9,3) |
|
|
Прогноз по MSKCC |
Благоприятный |
19 (25,3) |
|
Промежуточный |
27 (36,0) |
|
|
Плохой |
6 (8,0) |
|
|
Неизвестно |
23 (30,6) |
|
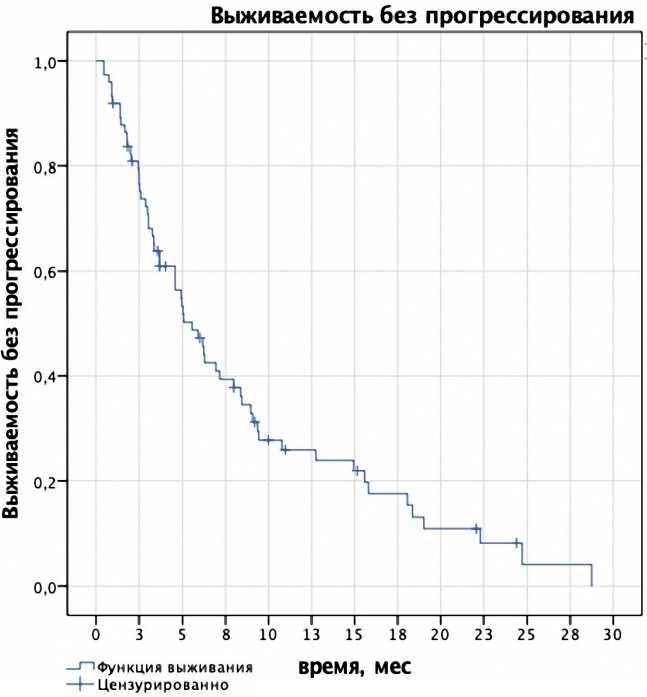
Рисунок 1. Выживаемость без прогрессирования, рассчитанная по методу Каплана–Мейера.
Частота объективного ответа составила 21,3%: у 3 (4,0%) пациентов был достигнут полный ответ, у 13 (17,3%) — частичный ответ. Стабилизация заболевания отмечалась у 30 (40,0%) пациентов. Таким образом, контроль заболевания наблюдался у 46 пациентов (61,3%).
Медиана ВБП составила 5,5 мес. (95% ДИ 4,28–6,83). Одно-, двухлетняя ВБП — 17 и 2%, соответственно (рис. 1). Медиана ОВ не достигнута. Одно-, двухлетняя ОВ составила 62 и 59%, соответственно (рис. 2). Общая медиана
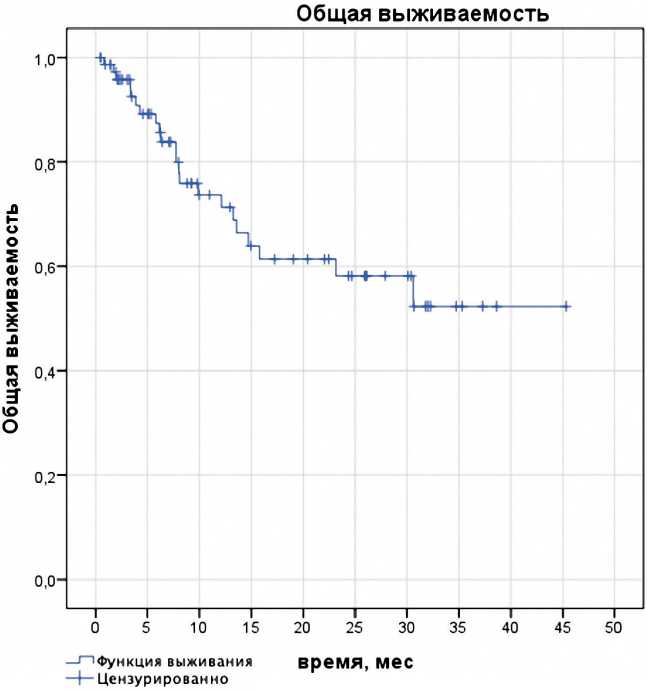
Рисунок 2. Общая выживаемость, рассчитанная по методу Каплана–Мейера.
периода наблюдения (мин — макс) составила 8,4 месяца (0,4–45 месяцев), в течение которых 45% пациентов (34/75) умерли. Основной причиной смерти было прогрессирование заболевания.
ОПЫТ ПРИМЕНЕНИЯ НИВОЛУМАБА У РОССИЙСКИХ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ В РАМКАХ ПРОГРАММЫ РАСШИРЕННОГО ДОСТУПА. ПОДГРУППОВОЙ АНАЛИЗ КОРРЕЛЯЦИИ ЭКСПРЕССИОННЫХ
МАРКЕРОВ И ЭФФЕКТИВНОСТИ ТЕРАПИИ НИВОЛУМАБОМ
Собственные исследования
В результате проведенного однофакторного анализа были выделены следующие благоприятные клинические и лабораторные факторы, ассоциированные с более высокими показателями ОВ: пол — мужской, статус ECOG — 0 баллов, менее 3 зон отдаленного метастазирования, уровень гемоглобина более 115 г/л, уровень тромбоцитов менее 300 × 109/л. (табл. 2). Учитывая ограниченное число больных, включенных в исследование, и наличие валидированных прогностических моделей (MSKCC и IMDC), поиск независимых факторов прогноза на основе многофакторного анализа не проводился.
Безопасность
В данном исследовании не было выявлено ранее не описанных нежелательных явлений (НЯ). Возникновение НЯ, связанных с приемом ниволумаба, наблюдалось у 20 (26,6%) пациентов. Основные жалобы были на усталость (2,7%), сыпь (2,7%), зуд (1,3%), стоматит (1,3%), снижение аппетита (1,3%), анемию (1,3%). Иммуноопосредованные НЯ диагностированы у 21 (28,1%) пациента, из них 3–4 степени были у 10 (13,3%) пациентов (табл. 3). Большая часть НЯ купировались в течение 3–4 недель от момента возникновения. Отмена терапии в связи с непереносимостью произошла у 3 (4%) пациентов. Не зафиксировано ни одного смертельного случая, связанного с возникновением НЯ.
Таблица 2. Прогностические факторы в отношении ОВ
|
Факторы |
МВБП, мес |
n |
ОР (95% ДИ) |
p |
|
|
Возраст |
≤ 65 |
4,57 (2,80–6,33) |
54 |
1,40 (0,76– 2,55) |
0,28 |
|
> 65 |
8,38 (4,02–12,74) |
21 |
|||
|
Пол |
Мужской |
7,162 (4,44–9,89) |
47 |
0,53 (0,31– 0,90) |
0,018 |
|
Женский |
3,35 (2,53–4,18) |
28 |
|||
|
ECOG |
0 |
15,57 (5,51–25,64) |
18 |
0,43 (0,22– 0,85) |
0,015 |
|
1–2 |
4,57 (3,05–6,08) |
56 |
|||
|
Зоны отдаленного метастазирования |
1–2 |
6,93 (1,75–12,11) |
38 |
0,57 (0,34– 0,96) |
0,036 |
|
3–5 |
4,93 (3,10–6,76) |
37 |
|||
|
Гемоглобин |
> 115 |
6,28 (3,07–9,48) |
40 |
0,54 (0,31– 0,92) |
0,025 |
|
≤ 115 |
4,57 (2,92–6,22 |
25 |
|||
|
Тромбоциты |
≤ 300 |
6,28 (3,65–8,90) |
41 |
0,56 (0,32– 0.99) |
0,045 |
|
> 300 |
3,68 (2,56–4,80) |
24 |
|||
|
Прогноз по MSKCC |
Благоприятный |
8,44 (6,68–10,21) |
19 |
0,54 (0,28– 1,04) |
0,065 |
|
Промежуточный и плохой |
4,96 (2,70–7,22) |
33 |
|||
|
Предшествующие линии лечения (количество) |
0–1 |
5,55 (3,12–7,98) |
31 |
0,944 (0,56– 1,59) |
0,83 |
|
2 и более |
4,93 (2,91–6,94) |
44 |
|||
|
Иммуно-опосредованные нежелательные явления |
Были |
6,18 (3,75–8,61) |
20 |
0,64 (0,35– 1,16) |
0,15 |
|
Нет |
5,03 (3,21–6,84) |
55 |
|||
Таблица 3. Иммуноопосредованные НЯ
|
НЯ |
Число больных с НЯ, n (%) |
|
|
Любой степени |
3–4 степени |
|
|
Легочные |
2 (2,7) |
2 (2,7) |
|
Гастроинтестинальные |
0 |
0 |
|
Кожные |
2 (2,7) |
1 (1,3) |
|
Гепатотоксичность |
4 (5,3) |
2 (2,7) |
|
Нефротоксичность |
2 (2,7) |
1 (1,3) |
|
Эндокринопатии |
9 (12,0) |
3 (4,0) |
|
Другое |
2 (2,7) |
1 (1,3) |
Результаты молекулярного исследования
С целью поискового анализа молекулярных биомаркеров, коррелирующих с ответом на иммунотерапевтическое лечение, мы провели полнотранскриптомное РНК-секвенирование 16 образцов опухолевой ткани (FFPE) у 15 пациентов. Клинико-патологические характеристики данной подгруппы больных представлены в табл. 4. По результатам секвенирования было получено в среднем 1,24 млн чтений на каждый образец. После удаления чтений, картируемых на рибосомальную РНК, среднее количество чтений, картируемых на белок-кодирующие гены составило 5,68 млн чтений. Данный объем является достаточным для проведения экспрессионного анализа. Однако для двух образцов количество чтений, картируемых на белок-кодирующие гены составило 1 млн и меньше, а метод главных компонент продемонстрировал выпадение их из общего массива данных (рис. 3). В этих же образцах наблюдалось понижение экспрессии генов GAPDH и ACTB (повсеместно экспрессируемых во всех тканях человека) по сравнению со средним значением (p < 0,001) (рис. 4а), что может означать низкое качество данных, полученных для этих образцов. В связи с этим указанные образцы далее не использовались для анализа.
Понижение размерности данных экспрессии генов с помощью метода главных компонент не выявил кластеризации образцов пациентов в зависимости от ответа на терапию
ОПЫТ ПРИМЕНЕНИЯ НИВОЛУМАБА У РОССИЙСКИХ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ В РАМКАХ ПРОГРАММЫ РАСШИРЕННОГО ДОСТУПА. ПОДГРУППОВОЙ АНАЛИЗ КОРРЕЛЯЦИИ ЭКСПРЕССИОННЫХ МАРКЕРОВ И ЭФФЕКТИВНОСТИ ТЕРАПИИ НИВОЛУМАБОМ
Собственные исследования
Таблица 4. Характеристика пациентов, включенных в подгрупповой анализ предиктивных биомаркеров
|
Характеристика |
Количество (%) |
|
Всего |
15 (100%) |
|
Пол пациента |
|
|
Мужской |
7 (47%) |
|
Женский |
8 (53%) |
|
Возраст (среднее ± стандартное отклонение) |
59 ± 6 |
|
Стадия заболевания (на момент забора биоматериала) |
|
|
I |
1 (7%) |
|
II |
0 (0%) |
|
III |
6 (40%) |
|
IV |
8 (53%) |
|
Прогноз MSKCC |
|
|
Благоприятный |
3 (20%) |
|
Промежуточный |
5 (33%) |
|
Плохой |
1 (7%) |
|
Неизвестно |
6 (40%) |
|
Объем оперативного лечения |
|
|
Циторедуктивная нефрэктомия |
8 (53%) |
|
Радикальная операция |
7 (47%) |
|
Число линий предшествующей терапии |
|
|
1 |
4 (27%) |
|
2 |
7 (46%) |
|
3 и более |
4 (27%)) |
|
Ответ на терапию ниволумабом |
|
|
Полный ответ |
1 (7%) |
|
Частичный ответ |
3 (20%) |
|
Стабилизация заболевания |
8 (53%) |
|
Прогрессирование заболевания |
3 (20%) |
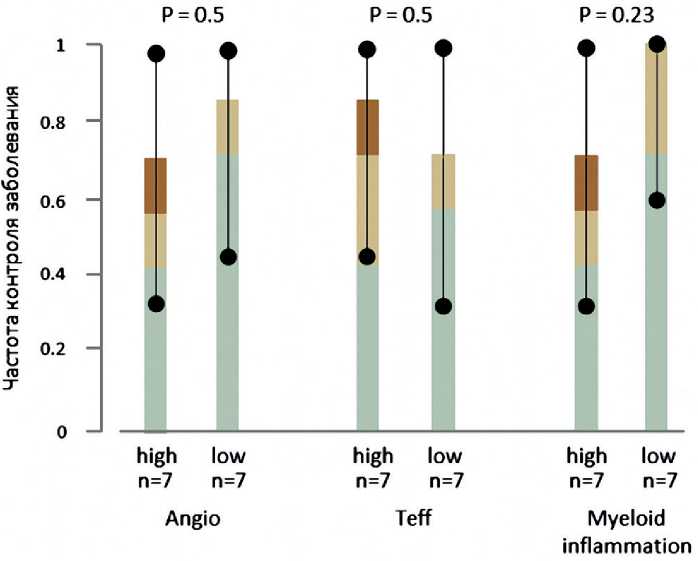
ниволумабом (рис. 3). Анализ экспрессии отдельных генов (PDCD1, CD274, CD8A, CD8B, CD4) показал, что полный и частичный ответ наблюдался в группе пациентов с высоким значением экспрессии CD274 (PD-L1). Частота объективного ответа в группе пациентов с уровнем экспрессии CD274 выше [n = 7] и ниже [n = 7] медианного значения составила 57% [95% ДИ 18–90%] против 0% [95% ДИ 0–40%] (p=0,18) соответственно. Аналогично, объективный ответ не наблюдался в группе пациентов с низким значением экспрессии CD4 (ЧОО 57% [95% ДИ 18–90%] против 0% [95% ДИ 0–40%] в группе пациентов со значением экспрессии выше [n = 7] и ниже [n = 7] медианного, соответственно, p = 0,18, рис. 4). Однако частота контроля заболевания в подгруппе пациентов со значением экспрессии сигнатуры генов (CD274 + CD4) превышающим среднее значение равна частоте контроля заболевания в подгруппе пациентов со значением экспрессии этой сигнатуры меньше среднего, что не подтверждает связь коэкспрессии этих генов с ответом на терапию ниволумабом. Корреляции ответа на ниволумаб с экспрессией генов PDCD1, CD8A и CD8B не наблюдалось (рис. 5). Корреляции частоты контроля заболевания с уровнем значения экспрессионных сигнатур не обнаружено (рис. 5). В подгруппе пациентов со значением миелоидной сигнатуры ниже медианного [n = 7] частота контроля заболевания составила 100% [95% ДИ 59–100%], однако статистической разницы с частотой контроля заболевания в подгруппе пациентов со значением миелоидной сигнатуры выше медианного [n = 7] обнаружено не было (p = 0,23, рис. 4). Также ответ наблюдался только в подгруппе пациентов с высоким значением экспрессии ангиогенной сигнатуры (ЧОО 40% [95% ДИ 12–73%] против 0% [95% ДИ 0–52%] при значении сигнатуры 24,8 и выше [n = 10] и ниже [n = 5] соответственно, p > 0,1), а два пациента с самым высоким значением экспрессии Т-эффекторной сигнатуры
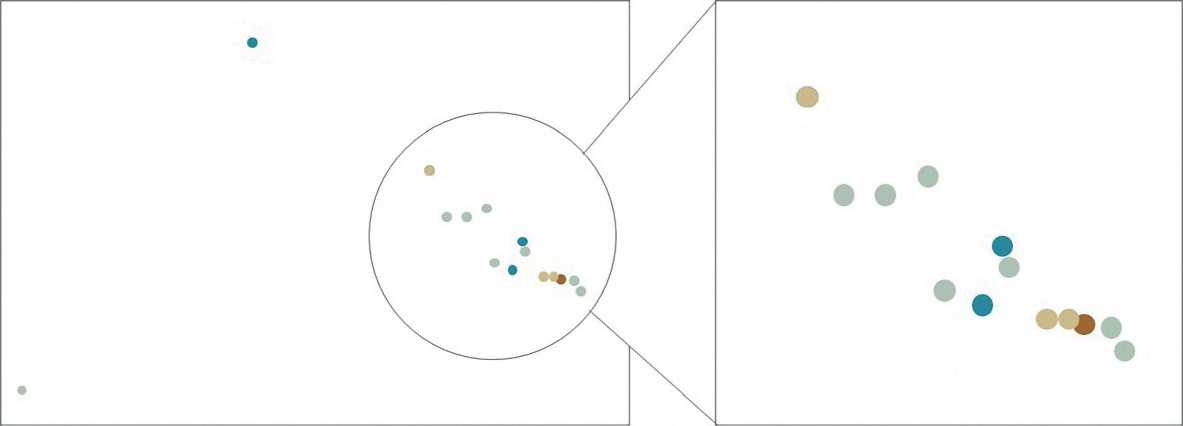
® Полный ответ Частичный ответ Стабилизация заболевания ® Прогрессирование заболевания
Рисунок 3. Кластеризация образцов на основании данных экспрессии белок-кодирующих генов методом главных компонент.
Собственные исследования
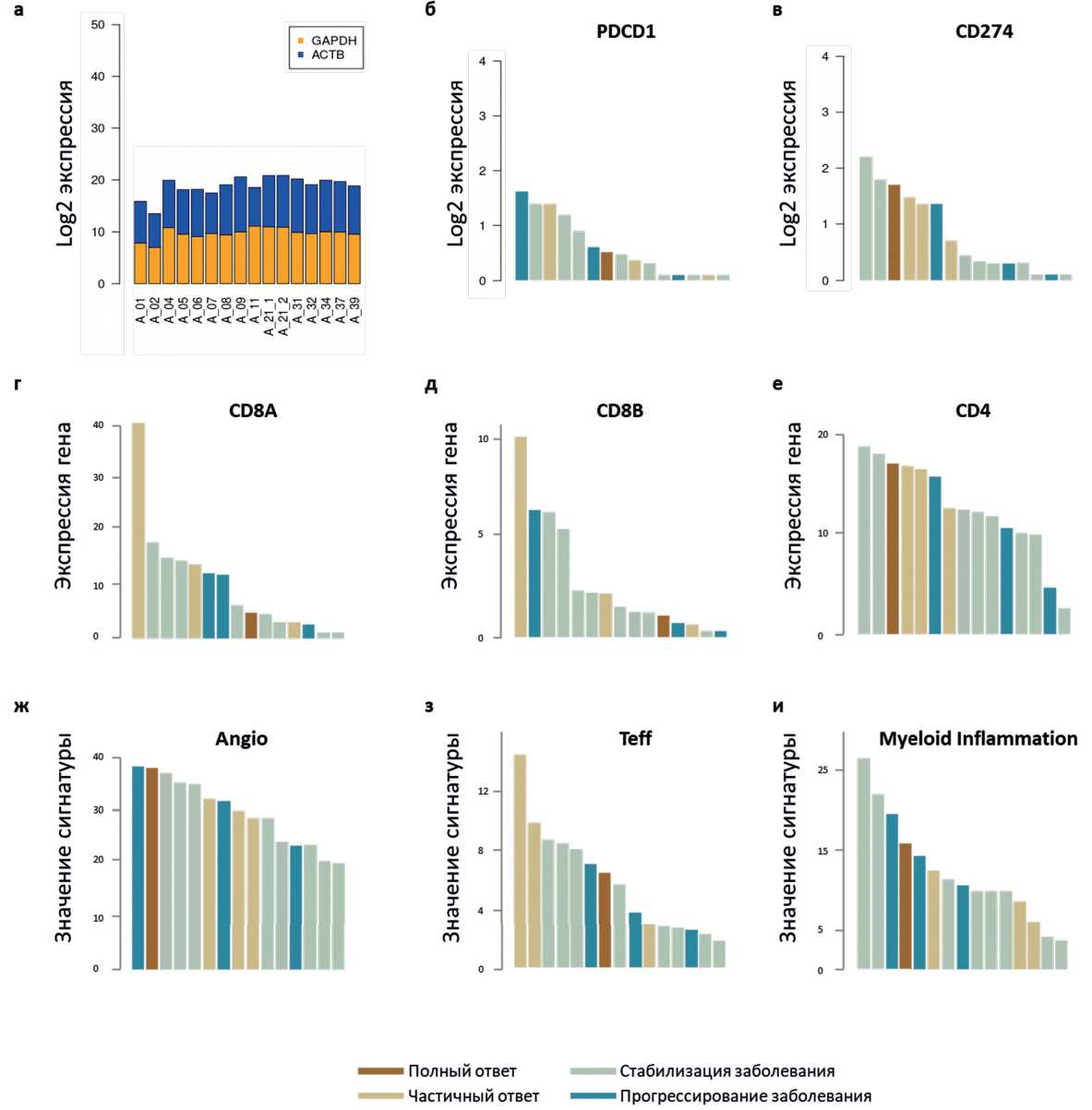
Рисунок 4. Значения экспрессии «housekeeping genes» (а), PDCD1 (б), CD274 (в), CD8A (г), CD8B (д), CD4 (е). Значения экспрессионных сигнатур генов [Angio (ж); Teff (з); Myeloid Inflammation (и)].
^^" П ол ны й ответЧастичный ответ
Стабилизация заболевания
Рисунок 5. Частота контроля заболевания в группах с высоким и низким значением экспрессионных сигнатур.
Собственные исследования
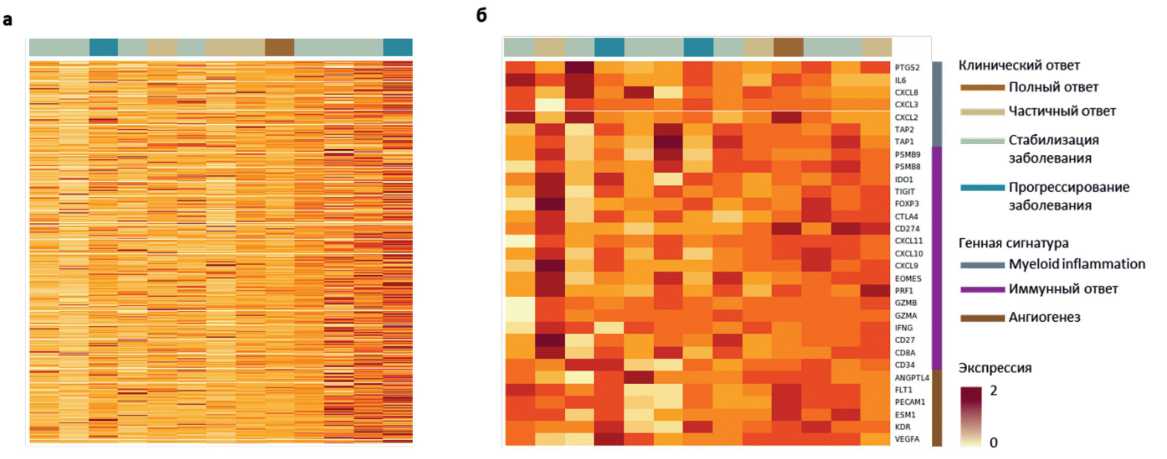
Рисунок 6. Карта интенсивности экспрессии (a) белок-кодирующих генов и (б) связанных с биологическими процессами генов в образцах.
продемонстрировали частичный ответ на терапию ниволу-мабом. Карта интенсивности экспрессии всех генов (рис. 6а) или генов, имеющих биологическую значимость в отношении ангиогенеза, иммунного ответа или миелоидного воспаления (рис. 6б) также не позволила выделить группы пациентов, ответивших на лечение.
Обсуждение
Данное исследование было проведено для оценки безопасности и эффективности ниволумаба у пациентов с метастатическим почечно-клеточным раком в рамках программы расширенного доступа в России. Параллельно была проведена оценка клинических характеристик пациентов и показателей выживаемости.
По данным проведенного анализа ниволумаб оказался эффективным и безопасным препаратом в реальной клинической практике. По сравнению с группой пациентов, получавших ниволумаб в исследовании Checkmate 025, в популяции российских пациентов отмечается меньшая частота возникновения нежелательных явлений любой степени. Кроме того, в нашем исследовании преобладали пациенты с неблагоприятными прогностическими характеристиками, ранее получившие 2 и более линий терапии (58%) и статусом ECOG > 1 (75% больных).
Отмечаются сопоставимые данные по ВБП, частоте объективного ответа в группе ниволумаба по сравнению с исследованием Checkmate 025 [22], что говорит о сопоставимой эффективности препарата в российской популяции.
Корреляция экспрессии генных сигнатур и ответа на иммунотерапевтическое лечение была ранее исследована в рамках наблюдательных исследований нескольких рандомизированных клинических исследований. Подгрупповой анализ рандомизированного клинического исследования
II фазы IMmotion 150 (атезолизумаб в монотерапии либо в комбинации с бевацизумабом в сравнении с сунитинибом) продемонстрировал ассоциацию экспрессии ангиогенной, T— эффекторной и миелоидной сигнатур с эффективностью различных терапевтических подходов [23]. В группе пациентов, получавших атезолизумаб в комбинации с бевацизума-бом, экспрессия генной сигнатуры иммунного ответа Teff-high коррелировала с частотой объективного ответа (49% против 16%) и медианой ВБП (ОР 0,50; 95% ДИ, 0,30–0,86). Также в исследовании была показана низкая эффективность атезолизумаба в монотерапии в подгруппе пациентов с высокой экспрессией генной сигнатуры миелоидных клеток (Myeloid Inflammation) (ОР для медианы ВБП 2,98; 95% ДИ, 1,68–5,29). В группе пациентов, получавших суни-тиниб в монотерапии, данной корреляции не наблюдалось. Релевантность этих генетических профилей в отношении эффективности анти-PD-L1 терапии была подтверждена в последующем анализе результатов клинического исследования III фазы IMmotion151 [24]. В подгруппе пациентов с высокой экспрессией сигнатуры Teff атезолизумаб в комбинации с бевацизумабом способствовал увеличению медианы ВБП в сравнении с сунитинибом в монорежиме (ОР, 0,59; 95% ДИ, 0,47–0,75). При этом, в другом клиническом исследовании (NIVOREN), в котором 324 пациента метастатическим ПКР получали ниволумаб в монотерапии, было показано отсутствие предиктивной роли ангиогенной и Т-эффекторной генетических сигнатур в отдельности [25]. Однако комбинация данных сигнатур коррелировала с ответом на терапию. Так, в подгруппе пациентов с Teff-high/ Angio-high медиана ВБП составила 10,1 месяца, а частота ответа — 47%, в то время как в подгруппе пациентов с Teff-low/Angio-low — 2,6 месяцев и 5%, соответственно.
В нашем исследовании подгрупповой анализ не показал статистически-значимой корреляции эффективности
ОПЫТ ПРИМЕНЕНИЯ НИВОЛУМАБА У РОССИЙСКИХ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ ПОЧЕЧНО-КЛЕТОЧНЫМ РАКОМ В РАМКАХ ПРОГРАММЫ РАСШИРЕННОГО ДОСТУПА. ПОДГРУППОВОЙ АНАЛИЗ КОРРЕЛЯЦИИ ЭКСПРЕССИОННЫХ
МАРКЕРОВ И ЭФФЕКТИВНОСТИ ТЕРАПИИ НИВОЛУМАБОМ
Собственные исследования терапии ниволумабом и экспрессии генов CD274 (PD-L1), CD8 и CD4. В то же время, ответ на терапию наблюдался только среди пациентов с высоким значением экспрессии CD4 и CD274, хотя результаты не достигли статистической значимости. Частота контроля заболевания не отличалась в подгруппах пациентов с высоким/низким значением экспрессии какой-либо из исследованных сигнатур (p составил 0,5, 0,5 и 0,23 для ангиогенной, T-эффекторной и миелоидной сигнатур, соответственно), а метод главных компонент не позволил выявить кластеризацию пациентов с наличием и отсутствием объективного ответа. Подобные противоречивые результаты могут быть связаны с ограниченным числом больных, включенных в молекулярный анализ, а также их высокой гетерогенностью в отношении количества предшествующих линий терапии и прогностических характеристик. Также подобные результаты могли быть связаны с качеством биологического материала. Так, два образца не прошли контроль качества данных (низкое количество чтений, картируемых на белок-кодирующие гены, высокое количество C/G > T/A артефактов по результатам детектирования
мутаций, низкая экспрессия housekeeping genes), а среди остальных образцов наблюдался высокий разброс количества генов, картируемых на белок-кодирующие гены. Дальнейшие исследования на большей выборке пациентов помогут подтвердить или опровергнуть предиктивную роль выбранных для анализа биомаркеров в гетерогенной популяции больных ПКР.
Ограничения
Это исследование имеет ряд ограничений, включая ретроспективный, наблюдательный дизайн, незначительное количество пациентов включенных в базу, малое количество гистологического материала для молекулярного анализа, что могло повлиять на полученный результат.
Финансовая заинтересованность
Создание базы данных и молекулярный анализ проведены при поддержке компании Bristol-Myers Squibb.
Список литературы Опыт применения ниволумаба у российских пациентов с метастатическим почечно-клеточным раком в рамках программы расширенного доступа. Подгрупповой анализ корреляции экспрессионных маркеров и эффективности терапии ниволумабом
- Motzer R. J. et al. Nivolumab plus ipilimumab versus sunitinib for first-line treatment of advanced renal cell carcinoma: extended 4-year follow-up of the phase III CheckMate 214 trial. ESMO Open. 2020 Nov;5 (6):e001079. doi: 10.1136/ esmoopen-2020-001079.
- Rini B. I. et al. Pembrolizumab plus axitinib versus sunitinib monotherapy as first-line treatment of advanced renal cell carcinoma (KEYNOTE-426): extended follow-up from a randomised, open-label, phase 3 trial. Lancet Oncol. 2020 Dec;21 (12):1563-1573. doi: 10.1016/S1470-2045 (20) 30436-8.
- Choueiri T. K., Motzer R. J., Rini B. I. et al. Updated efficacy results from the JAVELIN Renal 101 trial: first-line avelumab plus axitinib versus sunitinib in patients with advanced renal cell carcinoma. Ann Oncol. 2020 Aug;31 (8):1030-1039. doi: 10.1016/j. annonc. 2020.04.010.
- Atkins M. B., Clark J. I., Quinn D. I. Immune checkpoint inhibitors in advanced renal cell carcinoma: experience to date and future directions. Annals of Oncology 28: 1484-1494, 2017. doi:10.1093/annonc/mdx151.
- Motzer R. J., Escudier B., McDermott D. F., et al. Nivolumab versus Everolimus in advanced renal-cell carcinoma. N Engl J Med. 2015; 373 (19): 1803-1813.
- Motzer R. J., Tykodi S. S. et al. Nivolumab versus Everolimus in patients with advanced renal cell carcinoma: updated results with long-term follow-up of the randomized, open-label, phase 3 CheckMate 025 Trial. Journal of Clinical Oncology doi: 10.1200/JCO. 2020.38.6_suppl. 617.
- Kamba T., Yamasaki T., Teramukai S., Shibasaki N., Arakaki R., Sakamoto H. et al. Improvement of prognosis in patients with metastatic renal cell carcinoma and Memorial Sloan-Kettering Cancer Center intermediate risk features by modern strategy including molecular-targeted therapy in clinical practice. Int J Clin Oncol. 2014;19 (3):505-15. doi: 10.1007/s10147-013-0581-2.
- Konishi S., Hatakeyama S., Numakura K., Narita S., Inoue T., Saito M. et al. Validation of the IMDC prognostic model in patients with metastatic renal-cell carcinoma treated with first-line Axitinib: a multicenter retrospective study. Clin Genitourin Cancer. 2019 Oct;17 (5):e1080-e1089. doi: 10.1016/j. clgc. 2019.07.006.
- Jardim D. L., Goodman A., de Melo Gagliato D., Kurzrock R. The Challenges of Tumor Mutational Burden as an Immunotherapy Biomarker. Cancer Cell. 2021 Feb 8;39 (2):154-173. doi: 10.1016/j. ccell. 2020.10.001.
- Shen X., Zhao B. Efficacy of PD-1 or PD-L1 inhibitors and PD-L1 expression status in cancer: meta-analysis. BMJ. 2018 Sep 10;362: k3529. doi: 10.1136/bmj. k3529.
- Xu Y., Wan B., Chen X., Zhan P., Zhao Y., Zhang T., Liu H. et al. The association of PD-L1 expression with the efficacy of anti-PD-1/PD-L1 immunotherapy and survival of non-small cell lung cancer patients: a meta-analysis of randomized controlled trials. Transl Lung Cancer Res. 2019 Aug;8 (4):413-428. doi: 10.21037/tlcr. 2019.08.09.
- Halbert B., Einstein D. J. Hot or Not: Tumor Mutational Burden (TMB) as a Biomarker of Immunotherapy Response in Genitourinary Cancers. Urology. 2021 Jan;147:119-126. doi: 10.1016/j. urology. 2020.10.030.
- Zhu J., Armstrong A. J., Friedlander T. W., Kim W., Pal S. K., George D. J., Zhang T. Biomarkers of immunotherapy in urothelial and renal cell carcinoma: PD-L1, tumor mutational burden, and beyond. J Immunother Cancer. 2018 Jan 25;6 (1):4. doi: 10.1186/s40425-018-0314-1.
- Motzer R. J., Escudier B., McDermott D. F., George S. et al. CheckMate 025 Investigators. Nivolumab versus Everolimus in Advanced Renal-Cell Carcinoma. N Engl J Med. 2015 Nov 5;373 (19):1803-13. doi: 10.1056/NEJMoa1510665.
- Motzer R. J., Tannir N. M., McDermott D. F. et al. CheckMate 214 Investigators. Nivolumab plus Ipilimumab versus Sunitinib in Advanced Renal-Cell Carcinoma. N Engl J Med. 2018 Apr 5;378 (14):1277-1290. doi: 10.1056/NEJMoa1712126.
- McDermott D. F., Huseni M. A., Atkins M. B., Motzer R. J., Rini B. I. et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat Med. 2018 Jun;24 (6):749-757. doi: 10.1038/s41591-018-0053-3.
- Fehrenbacher L., Spira A., Ballinger M., Kowanetz M. et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicentre, open-label, phase 2 randomised controlled trial. Lancet. 2016 Apr 30;387 (10030):1837-46. doi: 10.1016/S0140-6736 (16) 00587-0.
- Rosenberg J. E., Hoffman-Censits J., Powles T., van der Heijden M. S. et al. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet. 2016 May 7;387 (10031):1909-20. doi: 10.1016/S0140-6736 (16) 00561-4.
- Snyder A., Makarov V., Merghoub T., Yuan J. et al. Genetic basis for clinical response to CTLA-4 blockade in melanoma. N Engl J Med. 2014 Dec 4;371 (23):2189-2199. doi: 10.1056/NEJMoa1406498.
- Rizvi N. A., Mazieres J., Planchard D. et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial. Lancet Oncol. 2015 Mar;16 (3):257-65. doi: 10.1016/S1470-2045 (15) 70054-9.
- Gabrilovich D. I., Nagaraj S. Myeloid-derived suppressor cells as regulators of the immune system. Nat Rev Immunol. 2009 Mar;9 (3):162-74. doi: 10.1038/nri2506.
- Robert J. Motzer et al. CheckMate 025 Randomized Phase 3 Study: Outcomes by Key Baseline Factors and Prior Therapy for Nivolumab Versus Everolimus in Advanced Renal Cell Carcinoma. Eur Urol. 2017 Dec;72 (6):962-971. doi: 10.1016/j. eururo. 2017.02.010.
- McDermott D. F., Huseni M. A., Atkins M. B., Motzer R. J. et al. Clinical activity and molecular correlates of response to atezolizumab alone or in combination with bevacizumab versus sunitinib in renal cell carcinoma. Nat Med. 2018 Jun;24 (6):749-757. doi: 10.1038/s41591-018-0053-3.
- Rini B. I., Motzer R. J., Powles T., McDermott D. F. et al. Atezolizumab plus Bevacizumab Versus Sunitinib for Patients with Untreated Metastatic Renal Cell Carcinoma and Sarcomatoid Features: A Prespecified Subgroup Analysis of the IMmotion151 Clinical Trial. Eur Urol. 2021 May;79 (5):659-662. doi: 10.1016/j. eururo. 2020.06.021.
- Courcier J., Dalban C., Laguerre B., Ladoire S. et al. Primary Renal Tumour Response in Patients Treated with Nivolumab for Metastatic Renal Cell Carcinoma: Results from the GETUG-AFU 26 NIVOREN Trial. Eur Urol. 2021 Jun 5: S0302-2838 (21) 00389-4. doi: 10.1016/j. eururo. 2021.05.020.


