Опыт применения пертузумаба в противоопухолевой лекарственной терапии HER2-позитивного рака молочной железы
Автор: Кит Олег Иванович, Владимирова Любовь Юрьевна, Калабанова Елена Александровна, Сторожакова Анна Эдуардовна, Кабанов Сергей Николаевич, Снежко Татьяна Александровна, Миташок Ирина Степановна, Светицкая Яна Владимировна, Саманева Наталья Юрьевна, Корнилова Ирина Сергеевна, Пржедецкий Юрий Валентинович, Позднякова Виктория Вадимовна, Абрамова Наталья Александровна, Попова Ирина Леонидовна, Тихановская Наталья Михайловна, Льянова Аза Ахмедовна, Новоселова Кристина Александровна, Рядинская Людмила Алексеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 2 т.20, 2021 года.
Бесплатный доступ
Актуальность. Рак молочной железы (РМЖ) по заболеваемости и смертности среди женского населения в Российской Федерации занимает лидирующие позиции. Прогноз течения заболевания во многом определяется биологическим подтипом опухоли. Для Нег2-позитивного РМЖ характерны агрессивное течение и неблагоприятный прогноз. Внедрение в клиническую практику пертузумаба, являющегося рекомбинантным гуманизированным моноклональным антителом к рецепторам эпидермального фактора роста человека 2-го типа, позволило значительно улучшить непосредственные и отдаленные результаты лечения. Цель исследования - оценка результатов лечения больных раком молочной железы с Нег2-положительным молекулярно-генетическим подтипом при проведении химиотерапии в сочетании с двойной анти-Нег2-блокадой, а также степени выраженности и частоты встречаемости побочных эффектов. Материал и методы. В период с 2015 по 2018 г 37 пациенткам с Нег2-положительным молекулярно-генетическим подтипом рака молочной железы проведена химиотерапия в сочетании с двойной анти-Нег2-блокадой (доцетаксел 75 мг/м2, внутривенно, в 1-й день + трастузумаб 6 мг/кг (нагрузочная доза - 8 мг/кг), внутривенно, в 1-й день + пертузумаб 420 мг (нагрузочная доза - 840 мг), внутривенно, в 1-й день, 1 раз в 3 нед). На момент установления диагноза средний возраст был 45,6 ± 11,6 года. Результаты. Применение в неоадъювантном режиме пертузумаба в комбинации с трастузумабом и доцетакселом позволило получить полный патоморфологический ответ у 12 % больных, патоморфоз III степени - у 36 %. При использовании данной схемы противоопухолевой лекарственной терапии в неоадъювантном режиме в настоящее время к III клинической группе относятся 64 % пациенток, про-грессирование выявлено у 4 %. Чаще выявлялись следующие побочные эффекты: общая слабость и повышенная утомляемость - в 5,4 %, гематологическая токсичность в виде лейкопении I-II степени - в 5,4 % случаев. Заключение. Результаты подтверждают полученную ранее в рандомизированных исследованиях эффективность противоопухолевой лекарственной терапии пертузумабом в комбинации с трастузумабом и доцетакселом у больных Нег2-положительным раком молочной железы.
Рак молочной железы, нег2-положительный подтип, пертузумаб, прогноз
Короткий адрес: https://sciup.org/140254432
IDR: 140254432 | УДК: 618.19-006.6-08:615.277.3:615.015 | DOI: 10.21294/1814-4861-2021-20-2-85-92
Текст научной статьи Опыт применения пертузумаба в противоопухолевой лекарственной терапии HER2-позитивного рака молочной железы
Рак молочной железы (РМЖ) среди женского населения России занимает ведущую позицию. Ежегодно в России диагностируется около 50 000 новых случаев заболевания РМЖ [1]. В 2017 г. абсолютное число женщин с впервые установленным диагнозом рак молочной железы составило 70 569. Известно, что в структуре смертности женщин наибольший удельный вес имеют злокачественные образования молочной железы, поэтому улучшение результатов лечения РМЖ является актуальным вопросом современной онкологии.
Течение и прогноз заболевания зависят от молекулярно-генетического подтипа РМЖ. В настоящее время известно о многочисленных различиях между подтипами РМЖ, например в уровне экспрессии рецепторов белков, участвующих в процессе апоптоза: p53 и BCL-2. Так, положительный Her2-статус опухоли наиболее сильно коррелирует с высоким уровнем экспрессии р53 [2]. По данным Всероссийского исследования «Эпидемиологическая программа скрининга Her2-статуса у больных раком молочной железы», 16 % пациентов имеют Her2-положительный статус [3]. Гиперэкспрессия
Her2 в опухоли ведет к усилению пролиферации и ангиогенеза, нарушению регуляции апоптоза. Поэтому Her2-позитивный рак молочной железы характеризуется агрессивным течением и ассоциируется с неблагоприятным прогнозом. Согласно исследованиям В.Е. Плотниковой и соавт. [4], в которых изучались факторы риска метастатического поражения головного мозга при РМЖ, в данной группе достоверно чаще встречались больные с гиперэкспрессией Her2/neu (p<0,05).
Применение неоадъювантной противоопухолевой лекарственной терапии при первичнооперабельном РМЖ (II стадия) значительно увеличивает число случаев проведения органосохраняющего лечения, а при местнораспространенном РМЖ (III стадия) неоадъювантная терапия необходима для перевода опухоли из неоперабельного состояния в операбельное и выполнения хирургического вмешательства после уменьшения размера опухоли [5]. Показателем эффективности неоадъювантной лекарственной терапии является значительное уменьшение опухоли в размерах (объективный ответ) или даже её исчезновение
(полный ответ или полный патоморфологический ответ). Полный патоморфологический ответ ассоциируется с лучшими отдаленными результатами лечения (безрецидивной выживаемостью и выживаемостью без прогрессирования). M. Kim et al. представлен анализ 14 рандомизированных клинических исследований, выявивших снижение риска смерти почти наполовину у пациентов, получивших полный патоморфологический ответ, по сравнению с теми лицами, у кого сохранялась резидуальная опухоль на момент хирургического этапа лечения [6]. Поэтому целесообразным является назначение наиболее эффективных лекарственных комбинаций на этапах неоадъювантной лекарственной терапии РМЖ.
Результаты проведенных рандомизированных исследований II фазы NeoSphere и TRYPHAENA позволили сделать выводы о высокой эффективности комбинации пертузумаба и трастузумаба с доцетакселом в составе антрациклин-содержащей и безантрациклиновой схемы неоадъювантной терапии первично-операбельного и местнораспространенного (в том числе отёчно-инфильтративного) Her2-положительного РМЖ. Частота полного патоморфологического ответа достигла 66 %, объективный ответ на терапию пертузумабом и трастузумабом отмечался у 95 % пациенток при одной из схем химиотерапии. Неоадъювантная терапия комбинацией пертузумаба и трастузумаба с доцетакселом снижала риск рецидива на 40 % (5-летняя безрецидивная выживаемость отмечена у 84 % пациентов). Необходимо отметить благоприятный профиль безопасности данной схемы лечения, тип и частота нежелательных явлений были обусловлены применяемыми химиопрепаратами [7–10].
Целью адъювантного этапа лечения РМЖ является профилактика возможного рецидива заболевания. При Her2-положительном РМЖ адъювантное лечение анти-Her2-препаратами продолжается 1 год (включая дооперационный этап в случае проведения неоадъювантной терапии). Несмотря на применение стандартной адъювантной терапии трастузумабом в течение 1 года у пациенток с ранним Her2-положительным РМЖ, более 25 % пациенток рецидивируют в течение первых 10 лет. Чаще всего рецидив заболевания наблюдается у пациенток с метастазами в лимфатические узлы на момент диагностики, а также у пациенток с Her2-положительным гормон-отрицательным вариантом опухоли [11, 12]. Применение комбинации пер-тузумаба и трастузумаба в адъювантном режиме позволяет снизить риск рецидива у пациенток с Her2-положительным РМЖ с метастазами в лимфатические узлы или отрицательным статусом гормональных рецепторов до 24 % [13].
У больных РМЖ IV стадии противоопухолевая лекарственная терапия направлена на улучшение качества жизни и увеличение ее продолжительности.
У больных метастатическим Her2-положительным раком молочной железы в первой линии терапии применение комбинации пертузумаба и трастузумаба с доцетакселом позволило достичь общей выживаемости, равной 56,5 мес (значимое увеличение на 15,7 мес, ОР=0,68, р˂0,001). Особенно актуальным у данной категории больных является благоприятный профиль безопасности комбинации пертузумаб + трастузумаб + доцетаксел. Выявленные нежелательные явления были характерны для доцетаксела [14, 15].
Нами представлен опыт проведения двойной анти-Her2-блокады у пациенток с наличием гиперэкспрессии Her2/Neu. В период с 2015 по 2018 г. 37 пациенткам с Her2-положительным молекулярно-генетическим подтипом РМЖ проведена химиотерапия в сочетании с двойной анти-Her2-блокадой. Нелюминальный Her2-положительный подтип выявлен у 16 (43,2 %), люминальный В Her2-положительный подтип – у 21 (56,8 %) пациентки.
В анализируемой группе больных I стадия РМЖ выявлена у 1 (2,7 %) пациентки, IIа стадия – у 6 (16,2 %), IIb стадия – у 12 (32,5 %), IIIа стадия – у 2 (5,4 %) больных, IIIb стадия – у 9 (24,3 %), IIIc стадия – у 5 (13,5 %) больных. При первичном обращении IV стадия РМЖ выявлена у 2 (5,4 %) больных (табл. 1). На момент установления диагноза пациентки были в возрасте от 28 до 68 лет, средний возраст – 45,6 ± 11,6 года.
В неоадъювантном режиме противоопухолевая лекарственная терапия по схеме: доцетаксел 75 мг/м2, внутривенно, в 1-й день + трастузумаб 6 мг/кг (нагрузочная доза – 8 мг/кг), внутривенно, в 1-й день + пертузумаб 420 мг (нагрузочная доза – 840 мг), внутривенно, в 1-й день, 1 раз в 3 нед проведена 25 больным (67,6 % от общего числа наблюдаемых пациенток). Из них IIа стадия РМЖ диагностирована у 4 (16 %), IIb стадия – у 11 (44 %), IIIа стадия – у 2 (8 %), IIIb стадия – у 5 (20 %), IIIc стадия – у 3 (12 %) больных. Люминальный В Her2-положительный подтип выявлен у 15 (60 %), нелюминальный Her2-положительный подтип – у 10 (40 %) пациенток.
После неоадъювантной химиотерапии в сочетании с двойной анти-Her2-блокадой полный ответ по критериям RECIST 1.1 (2009 г.) выявлен у 5 (20 %) пациенток, частичный ответ – у 10 (40 %), стабилизация – у 10 (40 %) больных. Полный патоморфологический ответ по Г.А. Лавниковой выявлен у 3 (12 %), патоморфоз III степени – у 9 (36 %) больных. В остальных случаях, у 13 (52 %) больных по результатам послеоперационного гистологического анализа выявлен лекарственный патоморфоз II степени.
Из 25 больных РМЖ, получивших противоопухолевую лекарственную терапию по схеме трастузумаб + пертузумаб + доцетаксел в неоадъювантном режиме, 16 (64 %) пациенток на момент
Таблица 1/Table 1
Распределение больных РМЖ по стадиям и системе TNM (7-е издание, 2010 г.)
Distribution of patients by stages and the TNM classification (7th edition, 2010)
Клинический пример
Пациентка Т., 48 лет, в мае 2017 г. обратилась в клинико-диагностическое отделение нашего центра с жалобами на образование в левой молочной железе. При выполнении КТ органов грудной клетки, брюшной полости, малого таза в левой молочной железе определялась опухоль 4×3 см, аксиллярные лимфоузлы слева 1,6 см, в других органах метастазы не определялись. Выполнена трепан-биопсия опухоли левой молочной железы, патоморфологическое заключение – инвазивная карцинома. По данным иммуногистохимического исследования: экспрессия рецепторов эстрогена – 85 %, экспрессия рецепторов прогестерона – 50 %, экспрессия Ki67 – 60 % ядер, Her2/Neu на уровне 3 (+). Установлен клинический диагноз: рак левой молочной железы St IIb, сT2N1M0, люминальный В подтип с гиперэкспрессией Her2/Neu.
С 1.06.17 проведено 4 курса неоадъювантной полихимиотерапии по схеме АС (доксорубицин в дозе 60 мг/м2, внутривенно капельно, в 1-й день, циклофосфамид – 600 мг/м2, внутривенно капельно, в 1-й день, цикл – 21 день). С 5.09.17 проведено 4 курса неоадъювантной полихимиотерапии по схеме: доцетаксел 75 мг /м2, внутривенно, в 1-й день + трастузумаб 6 мг / кг (нагрузочная доза – 8 мг / кг), внутривенно, в 1-й день + пертузумаб 420 мг (нагрузочная доза – 840 мг), внутривенно, в 1-й день, 1 раз в 3 нед. Проведение химиотера- пии в комбинации с двойной анти-Her2-блокадой какими-либо клинически значимыми осложнениями не сопровождалось (отмечена тошнота I степени). По данным эхокардиографии фракция выброса левого желудочка до начала таргетной терапии составила 62,4 %, после завершения неоадъювантного этапа противоопухолевой лекарственной терапии – 61,7 %.
После 8 курсов неоадъювантной полихимиотерапии при контрольной КТ органов грудной клетки, брюшной полости, малого таза в левой молочной железе обнаружен узел размером 1 см, аксиллярные лимфоузлы не определяются. Таким образом, по критериям RECIST 1.1 выявлен частичный ответ. 30.11.17 выполнена радикальная мастэктомия слева по Маддену. При гистологическом исследовании на месте опухоли выявлен фиброз, полный морфологический ответ опухоли на лечение, RCB 0 (рис. 1–2).
Далее была проведена конформная дистанционная лучевая терапия на послеоперационный рубец на месте левой молочной железы и зоны лимфооттока слева, СОД 50 изоГр. Продолжено введение трастузумаба в дозе 6 мг/кг, внутривенно капельно, 1 раз в 21 день, до 12 мес (с учетом дооперационного этапа) и гормонотерапия антиэстрогенами. В настоящее время пациентка жива, находится в III клинической группе. Период наблюдения от момента установления диагноза до времени подачи статьи в редакцию журнала составил 22 мес без признаков прогрессирования.
Медиана наблюдения за группой больных, получивших химиотерапию таксанами в сочетании с двойной анти-Her2-блокадой в неоадъювантном и адъювантном режиме, составила 14 мес. Медиана общей выживаемости к настоящему времени не достигнута.
При генерализации Her2-положительного РМЖ данная схема была использована у 10 (27 %)
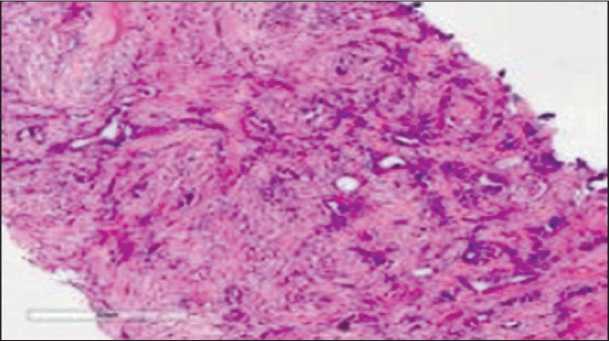
Рис. 1. Микрофото. Биоптат РМЖ до начала противоопухолевой лекарственной терапии. Окраска гематоксилином и эозином, ×5
Fig. 1. Microphoto. Breast cancer biopsy material before anticancer therapy. Hematoxylin and eosin staining, ×5
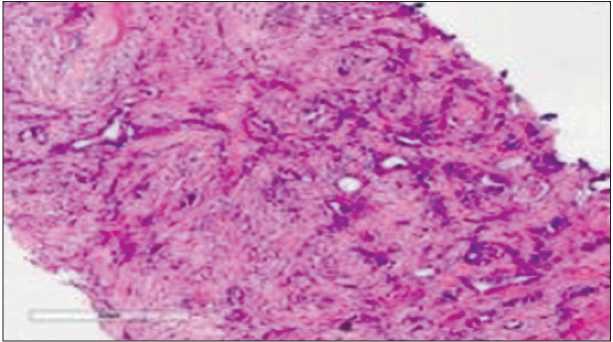
Рис. 2. Микрофото. После неоадъювантной противоопухолевой лекарственной терапии – фиброзная ткань на месте опухоли с единичными сохранившимися железами молочной железы нормального строения. Окраска гематоксилином и эозином, ×5
Fig. 2. Microphoto. After neoadjuvant anticancer medical therapy – fibrous tissue in place of the tumor with single preserved glands of the breast with the normal structure.
Hematoxylin and eosin staining, ×5
пациенток, у двух из них на момент обращения был выявлен первично-генерализованный Her2-положительный РМЖ. Частота объективного ответа, по нашим данным, составила 60 % (6 больных), при этом полный ответ выявлен у 1 (10 %) пациентки. Прогрессирование выявлено у 4 (40 %) больных. Эти значения ниже, чем представленные в результатах исследования CLEOPATRA (изучение пертузумаба, трастузумаба, доцетаксела в лечении Her-2-положительного метастатического РМЖ), где частота объективного ответа составила 80,2 %, что, возможно, связано с небольшой группой наблюдаемых нами больных. По нашим данным, при генерализованном РМЖ медиана общей выживаемости составила 56 мес, общая трехлетняя выживаемость – 68 %, больные продолжают наблюдаться. Согласно данным двойного слепого рандомизированного исследования CLEOPATRA, медиана общей выживаемости составила 56,5 мес. Таким образом, полученные нами данные по отдаленным результатам лечения не отличаются от показателей в исследовании CLEOPATRA.
При противоопухолевой терапии пертузумабом в комбинации с трастузумабом и доцетакселом нами отмечены следующие нежелательные явления: общая слабость и повышенная утомляемость – в 5,4 % случаев, гематологическая токсичность в виде лейкопении I–II степени – в 5,4 % случаев. Реже отмечались – нейтропения I степени (2,7 %), сыпь на коже I степени (2,7 %), тошнота I степени (2,7 %), тахикардия II степени (2,7 %), повышение уровней АЛТ и АСТ – печеночная токсичность I степени (2,7 %). Нежелательные явления были контролируемыми, поддавались медикаментозной коррекции, не требовали отсрочки курса противоопухолевой терапии или снижения дозы лекарствен- ных препаратов. Включение пертузумаба в схемы противоопухолевой лекарственной терапии не изменяло профиль токсичности. Всем пациенткам до начала терапии пертузумабом и трастузумабом и каждые 3 мес оценивалась фракция выброса левого желудочка, которая в среднем до начала лечения составила 67 ± 3%, через 3 мес – 64 ± 3 %. Таким образом, не отмечалось клинически значимого изменения данного показателя.
При сравнении полученных нами данных о степени патоморфологического ответа после неоадъювантной терапии комбинацией пертузумаба и трастузумаба с доцетакселом с данными исследования II фазы NeoSphere выявлены некоторые различия. По данным исследования NeoSphere, в 45,8 % случаев был получен полный патоморфо-логический ответ, в нашей группе он наблюдался у 12 % пациенток. Возможное объяснение этих различий – преобладание в нашей группе люминального В подтипа опухоли, при котором реже достигается патоморфоз III–IV степени.
В группе больных РМЖ, получивших противоопухолевую лекарственную терапию по схеме трастузумаб + пертузумаб + доцетаксел в неоадъювантном и/или адъювантном режиме, медиана общей выживаемости не достигнута, общая однолетняя выживаемость – 100 %.
Полученные данные подтверждают эффективность противоопухолевой лекарственной терапии у пациенток с Her2-положительным раком молочной железы пертузумабом в комбинации с трастузумабом и доцетакселом. Отмечена хорошая переносимость этих комбинаций, применение данной схемы не сопровождалось серьезными нежелательными явлениями.
Список литературы Опыт применения пертузумаба в противоопухолевой лекарственной терапии HER2-позитивного рака молочной железы
- Kolyadina I.V., Poddubnaya I.V., Frank G.A., Komov D.V., Karseladze A.I., Ermilova V.D., Vishnevskaya Ya.V. Geterogennost' raka molochnoi zhelezy I stadii: biologicheskoe i prognosticheskoe znachenie. Zlokachestvennye opukholi. 2015; 1: 35-45. https://doi.org/10.18027/2224-5057-2015-1-31-40.
- Kit O.I., Shatova Yu.S., Novikova I.A., Vladimirova L.Yu., Ul'yanova E.P., Komova E.A., Kechedzhieva E.E. Ekspressiya p53 i BCL2 pri razlichnykh podtipakh raka molochnoi zhelezy. Fundamental'nye issledovaniya. 2014; 10: 85-88.
- Poddubnaya I.V., Frank G.A., Yagudina R.I., Koroleva N.I., Zavalishina L.E. Rezul'taty epidemiologicheskoi programmy skrininga HER2-statusa u patsientok s rakom molochnoi zhelezy v federal'nykh okrugakh Rossiiskoi Federatsii za 2015 god. Sovremennaya onkologiya. 2016; 3(18): 19-26.
- Plotnikova B.E., Nepomnyashchaya E.M., Grigorov C.V. Faktory riska metastaticheskogo porazheniya golovnogo mozga pri rake molochnoi zhelezy. Nauchnye vedomosti. Seriya Meditsina. Farmatsiya. 2013; 11(154) (22): 84-89.
- Rossiiskoe obshchestvo klinicheskoi onkologii (RUSSCO). Prakticheskie rekomendatsii po lekarstvennomu lecheniyu invazivnogo raka molochnoi zhelezy. 2018; 113-144.
- Kim M.M., Allen P., Gonzalez-Angulo A.M., Woodward W.A., MericBernstam F., Buzdar A.U., Hunt K.K., Kuerer H.M., Litton J.K., Hortobagyi G.N., Buchholz T.A., Mittendorf E.A. Pathologic complete response to neoadjuvant chemotherapy with trastuzumab predicts for improved survival in women with HER2-overexpressing breast cancer. Ann Oncol. 2013 Aug; 24(8): 1999-2004. https://doi.org/10.1093/annonc/mdt131.
- Nagayama A., Hayashida T., Jinno H., Takahashi M., Seki T., Matsumoto A., Murata T., Ashrafian H., Athanasiou T., Okabayashi K., Kitagawa Y. Comparative effectiveness of neoadjuvant therapy for HER2-positive breast cancer: a network meta-analysis. J Natl Cancer Inst. 2014 Sep 15; 106(9): dju203. https://doi.org/10.1093/jnci/dju203.
- Schneeweiss A., Chia S., Hickish T., Harvey V., Eniu A., Hegg R., Tausch C., Seo J.H., Tsai Y.F., Ratnayake J., McNally V., Ross G., Cortés J. Pertuzumab plus trastuzumab in combination with standard neoadjuvant anthracycline-containing and anthracycline-free chemotherapy regimens in patients with HER2-positive early breast cancer: a randomized phase II cardiac safety study (TRYPHAENA). Ann Oncol. 2013; 24(9): 2278-84. https://doi.org/10.1093/annonc/mdt182.
- Gianni L., Pienkowski T., Im Y.H., Roman L., Tseng L.M., Liu M.C., Lluch A., Staroslawska E., de la Haba-Rodriguez J., Im S.A., Pedrini J.L., Poirier B., Morandi P., Semiglazov V., Srimuninnimit V., Bianchi G., Szado T., Ratnayake J., Ross G., Valagussa P. Efficacy and safety of neoadjuvant pertuzumab and trastuzumab in women with locally advanced, inflammatory, or early HER2-positive breast cancer (NeoSphere): a randomised multicentre, open-label, phase 2 trial. Lancet Oncol. 2012 Jan; 13(1): 25-32. https://doi.org/10.1016/S1470-2045(11)70336-9.
- Gianni L., Pienkowski T., Im Y.-H. Five-year analysis of the phase II NeoSphere trial evaluating four cycles of neoadjuvant docetaxel (D) and/or trastuzumab (T) and/or pertuzumab (P). J Clin Oncol. 2015; 33(15_suppl): 505. https://doi.org/10.1200/jco.2015.33.15_suppl.505.
- Perez E.A., Romond E.H., Suman V.J., Jeong J.H., Sledge G., Geyer C.E.Jr., Martino S., Rastogi P., Gralow J., Swain S.M., Winer E.P., Colon-Otero G., Davidson N.E., Mamounas E., Zujewski J.A., Wolmark N. Trastuzumab plus adjuvant chemotherapy for human epidermal growth factor receptor 2-positive breast cancer: planned joint analysis of overall survival from NSABP B-31 and NCCTG N9831. J Clin Oncol. 2014 Nov 20; 32(33): 3744-52. https://doi.org/10.1200/JCO.2014.55.5730.
- Cameron D., Piccart-Gebhart M.J., Gelber R.D., Procter M., Goldhirsch A., de Azambuja E., Castro G.Jr., Untch M., Smith I., Gianni L., Baselga J., Al-Sakaff N., Lauer S., McFadden E., Leyland-Jones B., Bell R., Dowsett M., Jackisch C.; Herceptin Adjuvant (HERA) Trial Study Team. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2-positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017 Mar 25; 389(10075): 1195-1205. https://doi.org/10.1016/S0140-6736(16)32616-2.
- Curigliano G., Burstein H.J., Winer E.P., Gnant M., Dubsky P., Loibl S., Colleoni M., Regan M.M., Piccart-Gebhart M., Senn H.J., Thürlimann B.; St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2017, André F., Baselga J., Bergh J., Bonnefoi H., Brucker S.Y., Cardoso F., Carey L., Ciruelos E., Cuzick J., Denkert C., Di Leo A., Ejlertsen B., Francis P., Galimberti V., Garber J., Gulluoglu B., Goodwin P., Harbeck N., Hayes D.F., Huang C.S., Huober J., Hussein K., Jassem J., Jiang Z., Karlsson P., Morrow M., Orecchia R., Osborne K.C., Pagani O., Partridge A.H., Pritchard K., Ro J., Rutgers E.J.T., Sedlmayer F., Semiglazov V., Shao Z., Smith I., Toi M., Tutt A., Viale G., Watanabe T., Whelan T.J., Xu B. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. Ann Oncol. 2017 Aug 1; 28(8): 1700-1712. https://doi.org/10.1093/annonc/mdx308.
- Swain S.M., Miles D., Kim S.B., Im Y.H., Im S.A., Semiglazov V., Ciruelos E., Schneeweiss A., Loi S., Monturus E., Clark E., Knott A., Restuccia E., Benyunes M.C., Cortés J.; CLEOPATRA study group. Pertuzumab, trastuzumab, and docetaxel for HER2-positive metastatic breast cancer (CLEOPATRA): end-of-study results from a double-blind, randomised, placebo-controlled, phase 3 study. Lancet Oncol. 2020 Apr; 21(4): 519-530. https://doi.org/10.1016/S1470-2045(19)30863-0.
- Swain S.M., Baselga J., Kim S.B., Ro J., Semiglazov V., Campone M., Ciruelos E., Ferrero J.M., Schneeweiss A., Heeson S., Clark E., Ross G., Benyunes M.C., Cortés J.; CLEOPATRA Study Group. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med. 2015 Feb 19; 372(8): 724-34. https://doi.org/10.1056/NEJMoa1413513.


