Опыт применения портативного отечественного нейтронного генератора в схемах гамма-нейтронной терапии домашних животных со злокачественными новообразованиями
Автор: Корякин С.Н., Кайдан Н.А., Исаева Е.В., Ульяненко Л.Н., Лычагин А.А., Ульяненко С.Е.
Рубрика: Научные статьи
Статья в выпуске: 1 т.27, 2018 года.
Бесплатный доступ
Апробация схем гамма- и нейтронного воздействий в опытах in vivo основана на полученных нами ранее данных о синергическом взаимодействии двух излучений различного качества. Источником нейтронов служил портативный импульсный генератор ИНГ-031. Номинальная энергия нейтронного излучения - 14,1 МэВ, интенсивность потока нейтронов - до 6×109 н/с, длительность импульсов - 1 мкс. Схемы сочетанного нейтронного и гамма-облучений были апробированы (отдельные клинические случаи) на 18 мелких домашних животных (14 собаках и 4 кошках в возрасте от 4 до 18 лет) со злокачественными опухолями. Животных облучали 2 раза в неделю, по 4-6 сеансов за курс. В течение каждого сеанса облучение проводили сначала g-излучением, затем нейтронами с интервалом между воздействиями 15 мин. Разовая очаговая доза g-облучения составляла 5-8 Гр, нейтронов - 1,0-1,4 Гр. Вклад нейтронов в суммарную очаговую дозу (СОД) облучения с учётом коэффициента ОБЭ (2,5) составлял от 25 до 40%. Значения СОД варьировали от 10,5 до 48,0 Гр-экв. После курса гамма-нейтронной терапии у 58% животных была достигнута полная и у 16% - частичная регрессия опухоли. Уменьшение размера опухоли в 1,5-3 раза и улучшение общего состояния животных отмечали уже после 3-4 сеансов облучения. Реакции нормальных тканей, попадающих в поле облучения, у животных с полной или частичной регрессией опухоли были незначительными. Результаты предварительных исследований свидетельствуют о возможности разработки медицинской технологии сочетанной гамма-нейтронной терапии с использованием портативных генераторов нейтронов и перспективности её внедрения в клиническую практику.
Нейтронный генератор, дозиметрия, гамма-нейтронное облучение, поглощённая доза, радиобиологические эффекты, обэ, злокачественные новообразования, кошки, собаки, лучевая терапия, эффективность лечения, сопутствующие реакции
Короткий адрес: https://sciup.org/170170339
IDR: 170170339 | УДК: 616-006.04-085.014.482.4/6-092.9 | DOI: 10.21870/0131-3878-2018-27-1-94-106
Текст научной статьи Опыт применения портативного отечественного нейтронного генератора в схемах гамма-нейтронной терапии домашних животных со злокачественными новообразованиями
Для диагностики и лучевой терапии пациентов со злокачественными новообразованиями могут быть использованы различные виды ионизирующего излучения, однако излучения с высокими значениями ЛПЭ (линейная передача энергии) эффективнее воздействуют на радиоре-зистентные или интенсивно растущие опухоли [1-3]. Терапевтический эффект от нейтронов может быть достигнут при меньших дозах, чем при других видах излучения [4, 5], поскольку они, во-первых, способны индуцировать множественные летальные для клетки двунитевые разрывы ДНК за счёт образования вторичных частиц – продуктов отдачи (протоны и тяжёлые ионы) с высокой ЛПЭ и, во-вторых, развитие биологического эффекта практически не зависит от фаз клеточного цикла и насыщения клеток кислородом.
Источниками быстрых нейтронов для медицинских целей, как правило, служат ускорители заряженных частиц, нейтронные генераторы, реакторы. В настоящее время в мире проводится лечение в семи центрах нейтронной терапии (из 24 созданных) [6]: 3 центра находятся в США – Батавия (Лаборатория Ферми, линейный ускоритель протонов, 70 МэВ, начало работы 1976 г.),
Корякин С.Н. * – зав. лаб., к.б.н.; Исаева Е.В. – с.н.с., к.вет.н.; Ульяненко Л.Н. – в.н.с., д.б.н., проф.; Лычагин А.А. – зав. лаб., к.ф.-м.н.; Ульяненко С.Е. – зав. отделом, д.б.н. МРНЦ им. А.Ф. Цыба – филиал ФБГУ «НМИЦ радиологии» Минздрава России. Кайдан Н.А. – терапевт-онколог. Вет. центр «Велес».
Детройт (циклотрон, d(48,5)+Be, 1990 г.), Сиэтл (циклотрон, 50 МэВ, 1984 г.); 2 центра в России – Снежинск (нейтронный генератор НГ-12И, D-T реакция, энергия нейтронов 12-14 МэВ, 1999 г.), Томск (циклотрон У-120, энергия нейтронов 6,3 МэВ, 1984 г.); 1 центр в ЮАР, Кейптаун (Лаборатория Итемба, циклотрон, p(66)+Be, 1988 г.); 1 центр в Германии, Мюнхен – реактор FRM-II.
В Обнинске на горизонтальном пучке Б-3 реактора БР-10 с 1985 г. применяли нейтронное излучение в целях терапии онкологических больных [7], но после вывода реактора из эксплуатации (2002 г.) клинические исследования прекратились.
Одной из причин ограничения применения нейтронного излучения для лечения онкологических больных является высокий риск развития тяжёлых местных поздних лучевых повреждений [8, 9]. Поэтому нейтроны редко применяют в самостоятельном варианте, чаще в смешанных фотонно-нейтронных курсах облучения, в том числе до или после проведения хирургической операции. Сочетанная фотонно-нейтронная терапия позволяет сохранить преимущества нейтронного облучения и одновременно ослабить его негативное воздействие, предоставляя возможность расширить показания к её применению [9, 10]. В России сочетанная фотоннонейтронная терапия проводится, в основном, у пациентов с радиорезистентными и местнораспространёнными злокачественными новообразованиями, такими как опухоли околоушной слюнной железы, щитовидной железы, местнораспространённый рак молочной железы и его рецидивы, рак гортани и гортаноглотки [10-12].
Как правило, источники нейтронов – массивные циклотроны, созданные для решения физических задач и лишь приспособленные для медицинских целей [10]. Этим недостатком (громоздкость и удалённость источников излучения от клиник), в первую очередь, объясняется сдержанное использование нейтронного излучения в онкологии. Применение малогабаритных портативных генераторов нейтронов внутриклинического размещения позволит значительно расширить возможность использования нейтронной терапии в различных медицинских учреждениях.
Во ФГУП «ВНИИА им. Н.Л. Духова» (Москва) совместно с МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России разработаны и изготовлены портативные нейтронные генераторы (ПНГ) с энергией нейтронов 14,1 МэВ импульсного (ИНГ-031) и непрерывного (НГ-14) действия, ведутся работы по разработке ПНГ типа НГ-24 для внутриклинического размещения. Спроектировано устройство для дистанционной терапии быстрыми нейтронами на базе генератора НГ-24 с использованием ядерной реакции 3Т(d,n)4Не с потоком нейтронов ~1011 н/с [13]. На устройство для лучевой терапии быстрыми нейтронами и аппарат для дистанционной нейтронной терапии получены патенты на изобретения [14, 15].
В МРНЦ им. А.Ф. Цыба разработан оригинальный подход повышения эффективности подавления опухолевых клеток за счёт применения фотонного и нейтронного излучений с определённым вкладом [16]. Результаты экспериментальных исследований с использованием ПНГ дают основание для развития фотонно-нейтронной терапии в России. Установлено, что импульсное и непрерывное нейтронное излучение с энергией 14,1 МэВ не отличаются по своей эффективности при действии на культуру клеток мышиной меланомы В-16 [17, 18]. Результаты одновременного облучения той же культуры гамма- и нейтронным излучениями показали, что при вкладе последнего в суммарную дозу 15-30% наблюдается синергизм [16]. Подтверждение обнаруженного эффекта в опытах in vivo позволит откорректировать дозу облучения в схемах лучевой терапии в меньшую сторону и за счёт этого снизить вероятность повреждения здоровых тканей при сохранении того же уровня противоопухолевой эффективности.
Целью настоящих исследований явилось апробирование отечественного портативного нейтронного генератора в схемах гамма-нейтронной терапии домашних животных с различными клиническими случаями злокачественных новообразований разной локализации.
Материал и методы
Источники ионизирующего излучения . В качестве источника нейтронного излучения использовали портативный импульсный генератор ИНГ-031, разработанный во ФГУП «ВНИИА им. Н.Л. Духова», Москва. Генератор позволял получить импульсный поток нейтронов интенсивностью до 6 - 10 9 н/с с длительностью импульса 1 мкс и частотой повторения 50 Гц. Высокая степень моноэнергетичности нейтронного излучения генератора упрощает дозиметрию и расчёт распределения радиационных полей.
Источником гамма-излучения служила терапевтическая установка «Луч» (60Со, Е ср =1,25 МэВ).
Дозиметрия. Дозиметрия нейтронного и гамма-излучения обеспечивалась с помощью приборов «Измеритель нейтронного потока автоматизированный» (ИНПА), разработки ВНИИА, дозиметров ДКС-101 и UNIDOZ с ионизационными камерами. Погрешность определения поглощённой дозы составляла около 15%. При использовании гамма-источника дозу рассчитывали на основе взаимосогласованной совокупности расчётных, паспортных и измеренных дозиметром данных.
Для получения требуемых терапевтических доз центр опухоли размещали по оси генератора на расстоянии 5-6 см от мишени генератора. Поглощённую дозу определяли расчётом, исходя из полного выхода нейтронов из мишени с использованием табличного коэффициента преобразования потока нейтронов в дозу (керма-фактора k f ) [19] и геометрического фактора G [20], учитывающего геометрию эксперимента (расположение объекта облучения относительно мишени генератора).
G определяли по формуле: ln 1
h 2 + r2 - r 2 + v4 + 2 r 2 ( h2 - R 2 ) + ( h 2 + R 2 ) 2
G = 2 - 2 ,
4 nr2 2h где r – радиус мишени генератора, см, R – расстояние от оси пучка до центра объекта облучения, см, h – расстояние от центра мишени до объекта по оси пучка, см.
Продолжительность облучения фиксировали по показаниям мониторного детектора ИНПА, который заранее, до опыта калибровали на полный выход нейтронов из мишени генератора. В свою очередь, определение потока нейтронов в процессе калибровки мониторов проводилось с помощью трековых детекторов. В этом случае выход нейтронов из мишени рассчитывали по формуле N 0 = F / G , где F - поток нейтронов в точке с координатами ( h , R ) при эффективном радиусе мишени r , определённом по данным, полученным с помощью трековых детекторов и активационного анализа. Оба эти метода позволяют определять нейтронную составляющую поглощённой дозы.
В качестве трековых детекторов использовали детекторы деления из набора ДКН-2 (ВНИИФТРИ, Менделеево) на основе слюды с делящимися изотопами-мишенями 238U, 237Np. Выбор этих изотопов обусловлен тем, что реакции деления на них являются пороговыми (0,4 и 0,6 МэВ соответственно), что в значительной мере режектирует регистрацию неупругорассеянных и замедленных в результате многократных упругих соударений нейтронов с материалами конструкции генератора, окружающего оборудования, а также полностью тепловые и эпитепловые нейтроны из защиты, стен, пола, оборудования.
При облучении нейтронами генератора ИНГ-031 биологический объект подвергается также воздействию сопутствующего гамма-излучения, которое включает в себя тормозное излучение дейтронов в ускоряющей трубке генератора, мгновенное и активационное излучение в результате взаимодействия нейтронов с материалами мишени и окружающего оборудования. Сопутствующее гамма-излучение даёт вклад в поглощённую дозу по экспериментальным данным до 20%.
Режим облучения определяли, исходя из разовой очаговой дозы (РОД), эквивалентной дозе гамма-облучения (Д, Гр-экв.):
Д = (МД n . ОБЭ n + МД Y1 )• tn + МД Y2 • tY + МД Y3 • t , где МДп - мощность поглощённой дозы нейтронного облучения, Гр/мин; МДу1 - мощность поглощённой дозы сопутствующего гамма-облучения от элементов конструкции генератора, Гр/мин; МДУ2 - мощность поглощённой дозы основного гамма-облучения, Гр/мин; tn - время облучения на нейтроном генераторе, мин; tY - время облучения на гамма-установке, мин; t - время нахождения животного в зале облучения, мин; МДу3 - усреднённая за время t поглощённая доза от активационных гамма-квантов.
Долей вклада в суммарную дозу упругорассеянных на стенах и окружающем оборудовании нейтронов (и альбедных гамма-квантов) вследствие его незначительности пренебрегали.
Группы животных и режимы гамма-нейтронного облучения. Апробирование схем локального гамма-нейтронного облучения для терапии мелких домашних животных с различными клиническими случаями злокачественных новообразований разной локализации выполнено на 18 собаках и кошках, которым ранее было проведено хирургическое удаление опухолей в сочетании с химиотерапией и у которых впоследствии (через 1-3 мес. после курса лечения) выявлены агрессивные постоперационные рецидивы. Повторно животные поступили на лечение в ветеринарные клиники Москвы, Московской области и Обнинска: 14 собак разных пород в возрасте от 4 до 17 лет (средний возраст 10 лет) и 4 беспородные кошки в возрасте 11-18 лет (средний возраст 13 лет). У каждого животного отбирали образцы крови на общий клинический и биохимический анализы. Для выявления метастазов проводили рентгенологическое исследование лёгких в двух проекциях (прямая и боковая) и ультразвуковое исследование органов брюшной полости. Кроме того, выполняли цитологическую и гистологическую верификации злокачественности новообразований.
По результатам клинического обследования животных на момент начала проведения лучевой терапии прямых противопоказаний к лечению не было.
Распределение животных по группам в зависимости от типа и локализации опухоли, стадии заболевания, а также обобщённые данные по дозам облучения приведены в табл. 1.
Курс и режим облучения определяли для каждого животного индивидуально в зависимости от типа опухоли и общего состояния. Животных облучали под общей внутривенной анестезией 2 раза в неделю, по 4-6 сеансов за курс. В течение каждого сеанса облучение проводили с одного или двух полей последовательно сначала у -излучением, затем нейтронным с интервалом между воздействиями 15 мин. Разовая очаговая доза у -облучения составляла 5-8 Гр, нейтронов - 1,0-1,4 Гр (без учёта коэффициента относительной биологической эффективности -ОБЭ). На основании наших исследований коэффициент ОБЭ нейтронного излучения принимали равным 2,5 [18]. Вклад нейтронов в суммарную очаговую дозу (СОД) облучения составлял с учётом коэффициента ОБЭ от 25 до 40%.
Таблица 1
Группы животных и режимы гамма-нейтронного (γ + n) облучения
|
Группа |
Тип опухоли, локализация |
Количество животных в группе/стадия заболевания |
СОД, Гр-экв. |
РОД, Гр |
|
1 |
Аденокарцинома (носовых ходов; рецидив послеоперационный носовых ходов, параанальной железы) |
5 (собаки) / III |
30-48 |
5-7 Гр (γ) + 1,0-1,2 Гр (n) |
|
2 |
Меланома (кожи нижней челюсти; слизистой оболочки носового зеркала) |
2 (собаки) / II-III |
26-45 |
5 Гр (γ) + 1,0-1,4 Гр (n) |
|
3 |
Плоскоклеточный умеренно и низкодифференцированный рак слизистой оболочки ротовой полости (язык) |
3 (кошки) / II-III-IV |
36-45 |
5 Гр (γ) + 1,0-1,3 Гр (n) |
|
4 |
Плоскоклеточный умеренно и низкодифференцированный рак кожи |
4 (3 собаки, 1 кошка) / II-III-IV |
22-48 |
5-7 Гр (γ) + 1 Гр (n) |
|
5 |
Саркома (фибросаркома носовых ходов, венерическая саркома, саркома мягких тканей) |
4 (собаки) / III-IV |
10,5-45 |
5-8 Гр (γ) + 1 Гр (n) |
В процессе реализации и после курса лучевой терапии животные находились под контролем ветеринарных врачей-онкологов: два раза в неделю им проводили общий клинический анализ крови, один раз в неделю – биохимический анализ крови; рентгенологическое исследование лёгких в двух проекциях (прямая и боковая) и ультразвуковое исследование органов брюшной полости – один раз в месяц.
Результаты и обсуждение
Параметры дозиметрических измерений . Вследствие того, что пучок нейтронов не коллимировали, поглощённая доза была неравномерно распределена по объёму опухоли, а именно: по краям была меньше, чем в центре из-за изменения фактора G. Фактор G меняется в зависимости от расположения опухоли по отношению к центру мишени генератора, при этом геометрические размеры опухоли влияют на величину поглощённой дозы.
На рис. 1 представлено относительное изменение величины средней по опухоли поглощённой дозы в зависимости от её размера в виде поправочного коэффициента на величину дозы в центре мишени (расчётные данные). Изменение дозы в связи с зависимостью керма-фактора от энергии нейтронов, меняющейся вследствие угловой зависимости последней, составляло менее 1% и не учитывалось.
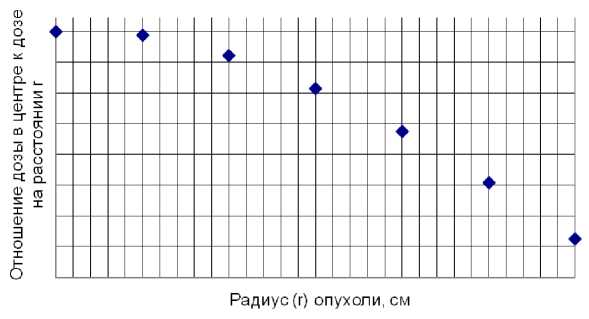
Рис. 1. Изменение величины средней поглощённой дозы в зависимости от радиального размера опухоли без учёта коэффициента поглощения (за 1 принято значение дозы по центру опухоли).
Необходимо оценивать также и уменьшение дозы (уменьшение G-фактора) по мере удаления среза опухоли от мишени генератора. Влияние толщины объекта на величину средней по оси дозы для модели опухоли (цилиндр) с радиусом 3 см представлено на рис. 2. Оба рисунка показывают, что для повышения достоверности оценки поглощённой дозы и результатов эксперимента необходимо производить расчёт для каждого объекта и геометрии его расположения. Поэтому целесообразно для сокращения времени подготовки к планируемому эксперименту использовать расчёт на основании метода Монте-Карло.
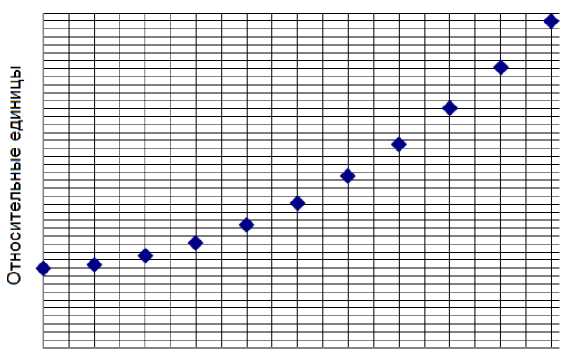
Толщина объекта, см
Рис. 2. Отношение усреднённой величины поглощённой дозы по высоте опухоли (модель цилиндра радиусом 3 см) к расчётной дозе в центре опухоли в зависимости от толщины объекта.
Верификация измерения поглощённых доз показала их полное соответствие плану облучения в пределах существующих погрешностей и допущений.
Противоопухолевая эффективность гамма-нейтронной терапии . Результаты наших исследований с использованием малогабаритного нейтронного генератора для внутри-клинического размещения показали, что после курса гамма-нейтронной терапии у 14 животных (73,7%) из всех групп была достигнута полная (11/57,9%) или частичная (3/15,8%) регрессия опухоли. Уменьшение болезненности, снижение экссудации, отёчности, а также размера новообразований в 1,5-3 раза, улучшение в общем состоянии животных наблюдали уже после 3-4 сеансов облучения. Полную регрессию опухоли после однократного облучения в дозе 10,5 Гр-экв. [8 Гр ( γ ) + 1 Гр (n)] наблюдали у собаки с диагнозом венерическая саркома (5 группа). Трём животным с частичной регрессией (двум с саркомой мягких тканей, одному с меланомой слизистой оболочки носового зеркала, из 5 и 2 групп соответственно) были выполнены хирургические операции по удалению остатков опухолей. У оперированных животных безрецидивный период составил более одного года (срок наблюдения 14 мес.). Метастазирования во внутренние органы у этих животных не отмечено. Среди животных с полной регрессией опухоли отдалённые метастазы во внутренние органы возникли у трёх кошек (27,3%) с плоскоклеточным раком кожи (4 группа) и новообразованиями (3 группа) в ротовой полости (III-IV стадии). У остальных животных период без признаков заболевания варьировал от 3 до 14 мес. (сроки наблюдения).
Реакции нормальных, прилегающих к опухоли тканей, попадающих в поле облучения, у животных с полной или частичной регрессией опухоли были незначительными: выявлены ало- пеция у двух собак и кратковременная эритема и алопеция у одной кошки. На рис. 3 показана зона с плоскоклеточным раком кожи пальца задней левой конечности собаки (ризеншнауцер) до и после шести сеансов облучения.
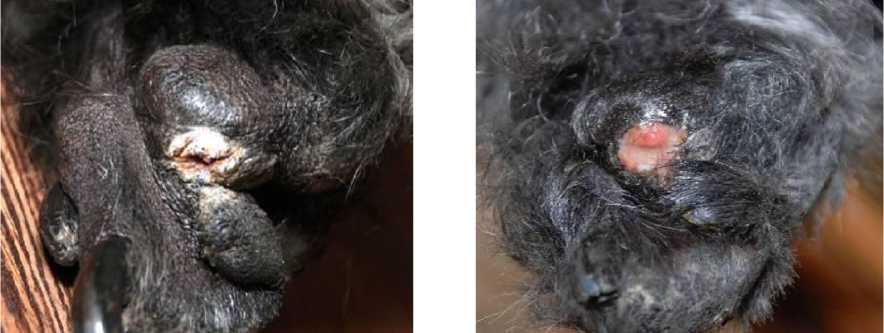
Рис. 3. Собака породы ризеншнауцер (7 лет), плоскоклеточный умереннодифференцированный рак кожи пальца задней левой конечности, СОД 45 Гр-экв.; до облучения (слева) и после 6 сеансов терапии (справа).
В 5 случаях из 18 (27,8%) положительных изменений в процессе лечения не отмечено. У двух животных наступила смерть от сердечной недостаточности до окончания курса лучевой терапии (собаки с меланомой кожи - III стадия, 2 группа) и рецидивом плоскоклеточного низкодифференцированного рака кожи - III-IV стадия, 4 группа). Ещё у трёх животных произошло ухудшение общего состояния и лечение было прекращено: собака с фибросаркомой носовых ходов (III-IV стадия, 5 группа), аденокарциномой параанальной железы (III стадия, 1 группа) и аденокарциномой носовых ходов (III стадия, 1 группа).
Обращает на себя внимание случай полного излечения собаки с венерической саркомой после одного сеанса гамма-нейтронной терапии в дозе 10,5 Гр без каких-либо отдалённых последствий. Лучевая терапия животному была назначена по причине невозможности проведения стандартного для этой болезни химиотерапевтического лечения (наличие сопутствующего заболевания).
Следует отметить, что применение лучевой терапии в отечественной ветеринарии ограничено, что обусловлено, прежде всего, отсутствием собственных источников облучения. Описано лечение животных с новообразованиями с использованием редкоионизирующих излучений (проводят в ветеринарной клинике «Биоконтроль», Москва, при ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России и в городском ветеринарном онкологическом центре «Прайд», Санкт-Петербург, на базе ФГБУ «Российский научный центр радиологии и хирургических технологий им. А.М. Гранова» Минздрава России) [21-23]. В ветеринарной клинике «Биоконтроль» применяли гамма-излучение в качестве основного метода при мастоцитомах низкой степени дифференцировки клеток, а также нере-зектабельных опухолях (СОД 40-55 Гр), меланомах (СОД 40-50 Гр) [21]. Отмечена стабилизация роста и частичная регрессия опухоли в 55-65% случаев. В РНЦРХТ источником ионизирующего излучения служили рентгенотерапевтические аппараты РУМ-17 и РУМ-7 для близко- фокусной терапии опухолей, расположенных на поверхности тела и слизистых оболочках, и гамма-аппарат серии «Рокус» (60Со) для терапии опухолей костей, носовой полости и внутренних органов [24]. СОД составляла 40-60 Гр, РОД - 2-5 Гр 2-5 раз в неделю. При хороших результатах лечения некоторых видов опухолей самостоятельно (плоскоклеточная и базальноклеточная карцинома, мастоцитома, лимфома, трансмиссивная венерическая саркома) и в сочетании с хирургической операцией и химиотерапией (саркома мягких тканей, аденокарцинома, опухоли костей некоторых локализаций) отмечены выраженные лучевые реакции со стороны кожи (эритемы, алопеции, сухой и влажный дерматиты) [23].
Опыт применения нейтрон-захватной терапии (НЗТ) на реакторе ИРТ МИФИ [25] описан при лечении собак с меланомой слизистой оболочки ротовой полости и остеосаркомой в ветеринарной клинике «Биоконтроль». Однако реализация этого метода для лечения мелких домашних животных является дорогостоящей и трудно тиражируемой технологией.
Анализ результатов показывает, что проведение гамма-нейтронной терапии на базе МРНЦ им. А.Ф. Цыба обеспечивает сопоставимый эффект по сравнению с конвенциональными методами лучевой терапии, используемыми в некоторых ветеринарных клиниках, и не приводит к выраженным лучевым реакциям, характерным для гамма-облучения. Кроме того, гамма-нейтронная терапия позволяет снизить СОД, что может положительно сказаться на общем состоянии животных и сократить реабилитационный период.
Заключение
Лечение домашних животных со злокачественными новообразованиями методами нейтронной и гамма-нейтронной терапии в России не осуществляется. В целом, состояние нейтронной терапии и перспективы развития медицинской технологии в России напрямую зависят от существующих источников нейтронного излучения. Портативные источники для нейтронной терапии предоставляют абсолютно новые возможности для проведения лучевой терапии, особенно в сочетании с другими видами излучения. Реализация этих технологий в клинической практике с вкладом нейтронов в суммарную очаговую дозу облучения 20-40% позволяет существенно повысить эффективность лучевой терапии, не увеличивая риск повреждения окружающих опухоль здоровых тканей.
Портативный импульсный генератор нейтронного излучения ИНГ-031, а также генераторы НГ-14 и НГ-24 предполагают внутриклиническое размещение [15]. Достоинствами этих генераторов являются компактность, простота в эксплуатации и низкая стоимость, что делает их доступными источниками излучения для многих медицинских учреждений. Апробированный в опытах на домашних животных ПНГ удовлетворяет потребностям гамма-нейтронной терапии: мо-ноэнергетичность потока нейтронов, достаточная равномерность дозового поля, возможность регулирования вклада нейтронов в суммарную дозу облучения и оптимальный временной интервал между фракциями фотонов и нейтронов. Предложенная схема гамма-нейтронного облучения домашних животных (кошки, собаки) с опухолями с использованием портативного источника нейтронов отечественной разработки с вкладом в СОД нейтронного излучения 25-40%, как показали наши предварительные исследования, позволяет достичь высокой эффективности при незначительных повреждениях окружающих здоровых тканей.
В настоящее время совместными усилиями МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России (Обнинск) и ФГУП «ВНИИА им. Н.Л. Духова» (Москва) разрабатывается нейтронный терапевтический комплекс на базе портативного генератора НГ-24 (энергия нейтронов 14,1 МэВ). Апробирование данной установки на большем количестве мелких домашних животных с опухолями различной локализации позволит предложить в медицинскую практику схемы сочетанной гамма-нейтронной терапии с минимально возможным интервалом в последовательности облучения (до 15 мин), эффективность которых подтверждена при радиобиологическом тестировании с относительно небольшим вкладом нейтронов в суммарную дозу (10-30%) [1, 14, 16, 26, 27] и в экспериментальных исследованиях.
Список литературы Опыт применения портативного отечественного нейтронного генератора в схемах гамма-нейтронной терапии домашних животных со злокачественными новообразованиями
- Каприн А.Д., Ульяненко С.Е. Адронная терапия -точки развития//Медицина: целевые проекты. 2016. № 23. С. 56-59.
- Laramore G.E. The use of neutrons in cancer therapy: a historical perspective through the modern era//Semin. Oncol. 1997. V. 24, N 6. P. 672-685.
- Laramore G.E., Wootton P., Livesey J.C., Wilbur D.S., Risler R., Phillips M., Jacky J., Buchholz T.A., Griffin T.W., Brossard S. Boron neutron capture therapy: a mechanism for achieving a concomitant tumor boost in fast neutron radiotherapy//Int. J. Radiat. Oncol. Biol. Phys. 1994. V. 28, N 5. P. 1135-1142.
- Britten R.A., Peters L.J., Murray D. Biological factors influencing the RBE of neutrons: implications for their past, present and future use in radiotherapy//Radiat. Res. 2001. V. 156. P. 125-135.
- Мусабаева Л.И. Применение нейтронов в онкологии//Мед. радиол. 1985. Вып. 30, №. 9. С. 57-63.
- Particle Therapy Co-Operation Groop (PTCOG). . URL: http://ptcog.ch.
- Гулидов И.А., Мардынский Ю.С., Цыб А.Ф., Сысоев А.С. Нейтроны ядерных реакторов в лечении злокачественных новообразований. Обнинск, 2001. 131 с.
- Гулидов И.А., Мардынский Ю.С., Сысоев А.С., Аминов Г.Г. Нейтроны в комплексном лечении рака молочной железы//ХI Российский Онкологический конгресс, 20-22 ноября 2007 г. М., 2007. С. 106-108.
- Гулидов И.А., Асланиди И.П. О состоянии и перспективах развития дистанционной нейтронной терапии//Вопросы онкологии. 2014. Т. 60, № 4. С. 408-412.
- Важенин А.В., Рыкованов Г.Н. Уральский центр нейтронной терапии: история создания, методология, результаты работы. М: Издательство РАМН, 2008. 144 с.
- Мусабаева Л.И., Лисин В.А., Старцева Ж.А., Грибова О.В., Великая В.В., Мельников А.А. Нейтронная терапия на циклотроне U-120. К 30-летию применения нейтронной терапии -обзор результатов научных исследований//Медицинская радиология и радиационная безопасность. 2013. Т. 58, № 2. С. 53-61.
- Мусабаева Л.И. Научно-практическая конференция с международным участием «Нейтронная терапия в онкологии: проблемы, успехи, перспективы». Томск, 3-4 октября 2013 г.//Медицинская радиология и радиационная безопасность. 2013. Т. 58, № 6. С. 77-78.
- Литяев В.М., Федоров В.В., Соловьев А.Н., Ульяненко С.Е. Устройство для терапии быстрыми нейтронами на НГ-24//Медицинская физика. 2016. Т. 70, № 2. С. 94-100.
- Устройство для лучевой терапии быстрыми нейтронами. Патент на изобретение № 2442620, 20.02.2012 г. Авторы: Литяев В.М., Ульяненко С.Е., Горбушин Н.Г. . URL: http://www.allpatents.ru.
- Аппарат для дистанционной нейтронной терапии. Патент на изобретение № 2526244, 26.06.2014 г. Авторы: Литяев В.М., Ульяненко С.Е., Корякин С.Н., Бровин А.И., Сыромуков С.В., Боголюбов Е.П., Рыжков В.И., Горбушин Н.Г. URL: http://www.freepatent.ru.
- Бекетов Е.Е., Исаева Е.В., Корякин С.Н., Лычагин А.А., Ульяненко С.Е. Зависимость эффективности одновременного воздействия гамма-квантов и нейтронов с энергией 14 МэВ от вклада плотноионизирующего компонента//Радиация и риск. 2012. Т. 21, № 3. С. 81-90.
- Исаева Е.В., Бекетов Е.Е., Корякин С.Н., Лычагин А.А., Ульяненко С.Е. Сравнение биологической эффективности импульсного и непрерывного нейтронного излучения с энергией 14 МэВ на культуре клеток мышиной меланомы В-16//Радиация и риск. 2012. Т. 21, № 2. С. 83-90.
- Isaeva E.V., Beketov E.E., Koryakin S.N., Ulyanenko S.E., Lychagin A.A. A comparative study of the biological effectiveness of 14-MEV neutron pulse and continuous radiation using mouse B-16 cells//Radiat. Prot. Dosim. 2014. V. 161, N 1-4. P. 478-482.
- ICRU Report 26. Neutron Dosimetry for Biology and Medicine. Washington, D.C.: ICRU, 1977. P. 78-89.
- Руководство по радиационной защите для инженеров: пер. с англ./под ред. Д.Л. Бродера. М: Атомиздат, 1973. Т. 2. 288 с.
- Лисицкая К.В., Седов С.В., Якунина М.Н. Мастоцитома собак: этиология, клиника, диагностика и лечение. . URL: http://www.biocontrol.ru.
- Кузнецова А.Л., Шимширт А.А., Ягников С.А., Козловская Н.Г., Лисицкая К.В., Соловьева О.В., Арнопольская А.М., Телицын В.В. Сравнительная характеристика методов лечения меланомы у собак//Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2009. № 4. С. 28-33.
- Брюшковский К.Ю. Возможности лучевой терапии в лечении новообразований у животных. . URL: http://www.veterinar.ru.
- Лычагин А.А. Портативные нейтронные генераторы в медицине//Медицинская техника. 2014. Т. 48, № 1. С. 9-12.
- Арнопольская А.М., Митин В.Н., Кулаков В.Н., Хохлов В.Ф., Шейно И.Н., Козловская Н.Г., Портнов А.А. Результаты лечения опухолевых поражений у собак посредством нейтрон-захватной терапии//Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2007. № 3. С. 20-22.
- Лычагин А.А., Бекетов Е.Е., Корякин C.Н., Исаева Е.В., Ульяненко С.Е. Экспериментальная установка для облучения биологических объектов смешанными полями ионизирующих излучений разного качества//Медицинская физика. 2013. T. 59, № 3. С. 56-60.
- Южаков В.В., Севанькаев А.В., Ульяненко С.Е., Яковлева Н.Д., Кузнецова М.Н., Цыганова М.Г., Фомина Н.К., Ингель И.Э., Лычагин А.А. Эффективность фракционированного воздействия гамма-излучения и быстрых нейтронов на саркому М-1//Радиационная биология. Радиоэкология. 2013. Т. 53, № 3. С. 267-279.


