Ортотопические модели в экспериментальной онкологии: обзор литературы. К 150-летию первой успешной серийной трансплантации опухоли у животных
Автор: Муразов Я.Г., Ковалева М.А., Крышень К.Л., Макарова М.Н., Макаров В.Г.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 6 т.24, 2025 года.
Бесплатный доступ
Актуальность. Трансплантируемые модели с использованием аллографтов и ксенографтов опухолей человека остаются незаменимым инструментом в экспериментальной онкологии для изучения механизмов канцерогенеза и оценки противоопухолевой активности перспективных средств лечения злокачественных новообразований. Цель исследования – провести традиционный анализ научной литературы, посвященной возможностям метода ортотопической трансплантации у лабораторных животных с использованием различных источников получения опухолевого материала; описать основные преимущества и ограничения ортотопических моделей; представить практические рекомендации, которые помогут исследователям в рутинной практике при работе с ортотопическими трансплантируемыми моделями. Материал и методы. Поиск публикаций выполняли в базах данных PubMed и Google Scholar. В обзор включали релевантные публикации, доступные для поиска на 30 апреля 2025 г. Результаты. Показано, что по сравнению с трансплантацией суспензий опухолевых клеток, культивированных in vitro, трансплантация фрагментов со́лидных опухолей обеспечивает сохранение клональной гетерогенности опухоли, компонентов ее микроокружения и внеклеточного матрикса, которые поддерживают энграфтмент и рост опухоли. В сравнении с подкожной перевивкой ортотопические модели более точно воспроизводят сложное взаимодействие в системе «опухоль-организм хозяина» и патологические особенности злокачественных новообразований человека, включая метастатическую болезнь. Поскольку ортотопические опухоли находятся в естественном микроокружении, доклиническая оценка ответа таких опухолей в дальнейшем лучше транслируется в ранние фазы клинического изучения. Заключение. Включение ортотопических моделей в программы неклинических фармакодинамических исследований in vivo дает возможность получить более полное представление о противоопухолевой активности проводимого экспериментального лечения, а также повышает прогностическую ценность и надежность доклинических результатов.
Доклиническое исследование, канцерогенез, ортотопическая трансплантация, клеточная линия, фрагмент солидной опухоли, ксенографт, изографт
Короткий адрес: https://sciup.org/140313335
IDR: 140313335 | УДК: 616-006-089.843]-092.9 | DOI: 10.21294/1814-4861-2025-24-6-160-172
Текст научной статьи Ортотопические модели в экспериментальной онкологии: обзор литературы. К 150-летию первой успешной серийной трансплантации опухоли у животных
19 декабря 1875 г. в зоохирургическом кабинете ветеринарного отделения Императорской медикохирургической академии (ныне Военно-медицинская академия имени С.М. Кирова, г. Санкт-Петербург) русский ветеринарный врач Мстислав Александрович Новинский успешно выполнил первую серийную трансплантацию подкожных опухолей («carcinoma medullare parvicellulare») со- бакам (рис. 1). Именно М.А. Новинский по праву считается основоположником экспериментальной онкологии не только в России, но и в мире. Экспериментальная модель перевиваемой карциномы Эрлиха мышей появится лишь спустя 30 лет [1]. К сожалению, деятельность М.А. Новинского освещена в литературе лишь немногими исследователями. Основные факты его биографии ввел в научный оборот Л.М. Шабад, ученый-онколог,

Рис. 1. Титульная страница диссертации (слева) и почтовая марка с портретом М.А. Новинского (справа).
Примечание: рисунок выполнен авторами Fig. 1. The cover page of the dissertation (left) and a postage stamp (right) with the portrait of M.A. Novinsky. Note: created by the authors один из создателей экспериментальной онкологии в Советском Союзе, работавший с архивами, содержащими информацию по теме исследований М.А. Новинского [2].
Спустя 150 лет трансплантируемые модели у животных, в первую очередь у грызунов, с использованием аллографтов (сингенных опухолей) и ксенографтов опухолей человека остаются незаменимым и важным инструментом в экспериментальной онкологии для изучения механизмов канцерогенеза и оценки противоопухолевой активности перспективных фармакологических и нефармакологических методов лечения злокачественных новообразований (ЗНО) [3–5]. Представленный обзор обобщает данные литературы, посвященные теоретическим и практическим аспектам разработки ортотопических моделей на доклиническом этапе изучения средств противоопухолевой терапии.
Цель исследования – провести традиционный анализ научной литературы, посвященной возможностям метода ортотопической трансплантации у лабораторных животных с использованием различных источников получения опухолевого материала; описать основные преимущества и ограничения ортотопических моделей; представить практические рекомендации, которые помогут исследователям в рутинной практике при работе с ортотопическими трансплантируемыми моделями.
Поиск публикаций выполняли в базах данных PubMed и Google Scholar. В обзор включали релевантные публикации, доступные для поиска на 30 апреля 2025 г.
Результаты и обсуждение
В историческом плане получение инбредных линий мышей в 30–50-х гг. XX в. было важным шагом на пути изучения причин и механизмов канцерогенеза, а также новых терапевтических подходов на сингенных моделях у животных [6]. В результате этих ранних исследований сложилось общее заблуждение, что опухоли у грызунов чувствительны к лекарственной терапии и хорошо поддаются лечению. На самом деле это не так, и еще в 1987 г. Т.Н. Corbett et al. отметили, что большинство лекарственных средств, которые в то время поступили в клиники, обладали слабой или «нулевой» активностью в отношении большинства трансплантируемых со́лидных опухолей у мышей [7]. В 1970-х гг. внедрение трансплантации опухолевого материала, полученного от человека, иммунодефицитным мышам дало надежду на повышение предиктивной валидности, воспроизводимости и транслируемости доклинических результатов. Эта надежда оправдалась лишь частично. Причина этого отчасти заключается в широком распространении подхода, основанного на трансплантации иммортализованных гомоген- ных клеточных линий опухолей человека (cell line-derived xenograft, CDX) [8, 9]. В 1969 г. J. Rygaard и C.O. Povlsen впервые успешно выполнили гетеротопическую трансплантацию фрагмента опухоли толстой кишки пациента бестимусной мыши [10], что положило начало развитию нового подхода с трансплантацией ксенографтов, полученных от пациента (patient-derived xenograft, PDX). Фрагменты опухоли, полученные от пациента, трансплантируются иммунодефицитным мышам без предварительного культивирования in vitro, что позволяет сохранить исходные характеристики опухоли [11].
Методы трансплантации опухолевого материала в исследованиях in vivo
Основными методами трансплантации опухолевого материала являются подкожный (эктопический, гетеротопический) и ортотопический [12–14]. Подкожная (внутрикожная) трансплантация – это простая в освоении техника, которая не считается инвазивной процедурой. После того как наблюдается энграфтмент опухоли, ее объем легко можно измерить вручную с помощью штангенциркуля, что позволяет эффективно отслеживать кинетику роста опухоли. Ортотопические трансплантаты представляют собой опухоли, перевиваемые в физиологически релевантную нишу, то есть орган или ткань, из которого опухоль развивается спонтанно у человека или животных. Хотя и ортотопическая, и подкожная трансплантация имеют свои уникальные преимущества и ограничения, выбор между ними должен основываться на целях конкретного исследования. Для исследований, направленных на изучение общих вопросов опухолевого роста или раннего скрининга молекул-кандидатов, предпочтительнее использовать подкожные модели. Для экспериментов, требующих «клинически значимой пользы» и высокого трансляционного потенциала, особенно для изучения процессов метастазирования или взаимодействия опухоли с ее микроокружением, предпочтительнее использовать ортотопические модели. Преимущества, ограничения и область применения подкожных и ортотопических моделей представлены в таблице.
Практические аспекты создания ортотопических моделей
Источники получения опухолевого материала
Происхождение опухолевого материала является одним из наиболее важных факторов, влияющих на биологический фенотип аллографтов и ксенографтов у лабораторных животных [15]. Основными источниками получения опухолевого материала для ортотопической трансплантации являются суспензия опухолевых клеток и интактные фрагменты солидной опухоли человека (PDX) или животных (изографты).
Таблица /table
Основные характеристики подкожных и ортотопических моделей the main features of subcutaneous and orthotopic models
Область применения/
Преимущества/Advantages Ограничения/Limitations
Scope of application
Подкожная модель/Subcutaneous model
^ Простота: инокуляция опухолевых клеток или фрагментов опухоли под-кожно/внутрикожно проводится обычно в боковую поверхность тела животного. Модель технически простая и быстрая в сравнении с ортотопической/Simplicity: subcutaneous/intradermal inoculation of tumor cells or tumor fragments usually carried out into the flank of animal’s body. The model is technically easier and faster than orthotopic.
^ Измерение опухоли: подкожные опухоли легко пальпируются, что позволяет легко наблюдать за их ростом и измерять штангенциркулем/Tumor measurement: tumors implanted subcutaneously are easily palpable, allowing for straightforward monitoring of tumor growth by simple caliper measurements.
^ Высокий энграфтмент (прививаемость): подкожные опухоли демонстрируют высокую степень прививаемости, требуют меньшего количества животных и делают результаты исследования более предсказуемыми/High engraftment (take rate): subcutaneous tumor often yields a high take rate, requiring fewer animals and making it more predictable for study outcomes.
^ Экономическая эффективность: требуется меньше технически подготовленного персонала, что ускоряет процедуры и снижает затраты/Cost-efficient: less technically trained personnel are required, translating to quicker procedures and reduced cost.
^ Анатомические различия: подкожные опухоли не отражают микроокружение опухоли в нативных тканях, в которых она возникла. Это может влиять на поведение опухоли и ответ на лечение/Anatomical differences: subcutaneous environment might not accurately reflect the native tissue from which the tumor originated. This can affect tumor behavior and responsiveness to treatment.
^ Низкий метастатический потенциал: подкожные модели редко метастазируют, что ограничивает их использование в исследованиях, где основной целью является изучение метаста-зирования/Low metastatic potential: subcutaneous models are less likely to metastasize compared to orthotopic models, which limits its use in studies where metastasis is the primary aim.
^ Слабая степень васкуляризации: подкожные опухоли не образуют, как правило, обширную сосудистую сеть, характерную для ортотопических или спонтанных опухолей. Это может влиять на доставку тестируемых объектов к опухоли и ее взаимодействие с микроокружением/Poor vascularization: subcutaneous tumors might not develop the extensive vascular network seen in orthotopically implanted or spontaneous tumors. This may affect drug delivery and tumor microenvironment interactions.
^ Неоднозначный ответ опухоли на изучаемое вмешательство: при подкожной перевивке ответ опухоли на лечение, особенно при воздействии на определенные органы или системы, может быть иным, нежели при ортотопической трансплантации или в условиях организма человека/Inconsistent tumor response to the intervention: some therapeutics especially those targeting specific organ or systems, might not elicit the same response in subcutaneous models as they would in orthotopic models or human conditions.
^ Подкожные модели идеальны для предварительных/разведочных исследований, оценки тумороген-ности клеточной линии или биомедицинского клеточного продукта или оценки противоопухолевой активности на ранней стадии разра-ботки/Subcutaneous models are ideal for preliminary/exploratory studies, assessment of the tumorigenicity of a cell line or biomedical cell product, or evaluation of antitumor activity at an early stage of development.
^ Несложный мониторинг роста делает подкожные модели особенно подходящими для проектов, в которых приоритет отдается простому, неинвазивному отслеживанию прогрессирования опухоли/ Ease of growth monitoring makes subcutaneous models especially suitable for projects that prioritize straightforward, non-invasive tracking of tumor progression.
^ Если исследование проводится в условиях бюджетных ограничений и требуется более экономически эффективный подход без ущерба для основных аспектов роста опухоли, подкожные модели являются самыми подходящими/ When the study operates under budget constraints and a more costeffective approach is required without compromising basic aspects of tumor growth, subcutaneous models are most suitable.
^ Модель подходит для краткосрочных исследований, которые не требуют углубленного изучения поведения опухоли и ее метаста-зирования/The model is suitable for short-term studies that do not require in-depth investigation of tumor behavior and its metastasis.
Окончание таблицы/end of table
Ортотопическая модель/Orthotopic model
^ Микроокружение опухоли: трансплантация опухоли в орган/ткань, из которой она возникла, лучше отражает естественное микроокружение и позволяет повысить трансляционный потенциал модели/ Tumor microenvironment: implanting the tumor in its organ/tissue of origin better reflects the natural microenvironment and allows for increased translational potential of the model.
^ Метастатический потенциал: ортотопические опухоли демонстрируют высокую способность к метастазированию, что важно в контексте изучения процессов метастазирования или при оценке средств, нацеленных на метастатические клетки/ Metastatic potential: orthotopic tumors show a higher tendency for metastasis, which is important in the context of studying metastasis processes or testing drugs targeting metastatic cells.
^ Ответ на лечение: поскольку опухоли находятся в физиологической среде и способны сами влиять на свое микроокружение, они могут реагировать на лечение так же, как и у человека, что позволяет более точно прогнозировать эффективность в дальнейших клинических исследованиях/ Treatment response: since the tumors are in a physiological environment and can influence their own microenvironment, they might respond more similarly to therapies as they would in humans, providing a more accurate prediction of efficacy in further clinical trials. ^ Расширенная совместимость с методами визуализации: расположение опухоли в нативных тканях при наличии специального оборудования (например, для биолюминесцентных методов) позволяет использовать точные методы прижизненной визуализации, обеспечивая более глубокое понимание механизмов опухолевого роста, ангиогенеза и ответа на проводимое экспериментальное лечение/Advanced imagining compatibility: with the specialized equipment (e.g. bioluminescence techniques), the tumor location in native tissues allows for precise intravital visualization methods, providing a deeper understanding of tumor growth, angiogenesis, and response to experimental treatment.
^ Техническая сложность: ортотопическая трансплантация является технически сложной процедурой и требует специальных навыков, особенно при сложном хирургическом доступе (головной мозг, поджелудочная железа и др.)/Technical complexity: orthotopic transplantation is a technically demanding procedure and requires special skills, especially with challenging surgical access (brain, pancreas, etc).
^ Различия в степени энграфтмента опухоли: в зависимости от гистогенеза опухоли или особенностей клеточной линии может наблюдаться разница в частоте успешного энграфтмента.
В некоторых случаях для получения объективных результатов может потребоваться большее число животных или образцов/Variability in tumor engraftment: depending on the tissue type and cell line, there can be variability in the successful engraftment of the tumor. In some cases, more animals or samples may be required to obtain objective results.
^ Высокая стоимость: из-за потребности в специализированном оборудовании и необходимости подготовки квалифицированного персонала ортотопические модели могут быть дороже, чем подкожные/ High cost: due to the need for specialized equipment and trained staff, orthotopic models might be more expensive than subcutaneous ^ High cost: due to the need for specialized equipment and trained staff, orthotopic models might be more expensive than subcutaneous.
^ Модель необходима тогда, когда основное внимание уделяется изучению взаимодействия опухоли с ее микроокружением: клетками стромы, резидентными и инфильтрирующими опухоль иммунными клетками организма-хозяина и компонентами внеклеточного матрик-са/The model is required when the focus is on studying the interaction of the tumor with its microenvironment, including the relationship with stromal cells, resident and tumorinfiltrating immune cells of the host organism, and components of the extracellular matrix.
^ Модель особенно полезна при изучении механизмов метастазирования или оценке противоопухолевых средств, нацеленных на метастазирование/The model is particularly beneficial when studying metastatis mechanisms or evaluating antitumor agents targeting metastasis. ^ Модель незаменима, если необходимо оценить, как опухоль конкретной локализации реагирует на лечение, особенно при последующей трансляции результатов в клинические исследования/The model is essential if it is necessary to assess how a tumor of a specific location responds to treatment, especially when findings translated to further clinical trials.
^ Исследования, в которых используются передовые аппаратные методы прижизненной визуализации роста ортотопических опухолей, являются более совершенны-ми/Studies equipped to use modern imaging techniques for intravital visualization of orthotopic tumor growth are more advanced.
Примечание: таблица составлена авторами
Note: the table created by authors
Ортотопическая трансплантация суспензии опухолевых клеток (cellular orthotopic injection, COI) особенно ценна, когда требуются предварительные манипуляции с клетками, такие как культивирование ex vivo , экспозиция к фармакологически активным средствам, редактирование генов или генетический скрининг. Использование суспензии клеток делает эксперимент более «гомогенным», позволяя точно «дозировать» опухолевую нагрузку (количество трансплантируемых клеток) на каждое животное и избегать некоторых систематических ошибок на этапе получения и подготовки опухолевого материала для трансплантации. Суспензия опухолевых клеток может быть получена из коммерчески доступных иммортализованных сингенных и ксеногенных (CDX) клеточных линий, культивируемых in vitro , асцитных вариантов опухоли или путем механической и/или ферментативной диссоциации фрагментов солидной опухоли. Основным недостатком использования суспензии опухолевых клеток является высокий риск вытекания инокулята через канал, сформированный иглой (рис. 2). Это приводит к гематогенному и прямому имплантационному распространению опухоли в брюшной полости и артефактам метастазирования [16, 17]. Несколько факторов, таких как неоптимальные хирургические процедуры и неподходящий объем инъекции или размер иглы, могут увеличить риск вытекания клеток. Чтобы снизить риск вытекания клеточного инокулята, используются такие подходы, как совершенствование хирургической техники и выполнение манипуляции одним оператором, добавление к суспензии клеток солюбилизированного матрикса базальной мембраны, секретируемого клетками саркомы мыши Энгельбрета–Холма–Роя (Матригель®, Corning Life Sciences и его аналоги) в различной концентрации, использование ватного тампона для нажатия на место инъекции в течение ≥20 с [18, 19]. Стоит отметить, что в некоторых работах было показано, что Матригель® не способен предотвратить искусственное распространение опухолевых клеток [20]. Кроме того, поскольку Матригель® представляет собой матрикс базальной мембраны, его качество нестабильно, что может привести к вариабельности получаемых результатов [21].
Проблемы, сопряженные с культивированием клеток, такие как ошибочная идентификация клеточных линий, заражение микоплазмой, а также генотипическая и фенотипическая нестабильность, часто игнорируются научным сообществом [22]. В настоящее время ведутся широкие дебаты по поводу достоверности результатов, получаемых с использованием иммортализованных клеточных линий, из-за возможности клональной селекции и артефактов, связанных с культивированием in vitro . Клеточные линии адаптируются к искусственной среде роста «на пластике» без стромальных и сосудистых компонентов, иммунных клеток,
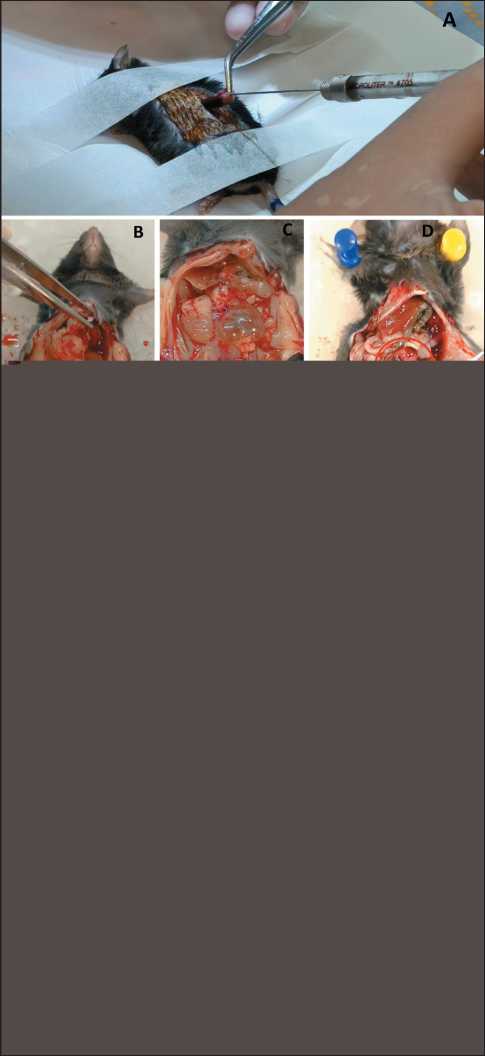
Рис. 2. Артефакты внутрибрюшинного и забрюшинного распространения опухоли в результате вытекания инокулята из места инъекции. А-D – трансплантация суспензии клеток сингенной протоковой аденокарциномы поджелудочной железы PAN02 вместе с Матригелем ® (1:1) в тело-хвост органа мышам C57BL/6 . Красным кругом отмечена первичная опухоль поджелудочной железы; белой стрелкой обозначен опухолевый узел в области послеоперационной раны; E-G – трансплантация суспензии сингенной карциномы яичника под капсулу сумки яичника у крыс Wistar. Примечание: рисунок выполнен авторами
Fig. 2. Artifacts of intraperitoneal and retroperitoneal tumor dissemination due to inoculum leakage from the injection site. A-D – transplantation of cell suspension of syngeneic pancreatic ductal adenocarcinoma PAN02 together with Matrigel® (1:1) into the body-tail of the organ in C57BL/6 mice. Red circle – the primary pancreatic tumor; white arrow – the tumor node in the area of the postoperative wound; E-G – transplantation of syngeneic ovarian carcinoma suspension under the ovarian bursa capsule in Wistar rats.Note: created by the authors инфильтрирующих опухоль. Известно, что из-за селекционного давления при культивировании in vitro клеточная линия, как правило, не сохраняет исходные молекулярные характеристики и гетерогенность материнской опухоли, из которой она была получена изначально [23]. Кроме того, механическая и/или ферментативная диссоциация является стрессовым событием для опухолевых клеток, которое нарушает межклеточную коммуникацию и естественное взаимодействие с компонентами стромы [17]. Клеточные суспензии не имеют нативной трехмерной архитектуры, которая, по-видимому, важна для полной реализации их спонтанного метастатического потенциала. L. Thorel et al. [24] провели крупное сравнительное исследование с использованием 7 моделей светлоклеточной карциномы яичника (4 клеточные линии, два органоида, полученных от пациента, и одна PDX-модель). Авторы продемонстрировали, что модели клеточных линий не подходят для прогнозирования ответа опухоли и разработки персонализированных методов лечения.
В ранее проведенных исследованиях показано, что ортототопическая трансплантация опухоли в виде фрагментов (surgical orthotopic implantation, SOI) является предпочтительной, поскольку они содержат компоненты стромы, внеклеточного матрикса и секретируемые биологически активные вещества. Модели SOI минуют этап диссоциации клеток. По данным ряда авторов, трансплантация фрагментов обеспечивает снижение латентного периода до появления измеряемых опухолей, увеличивает энграфтмент и усиливает их метастатический потенциал [25, 26]. Имплантация фрагментов опухоли (а не клеточной суспензии) является клинически более обоснованным подходом к созданию ортотопических моделей у мышей [27]. Трансплантируемые фрагменты опухоли человека (PDX) в целом лучше сохраняют генетические и эпигенетические особенности материнской опухоли по сравнению с клетками, культивированными in vitro . PDX-модели растут в трехмерной микросреде, которая включает в себя сосудистую сеть, обеспечивающую доставку питательных веществ и кислорода in vivo , а также стромальные и иммунокомпетентные клетки организма-хозяина, которые взаимодействуют и обмениваются информацией с опухолевыми клетками [28]. В случае ортотопической трансплантации ксенографтов опухолей человека (patient-derived orthotopic xenograft, PDOX) свежая опухолевая ткань может быть получена из первичных или метастатических очагов опухоли нативных или предлеченных пациентов во время операции, при биопсии или из свежего аутопсийного материала. Также распространен подход, когда интересующая опухоль сначала трансплантируется подкожно или ортотопически нескольким животным-донорам в виде суспензии сингенной или ксеногенной кле-
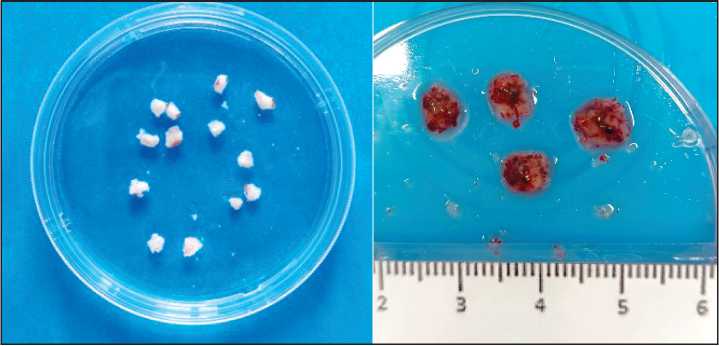
Рис. 3. Фрагменты солидной опухоли, подготовленные для ортотопической трансплантации мышам.
Примечание: рисунок выполнен авторами
Fig. 3. Solid tumor fragments prepared for orthotopic transplantation into mice. Note: created by the authors точной линии, культивированной in vitro, а затем сформированная стоковая опухоль разрезается на фрагменты и используется в основном эксперименте [16, 29–32]. Обычно для серийной трансплантации или трансплантации с целью изучения противоопухолевой активности можно получить 20–50 трансплантируемых фрагментов из одного опухолевого трансплантата (нулевого пассажа, P0). При этом крайне важно избегать некротических участков опухоли [33]. Рекомендуется использовать фрагменты опухоли размером 1–3 мм3 (~30 мг) [3, 16, 31, 33]. Для снижения риска систематической ошибки фрагмент опухоли для трансплантации конкретному животному должен выбираться случайным образом из всего набора подготовленных фрагментов (рис. 3).
Таким образом, для ортотопической трансплантации приемлемо использовать как фрагменты опухолей, так и клеточные суспензии, каждый из методов имеет свои преимущества и недостатки. Выбор между источниками опухолевого материала должен основываться на конкретных целях исследования и характеристиках изучаемой опухоли.
Способы фиксации фрагмента опухоли в целевом органе или ткани
Для фиксации фрагмента опухоли используются три основных метода: с помощью шовного материала; бесшовный метод; метод тканевой адгезии с использованием медицинского тканевого клея. Метод наложения швов подразумевает прямое подшивание фрагмента опухоли к органу или ткани. Чаще всего используется нить размером 7–0 или 8–0 [29, 34]. Данный метод технически сложен, требует специального оборудования (хирургический микроскоп), а также хороших хирургических навыков персонала. Бесшовная техника заключается в формировании кармана (полости) в ткани органа, где происходит иммобилизация фрагмента без наложения швов, что может снизить риск кровотечения и периоперационных осложнений [35–37]. Метод с использованием тканевого клея является хорошей альтернативой для исследователей, которые мало знакомы с микрохирургическими методами (рис. 4) [29, 38]. Тканевые биоразлагаемые цианакрилатные клеи широко используются в хирургической практике. Цианакрилаты быстро полимеризуются в течение 5–60 с в присутствии слабых оснований, например воды или крови. Необходимо отметить, что цианакрилатные клеи могут проявлять прямые цитотоксические эффекты. Реакция полимеризации клея является экзотермической, а выделяющееся тепло вызывает повреждение клеток, по крайней мере в исследованиях in vitro [39].
Периоперационный уход и обеспечение благополучия животных
Из-за возможных проблем, связанных с благополучием животных, требуется убедительное обоснование использования ортотопических моделей, основанное на научной необходимости и соответствии данной модели исследовательскому вопросу, чтобы уравновесить потенциальную пользу для здоровья человека или научных знаний и потенциальный вред для животных. Поскольку ортотопическая трансплантация является инвазивной процедурой и подразумевает оперативное вмешательство (за исключением трансплантации опухолей молочной железы, кожи), необходимо учитывать благополучие животных и проводить процедуры с особой тщательностью, чтобы свести к минимуму дискомфорт, боль и страдания. Согласно директиве Европейского Союза 2010/63/EU, все процедуры, проводимые на животных, должны быть классифицированы как легкие, умеренные или тяжелые [40]. Применение такой классификации к ортотопическим моделям с множественными возможными нежелательными эффектами представляется затруднительным.
Рекомендации OBSERVE (The Oncology Bestpractices: Signs, Endpoints and Refinements for in Vivo Experiments) предоставляют полный набор практических и конкретных рекомендаций по совершенствованию моделей ЗНО у мышей для исследователей, ветеринаров и сотрудников, ухаживающих за животными [41]. В рамках руководства OBSERVE подробно рассмотрены вопросы надлежащей подготовки и совершенствования конкретных методов трансплантации опухоли (внутрилегочная, органы брюшной полости и др.), а также описаны клинические органоспецифические признаки, которые могут быть связаны с конкретным типом опухоли, и способы оценки этих признаков.
Этические нормы требуют использования анестезии, мультимодальной обезболивающей терапии и других мер для обеспечения гуманного обращения с животными. Только при наличии прямых доказательств влияния противоболевой терапии на развитие экспериментальной патологии необходимо разработать альтернативный план по облегчению боли/дискомфорта животных совмест-

Рис. 4. Ортотопическая трансплантация методом тканевой адгезии. А – фиксация фрагмента опухоли (белая стрелка) на поверхности хвоста поджелудочной железы мыши C57BL/6 с помощью клея «Сульфакрилат», Россия; B – фиксация фрагмента опухоли на поверхности левой доли печени мыши C-NKG с помощью клея Histoacryl®, Испания; С – макроскопический вид сформированной ортотопической опухоли поджелудочной железы; D – макроскопический вид сформированной ортотопической опухоли печени; E – микроскопическая картина фрагмента ортотопической опухоли поджелудочной железы. Окраска гематоксилином и эозином, ×400;
F – микроскопическая картина фрагмента ортотопической опухоли печени. Окраска гематоксилином и эозином, ×400. Примечание: рисунок выполнен авторами
Fig. 4. Orthotopic transplantation by tissue adhesive method. A – fixation of a tumor fragment (white arrow) on the surface of the pancreas tail of a C57BL/6 mouse using Sulfacrylate glue, Russia; B – fixation of a tumor fragment on the surface of the left lobe of the liver of a C-NKG mouse using Histoacryl® glue, Spain;
C – macroscopic view of formed pancreatic orthotopic tumor;
D – macroscopic view of the formed orthotopic tumor in the liver. E – microscopic image of a fragment of an orthotopic pancreatic tumor. Hematoxylin and eosin staining, ×400; F – microscopic image of a fragment of an orthotopic liver tumor. Hematoxylin and eosin staining, ×400. Note: created by the authors но с ветеринарным персоналом. Ортотопическая трансплантация опухоли должна выполняться квалифицированным персоналом с использованием методов асептики и надлежащим периоперационным уходом (профилактика гипотермии, дегидратации). Чтобы уменьшить послеоперационный болевой синдром, размер разрезов должен быть минимальным, следует использовать иглы подходящего размера и минимальный объем для введения клеточной суспензии. Чтобы предотвратить случайную диссеминацию опухолевых клеток, при оперативном вмешательстве настоятельно рекомендуется использовать два набора хирургических инструментов: для манипуляций с опухолевой тканью; для манипуляций с неопухолевой тканью. Интрамаммарную трансплантацию (в жировую клетчатку молочной железы) предпочтительнее выполнять в третью или четвертую пару желез, так как в этой области с меньшей вероятностью возникнут осложнения, и влияние на нормальные функции организма будет минимальным. Следует избегать имплантации в краниальные (первые) и каудальные молочные железы (пятую у мышей, шестую у крыс), если в этом нет явной научной необходимости, так как рост опухоли в этой зоне может затруднить передвижение животного [41]. С учетом возможной пери- и постоперационной гибели животных, а также вариабельности энграфтмен-та (частоты приживления) необходимо рассмотреть вопрос об увеличении размера выборки.
Методы прижизненной визуализации роста ортотопических опухолей
В отличие от подкожных и некоторых ортотопических опухолей поверхностной локализации (молочная железа, кожа), прижизненное наблюдение за ростом большинства ортотопических опухолей невозможно без эвтаназии животного. Поэтому при отсутствии специального аппаратурного оснащения в экспериментах с ортотопическими моделями для наблюдения за ростом опухолей и построения кинетических кривых на определенных временных точках выполняют эвтаназию части животных в группах [19]. Для прижизненной визуализации абдоминальных опухолей наиболее простым и доступным способом оценки энграфтмента и измерения размеров ортотопических трансплантатов является контрольная лапаротомия в конкретный день после перевивки с последующим измерением линейных размеров опухоли штангенциркулем [42].
Различные аппаратные методы визуализации позволяют проводить серийные измерения опухоли в течение периода наблюдения, предоставляя ценные данные о размере опухолевого очага и прогрессировании процесса. Методы оптической визуализации, такие как биолюминесцентная визуализация всего животного (in vivo imaging system, IVIS), часто используются благодаря своей специфичности и универсальности, поскольку клетки можно либо трансфицировать генами биолюминесцентных ферментов, либо пометить флуоресцентным зондом [43]. В рутинной практике наиболее широко используется метод наблюдения за ортотопическими опухолями, который заключается в использовании клеток, трансфицированных люциферазой – ферментом, который излучает свет при взаимодействии со своим субстратом, люциферином. Субстрат вводится в организм, что позволяет неинвазивно получать изображения и определять интенсивность света в определенной области для оценки роста опухоли [38, 44]. Следует учитывать, что любые методы оптической визуализации подвержены рассеиванию и поглощению света. Поэтому оптическая визуализация может быть затруднена из-за глубины тканей и, как правило, применима только к мелким грызунам. Точное измерение опухолей становится особенно сложной задачей при наблюдении за ростом ортотопических трансплантатов, когда опухоли начинают расти за пределами нормального анатомического пространства, поскольку они могут достигать больших размеров, не препятствуя передвижению животного или его жизнеспособности. Большая опухоль не только увеличивает рассеивание, но и «подстраивается» под свое микроокружение, что приводит к изменениям в кровоснабжении, pH и окислительных субстратов, ключевых компонентов, которые регулируют реакции оксидоредуктаз (люцифераз). Кроме того, в больших опухолях формируются некротические очаги, нарушается кровоснабжение, вызывающее гипоксию и аномальный метаболизм, что может приводить к снижению концентрации люциферина и активности ферментов, уменьшению флуоресцентных сигналов и ложному снижению интенсивности флуоресценции [45]. Ввиду высокой стоимости оборудование для IVIS может быть недоступно для научных организаций.
K. Doyle et al. [44] в экспериментах с ортотопической моделью нейробластомы NB1643 установили, что рост опухоли хорошо отслеживается с помощью ультразвука с применением ультразвукового датчика Wisonic Piloter Veterinary 6–15 МГц. Хотя этот датчик обладает меньшей разрешающей способностью, чем датчики 22–55 МГц, он заметно дешевле и доступнее. Многочисленные исследования продемонстрировали успешное использование ультразвука для мониторинга роста опухоли in vivo с равными или превосходящими результатами по сравнению с одной только биолюминесцентной визуализацией. По данным авторов, не было существенной разницы в возможностях визуализации при ультразвуковом исследовании (УЗИ) по сравнению с IVIS, а УЗИ-мониторинг в динамике способствует более точной идентификации и измерению опухоли.
Компьютерная томография (КТ) используется у человека для определения локализации и характеристики опухолей, наблюдения за инвазией и метастазированием, а также планирования лечебного вмешательства и лекарственной терапии. КТ обычно плохо контрастирует с мягкими тканями. M.S. Myers et al. [45] установили, что, несмотря на сопоставимую скорость и более высокую точность, самым большим недостатком КТ по сравнению с биолюминесцентным методом является то, что она требует предварительных анатомических знаний, особенно без использования маркированных зондов. Авторы показали, что измерения с помощью биолюминесценции значительно различаются и не отражают реальный рост опухоли в ортотопической модели LNCaP. С другой стороны, КТ очень точно оценивала реальный размер и форму опухоли в динамике в двух ортотопических моделях рака предстательной железы. По мнению авторов, КТ более предпочтительна, когда невозможно провести биолюминесцентную трансфекцию или флуоресцентную маркировку трансплантируемого опухолевого материала [45].
В экспериментальной онкологии магнитнорезонансная томография (МРТ) может быть использована для определения размера, местоположения, сосудистой инвазии и гетерогенности опухоли. Этот метод хорошо переносится лабораторными животными, а повторное исследование не влияет на благополучие животных или рост опухоли [14].
В сравнении с оптической визуализацией метод позитронно-эмиссионной томографии, совмещенной с КТ (ПЭТ/КТ), предполагает использование дорогостоящих радиоактивных соединений и требует строгих подходов к обеспечению безопасности и необходимости логистики радиоактивных изотопов. В то же время метод ПЭТ/КТ не требует предварительной генетической модификации опухолевых клеток и предоставляет томографическую, анатомическую и молекулярную информацию с высоким разрешением. Использование радиоактивного изотопа 18F-фтордезоксиглюкозы ([18F] ФДГ) гарантирует высокую трансляционную мощность исследований, проводимых с помощью этого метода. Во время исследования методом ПЭТ/ КТ с [18F]ФДГ голодание и согревание мышей, а также время поглощения [18F]ФДГ в 1 час могут значительно улучшить визуализацию опухолей, поскольку условия сканирования сильно влияют на контрастность ПЭТ [32, 46].
Преимущества и недостатки основных методов неинвазивной прижизненной визуализации, используемых в доклинических исследованиях, их чувствительность, производительность, разрешающая способность описаны в работе M. Baker [47].


