Осложнения гибкой уретерореноскопии
Автор: Ханалиев Б.В., Иванов А.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Обзоры литературы
Статья в выпуске: 4 т.19, 2024 года.
Бесплатный доступ
Гибкая уретерореноскопия (УРС) является операцией выбора при лечении больных с нефролитиазом. В настоящее время данная методика успешно применяется при лечении пациентов с камнями не только менее 2 см, но и в некоторых случаях более 2 см, при любой локализации в почке с высокой частотой полного удаления камней, значительно сократив время пребывания в стационаре. Однако, несмотря на высокую технологичность и безопасность, гибкая УРС имеет свои возможные осложнения, которые рассмотрены в данном обзоре литературы.
Гибкая урс, классификация clavien-dindo, инфекционные осложнения, травматические осложнения
Короткий адрес: https://sciup.org/140308704
IDR: 140308704 | DOI: 10.25881/20728255_2024_19_4_120
Текст обзорной статьи Осложнения гибкой уретерореноскопии
Гибкая уретерореноскопия (УРС), являющаяся частью ретроградной интраренальной хирургии (РИРХ) – один современных эффективных методов лечения пациентов с камнями почек. С каждым годом гибкая УРС всё больше внедряется в урологическую практику, благодаря своей безопасности. Однако, как и при любом методе оперативного лечения, у этого вида хирургического лечения имеются свои возможные осложнения.
Классификация
Осложнения гибкой УРС классифицируют на интраоперационные и послеоперационные. К интраоперационным осложнениям относятся: травма слизистой верхних мочевыводящих путей (ВМП), ложный ход или отслоение слизистой, кровотечение и перфорация стенки мочеточника интродьюсером, блокированная дефлексия, выворот слизистой мочеточника, полный отрыв мочеточника (авульсия) и др. Послеоперационные осложнения: активизация инфекции мочевыводящих путей (МВП), кровотечение, длительный болевой синдром, сепсис и др. [1].
В качестве оценки послеоперационных осложнений традиционно используется классификация Clavien-Dindo (MCCS) по степеням тяжести:
I степень – любые отклонения от нормального послеоперационного течения, не требующие медикаментозного лечения или хирургического, эндоскопического, радиологического вмешательства.
II степень – требуется консервативное лечение, а так же лечение в виде гемотрансфузии, энтерального или парентерального питания.
-
III степень – требуется хирургическое, эндоскопическое или радиологическое вмешательство.
IIIa степень – вмешательство без общего обезболивания.
IIIb степень – вмешательство под общим обезболиванием.
-
IV степень – жизнеугрожающие осложнения (включая осложнения со стороны ЦНС), требующие интенсивной терапии, наблюдения в отделении реанимации, резекции органа.
IVa степень – недостаточность одного органа.
IVb степень – полиорганная недостаточность.
-
V степень – cмерть больного.
Наиболее адаптированной к эндоурологической оценке мочеточника является классификация, предложенная О. Траксером, включающая в себя 5 степеней повреждения мочеточника (табл. 1, Рис. 1) [2; 3].
Осложнения гибкой УРС
Исследование, проведенное Ю. Сюй в (2018), где были проанализированы 322 последовательные РИРХ, выполненные одним хирургом, показали, что общая частота осложнений после РИРХ составляет 26,1% (MCCS: I = 67,7%, II = 22,7%, IIIb = 7,2%, IVb = 2,4%). Как выявили авторы, на осложнения влияли следующие факторы: клинически значимый рост по бактериоло-
Табл. 1. Классификация повреждения мочеточника по Postureteroscopic Lesion Scale (PULS)
|
Grade |
Повреждение |
|
|
0 |
Нет повреждения |
Неосложненная уретероскопия |
|
1 |
Повреждение слизистой оболочки |
|
|
2 |
Повреждение подслизистой оболочки |
Осложненная уретероскопия |
|
3 |
Перфорация с повреждением менее 50% по окружности |
|
|
4 |
Перфорация с повреждением более 50% по окружности |
|
|
5 |
Отрыв |

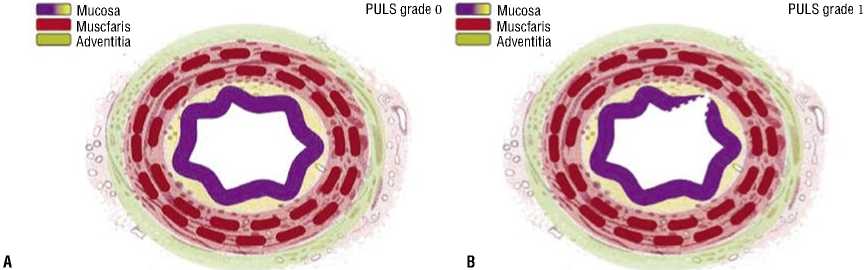
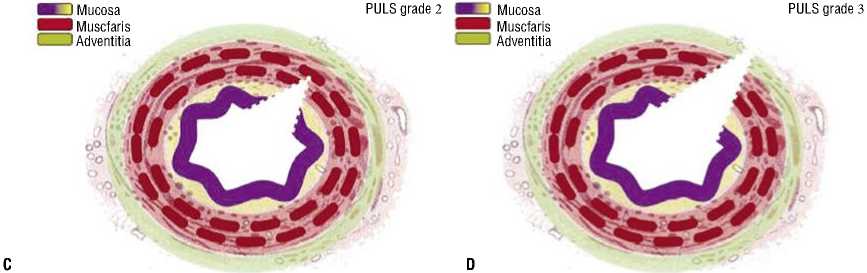
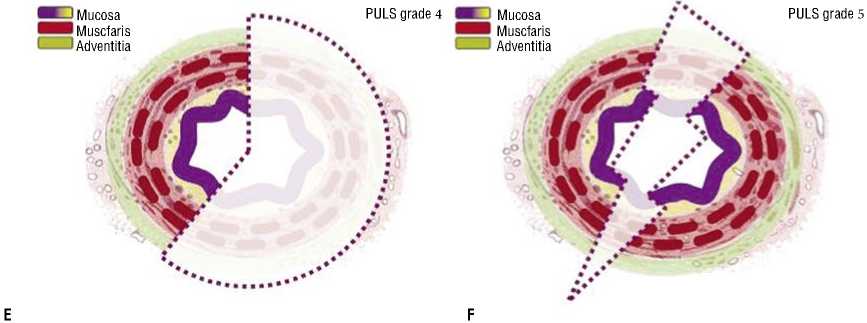
Рис. 1. Иллюстрации классов PULS 0-5 (a–f).
гическому анализу мочи, время операции, скорость ирригации и общий объем конкрементов. Большинство осложнений РИРХ относились к более низким классам по Clavien-Dindo [4].
Частота появления забрюшинных и околопочечных субкапсулярных гематом составляет от 0,4 до 1%. Л. Уайтхерст и Б.К. Сомани ретроспективно оценили 210 статей семи исследований (8929 пациентов). Предрасполагающими факторами были: умеренно-тяжелый гидронефроз, небольшой слой паренхимы, высокая продолжительность операции, артериальная гипертензия и выявление бактериурии по данным посева анализа мочи. Лечение варьировалось от консервативного (переливание крови, антибактериальная терапия (n = 22,55%)) до установки нефростомического дренажа (n = 27,5%). Повторное хи- рургическое вмешательство было необходимо у 7 (17,5%) пациентов. У двух пациентов проведена экстренная ангиография, у одного пациента из них произведена «открытая» нефрэктомия. Открытая операция с удалением тромбов была проведена у трех пациентов, нефростомия при тяжелом гидронефрозе у одного пациента и операция по коррекции неправильно расположенного стента у одного пациента. Отмечался один случай смертельного исхода от полиорганной неостаточности [5].
Инфекционные осложнения
Активизация ИМП является одной из наиболее частых и значимых осложнений при ретроградной интраренальной литотрипсии. Отдел клинических исследований общества эндоурологов (CROES) оценил
11 885 пациентов, перенесших уретерореноскопию, и обнаружил, что послеоперационная лихорадка возникла у 1,8% пациентов, у 1,0% пациентов активизировалась инфекция мочевыводящих путей (ИМП) и у 0,3% пациентов развился сепсис [6].
Систематический обзор, проведенный Б. Дыбовский и соавт., включающий 17 исследований (в том числе 10 за 2019–2021 годы), показал, что инфекционные осложнения после РИРХ наблюдались у 2,8–7,5% больных (в среднем 7,1%). Авторы выявили семь независимых факторов риска, связанных с инфекционными осложнениями после РИРХ: длительное время операции, положительное (клинически значимое) бактериологическое исследование мочи, частое использование антибиотиков в анамнезе, обнаружение в моче лейкоцитурии и нитритов, малый диаметр мочеточникового кожуха, струвитный уролитиаз, высокая скорость ирригации. Исследователи пришли к выводу: необходимо ограничивать время операции и скорости ирригации, а также рассмотреть необходимость использования интродьюсеров большего диаметра [7].
Н. Бходжани и соавт. определили такие факторы риска инфекционных осложнений как возраст, сахарный диабет, наличие стента мочеточника, положительный посев мочи, внутрипоченое давление (ВПД) более или равно 40 мм вод. ст., превышение длительности операции более 60 мин. (увеличивает риск развития инфекционных осложнений в 11 раз) [8; 9].
Нормальным ВПД является 0–15 см вод. ст. Использование помпы дает повышение более 400 см вод. ст., а пиковые значения доходят до 557 см вод. ст. [10].
Повышение ВПД более 204 см вод. ст. ухудшает кровоснабжение почки и венозный отток, вызывает повреждение почечной ткани и нарушение функции. На гистологическом уровне происходит вакуолизация и отшелушевание эпителия собирательных трубочек, микрокровоизлияния, фокальное склерозирование спустя 4–6 недель [11; 12]. Для того, чтобы избежать возможных осложнений во время любой эндоуроло-гической операции, ВПД не должно превышать 30 см вод. ст. [1].
Снизить осложнения, связанные с повышением ВПД, помогает использование мочеточникового кожуха: значительно уменьшает ВПД на 75%, при этом одновременно позволяет улучшить визуализацию [7; 13–16].
При ирригационном давлении 60–100 мм вод. ст. ВПД составляет 33,8-46,68 см вод. ст. при использовании кожуха 9,5/11,5
-
F, ВПД – 13,4–57,00 см вод. ст. при использовании кожуха 10/12 F, ВПД – 4,08–29,00 мм вод. ст. при использовании кожуха 11/13 F, ВПД – 2,72–20,0 см вод. ст. при использовании кожуха 12/14 F, ВПД – <20,00 см вод. ст. при использовании кожуха 14/16 F.
На сегодняший день, по мнению многих опытных урологов, оптимальным является кожух 12/14 F [17; 18].
Травматические повреждения мочеточника
Но, к сожалению, установка мочеточникового кожуха – не всегда безопасный этап. О. Траксер и А. Томас оценили 359 пациентов, перенесших РИРХ с установлением кожуха в неподготовленный ранее внутренним стентом мочеточник. Доля повреждений мочеточника составила 46,5 % (Grade 1 – 33%, grade 2 – 10%, grade 3 – 3%) [19].
Таким образом, традиционная установка мочеточникового стента на 10–14 суток (по мнению некоторых авторов – 5–7 суток) перед проведением РИРХ является обязательной процедурой, уменьшающей вероятность осложнений.
При соблюдении всех канонов безопасной эндоурологии повреждения мочеточника после РИРХ составляют 1–3% Стриктура мочеточника после РИРХ составляет менее 2% [20; 21].
Контроль температуры интраренальной жидкости имеет не менее важное значение в профилактики осложнений. Необратимые изменения в тканях начинаются при использовании температуры 43 °С в течение 120 минут (согласно правилу Sapareto «time-temperatu-re relationship»). Каждое последующее повышение на 1 °С сокращает это время на половину [22; 23].
Исследование, проведенное Али Х. Алдухи в эксперименте показало, где были протестированы 3 режима литотрипсии: при отсутствии ирригации, средней ирригации (100 см H2O) и интенсивной ирригации. Результаты исследования показали, что только интенсивная ирригация способствовала поддержке нормальной температуры за период всей операции (38–42 °С) [24].
Оптимальной ирригацией считается до 40 мл в минуту [25].
До сих пор остается актуальной проблемой колонизация почечных камней бактериями. Камни в почках, которые образуются вторично в результате инфицирования бактериями, продуцирующими уреазу, называются инфекционными камнями, а распространенными возбудителями являются виды Proteus, Klebsiella и Staphylococcus. Однако исследование, проведенное Пархоменко и соавт., где оценили бактериологическое исследование мочи и камней в когорте из 1191 пациента, обнаружили, что бактериология струвитных камней сместилась в сторону нетрадиционных микроорганизмов, расщепляющих мочевину, таких как виды Enterococcus [26].
Инфекционные камни часто состоят из фосфата магния-аммония (струвита) или карбоната апатита. В отличие от инфекционных камней есть инфицированные камни, представляющие колонизированные конкременты в почках, в которых образование и рост камней не связаны с продукцией уреазы.
Инфицированные камни с большей вероятностью, чем инфекционные камни, демонстрируют несоответствие между посевами камней и мочи. Однако, учитывая, что камни инфекционные часто являются следствием предшествующей ИМП (инфекции мочевыводящих путей), посев камней и посев мочи часто совпадают,
поэтому очень важно выполнять бактериологическое исследование мочи перед операцией.
Также известно, что инфицированные конкременты содержат до 40 раз больше эндотоксинов в сравнении с неинфицированными конкрементами [27].
Надо отметить, поскольку антибиотики не могут проникнуть в матрицу камня, критически важно планировать полное хирургическое удаление конкремента с дальнейшим проведением бактериологического анализа конкремента или мочи, взятой интраоперационно из почки путем внутреннего дренирования [28; 29].
Размер камней играет роль, как один из предикторов развития послеоперационных инфекционно-воспалительных изменений. Крупные камни, т.е. больше 20 мм, с большей вероятностью являются инфекционными и содержат большее количество эндотоксинов [30; 31].
Мнимое «благополучие» стерильности мочи создает средняя порция мочи. Daniele Castellani и соавт. провели метаанализ, в котором показали, что пузырная моча является плохим аргументом для оценки контаминации микроорганизмами, особенно при флотирующих камнях лоханки или лоханочно-мочеточникового сегмента. Для более точного соответствия рекомендуется забор лоханочной порции мочи и использование конкремента для бактериологического исследования [32].
Известно, что бактерии способны длительное время находиться в почечных камнях в составе биопленок. При проведении антимикробной терапии гибнут микроорганизмы, находящиеся в планктонной форме, в отличие от микроорганизмов, интегрированных в биопленку [33].
В мире отмечается стремительный рост антибио-тикорезистентности. Недавние исследования выявляли бактериурию, характеризующуюся полирезистентностью к антибактерилаьным препаратам, что несет существенный независимый риск развития послеоперационного сепсиса, невзирая на предоперационную антибиотико-терапию. Таким образом, высокий уровень антибио-тикорезистентности является значительным фактором отсутствия эффекта от эмпирического назначения препарата до операции [34].
Заключение
С усовершенствованием моделей инструментов, применяемых в РИРХ, ежегодно по данным исследований многие осложнения нивелируются. Накопленный опыт за годы использования гибких уретеронефроскопов сводит риск появления осложнений к минимальному, что позволяет данную методику рекомендовать себя как эффективную и безопасную.
Однако, инфекционные осложнения и по сей день остаются одной из актуальных проблем, увеличивают сроки пребывания в стационаре и последующий реабилитационный период, что несомненно сказывается так же на экономическом аспекте. Поэтому очень важно придерживаться всех необходимых технических правил соблюдения «безопасной» хирургии, адекватной и рациональной антибактериальной профилактики и терапии (в случае необходимости).
Несоответствие посева камня и средней порции мочи, подталкивает нас к поиску новых профилактических мер по предотвращению активизации ИМП в послеоперационном периоде. Есть необходимость исследовать новые факторы риска и пути их разрешения. По данному вопросу нами проводится исследование.
Список литературы Осложнения гибкой уретерореноскопии
- Гаджиев Н.К., Горгоцкий И.А., Шкарупа А.Г др. Гибкая уретерореноскопия. Методические рекомендации. Санкт-Петербург: Санкт-Петербургский государственный университет Клиника высоких медицинских технологий им. Н. И. Пирогова, 2022.
- Schoenthaler M. The Post-Ureteroscopic Lesion Scale (PULS): a multicenter video-based evaluation of inter-rater reliability / Schoenthaler M., Buchholz N., Farin E. et al. World J Urol. 2014; 32(4): 1033-40. doi: 10.1007/s00345-013-1185-1.
- Traxer O. Prospective Evaluation and Classification of Ureteral Wall Injuries Resulting from Insertion of a Ureteral Access Sheath During Retrograde Intrarenal Surgery. The Journal of Urology. 2012; 189. doi:10.1016/ j.juro.2012.08.197.
- Xu Y, Min Z, Wan SP, et al. Complications of retrograde intrarenal surgery classified by the modified Clavien grading system. Urolithiasis. 2018; 46(2): 197-202. doi: 10.1007/s00240-017-0961-6.
- Whitehurst LA, Somani BK. Perirenal Hematoma After Ureteroscopy: A Systematic Review. J Endourol. 2017; 31: 438-445. doi: 10.1089/end. 2016.0832.
- Rosette J, Denstedt J, Geavlete P, et al. The clinical research office of the endourological society ureteroscopy global study: indications, complications, and outcomes in 11,885 patients. J Endourol; 2014; 28: 131-139. doi: 10.1089/end.2013.0436.
- Dybowski B, Bres-Niewada E, Rzeszutko M, et al. Risk factors for infectious complications after retrograde intrarenal surgery – a systematic review and narrative synthesis. Cent European J Urol. 2021; 74: 437-445. doi: 10.5173/ceju.2021.250.
- Zhang H, Jiang T, Gao R, et al. Risk factors of infectious complications after retrograde intrarenal surgery: a retrospective clinical analysis. J Int Med Res. 2020; 48(9). doi: 10.1177/0300060520956833.
- Bhojani N, Miller LE., Bhattacharyya S, et al. Risk Factors for Urosepsis After Ureteroscopy for Stone Disease: A Systematic Review with Meta-Analysis. J Endourol. 2021; 35: 991-1000. doi: 10.1089/end.2020.1133.
- Rehman J, Monga M, Landman J, et al. Characterization of intrapelvic pressure during ureteropyeloscopy with ureteral access sheaths. J Urology. 2003; 61: 713-718. doi: 10.1016/s0090-4295(02)02440-8.
- Schwalb DM, Eshghi M, Davidian M, et al. Morphological and physiological changes in the urinary tract associated with ureteral dilation and ureteropyeloscopy: an experimental study. J Urol. 1993; 149: 1576-1585. doi: 10.1016/s0022-5347(17)36456-x.
- Jun HU, Frimodt-Møller PC, Osther PJ, Mortensen J. Pharmacological effect on pyeloureteric dynamics with a clinical perspective: a review of the literature. Urol Res. 2006; 34: 341-350. doi: 10.1007/s00240-006-0069-x.
- Auge BK, Pietrow PK, Lallas CD, et al. Ureteral access sheath provides protection against elevated renal pressures during routine flexible ureteroscopic stone manipulation. J Endourol. 2004; 18: 33-36. doi: 10.1089/ 089277904322836631.
- Monga M, Bodie J, Ercole B. Is there a role for small-diameter ureteral access sheaths? Impact on irrigant flow and intrapelvic pressures. Urology. 2004; 64: 439-441. doi: 10.1016/j.urology.2004.04.060.
- Sener TE, Cloutier J, Villa L, et al. Can We Provide Low Intrarenal Pressures with Good Irrigation Flow by Decreasing the Size of Ureteral Access Sheaths? J Endourol. 2016; 30: 49-55. doi: 10.1089/end.2015.0387.
- Ng YH, Somani BK, Dennison A, et al. Irrigant flow and intrarenal pressure during flexible ureteroscopy: the effect of different access sheaths, working channel instruments, and hydrostatic pressure. J Endourol. 2010; 24: 1915-1920. doi: 10.1089/end.2010.0188.
- Tokas T, Skolarikos A, Herrmann T, et al. Pressure matters 2: intrarenal pressure ranges during upper-tract endourological procedures. World J Urol. 2019; 37: 133-142. doi: 10.1007/s00345-018-2379-3.
- Noureldin YA, Kallidonis P, Ntasiotis P, et al. The Effect of Irrigation Power and Ureteral Access Sheath Diameter on the Maximal Intra-Pelvic Pressure During Ureteroscopy: In Vivo Experimental Study in a Live Anesthetized Pig. J Endourol. 2019; 33: 725-729. doi: 10.1089/end.2019.0317.
- Traxer O, Thomas A. Prospective evaluation and classification of ureteral wall injuries resulting from insertion of a ureteral access sheath during retrograde intrarenal surgery. J Urol. 2013; 189: 580-584. doi: 10.1016/j.juro.2012.08.197.
- Breda A, Ogunyemi O, Leppert JT, et al. Flexible ureteroscopy and laser lithotripsy for single intrarenal stones 2 cm or greater--is this the new frontier? J Urol. 2008; 179: 981-984. doi: 10.1016/j.juro.2007.10.083.
- Somani BK, Sun GY, Osther PJ, et al. Complications associated with ureterorenoscopy (URS) related to treatment of urolithiasis: the Clinical Research Office of Endourological Society URS Global study. World J Urol. 2017; 35: 675-681. doi: 10.1007/s00345-016-1909-0.
- Aldoukhi AH, Ghani KR, Hall TL, et al. Thermal Response to High-Power Holmium Laser Lithotripsy. J Endourol. 2017; 31: 1308-1312. doi: 10.1089/end.2017.0679.
- Малхасян В.А. Осложнения гибкой уретерореноскопии. [URL].
- Aldoukhi AH, Hall TL, Ghani KR, et al. Caliceal Fluid Temperature During High-Power Holmium Laser Lithotripsy in an In Vivo Porcine Model. J Endourol. 2018; 32: 724-729. doi: 10.1089/end.2018.0395.
- Maxwell AD, Conaghy BM, Harper JD, et al. Simulation of Laser Lithotripsy-Induced Heating in the Urinary Tract. J Endourol. 2019; 33: 113-119. doi: 10.1089/end.2018.0485.
- Parkhomenko E, Fazio A, Tran T, et al. A multi-institutional study of struvite stones: patterns of infection and colonization. J Endourol. 2017; 317: 533-537. doi: 10.1089/end.2016.0885.
- Fan J, Wan S, Liu L, et al. Predictors for uroseptic shock in patients who undergo minimally invasive percutaneous nephrolithotomy. Urolithiasis. 2017; 45: 573-578. doi: 10.1007/s00240-017-0963-4.
- Khusid JA, Hordines JC, Sadiq AS, et al. Prevention and Management of Infectious Complications of Retrograde Intrarenal Surgery. Sec. Genitourinary Surgery. 2021. doi: 10.3389/fsurg.2021.718583.
- Marien T, Miller NL. Treatment of the infected stone. Urol Clin North Am. 2015; 42: 459-472. doi: 10.1016/j.ucl.2015.05.009.
- Türk C, Neisius A, Petrik A, et al. EAU Guidelines on Urolithiasis. European Association of Urology. 2017; 84.
- Korets R, Graversen JA, Kates M, et al. Post-percutaneous nephrolithotomy systemic inflammatory response: a prospective analysis of preoperative urine, renal pelvic urine and stone cultures. J Urol. 2011; 186: 1899-1903. doi: 10.1016/j.juro.2011.06.064.
- Castellani D, Teoh JY-C, Pavia MP, et al. Assessing the Optimal Urine Culture for Predicting Systemic Inflammatory Response Syndrome After Percutaneous Nephrolithotomy and Retrograde Intrarenal Surgery: Results from a Systematic Review and Meta-Analysis. J Endourol. 2022; 36: 158-168. doi: 10.1089/end.2021.0386.
- Толордава Э.Р. Роль бактериальный биопленок в этиопатогенезе мочекаменной болезни: автореф. дис. … канд. биол. наук. М.; 2014.
- Patel N, Shi W, Liss M, et al. Multidrug resistant bacteriuria before percutaneous nephrolithotomy predicts for postoperative infectious complications. J Endourol. 2015; 29: 531-536. doi: 10.1089/end.2014.0776.


