Основные методы идентификации наркотических веществ в трупной моче и определение биохимических показателей в крови при положительных исследованиях на наркотики
Автор: Бычков Евгений Николаевич, Серкова Светлана Александровна, Арсентьева Любовь Анатольевна, Французова Татьяна Султановна, Блувштейн Григорий Аврамович, Бородулин Владимир Борисович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Наркология
Статья в выпуске: 3 т.7, 2011 года.
Бесплатный доступ
Представлены методы идентификации наркотических веществ, описаны хроматографические и спектральные характеристики наркотических веществ. Изучены взаимосвязи между биохимическими показателями при положительных исследованиях на наркотические вещества. Обнаружено увеличение концентрации мочевины в трупной крови наркоманов по сравнению с контрольными образцами
Креатинин, моча, наркотические вещества, спектроскопия, хроматография
Короткий адрес: https://sciup.org/14917376
IDR: 14917376
Текст научной статьи Основные методы идентификации наркотических веществ в трупной моче и определение биохимических показателей в крови при положительных исследованиях на наркотики
Адрес: 410012, г. Саратов, ул. Б. Казачья, 112.
Тел.: 89172007474.
хроматографические методы анализа, такие, как тонкослойная хроматография, спектрофотометрия, газовая хроматография и другие. Для определения наркотических веществ чаще всего используется моча, как наиболее информативный биообъект исследования.
Методы. Среди методов обнаружения наркотических веществ использовали тонкослойную хроматографию и спектрофотометрию [1, 2]. Хроматография как физико-химический процесс основана на различных скоростях движения и размывания концентрационных зон компонентов, которые движутся в потоке подвижной фазы вдоль слоя неподвижной фазы. При этом следует иметь в виду, что исследуемые вещества находятся в обеих фазах. После разделения анализируемой смеси на отдельные компоненты хроматографирование прекращают и в хроматографических зонах проводят качественное и количественное определение (детектирование). Для обнаружения бесцветных соединений чаще всего используют облучение УФ-светом, опрыскивание химическими реагентами, смачивание проявляющим раствором, капельное нанесение реагента, экстрагирование зоны вещества с сорбента для последующего исследования полученных соединений физическими и химическими методами. Идентификация компонентов проводится по свидетелям (метчикам) — известным эталонным веществам сравнения, хроматографируемым одновременно, на одной и той же пластинке, с анализируемой пробой.
Основными системами для двухмерной хроматографии наркотических веществ являются: 1) для опиатов: хлороформ — диоксан — ацетон — 25%-ный раствор аммиака (45:47.5:5:2.5), этилацетат — этанол — аммиак (9:1:0.5); 2) для амфетаминов: хлороформ — ацетон — этанол — 25%-ный раствор аммиака (20:20:3:1), толуол — этанол — триэтиламин (9:1:1) [3]. Основной качественной характеристикой тонкослойной хроматографии является величина Rf, которая представляет собой отношение расстояний, которые пройдены исследуемым веществом и подвижной фазой [4]. Для определения Rf очень важно точно установить положение фронта растворителя. При полном совпадении полученного значения с Rf известного соединения можно говорить только о возможной идентичности вещества, которую дополнительно подтверждали спектрофотометрией [5].
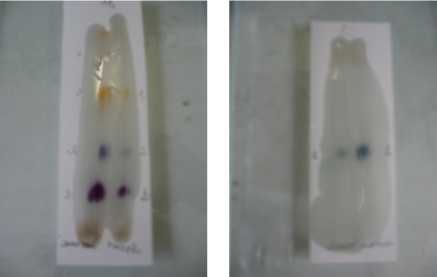
а б
Рис. 1. Система: этилацетат – этанол – 25%-ный аммиак (9:1:0,5). Реагент – реактив Марки. Объект – моча (а) Система: хлороформ – ацетон – этанол – 25%-ный аммиак (20:20:3:1). Реагент – реактив Марки. Объект – моча (б)
В скрининге наркотических веществ используются следующие реагенты для обнаружения: 1) раствор нингидрина, 2) реактив Драгендорфа, 3) реактив Манделина, 4) реактив Марки, 5) реактив Фреде; 6) 1 %-ный раствор Черного прочного К (FBK). Помимо производных амфетамина FBK дает различные окрашивания (красного, синего, оранжевого, фиолетового цвета) с некоторыми другими веществами (табл. 1, рис. 1–3).
На рисунках 1–3 представлены пластинки «Сорб-фил» с нанесенными на них объектами и метчиками
Таблица 1
Сравнительные значения Rf наркотических веществ на пластинках «Сорбфил»
|
Вещества (нарк.) |
Вид систем |
|||||||
|
основная система |
Rf |
основная система |
Rf |
основная система |
Rf |
основная система |
Rf |
|
|
Морфин |
Этилацетат – этанол – 25% аммиак (9:1:0.5) |
0.2 |
Хлороформ – диоксан – ацетон – 25% аммиака (45:47.5:5:2.5) |
0.17 |
- |
- |
- |
- |
|
Кодеин |
Этилацетат – этанол – 25% аммиак (9:1:0.5) |
0.34 |
Хлороформ – диоксан – ацетон – 25% аммиака (45:47.5:5:2.5) |
0.41 |
- |
- |
- |
- |
|
Промедол |
Этилацетат – этанол – 25% аммиак (9:1:0.5) |
0.69 |
Хлороформ – диоксан – ацетон – 25% аммиака (45:47.5:5:2.5) |
0.72 |
- |
- |
- |
- |
|
Героин |
Этилацетат – этанол – 25% аммиак (9:1:0.5) |
0.60 |
Хлороформ – диоксан – ацетон – 25% аммиака (45:47.5:5:2.5) |
0.48 |
- |
- |
- |
- |
|
МДА |
Хлороформ |
0.66 |
Толуол – |
0.46 |
Метанол – |
0.41 |
Этилацетат – |
0.62 |
|
МДМА МДЕА |
– ацетон – этанол – |
0.23 0.46 |
этанол – триэтиламин |
0.46 0.64 |
конц. аммиак (100:1.5) |
0.31 |
метанол – конц. аммиак |
0.62 |
|
ДОМ/STP ПМА ДМА ТМА ДОБ ДОХ МБДБ БДБ ДОЭТ Мескалин Метамфетамин |
25% водный раствор аммиака (20: 20:3:1) |
0.46 0.64 0.54 0.43 0.41 0.60 0.41 0.74 0.52 0.5 0.38 |
(9:1:1) |
0.43 0.36 0.42 0.30 0.40 0.43 0.62 0.59 0.40 0.12 0.46 |
0.35 0.41 0.37 0.37 0.36 0.44 0.33 |
(85:10:5) |
0.63 0.62 0.65 0.62 0.61 0.66 0.63 |
|

а
Рис. 2. Система: хлороформ – диоксан – ацетон – 25%-ный аммиак (45:47,5: 5:2,5).
Реагент – реактив Драгендорф. Объект – моча (а) Система: метанол – конц. аммиак (100:1,5) Реагент – 1%-ный раствор Черного прочного, 1М раствор едкого натра.Объект – моча (б)

б

Рис. 3. Система: этилацетат – метанол – конц. аммиак (85:10:5). Реагент – 1%-ный раствор Черного прочного, 1М раствор едкого натра. Объект – моча
после прогонки в основных камерах и опрыскивания реагентами
В основе количественных определений спектральными методами лежит закон Бугера — Ламберта — Бера, устанавливающий зависимость между оптической плотностью и концентрацией анализируемого раствора (табл. 2).
В работе использовались биохимические методики.
Определение ацетилхолинэстеразы (АХЭ) по методу Хестрина.
В пробирку помещали 1,5 мл фосфатного буфера с pH 7,6 по УИБ, 0,5 мл дистиллированной воды, 1 мл исследуемой крови в разведении 1:8 и 1 мл 0,4%-ного раствора ацетилхолинохлорида. Смесь термостатировали при периодическом встряхивании в течение 30 мин. Затем в пробирку добавляли 1 мл 25%-ного раствора трихлоруксусной кислоты, через 10 мин. содержимое пробирки отфильтровывали. К 1 мл безбелкового фильтрата добавляли 2 мл смеси растворов из 3,5н едкого натра и 2н солянокислого гидроксиламина в соотношении 1:1, 1 мл соляной кислоты в разведении 1:2, 1 мл 0,37м раствора хлорного железа в 0,1н растворе соляной кислоты. Раствор колориметрировали на КФК-3 при длине волны 510 нм, в кювете толщиной слоя 5,05 мм. В качестве раствора сравнения использовали контроль на реактивы. Концентрация неразрушенного ацетилхолинохлорида в растворе имеет линейную обратно пропорциональную зависимость от активности ацетилхолинэстеразы. Кроме того, проводили определение концентрации гемоглобина. В пробирку отмеряли 2 мл трансформирующего раствора из набора «Диахим-Гемциан», добавляли 0,2 мл разведенной крови 1:8, инкубировали при температуре 20˚С 15 мин. Центрифугировали 10 мин. при 15 тыс. об/мин. Затем снимали оптическую плотность на КФК-3 при длине волны 540 нм в кювете толщиной слоя 5,05 мм. В качестве раствора сравнения использовали контроль на реактивы.
Таблица 2
Спектральные характеристики наркотических веществ
|
Вещество |
Растворитель |
λ макс, нм |
|
Морфин |
н НСl 0.1 н NaOH |
285 205,298 |
|
Этанол |
286 |
|
|
Кодеин |
н НСl |
211,285 |
|
0.1 н NaOH |
284 |
|
|
Кодеина фосфат |
Вода |
284 |
|
Тебаин |
0.1 н НСl 0.1 н NaOH |
284 284 |
|
0.1 н НСl |
278 |
|
|
Героин |
0.1 н Н2SO4 |
279 |
|
Этанол |
281 |
|
|
0.1 н NaOH |
278 |
|
|
Амфетамины: МДА |
286 |
|
|
МДМА |
286 |
|
|
МДЕА |
286 |
|
|
ДОЭТ МБДБ |
Водный раствор |
289 |
|
286 |
||
|
ПМА |
275 |
|
|
ДОБ |
295 |
|
|
Мескалина сульфат |
268 |
Активность холинэстеразы прямо пропорциональна концентрации гемоглобина.
Расчет проводили по формулам:
Qon=
E 8-8 100—— .юо
E
V cm
(1),
где 8 — постоянная;
8 — разведение крови;
E
100--^100–% разрушенного ацетилхолинохлорида;
cm
Eоп — оптическая плотность опытного образца;
Eст — оптическая плотность стандартного раствора;
EHb — оптическая плотность гемоглобина.
После математических преобразований формула
-
(1) принимает вид линейной зависимости: Q on = 64 — E on ∙ F ,
где F = 64/E нь .
Определяем оптические плотности Eоп и Eст .
СHb=F2∙EHb, где F2=64.74,
(2),
Определяем оптическую плотность ЕНb , Q = -331 Нb
Cbb+10,7
% отклонения = 100—Q'100 отклонения
Определение мочевины в крови основано на измерении скорости образования окрашенного комплекса мочевины с диацетилмонооксимом в сильнокислой среде в присутствии тиосемикарбазида и ионов трехвалентного железа.
0,5 мл крови с 4,5 мл 5%-ного раствора трихлоруксусной кислоты центрифугировали 5 мин при 3000 об/мин. К 0,02 мл полученной надосадочной жидкости добавляли 2 мл реактива, полученного путем смешивания равных количеств 0,9 н серной кислоты и реактива на мочевину (диатилмонооксим 5 ммоль/л, тиосемикарбазид 0,08 ммоль/л и трехвалентное железо 25 ммоль/л). В качестве контроля раствор мочевины с концентрацией 16,65 ммоль/л. Растворы ставили на кипящую водяную баню на 10 мин. Реакционная смесь дает с мочевиной розовое окрашивание. Концентрация мочевины прямо пропорциональна его оптической плотности и рассчитывается по формуле: C = F • E on , F = 16-65/Ecm . Раствор колориметрировали на КФК-3, кювета 5,05 мм, длина волны 500 нм, определяли оптическую плотность и концентрацию мочевины.
Определение креатинина крови основано на измерении скорости образования окрашенного комплекса креатинина с пикриновой кислотой в щелочной среде.
0,5 мл крови добавляли 0,5 мл трихлоруксусной кислоты с концентрацией 1,22 ммоль/л, 1 мл дистиллированной воды, центрифугировали 5 мин при 3000 об/мин. К 1 мл надосадочной жидкости добавляли 0,5 мл пикриновой кислоты с концентрацией 0,04 ммоль/л и 0,5 мл едкого натра с концентрацией 0,75 ммоль/л, перемешивали и оставляли на 20 мин при комнатной температуре. В качестве контроля использовали раствор, со- стоящий из смеси креатинина 445,2 мкмоль/л и альбумина 20 г/л. Раствор сравнения — водный раствор пикриновой кислоты. Реакционная смесь дает с креатинином желто-оранжевое окрашивание. Концентрация креатинина прямо пропорциональна его оптической плотности и рассчитывается по формуле: C=FEon, F=0,177/Ecm. Раствор колориметрировался на КФК-3, кювета 5,05 мм, при длине волны 500 нм, измеряли оптическую плотность и концентрацию креатинина.
Результаты. Проведенный анализ десяти исследований трупной крови при положительных реакциях на наркотические вещества выявил следующее: 1) показатели ацетилхолинэстеразы в пяти случаях были в пределах нормы (292–334 ExhHb), в трех случаях были понижены на 2, 5 и 28% и в двух случаях повышены на 5 и 17%; 2) показатели мочевины в трех случаях укладывались в границы нормы (3,0-5,0 ммоль/л), в двух случаях были ниже нормы, а в пяти случаях повышены; 3) показатели креатинина в двух случаях были в пределах нормы (0,12–0,26 ммоль/л), в трех случаях понижены, а в пяти случаях повышены (табл. 3).
Таблица 3 Соотношения биохимических показателей в трупной крови при положительных исследованиях на наркотические вещества и в контроле
(3),
|
Биохимический показатель |
Контроль |
Исследуемая группа |
|
|
(М±m) |
(М±m) |
Р |
|
|
АХЭ |
312±22 |
338±24 |
Р>0,05 |
|
Креатинин |
0,19±0,07 |
0,22±0,08 |
Р>0,05 |
|
Мочевина |
4±0,87 |
7,5±0.8 |
Р<0,05 |
В качестве контроля брали трупную кровь при отрицательных результатах исследования на наркотические вещества. Из табл. 3 видно, что биохимические показатели ацетилхолинэстеразы и креатинин не являются достоверными величинами и находятся в интервале Р>0,05. В то же время концентрация мочевины в трупной крови потребителей наркотиков была выше по сравнению с кон-ролем (Р<0,05).
Обсуждение . Проведенное исследование позволяет говорить о несовпадении результатов биохимических исследований крови при наличии наркотических веществ и их дериватов в моче наркотизирующихся, несовершенстве имеющихся на сегодняшний день методов биохимического подтверждения потребления наркотических препаратов. Полученные результаты стимулируют поиск информативных биохимических маркеров при положительных исследованиях трупной крови на наркотические вещества.
Выводы:
-
1. Какой-либо зависимости между показателями ацетилхолинэстеразы и креатинина в трупной крови при положительных исследованиях на наркотические вещества не выявлено. Обнаружено увеличение концентрации мочевины в трупной крови потребителей наркотиков.
-
2. Целесообразно продолжить поиск информативных биохимических маркеров при положительных исследованиях трупной крови на наркотические вещества.
Список литературы Основные методы идентификации наркотических веществ в трупной моче и определение биохимических показателей в крови при положительных исследованиях на наркотики
- Еремин С. К., Изотов Б. Н., Веселовская Н.В. Анализ наркотических средств: метод, рук-во для врачей. М.: Медицина, 1993. С. 9-11.
- Значение биохимических исследований в комплексной диагностике острых отравлений опиатами/Г. В. Михайлова, О. Г. Асташкина, Е. Ю. Павленко [и др.]//Альманах судебной медицины. 2003. Вып. VI. С. 88-91.
- Экспертное исследование производных амфетамина/И. Г. Алексеев, А. В. Беляев, М. А. Дроздов [и др.]. М.: Медицина, 1998. 25 с.
- Крамаренко В.Ф. Токсикологическая химия. Киев, 1989 С. 184-190.
- Калетина Н.И. Токсикологическая химия: Метаболизм и анализ токсикантов. М.: ГЭОТАР-Медиа2008. С. 440-450.


