Основные молекулярные механизмы канцерогенеза, индуцированного вирусом папилломы человека
Автор: Полатова Д. Ш., Мадаминов А. Ю.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Обзор и аналитика. Канцерогенез
Статья в выпуске: 4 т.11, 2021 года.
Бесплатный доступ
Наиболее широко распространенным инфекционным фактором, вызывающим злокачественные новообразования, является вирус папилломы человека (ВПЧ). 16 генотип ВПЧ часто участвует в канцерогенезе плоскоклеточной карциномы ротоглотки, встречаясь в 80 % случаев. Вирусные белки E5, E6 и E7 являются основными драйверами, ответственными за инициирование и прогрессирование опухоли за счет стимуляции пролиферации клеток, выживания клеток, ингибирование клеточного апоптоза и модуляции дифференцировки кератиноцитов. Ранний промотор инициируется выше E6 независимо от дифференцировки клетки и синтезирует транскрипты, которые транслируются на ранних этапах жизненного цикла вируса. Поздний промотор запускается в зависимости от дифференцировки клетки и служит сугубо для производства набора транскриптов, которые побуждают трансляцию белков L1 и L2. Во время входа вируса в клетку белок L1 прикрепляется гепарансульфатными протеогликанами (ГСПГ) на внеклеточном матриксе, после чего вирус проникает в клетку путем микропиноцитоза. Взаимодействие с ГСПГ считается начальным контактом, который способствует конформационным изменениям капсида, позволяя облегчить перенос вириона на вторичные рецепторы. Деление клеток играет важную роль в доставке вирусного генома в ядро. ВПЧ перемещается по цитоплазме в просвете транспортных пузырьков, которые зарождаются из комплекса Гольджи, выстраиваются вдоль микротрубочек и передаются в конденсированные хромосомы. Считается, что интеграция генома ВПЧ вносит вклад в онкогенез за счет увеличения экспрессии онкогенов ВПЧ в клетке с помощью различных механизмов, которые способствуют неуправляемой пролиферации клетки, приводящей к значительному повреждению ДНК. Интегрированные транскрипты могут быть более стабильными и онкогенными, чем транскрипты ВПЧ, происходящие из эписомальной ДНК.
Вирус папилломы человека, базальные клетки, транскрипция генов, вирусные белки е6 и е7, пролиферация клеток, интеграция генома, повреждение днк
Короткий адрес: https://sciup.org/140290753
IDR: 140290753 | DOI: 10.18027/2224-5057-2021-11-4-39-47
Текст научной статьи Основные молекулярные механизмы канцерогенеза, индуцированного вирусом папилломы человека
В 1961 году Американский ученый Леонард Хейфлик обнаружил, что нормальная человеческая клетка может реплицироваться только от 40 до 60 раз в культуре клеток, прежде чем она больше не сможет делиться и разрушится в результате старения [1]. Было обнаружено, что предел Хей-флика коррелирует с длиной теломерной области на конце хромосом. В процессе репликации хромосомы небольшие сегменты ДНК в каждой теломере не могут копироваться и теряются. В 1971 году русский биолог Алексей Матвеевич Оловников предложил принцип маргинотомии в матричном синтезе полинуклеотидов, который заключается в том, что ДНК-полимераза не в состоянии полностью реплицировать линейную матрицу, которая получается всегда короче в начальной ее части. Постепенное укорачивание ДНК ограничивает пролиферативный потенциал клеток, и теломеры достигают критической длины. Именно в этот момент клетка стареет, а деления достигают своего предела
-
[2] . Некоторые вирусы, используя репликационные резервы хозяина, потенциально могут нарушить эту биологическую закономерность, что может привести к опасным заболеваниям, таким как злокачественные новообразования.
Вирус — неклеточная форма жизни, которая не имеет собственный обмен веществ, но, тем не менее, содержит надежно защищенную субстанцию наследственной информации, составляющую основу жизни. Наиболее широко распространенным инфекционным фактором, вызывающим злокачественные новообразования, является вирус папилломы человека (ВПЧ). ВПЧ с помощью собственных реплицируемых белков контролирует клеточный цикл, и в конечном итоге клетки трансформируются в злокачественные из-за бесконечной пролиферации. ВПЧ в отличие от более крупных ДНК-вирусов, таких как аденовирусы, герпесвирусы и поксвирусы, не кодируют автономный комплекс саморепликации, и они реплицируется и собираются исключительно в ядре клетки и используют для этого полимеразы хозяина [3].
Вирус папилломы человека
Понимание о связи злокачественных новообразований с инфекцией за последние 60 лет изменилось. Международное агентство по изучению рака классифицирует инфекционные патогены на следующие группы канцерогенов: Helicobacter pylori, ВПЧ высокого риска, вирус гепатита В и вирус гепатита С [4]. Наиболее распространенным является ВПЧ высокого риска, участвующий в канцерогенезе плоскоклеточной карциномы ротоглотки (ПККР) — ВПЧ 16-го генотипа (встречается в 80% случаев) и ВПЧ 18-го генотипа (приблизительно в 3% случаев) [5]. По состоянию на сентябрь 2021 года было идентифицировано 228 типов ВПЧ [6]. Эти типы делятся на 5 основных родов, связанных с различными заболеваниями: альфа -, бета -, гамма -, мю- и ню-папилломавирусы. Эти роды различаются по своему тропизму, который определяется проникновением вируса, обусловленным взаимодействием капсидного белка L1 с поверхностью клетки. ВПЧ рода бета -, гамма -, мю- и ню- обладают кожным тропизмом, который обычно приводит к появлению бородавок на коже рук или ног, в то время как представители рода альфа имеют тропизм к слизистым оболочкам и связаны с развитием рака.
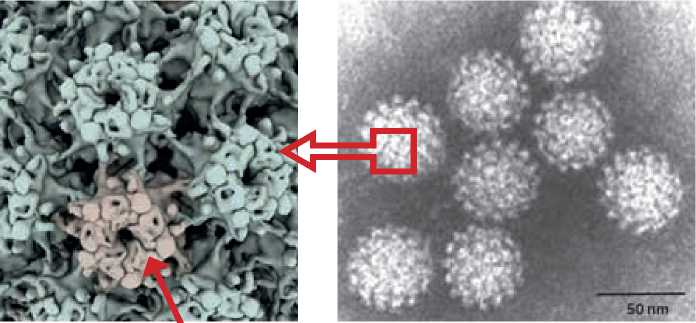
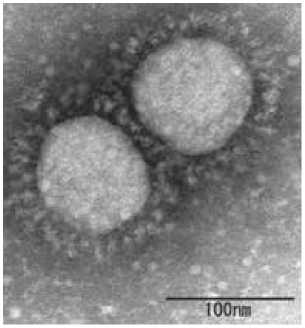
При электронной микроскопии с негативным окрашиванием разные исследователи получили различные результаты, но было обнаружено, что диаметр ВПЧ в среднем составляет примерно 50–55 нм, то есть он вдвое меньше вируса SARS-Cov-2 (рис. 1). Капсид ВПЧ состоит из двух белков: основного капсидного белка L1 и второстепенного капсидного белка L2. ВПЧ состоит исключительно из 360 молекул мономеров L1, организованных в 72 пентамерных капсомера, образующих икосаэдрическую решетку Т =7, в котором пентамеры занимают шестивалентные позиции [7]. Мономеры белка L2, вставлены в центры пентамеров [8]. С-конец L1 имеет α-спиральную природу, что делает его неупорядоченным и гибким. Это позволяет С-концу белка L1 действовать как «внедряющееся плечо», которое вторгается в соседние капсомеры [9].
Эти межкапсомерные взаимодействия дополнительно стабилизируются дисульфидными связями L1, которые ковалентно связывают высоко консервативные остатки цистеина, приводящие к образованию димеров и тримеров L1 [7]. Точная конформация белка L2 в капсиде по-прежнему остается малоинформативной. Большая часть белка L2 скрыта внутри зрелого капсида, тогда как только часть N-терминала на остатках 60–120 находится на поверхности. При входе вируса в клетку белок L2 проявляется и претерпевает конформационные изменения [10].
Две цепи вирусной ДНК используется в качестве матрицы для транскрипции, которая содержит 3 геномных области и ORF (Open Reading Frame) [11]. Ранняя (E) область занимает более 50% вирусного генома и кодирует 6 ORF: E1, E2, E4, E5, E6 и E7. Поздняя (L) область составляет почти 40% всего генома, транскрибируется после ранних генов и кодирует основные и второстепенные белки вирусного капсида L1 и L2, соответственно. Наконец, третья область вирусного генома представляет собой LCR (long control region, длинная контрольная область), сегмент с 850 парами оснований (10% генома). LCR не выполняет никакой функции в кодировании белков, но содержит первоисточник (ключ) репликации ДНК, а также последовательности, участвующие в транскрипционной регуляции [12]. ВПЧ может вызвать инфекцию только внутри активно делящихся базальных клеток плоского эпителия, потому что он полагается на клетки-хозяина для репликации генома. Базальный слой содержит резервные стволовые клетки, высокая репликационная активность которых обычно является мишенью для инфекции ВПЧ.
Жизненный цикл ВПЧ можно условно разделить на 3 фазы: установление, поддержание и продуктивная
ВПЧ
Рисунок 1. Изображение при электронной микроскопии ультраструктуры ВПЧ (Dr. Linda Stannard, Division of Medical Virology, UCT) и SARS-Cov-2 (National Institute of Infectious Diseases in the U. K.). На рисунке видно что, в отличие от SARS-Cov-2, ВПЧ не содержит оболочки, вместо нее имеются 72 пентомера, образованных из белка L1 (красная стрелка).
SARS-CoV-2
амплификация. Фаза установления включает транскрипцию и амплификацию генов вируса после проникновения в ядро. Вирусная ДНК изначально поддерживается в виде вне хромосомной эписомы, где экспрессия вирусных генов жестко регулируется с вирусными белками Е1 и Е2. E2 является ДНК-связывающим белком и играет важную роль в инициации репликации вирусной ДНК посредством связывания с первоисточником репликации (точка начала репликации, origin) на LCR. В конечном итоге каждая клетка хозяина будет содержать приблизительно 50–100 вирусных эписом, хотя в некоторых модельных системах клеточных культур обнаружено больше [13]. После начальной фазы установления начинается поддерживающая фаза, чтобы поддерживать постоянное количество вирусных геномов. Репликация вирусного генома происходит один раз за S-фазу клеточного цикла [14]. E2 имеет решающее значение для этой фазы, поскольку он связывает вирусный геном с хроматином клетки, поддерживая разделение вирусного генома на дочерние клетки во время митоза [15]. На второй фазе геномы ВПЧ могут сохраняться в базальных клетках от нескольких лет до десятилетий после первоначальной инфекции, что позволяет производить предраковые поражения с нарастающей клеточной дисплазией, которые либо устраняются, либо переходят в инвазивный рак. По данным разных авторов, менее 10% новых инфекций могут вызвать стойкое персистирование, дисплазию и рак. Это указывает на значительную роль иммунитета в очищении инфицированных клеток от вирусов [16].
Ранний промотор инициируется E6 и синтезирует транскрипты, которые транслируются на ранних этапах жизненного цикла вируса. Поскольку ранний промотор функционирует независимо от дифференцировки клетки, он может инициироваться до продуктивной фазы жизненного цикла вируса. Инфицированные клетки дифференцируются и продвигаются к поверхности эпителия. В какой-то момент ВПЧ переключаются со стабильного поддержания вирусного генома на продуктивную репликацию, которая происходит в дифференцирующихся эпителиальных клетках [11]. Обычно дифференцирующиеся клетки не могут поддерживать синтез вирусной ДНК, поскольку они больше не являются митотически активными, однако вирусные белки E6 и E7 активируют механизм репликации ДНК клетки-хозяина, обеспечивая непрерывный синтез вирусной ДНК. Поздний промотор запускается в зависимости от дифференцировки клетки и, таким образом, он активируется только в дифференцированных клетках (рис. 2). Поздний промотор сугубо служит для производства набора транскриптов, которые побуждают трансляцию белков L1 и L2 [17]. Транскрипция ДНК ВПЧ в основном контролируется белком E2 в дополнение к факторам транскрипции клеток хозяина, которые связываются со специфическими последовательностями LCR [18]. E2 является наиболее важным регулятором вирусной транскрипции при ранней экспрессии ВПЧ и оказывает сильное влияние на уровни белков E6 и E7 [19].
LCR, long control region — длинная контрольная область; Е2, сайт связывания с Е2; Е1, сайт связывания с Е1; SP1, specificity protein 1 — фактор транскрипции; ТАТА, сайт
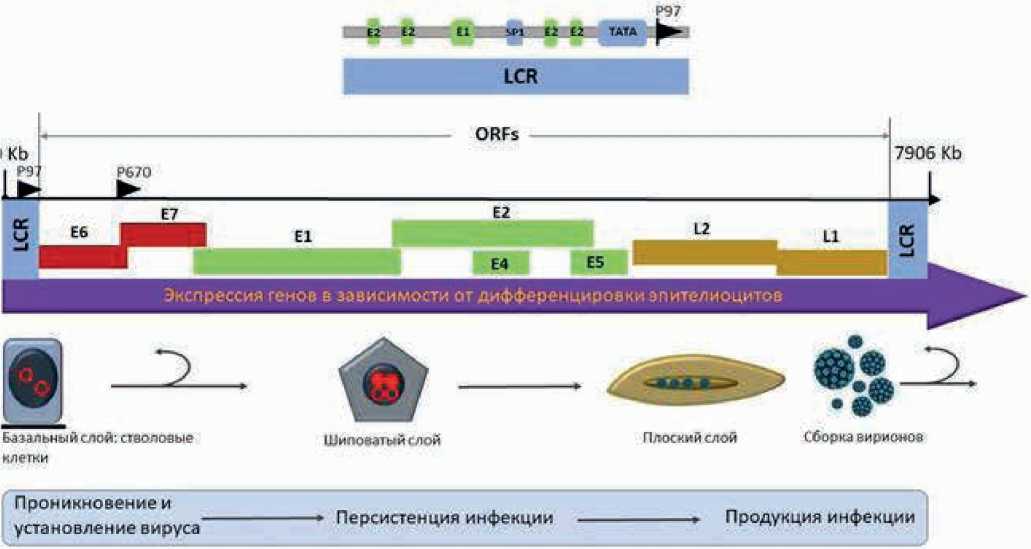
Рисунок 2. Транскрипция генов ВПЧ в зависимости от роста клеток плоского эпителия.
связывания фактора транскрипции; P97, ранний промотор; Р670, поздний промотор; ORFs, open reading frames — открытые рамки считывания.
Вирусные белки E5, E6 и E7 являются основными драйверами, ответственными за инициирование и прогрессирование рака за счет стимуляции пролиферации клеток, выживания клеток, ингибирование клеточного апоптоза и модуляции дифференцировки кератиноцитов [20]. E6 и E7 являются регуляторами развития клеточного цикла как в недифференцированных, так и в дифференцированных клетках эпителия и действуют как онкогенные белки при развитии рака. Белок E7 локализуются в ядре, где он связывается с белком ретинобластомы (Rb), и вызывает быструю протеосомную деградацию. Таким образом, E7 постоянно активирует ген E2F, что приводит к быстрому и постоянному переходу клетки в S-фазу [21]. Устойчивая потеря белка Rb приводит к стабилизации супрессора опухоли p53, который может привести к остановке клеточного цикла и апоптозу. Чтобы противодействовать этому, белки E6 высокого риска используют разные механизмы, чтобы препятствовать онкосупрессорной функции белка p53, одним из них является образование тример-ного комплекса E6-E6AP (E6-associated protein) — p53, который приводит к деградации p53 через убиквитин-зависимую протеолитическую систему. При этом p53 поддерживается на низком уровне, и инфицированные клетки могут избежать апоптоза и остановки клеточного цикла. Е6 и E7 модифицируют клеточную среду, чтобы вызвать амплификацию генома в дифференцированных клетках с задержкой роста за счет индукции неконтролируемой пролиферации, и это увеличивает зону инфицирования. Экспрессия онкогенных белков E6 и E7 вызывает нестабильность генома и ускоряет накопление мутаций, что приводит к развитию злокачественных новообразований [22]. Вирусный белок Е5 подавляет экспрессию молекулы главного комплекса гистосовместимости 1, повышает трансформирующие способности E6 и E7 и предотвращает дифференцировку кератиноцитов. Белок Е4 активируется на продуктивной стадии инфекции и имеет важную роль в синтезе поздних белков вирусного генома, способствующих высвобождению вирионов. После периода созревания геном ВПЧ может быть упакован в капсидные белки L1 и L2, вследствие чего происходит сборка и высвобождение вирионов из клеток внешнего слоя нелитическим образом. Однако белки E4 способствуют разрушению цито-кератиновых филаментов, после чего нарушается ядерная и цитоплазматическая целостность [11].
Интернализация вируса папилломы человека в клетку
Большая часть ВПЧ-положительных плоскоклеточных раков ротоглотки возникает на небной миндалине и основании языка, которые очень богаты лимфоидной тканью. Первоначальная инфекция ВПЧ происходит в результате микроповреждений эпителиальной ткани или через естественные фенестры крипт миндалин, что позволяет частицам ВПЧ проникать в клетку базального слоя. Клетки базального слоя состоят в основном из стволовых клеток и транзитно-амплифицирующих клеток. Именно эти стволовые клетки должны быть инфицированы для сохранения инфекционного поражения. Во время первичной инфекции капсиды ВПЧ преимущественно связываются с компонентами внеклеточного матрикса (ВКМ). ВКМ — это сеть секретируемых молекул, которые поддерживают клеточную адгезию, участвуют в межклеточной коммуникации, дифференциации и конструкции тканевой структуры [23]. ВКМ богат протеогликанами, особенно гепарансульфатными протеогликанами (ГСПГ), которые представляют собой гликопротеины, содержащие одну или несколько ковалентно связанных цепей гепарансульфата [24]. Капсид ВПЧ напрямую взаимодействует с этими молекулами на ВКМ поверхности клеток [25]. Это взаимодействие в значительной степени связано с белком L1, который участвует в последовательном включении сайтов связывания с гепарансульфатом и запускает специфические конформационные изменения в белках L1 и L2 [26]. Микродомены, обогащённые тетраспанином в плазматической мембране, могут служить платформой для входа ВПЧ, где локализуются многие другие предполагаемые рецепторы поглощения [27]. Происходящие события на ВКМ клеточной поверхности в основном опосредуются белком L1, и каким-то образом L2 остается неактивной конформацией, пока вирус находится во внеклеточном пространстве. Однако белок L2 абсолютно необходим для развития инфекции в внутриклеточном пространстве. Внутри клетки капсидный белок L2 связывается с вирусной ДНК, чтобы помочь доставить вирус в ядро хозяина. Белок L1 прикрепляется к ГСПГ на базальной мембране или поверхности базальных клетках, после чего вирус проникает в клетку посредством микро-пиноцитоза [28]. Рецепторы входа для ВПЧ до конца не изучены, но могут включать ряд белков, включая рецептор эпидермального фактора роста (EGFR), интегрины, мембранные микродомены обогащенные тетраспанином, ламинины и аннексин-А2 гетеротетрамер [29]. Длительная задержка процесса интернализации сопровождается изменением режима связывания и возможной передачи на вторичный рецептор. Наиболее вероятный механизм состоит в том, что конформационные изменения в L2, которые происходят на поверхности клетки, необходимы для открытия вторичного сайта связывания. Взаимодействие с ГСПГ считается начальным, неспецифическим контактом, который способствует конформационным изменениям капсида, позволяя перенос вириона на вторичный, высоко аффинный вирус-специфи-ческого рецептор проникновения [30].
Микропиноцитоз приводит к образованию небольших и гладких эндоцитозных пузырьков, содержащих частицы ВПЧ [31]. После эндоцитоза ВПЧ доставляются в эндосому или лизосому, где требуется среда с низким pH для удаления капсида ВПЧ. Было продемонстрировано, что циклофилины клетки-хозяина, вероятно, взаимодействует с сайтом связывания, расположенным на С-конце белка L2 в непосредственной близости от области, которая, опосредует гидрофобные взаимодействия с внутренней поверхностью капсомеров. Это взаимодействие облегчает диссоциацию большей части белок L1 из белка L2, который остается в комплексе с вирусной ДНК [32]. В то время как диссоциированный белок L1, по-видимому, нацелен на лизосомы для деградации, подмножество белка L1 на самом деле остается связанным как с L2, так и с вирусной ДНК [25]. Этот комплекс L1+L2+вирусная ДНК спасается от деградации за счет отвода из лизосомного компартмента ретромерным комплексом и передается в комплекс Гольджи [33]. Ретромер представляет собой цитозольный белковый комплекс, что способствует рециклированию трансмембранных рецепторов из эндосом в комплекс Гольджи. После проникновения через мембрану белок L2 остается связанным с вирусным геномом, который ориентирован на просветной стороне внутриклеточных мембран. Недавно было продемонстрировано, что деление клеток играет важную роль в проникновении ВПЧ, при котором разрыв ядерной оболочки во время митоза был предметом для ограничения шагов в доставке вирусного генома в ядро. Данные свидетельствуют о том, что вирусный геном проникает в ядро после разрушения мембраны во время профазы митоза [34]. ВПЧ перемещается по цитоплазме от эндосома к комплексу Гольджи и достигает ядра примерно через 24 часа после первоначального прикрепления вируса. Данные свидетельствуют о том, что во время митоза геном ВПЧ находится в просвете транспортных пузырьков, которые, вероятно, зарождаются из комплекса Гольджи, выстраиваются вдоль микротрубочек и передаются в конденсированные хромосомы [25].
ВПЧ разработали способы защиты своего генома от обнаружения в пределах цитозольных сенсоров до тех пор, пока вирусный геном не достигнет своего конечного пункта назначения. Цитозольные сенсоры являются составной частью врожденного иммунитета и включают следующие молекулы: AIM2 (отсутствующие в меланоме 2, absent in melanoma 2); интерферон-γ индуцируемый белок 16 (IFI16, interferon gamma inducible protein 16); циклическая гуанозинмонофосфат-аденозинмонофосфат синтаза (cGAS) и другие. Для того, чтобы ВПЧ уклонялся от врожденного иммунного распознавания клетки-хозяина, на протяжении всего митоза вирусная ДНК остается в просветном компоненте комплекса Гольджи или в транспортном пузырьке [25]. После начала митоза клетка подвергается серьезной структурной реорганизации. Фрагменты комплекса Гольджи и везикулы мигрируют по микротрубочкам, собираясь в каждой из двух центросом хромосомы. Это обеспечивает правильную сегрегацию этих компартментов для каждой новой дочерней клетки после того, как происходит деление [35]. После начала митоза вирусный геном отделяется от комплекса Гольджи, выстраивается вдоль астральных микротрубочек и располагается в непосредственной близости к центросомам. На более поздних стадиях митоза, таких как мета- и анафаза, вирусный геном ассоциируется с микротрубочками веретена и непосредственно внедряется в конденсированные хромосомы. Данные свидетельствуют о том, что в течение этого времени белок L2 все еще является трансмембранным, так как белок L1 и вирусный геном расположены на просветной стороне внутриклеточ-
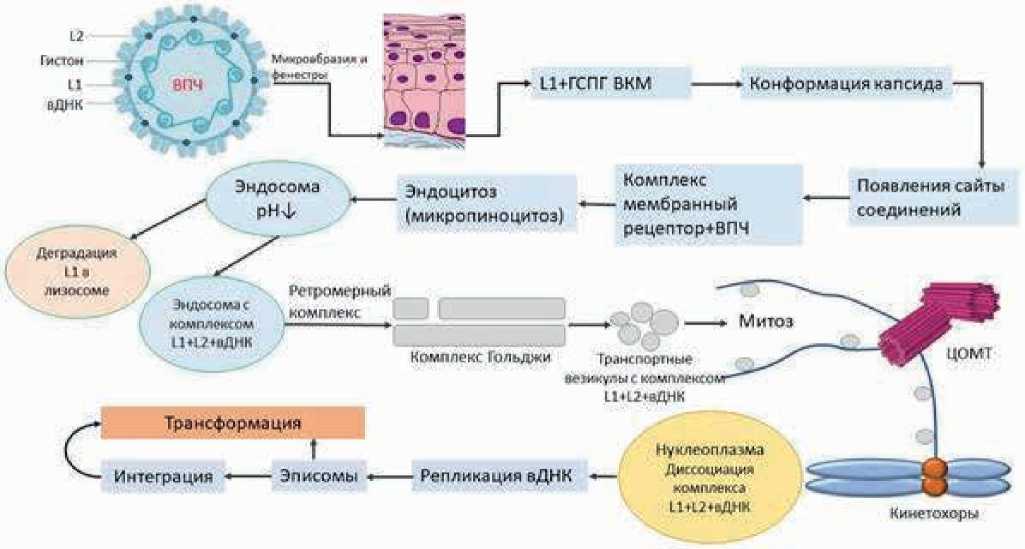
Рисунок 3. Интернализация ВПЧ в клетку хозяина. вДНК, вирусная дезоксирибонуклеиновая кислота; ГСПГ ВКМ, гепарансульфатные протеогликаны в внеклеточном матриксе; ЦОМТ, центр организации микротрубочек.
ных мембран [25]. В центросоме несущие ВПЧ везикулы могут захватываться митотическими кинезинами и перемещаться по микротрубочкам веретена к кинетохорам, в этот момент L2 может взаимодействовать с моторными белками микротрубочки. В процессе разборки и реформирования ядерной оболочки геном вируса позиционируется в нуклеоплазме (рис. 3).
Таким образом, геном ВПЧ, вероятно, сохраняется в комплексе Гольджи после снятия оболочки эндосомы, где он находится в ожидании, пока клетка хозяина снизит свои защитные силы после начала митоза. Структурная реорганизация во время деления клеток требует скоординированного перемещения пузырьков из различных компартментов вдоль микротрубочек и обогащения мито-тически ассоциированных белков. Между тем вероятно, что ВПЧ использует это событие, чтобы передвигаться по микротрубочкам для передачи на конденсированные хромосомы. Использование везикулярного транспорта для доставки вирусного генома непосредственно в ядро во время митоза, возможно, является одной из форм иммунного уклонения. При делении базальных клеток инфицированные дочерние клетки могут оставаться в базальном слое или могут стать транзитными амплифи-цирующими клетками, которые начинают перемещаться в супрабазальные эпителиальные слои [36]. Каждая новая инфицированная дочерняя клетка наполняется набором вирусных геномов, поскольку геномы делятся поровну во время митоза [37]. Инфицированные супрабазальные клетки остаются митотически активными из-за онкогенных свойств белков Е6 и E7. Из-за этого инфицированные клетки, которые уже дифференцировались, могут повторно войти в S-фазу и усилить экспрессию факторов клеточной репликации, которые необходимы для сопутствующей амплификации вирусного генома и экспрессии поздних генов.
Преодолев эти сложные препятствия, вирусная ДНК часто интегрируется с геномом клетки хозяина, по-види-мому, это происходит в основном случайным образом [38]. Интеграция является заглушенным процессом для вируса, но, к сожалению, может иметь серьезные последствия для хозяина. Механизм интеграции полностью не исследован, но была предложена модель петли: во время регулярной репликации конкатемеры ДНК вируса (сформированные благодаря скользящей репликации, rolling circle replication) в геноме хозяина образуют петлевые структуры. Эти петли провоцируют возникновения интеграции, после чего интегрированный ВПЧ напрямую способствует нестабильности генома, приводящей к развитию рака [39]. В некоторых исследованиях сообщается, что интеграция с генами или рядом с ними или другими горячими точками генома происходит чаще, чем ожидалось, и что это может привести к функциональным изменениям критических генов [40]. Считается, что помимо изменения экспрессии клеточных генов, интеграция также вносит вклад в онкогенез за счет увеличения уровней онкогенов ВПЧ в клетке с помощью различных механизмов, включая нарушение регуляторной функции вирусного белка E2 [41]. Однако устранение Е2 связанной негативной регуляции транскрипции усиливает конститутивную экспрессию белков E6 и E7, которые способствуют неуправляемой пролиферации клетки, приводящей к значительному повреждению ДНК [42]. Кроме того, интеграция в клеточных генах может привести к генерации слитых (гибридных) транскриптов вирус-хозяин, и эти транскрипты могут быть более стабильными и онкогенными, чем транскрипты ВПЧ, происходящие из эписомальной ДНК, что позволяет онкогенам ВПЧ существовать дольше [43].
Заключение
Данные показывают, что вирусы папилломы человека в процессе эволюции развили различные механизмы для преодоления защитной силы организма, чтобы дальше размножаться и выживать. Молекулярные изменения, которые происходят на этом пути, приводят к нарушению клеточного цикла, к неконтролируемому делению, что, в свою очередь, приводит к серьезным функциональным и структурным нарушениям в матрице ДНК. Потеря генов-супрессоров опухолей и кодируемых ими белков в результате делеций, мутаций, эпигенетического молчания и посттрансляционной модификации белков приводит к опухолевой трансформации. Своеобразная молекулярная характеристика вируса папилломы человека, побуждающего клетку к опухолевому фенотипу, может служить платформой для поиска конкретных маркеров.
Платформа современной онкологии, безусловно, способствует эффективной оценке токсичности, одновременно облегчая непрерывную оценку эффективности проводимой терапии, что приводит к более логичным схемам клинических испытаний, чем стандартные подходы. Это подчеркивает острую потребность в новых возможностях для контроля над инфекционно-опосредованными раками и постоянную необходимость комплексного молекулярного тестирования, которое продолжает улучшаться по мере того, как мы развиваем наше понимание этих сложных путей.
Список литературы Основные молекулярные механизмы канцерогенеза, индуцированного вирусом папилломы человека
- Hayflick L. The limited in vitro lifetime of human diploid cell strains. Exp Cell Res. 1965 Mar;37:614-36. doi: 10.1016/0014-4827(65)90211-9. PMID: 14315085.
- Оловников А.М. Принцип маргинотомии в темплатном синтезе полинуклеотидов. Доклады Академии наук СССР. 1971;201(6):1496-9. PMID: 5158754.
- R. Sanjuan, M. Pereira-Gomez, J. Risso, Chapter 3 - Genome Instability in DNA Viruses, Genome Stability, From Virus to Human Application, Academic Press, 2016, Pages 37-47, ISBN 9780128033098, https://doi.org/10.1016/B978-0-12-803309-8.00003-3.
- de Martel C, Georges D, Bray F, Ferlay J, Clifford GM. Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis. Lancet Glob Health. 2020 Feb;8(2):e180-e190. doi: 10.1016/S2214-109X(19)30488-7.
- Castellsagué X, Alemany L, Quer M, Halec G, Quirós B, Tous S, Clavero O, Alos L, Biegner T, Szafarowski T, Alejo M, Holzinger D, Cadena E, Claros E, Hall G, Laco J, Poljak M, Benevolo M, Kasamatsu E, Mehanna H, Ndiaye C, Guimerà N, Lloveras B, León X, Ruiz-Cabezas JC, Alvarado-Cabrero I, Kang CS, Oh JK, Garcia-Rojo M, Iljazovic E, Ajayi OF, Duarte F, Nessa A, Tinoco L, Duran-Padilla MA, Pirog EC, Viarheichyk H, Morales H, Costes V, Félix A, Germar MJ, Mena M, Ruacan A, Jain A, Mehrotra R, Goodman MT, Lombardi LE, Ferrera A, Malami S, Albanesi EI, Dabed P, Molina C, López-Revilla R, Mandys V, González ME, Velasco J, Bravo IG, Quint W, Pawlita M, Muñoz N, de Sanjosé S, Xavier Bosch F; ICO International HPV in Head and Neck Cancer Study Group. HPV Involvement in Head and Neck Cancers: Comprehensive Assessment of Biomarkers in 3680 Patients. J Natl Cancer Inst. 2016 Jan 28;108(6):djv403. doi: 10.1093/jnci/djv403. PMID: 26823521.
- International Human Papillomavirus (HPV) Reference Center [Internet]. Available from: https://www.hpvcenter.se/ human_reference_clones.
- DiGiuseppe S, Luszczek W, Keiffer TR, Bienkowska-Haba M, Guion LG, Sapp MJ. Incoming human papillomavirus type 16 genome resides in a vesicular compartment throughout mitosis. Proc Natl Acad Sci U S A. 2016; 113(22):6289-6294.
- Buck CB, Cheng N, Thompson CD, Lowy DR, Steven AC, Schiller JT, Trus BL. Arrangement of L2 within the papillomavirus capsid. J Virol. 2008; 82(11):5190-5197. [PubMed: 18367526].
- Wolf M, Garcea RL, Grigorieff N, Harrison SC. Subunit interactions in bovine papillomavirus. Proc Natl Acad Sci USA. 2010; 107(14):6298-6303. [PubMed: 20308582].
- Richards RM, Lowy DR, Schiller JT, Day PM. Cleavage of the papillomavirus minor capsid protein, L2, at a furin consensus site is necessary for infection. Proc. Natl. Acad. Sci. U S A. 2006; 103(5): 1522-1527. [PubMed: 16432208].
- Harden ME, Munger K. Human papillomavirus molecular biology. Mutat Res Rev Mutat Res. 2017 Apr-Jun;772:3-12. doi: 10.1016/j.mrrev.2016.07.002. Epub 2016 Jul 5. PMID: 28528688; PMCID: PMC5500221.
- Cosper PF, Bradley S, Luo L, Kimple RJ. Biology of HPV Mediated Carcinogenesis and Tumor Progression. Semin Radiat Oncol. 2021 Oct;31(4):265-273. doi: 10.1016/j.semradonc.2021.02.006. PMID: 34455982; PMCID: PMC8409095.
- Maglennon GA, McIntosh P, Doorbar J: Persistence of viral DNA in the epithelial basal layer suggests a model for papillomavirus latency following immune regression. Virology 414:153-163, 2011. Jun 5.
- Reinson T, Henno L, Toots M, Ustav M Jr, Ustav M. The Cell Cycle Timing of Human Papillomavirus DNA Replication. PLoS One. 2015 Jul 1;10(7):e0131675. doi: 10.1371/journal.pone.0131675. PMID: 26132923; PMCID: PMC4489393.
- Sekhar V, Reed SC, McBride AA: Interaction of the Betapapillomavirus E2 tethering protein with mitotic chromosomes. JVI 84:543-557, 2010. Jan 1.
- Schiffman M, Doorbar J, Wentzensen N, de Sanjosé S, Fakhry C, Monk BJ, Stanley MA, Franceschi S. Carcinogenic human papillomavirus infection. Nat Rev Dis Primers. 2016 Dec 1;2:16086. doi: 10.1038/nrdp.2016.86. PMID: 27905473.
- Conway MJ, Meyers C. Replication and assembly of human papillomaviruses. J Dent Res. 2009;88(4):307-317. doi:10.1177/0022034509333446.
- García-Vallvé S, Iglesias-Rozas JR, Alonso A, Bravo IG. Different papillomaviruses have different repertoires of transcription factor binding sites: convergence and divergence in the upstream regulatory region. BMC Evol Biol. 2006; 6:20, http://dx.doi.org/10.1186/1471-2148-6-20.
- Ribeiro, A. L., Caodaglio, A. S., & Sichero, L. (2018). Regulation of HPV transcription. Clinics (Sao Paulo, Brazil), 73(suppl 1), e486s. https://doi.org/10.6061/clinics/2018/e486s.
- Vande Pol SB, Klingelhutz AJ. Papillomavirus E6 oncoproteins. Virology. 2013;445(1-2):115-137. doi:10.1016/j.vi-rol.2013.04.026.
- Kono T, Laimins L. Genomic Instability and DNA Damage Repair Pathways Induced by Human Papillomaviruses. Viruses. 2021 Sep 14;13(9):1821. doi: 10.3390/v13091821. PMID: 34578402; PMCID: PMC8472259.
- Gupta S, Kumar P, Das BC. HPV: Molecular pathways and targets. Curr Probl Cancer. 2018 Mar-Apr;42(2):161-174. doi: 10.1016/j.currproblcancer.2018.03.003. Epub 2018 Apr 5. PMID: 29706467.
- Mouw JK, Ou G, Weaver VM. Extracellular matrix assembly: a multiscale deconstruction. Nat Rev Mol Cell Biol. 2014 Dec;15CL2):771-85. doi: 10.1038/nrm3902. Epub 2014 Nov 5. PMID: 25370693; PMCID: PMC4682873.
- Esko JD, Lindahl U. Molecular diversity of heparan sulfate. J Clin Invest. 2001 Jul;108(2):169-73. doi: 10.1172/JCI13530. PMID: 11457867; PMCID: PMC203033.
- DiGiuseppe S., Bienkowska-Haba M., Guion L.G., Sapp M. Cruising the cellular highways: how human papillomavirus travels from the surface to the nucleus. Virus Res. 2017 March 02; 231: 1-9. doi:10.1016/j.virusres.2016.10.015.
- Richards KF, Bienkowska-Haba M, Dasgupta J, Chen XS, Sapp M. Multiple heparan sulfate binding site engagements are required for the infectious entry of human papillomavirus type 16. J Virol. 2013 Nov;87(21):11426-37. doi: 10.1128/ JVI.01721-13. Epub 2013 Aug 21. PMID: 23966387; PMCID: PMC3807331.
- Scheffer KD, Berditchevski F, Florin L. The tetraspanin CD151 in papillomavirus infection. Viruses. 2014 Feb 18;6(2):893-908. doi: 10.3390/v6020893. PMID: 24553111; PMCID: PMC3939487.
- Sapp M, Bienkowska-Haba M. Viral entry mechanisms: human papillomavirus and a long journey from extracellular matrix to the nucleus. FEBS J. 2009 Dec;276(24):7206-16. doi: 10.1111/j.1742-4658.2009.07400.x. PMID: 19878308; PMCID: PMC2795018.
- Raff AB, Woodham AW, Raff LM, Skeate JG, Yan L, Da Silva DM, Schelhaas M, Kast WM. The evolving field of human papillomavirus receptor research: a review of binding and entry. J Virol. 2013 Jun;87(11):6062-72. doi: 10.1128/ JVI.00330-13. Epub 2013 Mar 27. PMID: 23536685; PMCID: PMC3648114.
- Ozbun MA. Extracellular events impacting human papillomavirus infections: Epithelial wounding to cell signaling involved in virus entry. Papillomavirus Res. 2019 Jun;7:188-192. doi: 10.1016/j.pvr.2019.04.009. Epub 2019 Apr 11. PMID: 30981651; PMCID: PMC6514438.
- Spoden G, Kühling L, Cordes N, Frenzel B, Sapp M, Boller K, Florin L, Schelhaas M. Human papillomavirus types 16, 18, and 31 share similar endocytic requirements for entry. J Virol. 2013 Jul;87(13):7765-73. doi: 10.1128/JVI.00370-13. Epub 2013 Apr 24. PMID: 23616662; PMCID: PMC3700296.
- Bienkowska-Haba M, Williams C, Kim SM, Garcea RL, Sapp M. Cyclophilins facilitate dissociation of the human papillomavirus type 16 capsid protein L1 from the L2/DNA complex following virus entry. J Virol. 2012 Sep;86(18):9875-87. doi: 10.1128/JVI.00980-12. Epub 2012 Jul 3. PMID: 22761365; PMCID: PMC3446629.
- Day PM, Thompson CD, Schowalter RM, Lowy DR, Schiller JT. Identification of a role for the trans-Golgi network in human papillomavirus 16 pseudovirus infection. J Virol. 2013 Apr;87(7):3862-70. doi: 10.1128/JVI.03222-12. Epub 2013 Jan 23. PMID: 23345514; PMCID: PMC3624235.
- Aydin I, Weber S, Snijder B, Samperio Ventayol P, Kuhbacher A, Becker M, Day PM, Schiller JT, Kann M, Pelkmans L, Helenius A, Schelhaas M. Large scale RNAi reveals the requirement of nuclear envelope breakdown for nuclear import of human papillomaviruses. PLoS Pathog. 2014; 10(5):e1004162.
- Jongsma ML, Berlin I, Neefjes J. On the move: organelle dynamics during mitosis. Trends Cell Biol. 2015 Mar;25(3):112-24. doi: 10.1016/j.tcb.2014.10.005. Epub 2014 Nov 18. PMID: 25466831.
- Graham SV, Faizo AAA. Control of human papillomavirus gene expression by alternative splicing. Virus Res. 2017 Mar 2;231:83-95. doi: 10.1016/j.virusres.2016.11.016. Epub 2016 Nov 17. PMID: 27867028; PMCID: PMC5335905.
- Sano D, Oridate N. The molecular mechanism of human papillomavirus-induced carcinogenesis in head and neck squamous cell carcinoma. Int J Clin Oncol. 2016 Oct;21(5):819-826. doi: 10.1007/s10147-016-1005-x. Epub 2016 Jun 23. PMID: 27339270.
- Wentzensen N, Vinokurova S, von Knebel Doeberitz M. Systematic review of genomic integration sites of human papillomavirus genomes in epithelial dysplasia and invasive cancer of the female lower genital tract. Cancer Res. 2004 Jun 1;64(11):3878-84. doi: 10.1158/0008-5472.CAN-04-0009. PMID: 15172997.
- Akagi K, Li J, Broutian TR, Padilla-Nash H, Xiao W, Jiang B, Rocco JW, Teknos TN, Kumar B, Wangsa D, He D, Ried T, Symer DE, Gillison ML. Genome-wide analysis of HPV integration in human cancers reveals recurrent, focal genomic instability. Genome Res. 2014 Feb;24(2):185-99. doi: 10.1101/gr.164806.113. Epub 2013 Nov 7. PMID: 24201445; PMCID: PMC3912410.
- Hu Z, Zhu D, Wang W, Li W, Jia W, Zeng X, Ding W, Yu L, Wang X, Wang L, Shen H, Zhang C, Liu H, Liu X, Zhao Y, Fang X, Li S, Chen W, Tang T, Fu A, Wang Z, Chen G, Gao Q, Li S, Xi L, Wang C, Liao S, Ma X, Wu P, Li K, Wang S, Zhou J, Wang J, Xu X, Wang H, Ma D. Genome-wide profiling of HPV integration in cervical cancer identifies clustered genomic hot spots and a potential microhomology-mediated integration mechanism. Nat Genet. 2015 Feb;47(2):158-63. doi: 10.1038/ng.3178. Epub 2015 Jan 12. PMID: 25581428.
- McBride AA, Warburton A. The role of integration in oncogenic progression of HPV-associated cancers. PLoS Pathog. 2017 Apr 6;13(4):e1006211. doi: 10.1371/journal.ppat.1006211. PMID: 28384274; PMCID: PMC5383336.
- Стукань А.И., Чухрай О.Ю., Порханов В.А., Мурашко Р.А., Бодня B.H., Макарова Ю.М. Орофарингеальная карцинома, ассоциированная с вирусом папилломы человека: тенденции эпидемиологии и методы выявления вируса в опухоли. Опухоли головы и шеи. 2018;8(3):77-83. https://doi.org/10.17650/2222-1468-2018-8-3-77-83.
- Walline HM, Goudsmit CM, McHugh JB, Tang AL, Owen JH, Teh BT, McKean E, Glover TW, Graham MP, Prince ME, Chepeha DB, Chinn SB, Ferris RL, Gollin SM, Hoffmann TK, Bier H, Brakenhoff R, Bradford CR, Carey TE; University of Michigan Head and Neck Specialized Program of Research Excellence (SPORE) Program. Integration of high-risk human papillomavirus into cellular cancer-related genes in head and neck cancer cell lines. Head Neck. 2017 May;39(5):840-852. doi: 10.1002/hed.24729. Epub 2017 Feb 25. PMID: 28236344; PMCID: PMC5392184.


