Основные параметры антиоксидантной системы крови у кроликов в половозрастной динамике
Автор: Аджиев Д.Д., Мальцев Г.Ю., Румянцев С.А., Маляренко Е.Н., Заторская Н.Ф.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Функциональные системы и гомеостаз в онтогенезе
Статья в выпуске: 2 т.50, 2015 года.
Бесплатный доступ
Антиоксидантная система (АОС) - важнейшее звено общей биологической защиты организма. При оценке ее состояния важен выбор адекватных, стабильных и чувствительных показателей для определения содержания продуктов перекисного окисления липидов (ПОЛ) и комплекса ферментов антиокислительной защиты. Антиоксидантный индекс (АОИ) основан на выявлении продуктов ПОЛ (малонового диальдегида, диеновых конъюгатов полиненасыщенных жирных кислот) в крови и эритроцитах и учете активности антиокислительных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы и глутатионредуктазы) в мембранах эритроцитов. Целью настоящей работы была оценка роли АОС крови в механизме окислительного гомеостаза у кроликов породы советская шиншилла разного пола в различные периоды онтогенеза. Исследования проводили на 10 особях в условиях биоклиники. Кровь отбирали у животных в возрасте 60, 120 и 180 сут. В плазме крови определяли содержание диеновых конъюгатов и малонового диальдегида, а также низкомолекулярных антиоксидантов α-токоферола и ретинола. В гемолизатах оценивали активность антиокислительных ферментов - глутатионредуктазы, глутатионпероксидазы, каталазы, супероксиддисмутазы. Впервые для биологической оценки антиоксидантной системы организма был использован общий АОИ как адекватный и чувствительный показатель, который представляет собой разницу между среднесуммарным накоплением основных ферментов АОС-системы и продуктов ПОЛ. В возрасте 180 сут увеличение количества холестерола, триглицеридов и глюкозы у самцов составило 11,6 %, 27,2 % (Р ≤ 0,001) и 12,9 % (Р ≤ 0,01); у самок - 14,7 %, 27,4 % (Р ≤ 0,001) и 13,0 % (Р ≤ 0,05). Содержание α-токоферола у 120- и 180-суточных самцов увеличивалось соответственно на 14,4 и 21,9 %, ретинола - на 8,3 и на 29,2 % по отношению к начальным (60 сут) значениям. У самок в этом же возрасте отмечали достоверное увеличение концентрации α-токоферола на 14,9 и 18,9 %, ретинола - на 13,6 и 50,0 %. Выявлены фазовые изменения общего и парциальных индексов АОИ в онтогенезе, характеризующие снижение компенсаторного потенциала системы антиоксидантной защиты крови. Так, общий индекс АОИ у 4-месячных самцов и самок увеличивался соответственно на 12-20 % и 4-12 %. Положительное значение индекса указывало на относительно компенсированное состояние антиокислительной защиты даже на фоне тенденции к снижению активности ферментативной защиты. У 6-месячных животных АОИ имел отрицательные значения, что характерно для состояния окислительного стресса. У самцов эти изменения были более значительными и достоверными. Предположительно изменения в активности ферментативной и неферментативной антиоксидантной системы и увеличение содержания продуктов ПОЛ обусловлены усиливающимися процессами свободнорадикального окисления, непосредственно связанными с ростом и развитием животного. Различия между самцами и самками отмечались по ряду биохимических показателей, но в целом в онтогенезе они заметно не варьируются. Определение и использование общего индекса АОИ, предложенное нами, может быть важным и информативным подходом в оценке состояния защитных систем у животных.
Кролики, онтогенез систем защиты, антиоксидантная система крови, аос, антиоксидантный индекс, аои
Короткий адрес: https://sciup.org/142133581
IDR: 142133581 | УДК: 636.92:591.11:616-092.19 | DOI: 10.15389/agrobiology.2015.2.208rus
Текст научной статьи Основные параметры антиоксидантной системы крови у кроликов в половозрастной динамике
Система антирадикальной защиты служит важнейшим звеном общей биологической защиты организма на атомарном и молекулярном уровне и обычно рассматривается как баланс между суммарным накоплением продуктов свободнорадикального окисления и общей активностью ферментативных и неферментативных систем антиокислительной защиты. При оценке состояния антиоксидантной системы (АОС) важен выбор адекватных, стабильных и чувствительных показателей для определения содержания продуктов перекисного окисления липидов (ПОЛ), инициированных радикалами, и комплекса ферментов антиокислительной защиты. Появляется также необходимость в использовании интегрирующих индексов, учитывающих отклонения параметров АОС от кон- трольных значений (1, 2).
Предложенный ранее (3) антиоксидантный индекс (АОИ) основан на определении в крови и эритроцитах продуктов ПОЛ (малонового диальдегида, диеновых конъюгатов полиненасыщенных жирных кислот) и оценке активности в мембранах эритроцитов структурно единых анти-окислительных ферментов (супероксиддисмутазы, каталазы, глутатионпероксидазы и глутатионредуктазы). Общий АОИ — это разность между парциальными индексами АОИ1 и АОИ2. АОИ1 представляет среднесуммарное отклонение от нормальных значений по активности ферментов, АОИ2 — по содержанию продуктов ПОЛ. Использование индекса АОИ выявило наличие сопоставимых по амплитуде отклонений у обоих парциальных индексов, что позволило использовать их в клинической практике (1, 2 ).
Дальнейшие исследования АОС связаны с общебиологической оценкой баланса между системами ферментативно-неферментативной защиты и системой накопления продуктов свободнорадикального окисления. При значениях АОИ ниже контрольных можно с уверенностью диагностировать окислительный стресс (4, 5 ) . Однако состояние компенсации, связанное со среднесуммарными отклонениями выше контрольных (АОИ1 более 100 %), вызывает больше вопросов.
Необходимо отметить, что если в клинических исследованиях используется норма, полученная на группе здоровых добровольцев в широком диапазоне возраста и пола, то в экспериментах на животных приходится оперировать величинами, установленными в контрольной группе. При этом в значительной степени игнорируются онтогенетические особенности развития АОС, учет которых важен, например, при выборе адекватных экспериментальных моделей (в частности, для испытания биологических препаратов с антиоксидантными свойствами) или в связи с проблемой повышения чувствительности интегральных показателей.
Целью настоящей работы было развернутое исследование антиоксидантной системы у кроликов обоего пола в различные периоды онтогенеза.
Методика . Исследования проводили на 10 кроликах породы советская шиншилла, находившихся в условиях биоклиники. Крольчат со средней живой массой 1,5 кг отбирали в 60-суточном возрасте. По принципу аналогов сформировали две группы (самцы и самки) по 5 гол. в каждой. В группе самок не было беременных и лактирующих. Подопытные животные находились в одинаковых условиях содержания в стандартных клетках и были клинически здоровы. Контрольными считали показатели у животных обоего пола в возрасте 60 сут. Основной рацион во всех группах соответствовал нормам кормления, разработанным НИИ пушного звероводства и кролиководства им. В.А. Афанасьева (6, 7). Животные получали гранулированный комбикорм К-122 (Россия). Общая питательность рационов в группах была одинаковой.
Состояние здоровья кроликов оценивали по клиническим показателям — ректальной температуре, частоте сердечных сокращений (ЧСС), частоте дыхания (ЧД), внешнему виду, а также по поведению (общая активность, пищевое поведение, дефекация и состояние кала, груминг, социальное взаимодействие, наличие стереотипий).
Кровь отбирали у животных в возрасте 60, 120 и 180 сут в стерильные пробирки методом пункции нижней краевой ушной вены.
Образцы гепаринизированной крови центрифугировали на стандартной лабораторной центрифуге Liston C 2204 Classic (ООО «Листон», Россия) при 3000 об/мин в течение 15 мин. Плазму тщательно отделяли от осадка эритроцитов. Гемолизаты готовили разведением эритроцитарной смеси дистиллированной водой (1:1 по объему), после чего замораживали при температуре от -10 до -15 °C.
Содержание диеновых конъюгатов в плазме (ДКпл . ) определяли с помощью метода, разработанного Z. Placer (8) в модификации В.Б. Гаврилова и М.И. Мишкорудной (9), концентрацию малонового диальдегида в плазме (МДАпл . ) — по M. Mihara с соавт. (10). В гемолизатах оценивали активность следующих антиокислительных ферментов: глутатионредуктазы (ГР) — на основе метода J. Tilbotson и H. Sauberlich (11) в адаптации для анализатора Labsystems FP-901 («Labsystems Diagnostics Oy», Финляндия) (12), глутатионпероксидазы (ГП) — согласно G. Mille (13) в модификации для анализатора FP-901 (14), каталазы (КАТ) — по N. Oshino с соавт. (15) в модификации Г.Ю. Мальцева и А.В. Васильева (16), супероксид-дисмутазы (СОД) — в соответствии с описанием M. Nishikimi с соавт. (17). Концентрацию ретинола и а -токоферола в плазме крови определяли методом высокоэффективной жидкостной хроматографии с использованием концентрирующих патронов. Биохимические исследования плазмы крови проводили на автоматическом анализаторе открытого типа Labio 200 («Mindray Medical International Ltd.», Китай) с фотометрическим детектированием (программное обеспечение Master Labio 200). Использовались реагенты компании «BIOCON Diagnostik GmbH» (Германия).
Антиоксидантный статус оценивали по антиоксидантному индексу (АОИ), который рассчитывали по формуле:
АОИ = АОИ1 - АОИ2 = [(ГП/ГП КоЮр. + ГР/ГР КоНтр. + СОД/СОД коНтр. + + КАТ/КАТ контр. )/4)] - [(ДК пЛ. /ДК пЛ. контр. + МДА пЛ. /МДА пЛ. контр. )/2], где АОИ — антиоксидантный инденкс; АОИ1 — суммарное значение для основных ферментов АОС-системы; АОП2 — суммарное значение для продуктов ПОЛ; ГП, ГР, СОД, КАТ, ДК ц Л . и МДАпл . — активность соответственно глутатионпероксидазы, глутатионредуктазы, супероксиддисму-тазы, каталазы и концентрация малонового диальдегида в плазме крови (в опыте и контроле). Индекс АОИ может быть выражен как в процентах, так и в долях. В первом случае контрольным значением считается 100 %, во втором — 0.
Полученные данные обрабатывали методами стандартной параметрической статистики с использованием t -критерия Стьюдента.
Результаты . Период, в течение которого мы проводили наблюдения, был оптимален как для лабораторных исследований (60-180 сут), так и для производственной практики (120-180 сут).
Состояние антиоксидантной системы у кроликов оценивали по активности ферментов антиокислительной защиты эритроцитов и содержанию продуктов ПОЛ. По процентному отклонению этих показателей от контроля у животных в возрасте 120 и 180 сут достоверных изменений практически не отмечалось (табл. 1). Наблюдалось некоторое неравномерное снижение значений всех показателей.
Расчетные интегрированные индексы (табл. 2) давали более полную информацию о состоянии АОС в онтогенезе. Так, у 4-месячных самцов отмечалось достоверное снижение индекса АОИ2 (примерно на 21-23 %), в то время как у самок различия оказались менее выражены (11-12 %). Это снижение приводило к относительному увеличению общего индекса АОИ: на 12-20 % — у самцов, на 4-12 % — у самок (в среднем соответственно + 15,8 и +8,2 %). Положительное значение АОИ указывало на относительно компенсированное состояние антиокислительной защиты даже на фоне тенденции к снижению активности ферментативной защиты.
-
1. Активность ферментов антиокислительной защиты эритроцитов и содержание продуктов перекисного окисления липидов в плазме крови у кроликов породы советская шиншилла разного пола и возраста ( M ± m , лабораторный опыт)
-
2. Индексы, характеризующие антиоксидантный статус у кроликов породы советская шиншилла разного пола и возраста ( M ± m , лабораторный опыт)
|
Группа |
ГП, мкмоль/(мин • мл) |
СОД, усл. ед/мл |
ГР, мкмоль/(мин • мл) |
КАТ, тыс. ед/мл |
ДК пл. , нмоль/мл |
МДА пл. , нмоль/мл |
|
Самцы (контроль, n = 5) |
20,2±0,7 |
В о з р 1243,0±59,0 |
а с т 60 сут 2,2±0,2 |
346,0±11,0 |
1,6±0,1 |
1,1±0,3 |
|
Самки (контроль, n = 5) |
18,8±1,9 |
1227,0±23,0 |
2,3±0,1 |
354,0±16,0 |
2,0±0,2 |
1,4±0,1 |
|
Самцы |
17,6±1,2 |
В о з р 1198±42 |
а с т 120 сут 2,2±0,1 |
333,0±22,0 |
1,3±0,1 |
0,8±0,1 |
|
Отклонение от контроля, % |
87,1±0,3 |
96,4±2,1 |
97,8±0,2 |
96,2±0,4 |
83,0±0,2 |
73,7±0,3 |
|
Самки |
18,1±2,2 |
1209,0±67,0 |
2,3±0,1 |
334,0±19,0 |
1,8±0,1 |
1,2±0,1 |
|
Отклонение от контроля, % |
96,3±0,7 |
98,5±2,0 |
97,9±0,1 |
94,4±1,3 |
88,2±0,2 |
88,9±0,1 |
|
Самцы |
17,6±1,4 |
В о з р 1156,0±69,0 |
а с т 180 сут 2,1±0,2 |
310,0±8,0 |
1,6±0,3 |
1,0±0,1 |
|
Отклонение от контроля, % |
87,1±0,4 |
93,0±2,6 |
91,2±0,2 |
89,6±0,8 |
98,7±0,2 |
86,8±0,3 |
|
Самки |
17,1±1,3 |
1116,0±5,0 |
2,1±0,1 |
330,0±12,0 |
1,9±0,2 |
1,3±0,1 |
|
Отклонение от контроля, % |
90,9±0,5 |
90,9±1,7 |
90,1±0,0 |
93,2±1,1 |
93,1±0,3 |
93,4±0,1 |
П р и м е ч а н и е. ГП — глутатионпероксидаза, ГР — глутатионредуктаза, СОД — супероксиддисмутаза,
КАТ — каталаза, ДК пл. — диеновые конъюгаты, МДА пл. — малоновый диальдегид.
|
Группа |
АОИ1, % |
| АОИ2, % | |
АОИ = (АОИ1 - АОИ2), % |
|
Самцы (контроль, n = 5) |
100 |
Возраст 60 сут 100 |
0 |
|
Самки (контроль, n = 5) |
100 |
100 |
0 |
|
Самцы |
94,2±2,1 |
Возраст 120 сут 78,4±0,1 * |
+ 15,8±2,1 |
|
Самки |
96,8±2,5 |
88,6±0,2 * |
+8,2±2,5 |
|
Самцы |
90,2±2,8 |
Возраст 180 сут 96,5±0,4 |
- 6,3±2,8 ** |
|
Самки |
91,2±2,1 |
93,3±0,2 |
- 2,1±2,1 |
|
Примечание. АОИ1 - |
- суммарное |
значение для основных |
ферментов антиоксидантной системы, |
АОИ2 — суммарное значение для продуктов перекисного окисления липидов, АОИ — интегрированный антиоксидантный индекс.
* Различия по отношению к контролю достоверны при Р < 0,05.
** Различия между АОИ1 и АОИ2 достоверны при Р < 0,05.
У 6-месячных животных восстановление индекса АОИ2 не компенсировалось индексом АОИ1, в результате чего общий индекс АОИ становился отрицательным ( - 6,3 % у самцов и - 2,1 % у самок), что характерно для состояния окислительного стресса. У самцов изменения парциальных индексов были более значительными (до 11 % по доверительному интервалу) и достоверными.
Выявленные закономерности практически в равной мере относились ко всем изученным показателям, то есть информативная ценность индекса АОИ возрастала с увеличением числа измеряемых однотипных параметров. Использование дополнительных критериев, помимо традиционного содержания МДА, активности СОД и некоторых других (18, 19), в значительной степени повышает информативность результатов исследований. При этом важность приобретают способы группировки показателей. Из полученных данных видно, что применение общего индекса (АОИ) позволяет достоверно оценить невысокие отклонения в антиоксидантном статусе в онтогенезе.
Таким образом, установлено, что в фазу полового созревания кро- ликов повышаются компенсационные возможности антиоксидантной системы, в то время как в более позднем возрасте появляется тенденция к усилению окислительного стресса (это подтвердили и представленные ниже результаты определения количества ретинола и а-токоферола в крови). Выявление тонких изменений антиоксидантного статуса — важная задача (20-22) как при оценке условий разведения (на животноводческих предприятиях, фермах и т.д.), так и в экспериментах с животными (в частности, с кроликами) как с биологическими моделями.
Адаптационные возможности кроликов в конвенциональных условиях содержания в биоклинике реализуются через энергетический обмен как одну из основных метаболических функций. Однако пребывание животных в клетках приводит к вынужденной гиподинамии вследствие ограничения двигательной активности. Снижение локомоций, в свою очередь, отражается на опорно-двигательной, дыхательной и других функциях ор- ганизма, что приводит к уменьшению энергетических затрат.
Наблюдаемые изменения в характере липидного и энергетического обмена (сдвиги в соотношении процессов синтеза и распада) можно, в частности, проследить по содержанию холестерола, триглицеридов и глюкозы в плазме крови (рис.).
Общее содержание холестерола и триглицеридов у кроликов с возрастом увеличивалось. Так, в конце эксперимента количество холестерола у самцов и самок повышалось соответственно на 11,6 и 14,7 % по сравнению с контролем, триглицеридов (основного источника энергии для клеток) — на 27,2 и 27,4 % (Р < 0,001). В возрасте 120 сут разница в показателях между самцами и самками достоверно составила 16,4 % (при Р < 0,05)
при общем преимуществе в содержании обоих самцов на всех этапах исследований.
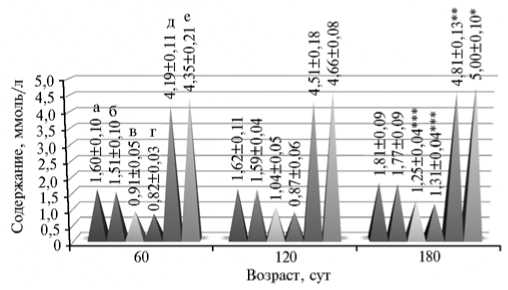
Содержание холестерола (а, б) , триглицеридов (в, г) и глюкозы (д, е) в плазме крови у кроликов породы советская шиншилла разного пола и возраста: а, в, д — самцы; б, г, е — самки (лабораторный опыт).
изучаемых субстратов у
Концентрация глюкозы также повышалась с возрастом. Так, на 180-е сут ее содержание у самцов увеличилось на 12,9 % (Р < 0,01), у самок — на 13,0 % (при Р < 0,05) по отно- шению к
началу опыта
(см. рис.). Этот показатель отражает состояние аэробного энергетического метаболизма. У самок кроликов концентрация глюкозы в плазме крови оказалась не- сколько выше, чем у самцов во все изучаемые периоды роста.
В целом липидный и энергетический обмен у самцов и самок в онтогенезе был идентичен.
Известно, что неферментативные системы антиоксидантной защиты организма также способствуют быстрой инактивации свободных радикалов кислорода (5, 23).
В зависимости от возраста общий сдвиг метаболизма у кроликов сопровождался изменениями не только в активности антиоксидантных ферментов, но и в концентрации в плазме крови низкомолекулярных ан- тиоксидантов а-токоферола и ретинола. Витамины с антиоксидантными свойствами а-токоферол (витамин Е) и ретинол (витамин А) относятся к числу важнейших неферментативных антиоксидантов, реализующих свое действие в мембранной и липопротеиновой фазах.
3. Содержание витаминов Е ( а -токоферол) и А (ретинол) в плазме крови у кроликов породы советская шиншилла разного пола и возраста ( M ± m , лабораторный опыт)
|
Показатель |
Возраст, сут |
Группа |
|
|
самцы |
самки |
||
|
а -Токоферол, мкг/мл |
60 |
1,46±0,08 |
1,48±0,18 |
|
120 |
1,67±0,26 |
1,70±0,13 |
|
|
180 |
1,78±0,12* |
1,76±0,09 |
|
|
Ретинол, мкг/мл |
60 |
0,24±0,03 |
0,22±0,04 |
|
120 |
0,26±0,03 |
0,25±0,02 |
|
|
180 |
0,31±0,05 |
0,33±0,04 |
|
* Различия по отношению к контролю (60 сут) достоверны при Р < 0,05.
В возрасте 120 и 180 сут у самцов содержание а -токоферола увеличивалось соответственно на 14,4 и 21,9 %, ретинола — на 8,3 и 29,2 % по отношению к начальным (60 сут) значениям. Аналогичная возрастная динамика была характерна и для самок: достоверное увеличение концентрации а -токоферола на 14,9 и 18,9 %, ретинола — на 13,6 и 50,0 % соответственно в возрасте 120 и 180 сут (табл. 3).
Кролики — самые скороспелые из всех сельскохозяйственных животных. Самки таких крупных пород, как советская шиншилла, достигают половой зрелости и могут быть оплодотворены в возрасте 4 мес. Примерно в те же сроки наступает половая зрелость самцов. Рост и развитие кроликов продолжаются до 8-10 мес. Полученные нами результаты позволили выявить важные особенности в онтогенетической организации системы антиокислительной защиты у кроликов разного пола. Основной из них было усиление компенсационных механизмов с участием эритроцитарных ферментов в период полового созревания, которое сменялось декомпенсацией и появлением признаков окислительного стресса в более позднем возрасте.
Ферментативное звено антиоксидантной защиты представляет собой цепь последовательных реакций по нейтрализации кислородных радикалов (супероксид-анион-радикал, синглетный кислород, перекись водорода, гидроксил-радикал и др.) и продуктов их взаимодействия с органическими соединениями, прежде всего ненасыщенными жирными кислотами, образующими в результате гидроперекиси жирных кислот. Основное свойство ферментативных антиоксидантных систем заключается в обеспечении долговременной защиты органов и тканей при повышении стационарного количества активных форм кислорода и свободных радикалов. Следует отметить, что основную роль в обеспечении долговременной ферментативной защиты играют гемопоэтические факторы, связанные с выработкой новых эритроцитов (24, 25).
Итак, у кроликов выявлено усиление механизмов противоокисли-тельной защиты с участием ферментативных систем эритроцитов в период полового созревания (120 сут) с последующей декомпенсацией и проявлением окислительного стресса (180 сут). В целом у самцов и самок возрастная динамика биохимических показателей, характеризующих состояния антиоксидантной системы (АОС), заметно не варьируется. Тем не менее, отмеченные колебания оказались сильнее выраженными у самцов. Более консервативный характер онтогенетических изменений у самок, очевидно, не случаен и требует дополнительного изучения. Следовательно, при ис- пользовании кроликов в биомедицинских экспериментах или при мониторинге на сельскохозяйственных предприятиях в ряде случаев желательно учитывать половую принадлежность животных. Впервые для определения противоокислительного статуса у кроликов нами использован комбинированный антиоксидантный индекс, позволяющий не только выявить изменения АОС крови, но и оценить влияние разных факторов антиоксидантной защиты в онтогенезе.
Л И Т Е Р А Т У Р А
-
1. Хубутия М.Ш., Шабанов А.К., Булава Г.В., Дорфман А.Г., Зайнуди-нов З.М., Скулачев М.В., Кузовлев А.Н., Гребенчиков О.А., Сергее-ев А.А., Шпитонков М.И., Мальцев Г.Ю. Окислительный дистресс у пострадавших с тяжелой сочетанной травмой. Общая реаниматология, 2014, 10(2): 23-30.
-
2. Зайнудинов З.М., Шабанов А.К., Зорин С.Н., Кузовлев Л.Н., Мальцев Г.Ю., Азаров Я.Б., Ворожко И.В., Гребенчиков О.А. Метаболизм селена у пострадавших с тяжелой сочетанной травмой. Актуальные вопросы анестезиологии и реаниматологии, 2014, 3: 68-71.
-
3. Мальцев Г.Ю., Васильев А.В. Антиоксидантный индекс в мониторинге лечебного питания. Вопросы питания, 1999, 2: 41-43.
-
4. Кения М.В., Лукаш А.И., Гуськов Е.П. Роль низкомолекулярных антиоксидантов при окислительном стрессе. Успехи современной биологии, 1993, 113(4): 456-470.
-
5. Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М., 2001.
-
6. Балакирев Н.А., Александрова В.С., Калугин Ю.А., Александров В.Н. Нормы и рационы кормления кроликов и нутрий. М., 2001: 4-29.
-
7. Балакирев Н.А., Тинаева Е.А., Тинаев Н.И., Шумилина Н.Н. Кролиководство. М., 2006.
-
8. Placer Z. Lipoperoxydation systeme im biologichen material. 2. Mitt Bestinemund der Lipoperoxidationim Sangetier organismus. Die Nahrung, 1968, 12(6): 679-684.
-
9. Гаврилов В.Б., Мишкорудная М.И. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови. Лабораторное дело, 1983, 3: 33-35.
-
10. Mihara M., Uchiyama M., Fukuzawa K. Thiobarbituric acid value on fresh homogenate of rat as a parameter of lipid peroxidation in aging, CCl4 intoxication and vitamin E deficiency. Biochem. Med., 1980, 23(3): 302-311.
-
11. Tilbotson J., Sauberlich H. Effect of riboflavin depletion and repletion on the erythrocyte glutathione reductase in the rat. J. Nutrition, 1971, 101(11): 1459-1466.
-
12. Мальцев Г.Ю., Орлова Л.А. Оптимизация определения активности глутатионре-дуктазы эритроцитов человека на полуавтоматическом анализаторе. Вопросы медицинской химии, 1993, 2: 59-61.
-
13. Mille G. The purification and properties of glutathione peroxidase of erythrocytes. J. Biol. Chem., 1959, 244: 502-506.
-
14. Мальцев Г.Ю., Тышко Н.В. Методы определения содержания глутатиона и активности глутатионпероксидазы в эритроцитах. Гигиена и санитария, 2002, 2: 69-72.
-
15. Oshino N., Chance B., Sies H., Bucher N. The role of H2O2 — generation in perfused rat liver and the reaction of catalase compound I and hydrogen donors II. Archive Bio-chem. Biophys., 1973, 154: 117-131.
-
16. Мальцев Г.Ю., Васильев А.В. Способ определения активности каталазы и супер-оксиддисмутазы эритроцитов на анализаторе открытого типа. Вопросы медицинской химии, 1994, 2: 56-58.
-
17. N i s h i k i m i M., A p p a j i N.A., Yagi K. The occurrence of superoxide anion in the reaction of phenazine methosulfate and molecular oxygen. Biochem. Biophys. Res. Commun., 1972, 46(2): 849-854.
-
18. Matsunami T., Sato Y., Sato T. Yukawa M. Antioxidant status and lipid peroxidation in diabetic rats under hyperbaric oxygen exposure. Physiol. Res., 2010, 59: 97-104.
-
19. Valko M., Leibfritz D., Moncol J., Cronin M., Mazur M., Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int. J. Biochem. Cell Biol., 2007, 39(1): 44-84.
-
20. Sharma N., Singh N.K., Singh O.P., Pandey V., Verma P.K. Oxidative stress and antioxidant status during transition period in dairy cows. Aust. J. Anim. Sci., 2011, 24: 4.
-
21. B e r n a b u c c i U., R o n c h i B., L a c e t e r a N., N a r d o n e A. Influence of body condition score on relationships between metabolic status and oxidative stress in periparturient dairy cows. J. Dairy Sci., 2005, 88: 2017-2026.
-
22. Sordillo L.M., Aitken S.L. Impact of oxidative stress on the health and immune function of dairy cattle. Vet. Immunol. Immunopathol., 2009, 128: 104-109.
-
23. Ìåíüùèêîâà Å.Á., Ëàíêèí Â.Ç., Çåíêîâ Í.Ê. Îêèñëèòåëüíûé ñòðåññ. Ïðîîê-ñèäàíòû è àíòèîêñèäàíòû. Ì., 2006.
-
24. Ernster L., Nordenbrand K. Microsomal lipid peroxidation. Meth. Enzymol., 1967, 10: 574-580.
-
25. May J.M., Qu Z.C., Morrow J.D. Interaction of ascorbate and alpha-tocopherol in resealed human erythrocyte ghosts. Transmembrane electron transfer and protection from lipid peroxidation. J. Biol. Chem., 1996, May 3, 271(18): 10577-10582.
1ГБУ Московский научно-практический центр Поступила в редакцию дерматовенерологии и косметологии, филиал 28 октября 2014 года
Клиника им. В.Г. Короленко,
-
2ФГБНУ НИИ питания,
109240 Ðîññèÿ, ã. Ìîñêâà, Óñòüèíñêèé ïð., 2/14, e-mail: mailbox@ion.ru ;
-
3 ФГБУ ФНКЦ детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева,
117997 Ðîññèÿ, ã. Ìîñêâà, óë. Ñàìîðû Ìàøåëà, 1, e-mail: s_roumiantsev@mail,ru
Sel’skokhozyaistvennaya biologiya / Agricultural Biology , 2015, V. 50, № 2, pp. 208-216
THE MAIN PARAMETERS OF THE ANTIOXIDANT SYSTEM IN BLOOD OF MALE AND FEMALE RABBITS IN AGE DYNAMICS
D.D. Adzhiev1, G.Yu. Mal’tsev2, S.A. Rumyantsev3, E.N. Malyarenko1, N.F. Zatorskaya1
Научные собрания
VIII МОСКОВСКИЙ МЕЖДУНАРОДНЫЙ КОНГРЕСС «БИОТЕХНОЛОГИЯ: СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ» И XIII МЕЖДУНАРОДНАЯ СПЕЦИАЛИЗИРОВАННАЯ ВЫСТАВКА«МИР БИОТЕХНОЛОГИИ-2015»
(17-20 марта, 2015 год, г. Москва)
(краткий пост-релиз)
В последние годы в Российской Федерации задействован широкий спектр инструментов поддержки развития биотехнологий. Тем не менее, анализ проблемы в мире и в России показал, что выход научных исследований и промышленного производства в этой сфере на глобальный уровень конкурентоспособности невозможен без целенаправленной государственной политики. Разработанная Комплексная программа развития биотехнологий в Российской Федерации на период до 2020 года «БИО-2020» представляет собой первый документ столь высокого уровня с амбициозными, но достижимыми целями: обеспечить за счет биотехнологий до 1 % ВВП России к 2020 году и выйти на показатель 3 % ВВП к 2030 году.
В подготовке и проведении Конгресса приняли участие Минпромторг России, Минобрнауки РФ, Российская академия наук, Федеральное агентство научных организаций России, Департамент науки, промышленной политики и предпринимательства г. Москвы, РФФИ. Проведение Конгресса подтвердило роль фундаментальных исследований и широкие возможности использования накопленного потенциала и дальнейшего развития в России различных сегментов современной биотехнологии, включая нанобиотехнологию, фармацевтическую и медицинскую биотехнологию, молекулярную и клеточную биотехнологию, агробиотехнологию, пищевую биотехнологию, экологическую биотехнологию, техническую биотехнологию, биоэнергетику, биоматериалы для биотехнологии и медицины, а также материальное обеспечение исследований и технических разработок.
Конгресс предоставил площадки для выступлений и дискуссий представителям науки, образования, бизнеса разных стран, российских государственных, законодательных и исполнительных структур, ведущих академических институтов, университетов, осуществляющих подготовку специалистов для биотехнологической отрасли, российских и зарубежных фирм — производителей инновационного оборудования, средств диагностики, медицинской техники. Отдельное внимание было уделено функционированию и достижениям фармацевтических и региональных кластеров, предприятий и центров в сфере трансфера биотехнологии. Многие вопросы продовольственной безопасности способна решить агробиотехнология, направленная на повышение эффективности растениеводства и животноводства биотехнологическими методами в селекционной работе, для защиты от болезней и вредителей растений и животных, для получения биопрепаратов. В докладах была подчеркнута необходимость ускорения создания «дорожных карт» с целью разработки и выпуска новой линейки биотехнологических продуктов для сельского хозяйства и их интеграции в цикл воспроизводства и потребления сельхозпродукции.
В научную программу Конгресса входило общее пленарное заседание «Фундаментальные исследования и биотехнология», заключительное пленарное заседание, 14 секций, 4 круглых стола. В Конгрессе приняли участие представители из 21 страны мира (Россия, США, Германия, Швеция, Белоруссия, Казахстан, Швейцария, Франция, Великобритания и т.д.). Общее число участников превысило 2500 человек, включая значительное число преподавателей и студентов высших учебных заведений, что свидетельствует о росте интереса к биотехнологии.
Конгресс обратил внимание бизнес-сообщества на наличие современных отечественных конкурентоспособных технологий по производству биоудобрений, средств защиты растений, кормовых добавок, вакцин, тест-систем для ветеринарии, систем и сенсоров для контроля качества и обеспечения безопасности пищевых продуктов и сырья, биоматериалов, органических кислот. Имеются научный фундамент и крупномасштабная апробация микробиологических технологий увеличения нефтеотдачи пластов, биоремедиации загрязненных территорий и др.
Конгресс и выставка продемонстрировали, что Российская Федерация развивается во многих областях биотехнологии и обладает необходимыми предпосылками и потенциалом (наличие биоресурсов и энергоресурсов, пресной воды, научных школ, квалифицированных кадров и т.д.), чтобы войти в число мировых лидеров в области биоиндустрии.
Список литературы Основные параметры антиоксидантной системы крови у кроликов в половозрастной динамике
- Хубутия М.Ш., Шабанов А.К., Булава Г.В., Дорфман А.Г., Зайнудинов З.М., Скулачев М.В., Кузовлев А.Н., Гребенчиков О.А., Сергееев А.А., Шпитонков М.И., Мальцев Г.Ю. Окислительный дистресс у пострадавших с тяжелой сочетанной травмой. Общая реаниматология, 2014, 10(2): 23-30.
- Зайнудинов З.М., Шабанов А.К., Зорин С.Н., Кузовлев Л.Н., Мальцев Г.Ю., Азаров Я.Б., Ворожко И.В., Гребенчиков О.А. Метаболизм селена у пострадавших с тяжелой сочетанной травмой. Актуальные вопросы анестезиологии и реаниматологии, 2014, 3: 68-71.
- Мальцев Г.Ю., Васильев А.В. Антиоксидантный индекс в мониторинге лечебного питания. Вопросы питания, 1999, 2: 41-43.
- Кения М.В., Лукаш А.И., Гуськов Е.П. Роль низкомолекулярных антиоксидантов при окислительном стрессе. Успехи современной биологии, 1993, 113(4): 456-470.
- Зенков Н.К., Ланкин В.З., Меньщикова Е.Б. Окислительный стресс: биохимический и патофизиологический аспекты. М., 2001.
- Балакирев Н.А., Александрова В.С., Калугин Ю.А., Александров В.Н. Нормы и рационы кормления кроликов и нутрий. М., 2001: 4-29.
- Балакирев Н.А., Тинаева Е.А., Тинаев Н.И., Шумилина Н.Н. Кролиководство. М., 2006.
- Placer Z. Lipoperoxydation systeme im biologichen material. 2. Mitt Bestinemund der Lipoperoxidationim Sangetier organismus. Die Nahrung, 1968, 12(6): 679-684.
- Гаврилов В.Б., Мишкорудная М.И. Спектрофотометрическое определение содержания гидроперекисей липидов в плазме крови. Лабораторное дело, 1983, 3: 33-35.
- Mihara M., Uchiyama M., Fukuzawa K. Thiobarbituric acid value on fresh homogenate of rat as a parameter of lipid peroxidation in aging, CCl4 intoxication and vitamin E deficiency. Biochem. Med., 1980, 23(3): 302-311.
- Tilbotson J., Sauberlich H. Effect of riboflavin depletion and repletion on the erythrocyte glutathione reductase in the rat. J. Nutrition, 1971, 101(11): 1459-1466.
- Мальцев Г.Ю., Орлова Л.А. Оптимизация определения активности глутатионредуктазы эритроцитов человека на полуавтоматическом анализаторе. Вопросы медицинской химии, 1993, 2: 59-61.
- Mille G. The purification and properties of glutathione peroxidase of erythrocytes. J. Biol. Chem., 1959, 244: 502-506.
- Мальцев Г.Ю., Тышко Н.В. Методы определения содержания глутатиона и активности глутатионпероксидазы в эритроцитах. Гигиена и санитария, 2002, 2: 69-72.
- Oshino N., Chance B., Sies H., Bucher N. The role of H2O2 -generation in perfused rat liver and the reaction of catalase compound I and hydrogen donors II. Archive Biochem. Biophys., 1973, 154: 117-131.
- Мальцев Г.Ю., Васильев А.В. Способ определения активности каталазы и супероксиддисмутазы эритроцитов на анализаторе открытого типа. Вопросы медицинской химии, 1994, 2: 56-58.
- Nishikimi M., Appaji N.A., Yagi K. The occurrence of superoxide anion in the reaction of phenazine methosulfate and molecular oxygen. Biochem. Biophys. Res. Commun., 1972, 46(2): 849-854.
- Matsunami T., Sato Y., Sato T. Yukawa M. Antioxidant status and lipid peroxidation in diabetic rats under hyperbaric oxygen exposure. Physiol. Res., 2010, 59: 97-104.
- Valko M., Leibfritz D., Moncol J., Cronin M., Mazur M., Telser J. Free radicals and antioxidants in normal physiological functions and human disease. Int. J. Biochem. Cell Biol., 2007, 39(1): 44-84.
- Sharma N., Singh N.K., Singh O.P., Pandey V., Verma P.K. Oxidative stress and antioxidant status during transition period in dairy cows. Aust. J. Anim. Sci., 2011, 24: 4.
- Bernabucci U., Ronchi B., Lacetera N., Nardone A. Influence of body condition score on relationships between metabolic status and oxidative stress in periparturient dairy cows. J. Dairy Sci., 2005, 88: 2017-2026.
- Sordillo L.M., Aitken S.L. Impact of oxidative stress on the health and immune function of dairy cattle. Vet. Immunol. Immunopathol., 2009, 128: 104-109.
- Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. Окислительный стресс. Прооксиданты и антиоксиданты. М., 2006.
- Ernster L., Nordenbrand K. Microsomal lipid peroxidation. Meth. Enzymol., 1967, 10: 574-580.
- May J.M., Qu Z.C., Morrow J.D. Interaction of ascorbate and alpha-tocopherol in resealed human erythrocyte ghosts. Transmembrane electron transfer and protection from lipid peroxidation. J. Biol. Chem., 1996, May 3, 271(18): 10577-10582


