Основные тенденции в формировании почвенного микробного сообщества в условиях стационарного полевого опыта по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК
Автор: Думова В.А., Першина Е.В., Мерзлякова Я.В., Круглов Ю.В., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиология почвы
Статья в выпуске: 5 т.48, 2013 года.
Бесплатный доступ
Биоразнообразие почвенных микробных сообществ в настоящее время изучается достаточно широко. Объектом наших исследований была структура сообщества в почве длительного стационарного опыта Московской сельскохозяйственной академии, заложенного в 1912 году. Мы проанализировали воздействие на почвенный микробиом различных сочетаний трех агротехнических факторов — возделываемой культуры (лен и озимая рожь), севооборота и известкования почвы. Данные по биоразнообразию были получены при помощи метода высокопроизводительного секвенирования. Также мы применили оригинальный подход к анализу данных высокопроизводительного секвенирования — метод «бинарного сэмплинга». Было показано, что в количественном отношении группа микроорганизмов, изменяющихся под влиянием изученных факторов, примерно равна группе не изменяющихся под воздействием этих факторов. Однако эти группы сильно различались по качественному составу: группа, подверженная влиянию, была более однородна. Таким образом, можно утверждать, что воздействию подвергается не очень большая часть микроорганизмов, а численность других остается более или менее стабильной. Выявлены таксономические группы организмов, чувствительные к каждому из изученных факторов. Предлагаемый нами подход с использованием «бинарного сэмплинга» дает возможность соотнести конкретные изменения в таксономической структуре микробного сообщества с действием определенного экологического фактора.
Микробиом почвы, высокопроизводительное секвенирование
Короткий адрес: https://sciup.org/142133448
IDR: 142133448 | УДК: 579.6/.8:631.46:574.24:575.852''1
Текст научной статьи Основные тенденции в формировании почвенного микробного сообщества в условиях стационарного полевого опыта по данным высокопроизводительного секвенирования библиотек гена 16S-рРНК
Длительные полевые опыты используются во всех странах мира для комплексных исследований в области агротехники и влияния различных факторов на урожайность. Многократная воспроизводимость этих экспериментов во времени приводит к установлению качественно новых закономерностей, которые невозможно определить при проведении краткосрочных опытов. Стационарный опыт Московской сельскохозяйственной академии (Российский государственный аграрный университет—МСХА им. К.А. Тимирязева), который мы использовали в нашем исследовании, был заложен в 1912 году А.Г. Дояренко. С момента основания этот опыт отличался от предшествующих многофакторной схемой: в комплексе изучалось влияние удобрений, монокультур и полноценного севооборота.
Ранее исследования биоразнообразия микроорганизмов проводились посевом почвенной суспензии на питательные среды. В настоящее время наука располагает методами, которые позволяют более полно охарактеризовать состав микробного сообщества, учитывая не только культивируемые, но и некультивируемые микроорганизмы (1-4). Однако еще недавно определение таксономического состава микробного сообщества с использованием этих приемов было достаточно трудоемким и дорогим. Требовались процедуры клонирования и последующего секвенирования отдельных нуклеотидных последовательностей, что существенно ограничивало как число выявляемых видов, так и диапазон исследуемых мест обитания (5, 6).
Работа выполнена при поддержке Министерства образования и науки РФ, ГК № 16.552.11.7047 и гранта РФФИ 12-04-01371-а.
Применение пиросеквенирования существенно расширило возможности масштабного изучения многокомпонентных экосистем, включая почвенные микробоценозы. В то же время результаты пиросеквенирования имеют очень сложную структуру, с трудом подвергаются анализу, и поэтому для того, чтобы разобраться в видовом многообразии, необходимо находить новые подходы к систематизации данных.
В представляемой работе мы предлагаем оригинальный подход к анализу данных (метод «бинарного сэмплинга»), направленный на выявление особенностей таксономической структуры почвенного микробиома, связанных с действием определенного экологического фактора. Смысл метода заключается в создании (еще на этапе отбора проб) такого набора образов, чтобы их можно было разделить на группы, которые различались бы только по одному из действующих экологических факторов, а по всем другим были бы сходны. Именно такая схема отбора проб позволит определять группы микроорганизмов, маркирующие наиболее существенные различия в таксономической структуре микробиоты, которые вызваны влиянием исследуемого фактора. При сопоставлении объединенных по выбранному фактору библиотек последовательностей можно выявить те таксоны, которые демонстрируют наиболее значимые различия.
Целью работы было исследование микробного сообщества в почвах длительного стационарного опыта методом высокопроизводительного секвенирования с применением предложенного нами «бинарного сэмплинга».
Методика . Земельный участок многолетнего опыта РГАУ— МСХА им. К.А. Тимирязева площадью около 1,5 га с уклоном 1 ° на северо-запад расположен на южной окраине Клинско-Дмитровской возвышенности, представленной моренной равниной. Превышение над уровнем моря 162 м. Среднемноголетнее количество осадков около 600 мм в год, из них примерно половина — за май—август, среднегодовая температура 4,1 ° С. Почва дерново-подзолистая, супесчаная. Отбор почвенных образцов проводили в июне 2010 года с глубины пахотного горизонта А1 (20 см) в восьми вариантах опыта (в зависимости от сочетания воздействующих агротехнических факторов).
Для выделения ДНК в пробирку объемом 2 мл отбирали навеску почвы (0,2 г). Добавляли равное по объему количество шариков диаметром 0,1 мм («Innomed», Венгрия), 350 мкл раствора А (натрий-фосфатный буфер — 20 мМ, изотиоцианат гуанидина — 240 мМ; рН 7,0), 350 мкл раствора Б (Трис-HCl — 500 мМ, SDS — 1 % по массе к объему; pH 7,0) и 400 мкл смеси фенол-хлороформ. Пробирку помещали во встряхиватель и разрушали образец в течение 10-15 мин. Затем центрифугировали при 10 000-15 000 g в течение 5 мин. Водную фазу отбирали, добавляли 400 мкл хлороформа, интенсивно встряхивали 1-3 мин, центрифугировали так же, как на предыдущей стадии, отбирали водную фазу. К неочищенному экстракту ДНК добавляли один объем изопропилового спирта, интенсивно встряхивали, центрифугировали, промывали 70 % этанолом, слегка подсушивали на воздухе и растворяли осадок при 65 ° С в течение 15 мин в 100 мкл воды.
Для очистки ДНК от примесей проводили электрофорез в 1 % агарозе (0,5х ТАЕ-буфер). Вырезанный блок, содержащий ДНК, помещали в пробирку типа эппендорф (1,5 мл), добавляли 2 объема раствора В (изотиоцианат гуанидина — 3 М, Трис-HCl — 20 мМ, Тритон X-100 — 20 мг/мл; рН 7,0) и инкубировали при 65 ° С до полного растворения блока. К раствору приливали 20 мкл раствора Г (раствор В с добавлением 86
тонкодисперсной окиси кремния, 40 мг/мл), перемешивали и инкубировали 5 мин при комнатной температуре, периодически встряхивая. Затем центрифугировали при максимальной скорости, полностью убирали супернатант, осадок суспендировали в 200 мкл раствора Д (этанол — 25 %, изопропанол — 25 %, NaCl — 100 мM, Трис-HCl — 10 мМ; рН 7,0), центрифугировали, полностью отбирали супернатант, осадок ресуспендировали в этаноле, опять центрифугировали и полностью удаляли супернатант. Осадок подсушивали на воздухе в течение 15 мин, добавляли 50 мкл элюирующего буфера (Трис-HCl — 10 мМ, EDTA — 1 мМ; рН 8,0) и подвергали умеренному встряхиванию на вортексе в течение 30 мин. После этого образцы центрифугировали и отбирали супернатант, избегая попадания окиси кремния в очищенный препарат ДНК.
При секвенировании нуклеотидных последовательностей очищенный препарат ДНК служил матрицей в реакции ПЦР с универсальными праймерами к вариабельному участку V4 гена 16S-рРHК (F515 — GTGCCAGCMGCCGCGGTAA, R806 — GGATACVSGGGTATCTAAT) (7) с добавлением олигонуклеотидных идентификаторов для каждой пробы и служебных последовательностей, необходимых для пиросеквенирования по протоколу «Roche» (Швейцария). Используемые праймеры были сконструированы на основе анализа последовательностей как бактерий, так и архей. Подготовку проб и секвенирование проводили на приборе GS Junior («Roche», Швейцария) согласно рекомендации производителя.
Для таксономической идентификации последовательностей дополнительно также воспользовались базой данных RDP (Ribosomal Database Project, . Сравнительный анализ микробных сообществ выполняли с использованием ресурса VAMPS (Visualization and Analysis of Microbial Population Structure, доступен на сайте . С помощью системы VAMPS получили таблицы, содержащие значения доли идентифицированных микроорганизмов в каждой пробе, на основании которых были построены итоговые диаграммы.
Компьютерную обработку полученных в результате секвенирования нуклеотидных последовательностей, удаление из их состава меток и праймеров осуществляли согласно методическим рекомендациям в приложении Ribosome Database Project (RDP) Pipeline (8). Выполняли выравнивание нуклеотидных последовательностей, построение матрицы генетических расстояний и кластерный анализ последовательностей с применением алгоритма «average neighbor». Далее проводили классификацию последовательностей на OTU (Operational Taxonomic Unit) с использованием критерия 97 % сходства
Для осуществления «бинарного сэмплинга» из каждой библиотеки брали случайную выборку из 985 последовательностей, нормализируя библиотеки для последующего сравнения, и создавали объединенные библиотеки по каждому из выбранных факторов. Библиотеки сравнивали в приложении RDP «LibCompare» . Таким образом были сформированы таблицы по каждому фактору, содержащие данные о значимости различий между двумя библиотеками, объединенными по соответствующему фактору. Порог для оценки значимости влияния фактора определили равным 0,05 (все показатели выше этого порога не отражали значимых различий и наоборот).
Результаты. Образцы почвы в стационарном полевом опыте РГАУ-МСХА им. К.А. Тимирязева отбирали под посевами льна и озимой ржи, с известкованием и без, в условиях севооборота и без него (табл.).
Характеристика исследованных образцов почвы (стационарный полевой опыт Российского государственного аграрного университета—МСХА им. К.А. Тимирязева, г. Москва, июнь 2010 года)
|
№ о бразца |
Известкование | Севооборс |
।т | Культура Число нуклеотидных последовательностей |
||
|
1 |
+ |
+ |
Рожь |
1208 |
|
2 |
- |
+ |
Рожь |
1613 |
|
3 |
+ |
+ |
Лен |
2584 |
|
4 |
- |
+ |
Лен |
1928 |
|
5 |
- |
- |
Лен |
2049 |
|
6 |
+ |
- |
Лен |
985 |
|
7 |
- |
- |
Рожь |
1342 |
|
8 |
+ |
- |
Рожь |
2002 |
Примечание. «+» и « - » — соответственно наличие и отсутствие действующего фактора.
А
100 %
Bacteria неиден-тифицированные
^Proteobacteria
50%
<=^ Gemmatimonadetes
<^ Firmicutes
<= Bacteroidetes
Acidobacteria Archea неиден-тифицированные Crenarcheota
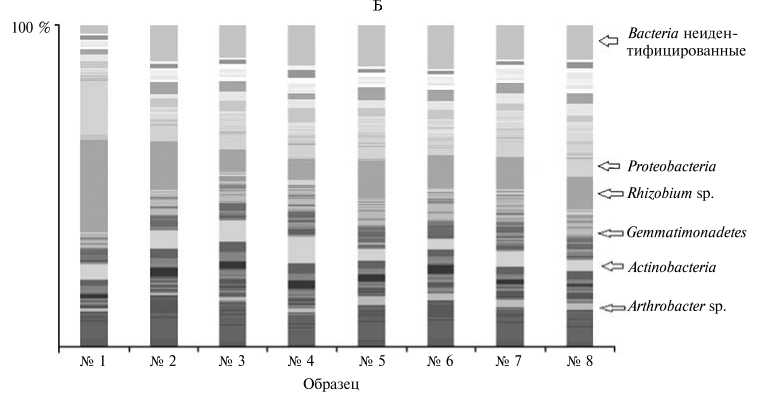
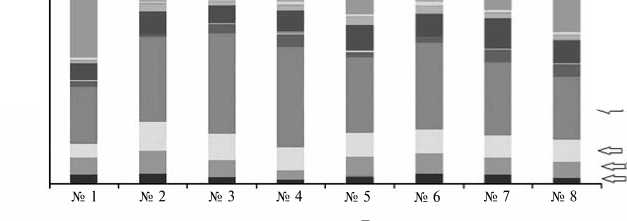
Рис. 1. Распределение фил (А) и родов (Б) микроорганизмов по образцам почвы (по данным высокопроизводительного секвенирования библиотек гена 168-рРНК): 1 — с известкованием и сево-обротом, 2 — с севооборотом, 3 — без севооборота, 4 — с известкованием без севооборота (под рожью); 5 — с известкованием и севооборотом, 6 — с севооборотом, 7 — без севооборота, 8 — с известкованием без севооборота (подо льном) (стационарный полевой опыт Российского государственного аграрного университета—МСХА им. К.А. Тимирязева, г. Москва, июнь 2010 года).
В составе сообщества были обнаружены представители 19 фил мик- роорганизмов (рис. 1, А), среди которых археи составляли небольшую долю (от 3 до 8 % в зависимости от образца). При этом следует отметить снижение числа архей в образцах с бессменной культурой озимой ржи. Среди бактерий наиболее широко оказалась представлена фила Proteobacteria с вкладом в сообщество около 50 %, за ней следовали Actinobacteria (около 20 %), Acidobacteria (5 %) и Firmicutes (5 %). Доля микроорганизмов, не идентифицируемых до филы, составляла примерно 15-20 %. Можно также выделить несколько фил, на которые в сообществе приходилось около 1 % — это Crenarcheota, Verrucomicrobia, Bacteroidetes и Gemmatimonadetes. Численность микроорганизмов из остальных фил в сообществах не достигала 1 %. Всего мы выявили около 300 родов микроорганизмов (см. рис. 1, Б), причем большую долю из них (около 40-50 %) составляли те, для которых последовательности ДНК не удалось идентифицировать до рода.
При рассмотрении сообщества на уровне рода в филе Proteobacteria доминировали представители Rhizobium (их содержание варьировало в пределах 10-20 %), Sphingomonas sp., Pseudomonas sp., а также не идентифицируемые до рода представители класса Proteobacteria . В образцах под посевами озимой ржи процент ризобий в почве сильно варьировал. Возделывание озимой ржи в севообороте приводило к увеличению численности ризобий, в то время как лен не оказывал такого влияния ни в условиях севооборота, ни без него. В целом можно отметить более высокую численность ризобий в севообороте, что вполне объяснимо, поскольку одной из культур в нем был клевер.
В филе Actinobacteria большую долю занимали неизвестные роды микроорганизмов из семейств Acidimicrobidae и Actinobacteridae , а также заметный вклад вносили Arthrobacter sp. (под посевами льна его содержание оказалось выше, чем под посевами озимой ржи), Solirubrobacter sp., Terra-bacter sp. и Nocardioides sp. Среди Acidobacteria доминировали представители родов GP1, GP16, GP3, GP4 и GP6. Для всех образцов было характерно общее снижение численности Acidobacteria при известковании почвы. Как отмечают C.L. Lauber с соавт. (9), микроорганизмы из филы Acidobacteria предрасположены к обитанию при более кислых значениях pH, и этим можно объяснить снижение их численности в образцах с известкованием почвы. Большинство представителей филы Firmicutes составляли не идентифицированные до рода микроорганизмы из классов Bacilli и Clostridia , а также роды Paenibacillus sp. и Bacillus sp.
Анализ данных секвенирования показал, что почвенное микробное сообщество обладает очень сложной структурой, ее изменения от образца к образцу не всегда очевидны, поэтому возникла необходимость упорядочить полученный материал, чтобы выявить микроорганизмы, наиболее чувствительные к действию определенного экологического фактора. В этом исследовании мы решили использовать метод «бинарного сэмплинга», принцип которого был описан выше. Использованный подход позволил нам выделить группы микроорганизмов, подверженные или не подверженные влиянию выбранных нами экологических факторов (кислотность почвы, агротехника и возделываемая культура).
Интересно отметить, что в количественном отношении группа микроорганизмов, изменяющихся под влиянием изученных факторов, оказалась примерно равна группе не изменяющихся под воздействием этих факторов (рис. 2). Однако эти группы сильно различались по качественному составу: группа, подверженная влиянию, была более однородна. Таким образом, можно утверждать, что воздействию подвергается не очень большая часть микроорганизмов, а численность других остается более или менее стабильной.

Рис. 2. Доля (%) видов микроорганизмов в образцах почвы, не подверженных (а) и подверженных (б) влиянию исследуемых факторов (по данным высокопроизводительного секвенирования библиотек гена 168-рРНК): I, II и III — соответственно известкование, севооборот и возделываемая культура (стационарный полевой опыт Российского государственного аграрного университета— МСХА им. К.А. Тимирязева, г. Москва, июнь 2010 года).
Представители трех фил — Aci-dobacteria , Actinobacteria , Proteobacteria были многочисленны во всех образцах и подвержены влиянию всех исследуемых факторов. Интересно отметить филу Gemmatimonadetes (10): входящий в нее вид Gemmatimonas sp. оказался чувствительным к воздействию всех факторов.
Если рассматривать влияние экологических факторов на роды бактерий, можно выявить ряд интересных закономерностей (рис. 3). Так, Rizo-bium sp. и Gemmatimonas sp. чувствительны ко всем трем изученным нами факторам (известкование, севооборот, культура растений). Влиянию всех трех факторов подвержены также различные представители филы Acidobacteria. Несмотря на то, что последние, как уже отмечалось, предпочитают более кислую среду обитания (9), видно, что не все представители этой филы проявили чувствительность к изменению кислотности почвы. Только у родов Gp1 и Gp2 численность в образцах с известкованием уменьшалась, остальные ацидобактерии оказались устойчивыми к изменению рН. Кроме того, стоит отметить изменения численности Sphingomonas sp., Streptomyces sp. и Nocardioides sp., на которые влияли лишь факторы, связанные с возделываемой культурой и севооборотом. Изменение рН незначительно сказались на этих видах микроорганизмов. Arthrobacter sp. был чувствителен к воздействию севооборота и выращиваемой культуре. Известкование снижало численность бактерий из родов Solirubrobacter, Paenibacillus, Bradyrhizobium.
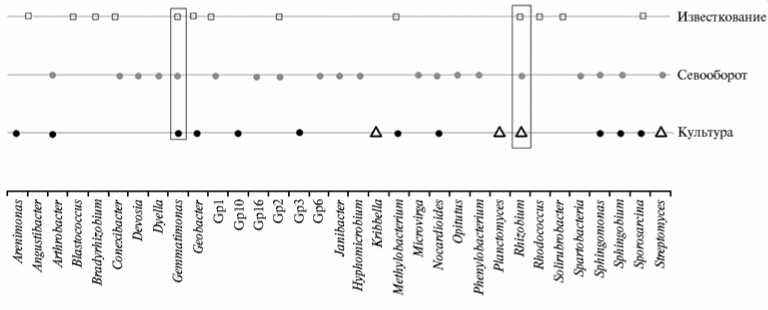
Рис. 3. Роды микроорганизмов, подверженных влиянию известкования, севооборота и возделываемой культуры (треугольники — рожь, черные кружки — лен) , которые были выявлены в исследованных образцах почвы по данным высокопроизводительного секвенирования библиотек гена 168-рРНК. Прямоугольниками отмечены роды, чувствительные ко всем трем факторам (стационарный полевой опыт Российского государственного аграрного университета— МСХА им. К.А. Тимирязева, г. Москва, июнь 2010 года).
Влиянию севооборота оказалась подвержена достаточно обширная группа микроорганизмов, среди которых Nocardioides sp., Spartobacteria sp., Hyphomicrobium sp., Streptomyces sp. и др. Сельскохозяйственная культура (в нашем случае лен и озимая рожь) влияет на Nocardioides sp., Sphingomonas sp., Streptomyces sp. и др. Однако велик список и тех микроорганизмов, которые нечувствительны к указанному фактору. Среди бактерий, устойчивых к воздействию всех трех факторов, можно выделить таких известных представителей почвенной микробиоты, как Pseudomonas sp., Bacillus sp., Rubrobacter sp.
Таким образом, исследованные нами факторы оказывали сильное воздействие на состав микробного сообщества, давая преимущество в развитии определенным группам микроорганизмов, имеющих те физиологические особенности, которые позволяют им занимать значительную часть экологической ниши. Существует «подвижная» часть микробного сообщества почвы, в нее входят наиболее многочисленные роды почвенных бактерий, такие как Rhizobium , Arthrobacter (см. рис. 3). Эта активная группа микроорганизмов может быть задействована в основных почвообразовательных процессах и поэтому более чутко реагирует на смену условий окружающей среды. В то же время в почве постоянно сохраняется пул всех микроорганизмов, который служит источником постоянного качественного и количественного изменения состава микробного сообщества. Несмотря на обнаруженные изменения в структуре почвенной микробиоты, можно сказать, что это сообщество, устойчивое к действию многих внешних факторов (кислотность, условия, создаваемые вследствие применения агротехники).
В заключение отметим, что выявить группы микроорганизмов, чувствительные к действию заданного экологического фактора, удается не всегда. Поэтому нами был опробован метод «бинарного сэмплинга», позволяющий более глубоко анализировать и систематизировать данные пиросеквенирования почвенной ДНК. Он позволил связать изменения в численности конкретных микроорганизмов с влиянием экологических факторов. Тем не менее, иногда непонятно, почему та или иная группа микроорганизмов чувствительна либо нечувствительна к действию экологического фактора, поскольку для оценки этого требуется знание физиологических особенностей микроорганизмов. Исследовать функциональную структуру сложнее, чем таксономическую, поэтому необходимо ограничить круг изучаемых микроорганизмов и рассматривать только те из них, которые реагируют на изменение факторов окружающей среды. Методика проведенного нами исследования представляет собой первый шаг в этом направлении, так как дает возможность соотнести конкретные изменения в таксономической структуре сообщества с действием определенного экологического фактора.
Итак, на основе анализа данных высокопроизводительного пиросеквенирования проведен подробный анализ таксономической структуры микробного сообщества в системе многолетнего стационарного полевого опыта Российского государственного аграрного университета—МСХА им. К.А. Тимирязева (в восьми вариантах, отражающих экологическое влияние различных сочетаний трех агротехнических факторов — возделываемой культуры, севооборота и известкования почвы). При анализе и систематизации результатов пиросеквенирования почвенной ДНК был опробован метод «бинарного сэмплинга», что дало возможность выявить группы организмов, чувствительных к действию заданных факторов. Показано, что предлагаемый подход позволяет соотнести изменения в таксономической структуре микробного сообщества с определенным внешним воздействием.


