Особенность экспрессии каспазы-3 в гиппокампе при моделировании острого эпилептического припадка
Автор: Демяшкин Г.А., Шаповалова Е.Ю., Григорян М.С., Зорин И.А.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 2 т.31, 2023 года.
Бесплатный доступ
Эпилепсия является одной из наиболее распространенных неврологических патологий, однако биологический субстрат заболевания до сих пор остается малоизученным. В ряде немногочисленных исследований было показано, что у экспериментальных животных после приступа эпилепсии отмечается повышение уровня некоторых каспаз, но имеющихся данных недостаточно для полного представления о природе каспазного каскада при эпилепсии, и, особенно, его терминальной фазы. Особого интереса заслуживает анализ патоморфологических изменений структур гиппокампа на фоне острого эпилептического припадка в корреляции между нейрональной потерей и терминальной фазой апоптоза или количественная оценка активности каспазы-3. Целью исследования явилась иммуногистохимическая оценка экспрессии каспазы-3 в гиппокампе в экспериментальной модели эпилепсии на лабораторных мышах. Животные были поделены на две группы: животным первой группы (n=28) внутрибрюшинно вводили препарат пентилентетразола однократно в дозе 45 мкг/кг для моделирования острого приступа эпилепсии, который оценивался по модифицированной шкале Расина, вторая группа животных была контрольной (n=20). Животных выводили из эксперимента через 3 часа и последовательно на 1, 3 и 5 сутки от начала введения препарата для динамического исследования изменений гиппокампа. Выведение животных из эксперимента осуществляли путем введения высоких доз анестетика. Фрагменты головного мозга животных исследовали с помощью окраски по Нисслю и оценивали количественные показатели экспрессии каспазы-3 при помощи иммуногистохимического метода в субрегионах СА1, СА3 и зубчатой извилины гиппокампа. Через 24 часа после моделирования острого эпилептического припадка обнаружили признаки гиппокампального склероза (глиоз, потерю нейронов) и увеличение количества нейронов, экспрессирующих каспазу-3 в 2,68 раза по сравнению с контрольной группой. В результате эксперимента выявили, что потеря нейронов гиппокампа субрегиона CA3 ассоциирована с увеличением экспрессии каспазы-3 через 24 часа после моделирования острого генерализованного припадка с помощью инъекции пентилентетразола.
Гиппокамп, эпилепсия, нейроны, каспаза-3, апоптоз
Короткий адрес: https://sciup.org/143180796
IDR: 143180796 | DOI: 10.20340/mv-mn.2023.31(2).801
Текст краткого сообщения Особенность экспрессии каспазы-3 в гиппокампе при моделировании острого эпилептического припадка
Демяшкин Г.А., Шаповалова Е.Ю., Григорян М.С., Зорин И.А. Особенность экспрессии каспазы-3 в гиппокампе при моделировании острого эпилептического припадка. Морфологические ведомости. 2023;31(2):801. (2).801
Demyashkin GA, Shapovalova EY, Grigoryan MS, Zorin IA. Features of the сaspase-3 expression in the hippocampus at the modelling of the experimental acute epileptic fit. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(2):801. (2).801
Введение. Эпилепсия является одной из наиболее распространенных неврологических патологий. Несмотря на длительное изучение эпилепсии и эпилептических припадков нейробиологиче-ский субстрат заболевания до сих пор остается малоизученным [1-4]. В настоящее время согласно протоколу Международной лиги по борьбе с эпилепсией (ILAE) склероз гиппокампа (мезиальный височный склероз) характеризуется потерей нейронов и глиозом и в котором выделяют 3 формы: типичная (I тип) и атипичная (II-III типы) [5]. Тем не менее, на сегодня остается неясным, является ли склероз гиппокампа причиной или следствием эпилепсии и эпилептических припадков [1, 6]. Для изучения эпилептогенеза и нейробиологического субстрата широко применяется экспериментальный метод моделирования эпилептических припадков. В большинстве работ отмечалось, что в эксперименте у животных обнаруживаются признаки повреждения гиппокампа, характерные для пациентов с эпилепсией [710]. Однако вопрос о механизмах нейронального повреждения до сих пор остается открытым. В ряде немногочисленных исследований было показано, что у экспериментальных животных после приступа эпилепсии отмечается повышение уровня некоторых каспаз в нейронах [11-12]. Такие данные позволяют предположить, что нарушение местного гомеостаза запускает апоптотический каскад, который приводит к гибели нейронов. Известно, что в головном мозге инициация апоптоза происходит через каспазы-8, -9, -10, которые активируют терминальные каспазы -3, -6, -7 [13-14]. Имеющихся данных недостаточно для полного представления о природе каспазного каскада при эпилепсии, и, особенно, его терминальной фазы. Особого интереса заслуживает анализ патоморфо-логических изменений структур гиппокампа на фоне острого эпилептического припадка в корреляции между нейрональной потерей и терминальной фазой апоптоза и количественная оценка активности каспазы-3 в связи с этим.
Цель исследования - иммуногистохимическая оценка экспрессии каспазы-3 в гиппокампе в экспериментальной модели эпилепсии на лабораторных мышах.
Материалы и методы исследования. Экспериментальное морфологическое исследование проводили в лабораториях Медицинской академии имени С.И. Георгиевского Крымского федерального университета имени В.И. Вернадского (Симферополь) и Институте трансляционной медицины и биотехнологии Первого Московского государственного медицинского университета имени И.М. Сеченова (Москва). В качестве животных моделей использовали самцов половозрелых мышей популяции CBA (весом 30-35 грамм, 12-ти недель жизни, n=30). Все манипуляции осуществляли согласно международным рекомендациям и руководствам по проведению медикобиологических исследований по уходу и использованию лабораторных животных (ILAR, DELS) и Правилам лабораторной практики и приказа Министерства здравоохранения РФ № 199-н от 01.04.2016 «Об утверждении правил лабораторной практики». Животные были поделены на группы: I-я (n=28) - моделирование острого приступа эпилепсии, который оценивался по модифицированной шкале Расина [10]; II-я группа (n=20) - контрольная. Для моделирования острого генерализованного приступа эпилепсии животным вводили эпилептогенный препарат пен-тилентетразол интраперитонеально, однократно, в дозе 45 мкг/ кг. Животных I-й и II-й группы выводили из эксперимента через 3 часа и последовательно на 1, 3 и 5 сутки от начала введения препарата для динамического исследования изменений в гиппокампе. Выведение животных из эксперимента осуществляли путем введения высоких доз анестетика. Для оценки морфологического субстрата эпилепсии при исследовании гиппокампа экспериментальных животных изучали субрегионы СА1, СА3 и область зубчатой извилины. Фрагменты головного мозга фиксировали в 10% нейтральном формалине, забуфе-ренном по Лилли при рН 7,2-7,4, затем заливали в парафин. После депарафинизации и регидратации парафиновых срезов их окрашивали по Нисслю. Иммуногистохимическое исследование проводили по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max (Leica, Германия). Использовались первичные мышиные моноклональные антитела к Caspase 3 (3CSP03; 0,1 мл) и вторичные – универсальные антитела (HiDef Detection™ HRP Polymer system, Cell Marque, США). Количество иммуно-позитивных клеток подсчитывали в 10 полях зрения препарата гиппокампа при увеличении х400. Для проверки выборки полученных данных на нормальность распределения использовали Критерий Шапиро–Уилка. Для проверки различий значений использовали t-критерий Стьюдента. Статистически значимыми считали результаты при p<0,05.
Результаты исследования и обсуждение. У всех животных I группы отмечали генерализованный эпилептический припадок, который, согласно модифицированной шкале Расина, соответствовал 4 (n=14), 5 (n=11) и 3 (n=3) баллам. Среднее время приступа составило 5,19±0,7 минут. В контрольной группе после интраперитонеальной инъекции физиологического раствора у животных не обнаружили судорожной активности, их поведение оценили на –1 балл по шкале Расина. После развития эпилептического приступа у всех животных не наблюдали признаков нарушения гемодинамики и расстройства поведенческих реакций. При гистологическом исследовании микропрепаратов гиппокампа опытной группы, окрашенных по Нисслю, через 3 часа после интраперитонеальной инъекции пентилентетразола нарушения его гистоархитектоники не обнаружили. Через 24 часа у животных опытной группы визу- ализировали дезинтеграцию темных нейронов с признаками пикноза и трудно различимыми границами между цитоплазмой и ядром (рис. 1). В динамике на 3 и 5 сутки отмечали тенденцию к уменьшению количества патологических нейронов.
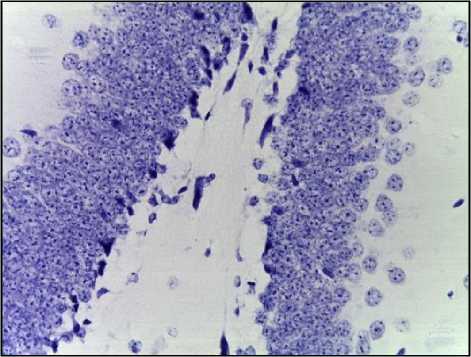
Рис. 1. Микрофото гистологического препарата головного мозга мыши экспериментальной группы. Окр.: по Нисс-лю. Ув.: х200
В контрольной группе наблюдали нормальное гистологическое строение вещества головного мозга и зоны гиппокампа. При исследовании уровня каспазы-3 в субрегионе CA3 через 24 часа после моделирования острого эпилептического припадка также наблюдали увеличение положительно окрашенных пирамидальных нейронов гиппокампа в 2,68 раза (рис. 2) по сравнению с контрольной группой (таблица 1). В других временных точках количество иммунопозитивных клеток статистически значимо не отличалось от контрольных значений.
Таблица 1
Относительное количество нейронов в % экспрессирующих каспазу-3 в субрегионе СА3 гиппокампа мыши при моделировании эпилептического припадка (M ± a)
|
Маркер |
Срок |
Группа I |
Группа II |
p-значение |
|
Каспаза-3 |
3 часа |
7,71 ± 1,12 |
6,80 ± 0,84 |
0,5 |
|
Каспаза-3 |
1 сутки |
21,95 ± 3,03 |
6,60 ± 1,96 |
< 0,01 |
|
Каспаза-3 |
3 сутки |
10,43 ± 1,72 |
7,80 ± 0,92 |
0,2 |
|
Каспаза-3 |
5 сутки |
8,20 ± 2,10 |
7,40 ± 1,14 |
0,39 |
Настоящее исследование посвящено изучению молекулярных механизмов клеточной гибели нейронов гиппокампа при остром генерализованном приступе эпилепсии, вызванного пентилентетразо-лом у мышей линии СВА. Для оценки эффекта острого эпилептического припадка (появление мезиального склероза) мы использовали окраску по Нисслю, позволяющую обнаружить темные нейроны, роль которых в настоящее время до конца не изучена. Раньше предполагалось, что их количество прямо пропорционально степени повреждения головного мозга, однако, на сегодня такая корреляция подвергается сомнению [15–17].
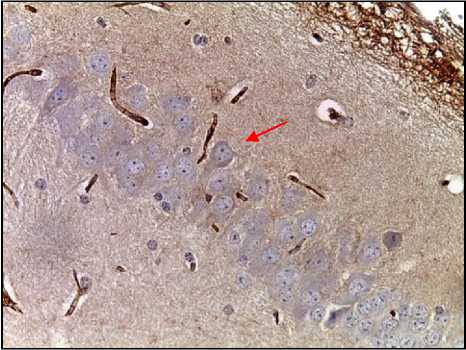
А
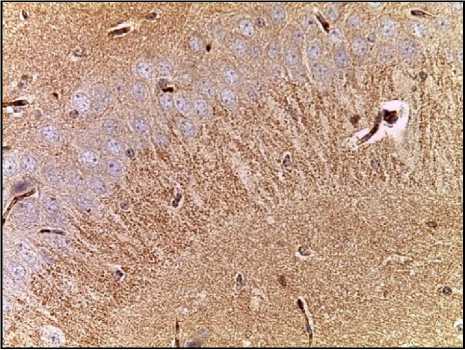
Б
Рис. 2. Микрофото гистологических препаратов головного мозга мыши экспериментальной (А) и контрольной (Б) групп СА3 региона гиппокампа через 24 часа после инъекции. Окр.: иммуногистохимическая с антителами к каспазе-3, докрашивание гематоксилином. Ув.: х400
Иммуногистохимическое исследование уровня активированной каспазы-3 показало, что через 24 часа после введения препарата пентилентетразола наблюдается наибольшее количество нейронов, экспрессирующих каспазу-3. Как известно, каспаза-3 является терминальной сигнальной молекулой в каспазном каскаде, инициирующем апоптоз. Принято считать, что при эпилептических припадках активация каспазы-3 происходит в ответ на повреждение и фрагментацию молекул ДНК в пирамидных нейронах, преимущественно СА1-СА3 региона гиппокампа [18-19]. Более того, существуют исследования, в которых ингибирование каспазы-3 приводило к увеличению количества выживших клеток после генерации эпилептического припадка [20]. Результаты настоящего исследования согласуются с устоявшимися представлениями о роли каспазы-3 в регуляции апоптоза, так как наибольшая экспрессия каспазы-3 ассоциируется с максимальной клеточной гибелью [21]. Особо стоит отметить, что уже на 5-е сутки гистоархитектоника гиппокампа соответствует норме. Та- кое быстрое восстановление не исключает того явления, что каспаза-3 в гиппокампе может регулировать не только терминальную стадию апоптоза, но и участвовать в ремоделировании синапсов и цитоскелета, клеточной дифференцировке и реинтеграции нейритов, необходимых для нейропластичности, как было показано в единичных исследованиях [22].
Заключение. Таким образом, суммируя полученные данные, можно отметить, что однократная инъекция пентилен-тетразола вызывает генерализованный эпилептический припадок, ассоциированный с увеличением экспрессии каспаза-3 при нейрональной гибели. В дальнейшем необходимо продолжить изучение роли каспазы-3 в этом явлении, так как, возможно, она не ограничивается лишь апоптоти-ческим действием. Потеря нейронов гиппокампа субрегиона CA3 ассоциирована с увеличением экспрессии каспазы-3 через 24 часа после моделирования острого генерализованного припадка с помощью инъекции пентилентетразола.
Список литературы Особенность экспрессии каспазы-3 в гиппокампе при моделировании острого эпилептического припадка
- Thom M. Review: Hippocampal sclerosis in epilepsy: a neuropathology review. Neuropathol Appl Neurobiol. 2014;40(5):520-543. DOI: 10.1111/nan.12150
- Chatzikonstantinou A. Epilepsy and the hippocampus. Front Neurol Neurosci. 2014;34:121-142. DOI: 10.1159/000356435
- Wolinski P, Ksiazek-Winiarek D, Glabinski A. Cytokines and Neurodegeneration in Epileptogenesis. Brain Sci. 2022;12(3):380. DOI: 10.3390/brainsci12030380
- Beghi E. The Epidemiology of Epilepsy. NED. 2020;54(2):185-191. DOI: 10.1159/000503831
- Blümcke I, Thom M, Aronica E et al. International consensus classification of hippocampal sclerosis in temporal lobe epilepsy: a Task Force report from the ILAE Commission on Diagnostic Methods. Epilepsia. 2013;54(7):1315-1329. DOI: 10.1111/epi.12220
- Walker MC. Hippocampal Sclerosis: Causes and Prevention. Semin Neurol. 2015;35(3):193-200. DOI: 10.1055/s-0035-1552618
- Kandratavicius L, Balista PA, Lopes-Aguiar C et al. Animal models of epilepsy: use and limitations. Neuropsychiatr Dis Treat. 2014;10:1693-1705. DOI: 10.2147/NDT.S50371
- Löscher W. Animal Models of Seizures and Epilepsy: Past, Present, and Future Role for the Discovery of Antiseizure Drugs. Neurochem Res. 2017;42(7):1873-1888. DOI: 10.1007/s11064-017-2222-z
- Shimada T, Yamagata K. Pentylenetetrazole-Induced Kindling Mouse Model. J Vis Exp. 2018;(136):56573. DOI: 10.3791/56573
- Van Erum J, Van Dam D, De Deyn PP. PTZ-induced seizures in mice require a revised Racine scale. Epilepsy & Behavior. 2019;95:51-55. DOI: 10.1016/j.yebeh.2019.02.029
- Engel T, Henshall DC. Apoptosis, Bcl-2 family proteins and caspases: the ABCs of seizure-damage and epileptogenesis? Int J Physiol Pathophys-iol Pharmacol. 2009;1(2):97-115. PMID: 21383882
- Sun J, Xie C, Liu W et al. The effects of simvastatin on hippocampal caspase-3 and Bcl-2 expression following kainate-induced seizures in rats. International Journal of Molecular Medicine. 2012;30(4):739-746. DOI: 10.3892/ijmm.2012.1076
- Nguyen TTM, Gillet G, Popgeorgiev N. Caspases in the Developing Central Nervous System: Apoptosis and Beyond. Frontiers in Cell and De-velopmental Biology. 2021;9. Accessed January 8, 2023. https://www.frontiersin.org/articles/10.3389/fcell.2021.702404
- Sharangpani A, Takanohashi A, Bell MJ. Caspase Activation in Fetal Rat Brain Following Experimental Intrauterine Inflammation. Brain Res. 2008;1200:138-145. DOI: 10.1016/j.brainres.2008.01.045
- Zimatkin SM, Bon’ EI. Dark Neurons of the Brain. Neurosci Behav Physi. 2018;48(8):908-912. DOI: 10.1007/s11055-018-0648-7
- Ahmadpour S, Behrad A, Vega IF. Dark Neurons: A protective mechanism or a mode of death. Journal of Medical Histology. 2019;3(2):125-131. DOI: 10.21608/jmh.2020.40221.1081
- Ooigawa H, Nawashiro H, Fukui S et al. The fate of Nissl-stained dark neurons following traumatic brain injury in rats: difference between neo-cortex and hippocampus regarding survival rate. Acta Neuropathol. 2006;112(4):471-481. DOI: 10.1007/s00401-006-0108-2
- Liu JP, Chang LR, Gao XL, Wu Y. Different expression of caspase-3 in rat hippocampal subregions during postnatal development. Microsc Res Tech. 2008;71(9):633-638. DOI: 10.1002/jemt.20600
- Basaranlar G, Derin N, Kencebay Manas C et al. The effects of sulfite on cPLA2, caspase-3, oxidative stress and locomotor activity in rats. Food and Chemical Toxicology. 2019;123:453-458. DOI: 10.1016/j.fct.2018.11.021
- Narkilahti S, Nissinen J, Pitkänen A. Administration of caspase 3 inhibitor during and after status epilepticus in rat: effect on neuronal damage and epileptogenesis. Neuropharmacology. 2003;44(8):1068-1088. DOI: 10.1016/s0028-3908(03)00115-1
- Baculis BC, Weiss AC, Pang W et al. Prolonged seizure activity causes caspase dependent cleavage and dysfunction of G-protein activated in-wardly rectifying potassium channels. Sci Rep. 2017;7(1):12313. DOI: 10.1038/s41598-017-12508-y
- Tzeng TT, Tsay HJ, Chang L et al. Caspase 3 involves in neuroplasticity, microglial activation and neurogenesis in the mice hippocampus after intracerebral injection of kainic acid. J Biomed Sci. 2013;20(1):90. DOI: 10.1186/1423-0127-20-90


