Особенности анодного поведения медной микроповерхности в растворе гидроксида калия при температуре 22...48 °С
Автор: Шарлай Екатерина Валерьевна, Марков Борис Анатольевич, Рябухин Александр Григорьевич
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 24 (283), 2012 года.
Бесплатный доступ
Потенциодинамическим методом исследовано влияние температуры на параметры электрохимического окисления медной поверхности кольцевого микроэлектрода и химическое взаимодействие анодных продуктов с компонентами щелочного электролита. Показано, что вольтамперометрия с линейной разверткой потенциала может быть использована для изучения структурно-динамических свойств растворов электролитов.
Анодное окисление меди, кольцевой микроэлектрод, структурно-динамические свойства раствора
Короткий адрес: https://sciup.org/147160237
IDR: 147160237 | УДК: 544.642
Текст научной статьи Особенности анодного поведения медной микроповерхности в растворе гидроксида калия при температуре 22...48 °С
В методе вольтамперометрии в качестве рабочих используются медные электроды различных конструкций, наиболее перспективными из которых являются микроэлектроды, характеризующиеся быстрым установлением стационарного двойного электрического слоя, малым омическом вкладом в измеряемые токи и другими преимуществами перед обычными электродами.
Поведение меди в кислых электролитах изучено широко и подробно, сведения же по анодному окислению меди в щелочных электролитах малочисленны и противоречивы. Недостаточно сведений, освещающих вопрос влияния температуры на параметры окисления меди, что и обусловило направленность данной работы. Кроме того, так как молекулы воды в двойном электрическом слое принимают непосредственное участие в процессах окисления меди, структурные преобразования водного каркаса должны повлиять на ход электрохимических зависимостей. Этот факт проверяется в данной работе сопоставлением экспериментальных данных по анодному окислению с литературными данными по известным температурным точкам конформационных переходов в структуре воды, среди которых наиболее известны следующие: максимум плотности при 4 °С; вязкость воды до 30 °С возрастает с повышением давления, минимум теплоемкости наблюдается при 35 °С, минимум отношения объемной и сдвиговой вязкостей находится при 40 °С, изотермическая сжимаемость имеет минимум при 45 °С.
Методика эксперимента
Для исследования электрохимического поведения меди в щелочи применялась трехэлектродная ячейка, описанная в [1]. Потенциал измерен относительно нормального водородного электрода (НВЭ). При снятии I, ф-кривых температура поддерживалась с помощью жидкостного циркуляционного термостата UH8 и дополнительно контролировалась термометром с точностью ±0,1 °С. Потенциодинамический режим обеспечивался потенциостатом ПИ-50-1 (погрешность регулирования потенциала ±0,5 мВ) и программатором ПР-8. Вольтамперограммы регистрировались двухкоординатным самописцем ЛКД4-003. Изучен интервал температур 22…48 °С с шагом в 1–2 °С. Деаэрирование перед опытом не производилось.
Электролит (KOH, Cm = 4 моль/л) готовился из реактива фирмы LACHEMA (Чехословакия) марки ч.д.а. на дистиллированной воде. Воспроизводимость данных по анодной максимальной силе тока подтверждается согласием трех I, ф-кривых для каждой температуры и скорости развертки потенциала. Интервал скоростей составлял от 0,001 до 0,1 В/с.
Результаты и их обсуждение
На рис. 1 представлен общий вид кривой, полученной в 4 М KOH на кольцевом медном микроэлектроде в интервале потенциалов от выделения кислорода до выделения водорода (путь развертки потенциала: φст → анодная область → катодная область→ φст). Анодный пик А и катодный К примерно одинаковы по высоте с небольшим преобладанием анодного пика, что может свидетельствовать о химическом распаде (растворении) продуктов окисления в прилегающем слое электролита.
Максимумы с увеличением скорости развертки потенциала раздвигаются по оси потенциалов дальше друг от друга (увеличивается степень необратимости процесса), максимальные токи закономерно увеличиваются, изменяется форма кривой.
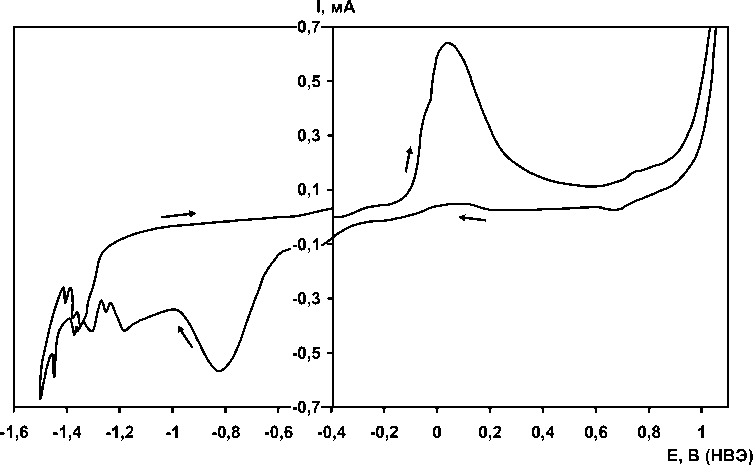
Рис. 1. Вольтамперограмма, зафиксированная на кольцевом медном электроде в 4 М KOH (20 °С, 0,05 В/с)
Область вольтамперограммы, соответствующая основному окислению меди со всеми особенностями, выделена на рис. 2. Кривые при средних скоростях развертки потенциала (0,005…0,02 В/с) представляют собой три четко выраженных перекрывающихся пика. Кроме того, в области потенциалов –0,35…–0,2 В (НВЭ) регистрируется слабо выраженный пик (см. рис. 1), практически независящий от скорости развертки потенциала, относимый по литературным данным [2] к образованию Cu 2 O по реакции:
2Cu + H 2 O – 2e → Cu 2 O + 2H+
(2H+ + 2OH– → 2H 2 O).
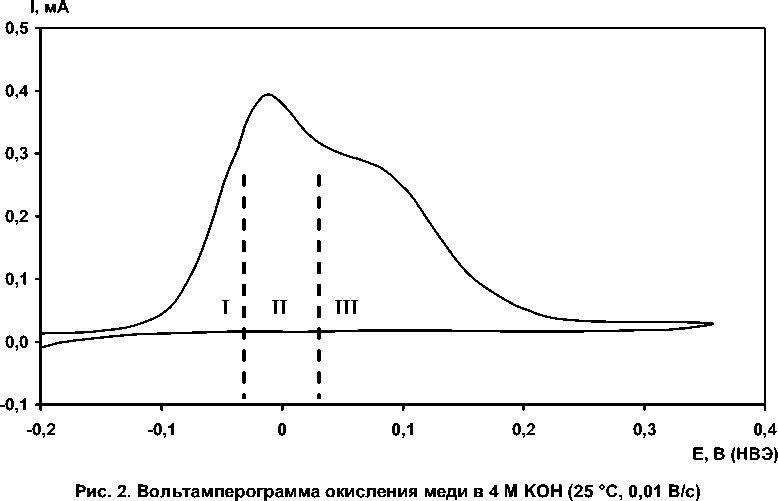
Физическая химия
Потенциалы двух последних пиков (области II, III) по литературным данным соответствуют процессам окисления меди до CuO (основа) и Cu(OH) 2 по реакциям [3]:
Cu 2 O + H 2 O – 2е → 2CuO + 2H+
(2H+ + 2OH– → 2H 2 O),
Cu 2 O + 2OH– + H 2 O – 2e → 2Cu(OH) 2 .
Потенциал процесса, соответствующего области III, достигается уже после начала пассивации.
Для исследования связи анодных и катодных максимумов с помощью метода циклической вольтамперометрии варьировалась глубина анодной поляризации с последующим катодным восстановлением. Результаты говорят о том что, возможно, появление плеча в области I связано с образованием особой фазы, сходной по строению и составу с фазой в области II (CuO), но отличающейся энергетически (менее стабильной, если исходить из смещения соответствующего катодного пика в более положительную область потенциалов). Не исключён вариант появления здесь «размерных эффектов»; точно на данном этапе работы сказать затруднительно. Циклическая вольтамперометрия показала, что все анодные процессы на меди в щелочной среде, кроме соответствующего анодному пику в области 0,7…0,8 В (см. рис. 1) (образование Cu 2 O 3 [4]), являются необратимыми, поскольку отвечающие им катодные пики смещены более чем на 0,2 В от потенциала анодного максимума.
Определение лимитирующей стадии процесса при потенциалах вплоть до максимума тремя способами показало, что во всем использованном интервале температур 22…48 °С окисление меди проходит в диффузионно-кинетической области.
-
1. Аппроксимация зависимости силы тока максимума от корня квадратного из скорости развертки логарифмической функцией дала лучшие по коэффициентам корреляции результаты, чем линейная, что соответствует кинетическому (либо смешанному) контролю процесса.
-
2. С.В. Горбачевым показано, что разнообразные электрохимические реакции удовлетворительно выражаются уравнением, сходным по смыслу с уравнением для скорости химических реакций Аррениуса:
-
3. Для применения третьего способа определения природы поляризации были собраны данные по координатам (перенапряжение, сила тока) девяти точек, расположенных на восходящей ветви анодной кривой. Данные обрабатывались в аррениусовских координатах, после чего были получены зависимости расчётной энергии активации процесса от перенапряжения (рис. 3).
i = K·exp(–Ea /(RT)), где i – плотность тока процесса; K – предэкспоненциальный множитель; R – универсальная газовая постоянная; Т – абсолютная температура; Еа – эффективная энергия активации. Построив логарифмическую зависимость силы тока (перенапряжения) от обратной абсолютной температуры (lnI–1/T), можно судить о природе контроля процесса по расчетной величине Еа (табл. 1) (термокинетический метод).
Величина эффективной энергии активации Еа при концентрационной поляризации близка к энергии активации диффузии и энергии активации вязкости растворителя (14…18 кДж/моль), при химической поляризации Е а электрохимических реакций имеет значения, близкие к обычным значениям энергии активации реакций в растворах (80…125 кДж/моль). Таким образом, полученные значения эффективной энергии активации анодного процесса при перенапряжениях 0,32, 0,38 и 0,40 В (восходящая ветвь вольтамперограммы) также указывают на прохождение его в области смешанной кинетики, причём, с уменьшением развертки потенциала и увеличением перенапряжения вклад диффузионных ограничений увеличивается (15,2 кДж/моль при 0,4 В).
Таблица 1
Эффективная энергия активации реакции окисления меди при перенапряжениях 0,32, 0,38 и 0,40 В (восходящая анодная ветвь)
|
V p , мВ/с |
E a , кДж/моль |
||
|
0,32 В (подъем кривой) |
0,38 В |
0,40 В (область максимума) |
|
|
0,100 |
45,0 |
38,4 |
36,2 |
|
0,050 |
45,6 |
35,7 |
31,1 |
|
0,020 |
37,7 |
28,8 |
15,2 |
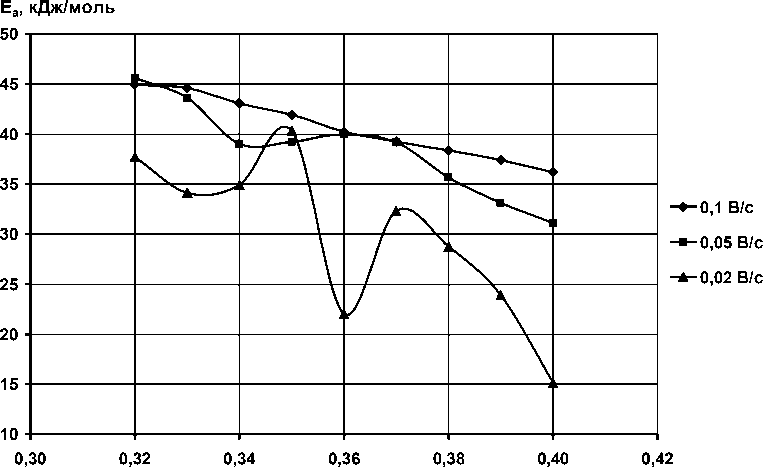
Е п , В
Рис. 3. Зависимость эффективной энергии активации процесса анодного окисления меди в 4 М KOH от перенапряжения
Из рис. 3 видно, что величины Е а (14…46 Дж/моль) говорят о прохождении анодного процесса для малых перенапряжений (0,32…0,39 В) в области смешанной кинетики, при перенапряжениях выше 0,39 В процесс окисления начинает контролировать в значительной степени диффузия электроактивных частиц. При этом кинетическая составляющая скорости процесса выражается в уменьшении эффективной энергии активации с ростом поляризации – параметра, связанного с энергией электрического поля.
Данная зависимость практически линейна только при максимальной применяемой скорости развертки потенциала, когда получаемые вольтамперограммы сглажены до одного анодного пика. При меньших скоростях развертки она экстремальна в области 0,34… 0,37 В, что совпадает с появлением на вольтамперограммах дополнительного пика в области I (см. рис. 2). Это может также указывать на прохождение при этих потенциалах отличного от проходящего при потенциале максимума окислительного процесса.
Механизм образования осадка (фазовый, адсорбционный), образующегося на электроде, оценивали по зависимостям потенциала максимума вольтамперограммы от корня квадратного, либо логарифма скорости развертки потенциала. Если зависимость потенциала от корня квадратного линейна – осадок имеет фазовую природу. Линейная зависимость потенциала от логарифма скорости развертки указывает на адсорбционный характер осадка. Как было установлено с учётом коэффициентов корреляции аппроксимирующих зависимостей, получающийся осадок имеет фазовую природу при температурах 22…28, 32, 38, 44, 46…48 °С, при 30, 33…37, 40…43, 45 °С образуется адсорбционный осадок.
Количество электронов, участвующих в процессе, проходящем при потенциале максимума, рассчитывалось по формуле, предложенной А.Г. Рябухиным для необратимых процессов:
I m / I Δ = (2,9951(α n e )1/2)/(1,545 – 2,01· Δ E ).
Здесь Im – максимальный ток вольтамперограммы; I Δ – ток, отстоящий на расстоянии Δ от максимального тока; Δ Е – разность потенциалов максимума и потенциала Δ ; α = 0,5 для растворов.
При этом расчёт вели по кривым, полученным при наименьшей использованной скорости развертки, ближайшей к стационарным условиям (0,001 В/с). За потенциал Δ принимали потенциал перегиба восходящей ветви вольтамперограммы окисления меди, соответствующий первому значительному максимуму дифференциальной кривой, т. е. точке перегиба вольтамперограм-мы. Результаты расчётов представлены в табл. 2. Как видно из таблицы, при всех температурах количество электронов близко к единице, что соответствует литературным данным и учитывалось в расчётах.
Физическая химия
Таблица 2
Количество электронов, участвующих в процессе, соответствующем максимуму кривой окисления меди ( V p = 0,001 В/с)
|
t , °C |
n е |
|
24 |
1,03 |
|
30 |
1,01 |
|
33 |
0,83 |
|
34 |
0,94 |
|
35 |
0,87 |
|
36 |
0,74 |
|
37 |
0,86 |
|
40 |
0,86 |
|
43 |
0,91 |
|
45 |
0,82 |
Полученные в графической форме температурные зависимости силы тока и потенциала анодного максимума вольтамперограмм имеют сложный экстремальный вид (рис. 4 и 5), воспроизводящийся при всех скоростях развертки, хотя в литературе широко распространено мнение о монотонности температурной зависимости силы тока и потенциала процесса как характеристик его скорости. Соответственно представленным данным расчёт эффективной энергии активации электрохимического процесса окисления возможен только в приближенном варианте.
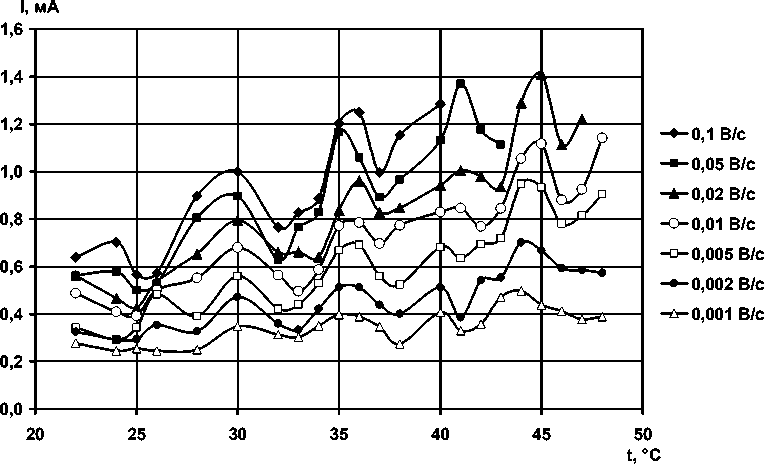
Рис. 4. Температурная зависимость силы тока анодных максимумов окисления меди в 4 М KOH при различных скоростях развертки потенциала
Сила тока процесса имеет общую тенденцию – с повышением температуры увеличиваться, а потенциал сдвигается в отрицательную область. Максимумы по силе тока располагаются при температурах: 30, 35–36, 40–41, 44–45 °С. Очевидна корреляция с вышеприведенными данными по механизму образования осадка: в этих точках анодный осадок охарактеризован как адсорбционный. Интересно то, что явно выделяется область 35–36 °С, коррелирующая со значением нормальной температуры тела человека, а интервал 30…45 °С является диапазоном возможности существования теплокровных организмов. На основании этого выдвинута гипотеза о связи экстремальных температурных точек полученных зависимостей с конформационными переходами в структуре воды и водных растворах электролита, происходящими при повышении температуры, поскольку в литературе содержатся многочисленные указания на соответствие величин обнаруженных нами экстремальных температур изменениям физических свойств воды и водных растворов.
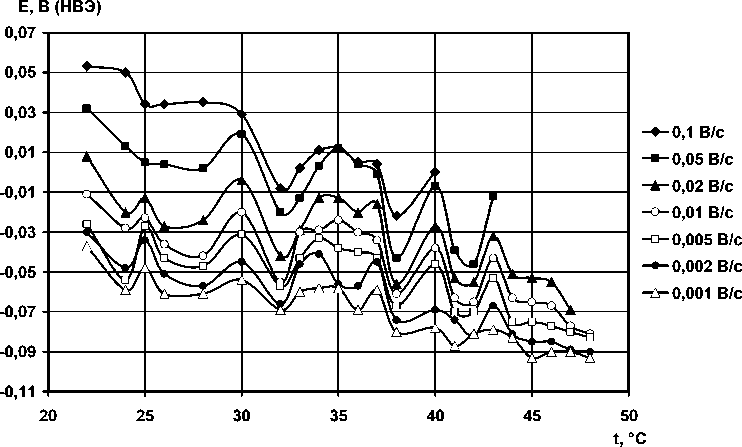
Рис. 5. Температурная зависимость потенциала анодных максимумов окисления меди в 4 М KOH при различных скоростях развертки потенциала
Предложенная гипотеза объясняет полученные данные по температурным зави с имостям электрохимических характеристик окисления меди, п оскольку конформационные пе р еходы в водном каркасе электролита закономерно должны приводить к отличному строению д войного электрического слоя на границе раздела фаз электрод/электролит, изменен и ю энергии гидрата-ции/дегидратации участвующих в процессе ионов, а с ледовательно, и другим величинам параметров вольтамперных кривых.
Установлено, что полученные температурные зависимости силы тока процесса окисления аппроксимируются следующим уравнением:
I = At + B + A 1sin(rn1 t + ф1)+A 2sin(m2t + Ф2), где А, В, А 1, А2, ю1, ы2, ф1 и ф2 - эмпирические константы.
В результате подбора коэффициентов по данной формуле методом на и меньших к в адратов получены следующие результаты для усредненных по скоростям значений силы тока м а ксимума (рис. 6). Кружками указаны усредненные экспериментально полученные точки. Пунктирная линия - результат аппроксимации по формуле. Уравнение описывает поведение отклика изучаемой системы медь/водный раствор гидроксида калия во всем использованном интервале температур при любой применявшейся скорости развертки.
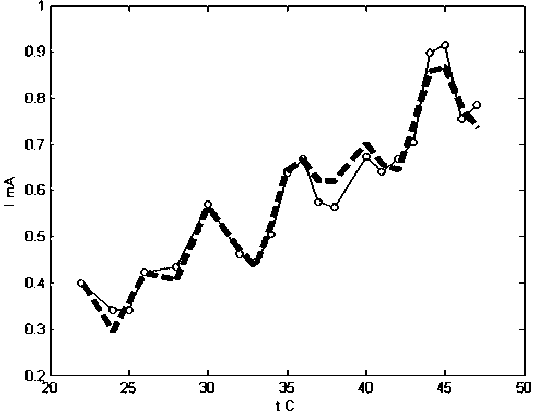
Рис. 6. Аппроксимирующая кривая для усредненных значений силы тока максимума анодного окисления меди в 4 М KOH
Список литературы Особенности анодного поведения медной микроповерхности в растворе гидроксида калия при температуре 22...48 °С
- Рябухин, А.Г. Вольтамперометрическое исследование электрохимических характеристик анодного процесса на кольцевом медном микроэлектроде в щелочной среде/А.Г. Рябухин, Е.В. Шарлай//Физико-химические процессы в неорганических материалах (ФХП-10): доклады Десятой междунар. конф., 10-12 окт. 2007 г.: в 2 т. -Кемерово: Кузбассвузиздат, 2007. -Т. 2. -С. 159-162.
- Оксидные пленки и электрокапиллярное поведение окисленной меди в растворах КОН/B.И. Наумов, Н.В. Салина, И.В. Китаев, Е.А. Федорова//Электрохимия. -1993.-Т. 29, № 8. -C.1003-1007.
- Abd El Haleem, S.M. Electrochemical behavior of copper in alkaline-sulfide solutions/S.M. Abd El Haleem, E.E. Abd El Aal//Corrosion. -2006. -Vol. 62. -№ 2. -P. 121-128.
- Ланина, С.Я. О реакциях выделения водорода на медном катоде и анодном окислении меди в кислых и щелочных растворах/С.Я. Ланина, З.А. Иофа//Электрохимия. -1969. -Т.5, № 3. -С. 359.
- Носков, А.В. Кинетика анодного окисления металлов в сернокислых электролитных средах в условиях нестабильности продуктов электрохимической реакции/А.В. Носков, Е.П. Гришина//Химия растворов и технология жидкофазных материалов. Достижения и перспективы: сб. науч.тр. -Иваново, 2006.-С. 64-71.


