Особенности антивазопролиферативной терапии после субмакулярной хирургии с сохранением стекловидного тела
Автор: Босов Э.Д., Богданова В.А., Сараева С.Н.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 4S1 т.19, 2024 года.
Бесплатный доступ
Обоснование: Возрастная макулярная дегенерация в современной мире является одной из лидирующих проблем, ведущих к слепоте. Это быстропрогрессирующее заболевание, которое характеризуется поражением центральной зоны сетчатки.Цель: провести оценку морфологических и функциональных параметров сетчатки после хирургического лечения субмакулярных кровоизлияний на фоне антивазопролиферативной терапии у пациентов с влажной формой возрастной макулярной дегенерации.Материалы и методы: Исследование проводилось на базе Центра офтальмологии НМХЦ им. Пирогова (г. Москва). В него были включены 90 человек с активной формой возрастной макулярной дегенерации. Средний возраст пациентов составил 71,3±8,5 лет, среди которых 50 женщин в возрасте от 61 до 82 лет и 40 мужчин от 74 до 78 лет. Обоснованием применения в данной работе стратегии «treat and extend» является возможность использования меньшего количества интравитреальных инъекций по сравнению с фиксированной схемой, дающей аналогичные результаты зрительных функций.Заключение: Можно сделать вывод, что сохранение стекловидного тела во время малоинвазивного витреоретинального вмешательства позволяет придерживаться режима «treat and extend» без уменьшения межинъекционного интервала.
Возрастная макулярная дегенерация, витреоретинальная хирургия, субмакулярное кровоизлияние, сетчатка, слепота, терапия
Короткий адрес: https://sciup.org/140307889
IDR: 140307889 | DOI: 10.25881/20728255_2024_19_4_S1_103
Текст научной статьи Особенности антивазопролиферативной терапии после субмакулярной хирургии с сохранением стекловидного тела
Обоснование
В современном мире продолжает расти заболеваемость возрастной макулярной дегенерацией (ВМД). По данным демографического анализа, количество больных неова-скулярной формой ВМД составляет более 200 миллионов человек, а к 2040 году количество больных неоваскуляр-ной ВМД вырастет на 57% [1]. Данное заболевание в ряде случаев может иметь осложненное течение с развитием субмакулярного кровоизлияния (СМК) (Рис. 1). При условии отсутствия своевременного хирургического лечения происходят непоправимые изменения центральных отделов сетчатки, из-за прямого воздействия сгустка крови на фоторецепторные слои [2]. При проведении витреоретинального вмешательства в период до 14 суток в 90% случаев удается добиться дислокации СМК и повышения зрительных функций до 0.3–0.7 в отдаленном периоде (Рис. 2) [3–5].
Важно отметить, что СМК является осложнением течения ВМД, поэтому субмакулярная хирургия не является патогенетическим лечением. Существующие на сегодняшний день техники витреоретинального вмешательства включают выполнение витреоэктомии и субмакулярного введения фибринолитических препаратов и/или стерильного воздуха [3–5]. При выборе стратегии лечения необходимо опираться на комбини-
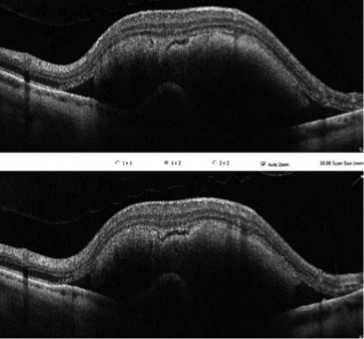
Рис. 1. Субмакулярное кровоизлияние до витреоретинального вмеша-
тельства.
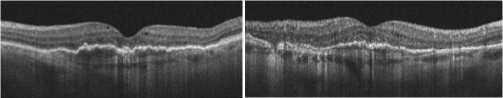
Рис. 2. Субмакулярное кровоизлияние после витреоретинального вмешательства.

рованную методику транслокации СМК и отсроченной антиангиогенной терапии [6; 7]. До конца не установлено, как выбор хирургической тактики повлияет на активность хориоидальной неоваскуляризации (ХНВ) и фармакокинетику анти-VEGF (vascular endothelial growth factor) препаратов. Важно, что отсутствие проведения витреоэктомии потенциально позволяет пролонгировать действие антивазопролиферативных молекул, что может стать преимуществом [8]. В глазу без стекловидного тела происходит сокращение периода полувыведения лекарственных форм и межинъекционного интервала [8]. Необходимость в высокоэффективной антиангиогенной терапии подтверждается уменьшением частоты рецидивов СМК на фоне улучшения морфофункциональных результатов [4].
Также остаются нерешенными вопросы выбора оптимального режима антиангиогенной терапии у пациентов, перенесших СМК. В существующих исследованиях не было установлено максимального интервала между интравитреальными инъекциями с учетом повышенного риска рецидива субфовеальных геморрагий [9]. Зарубежными авторами отмечено, что развитие повторного СМК происходит спонтанно в любой временной интервал даже на фоне стабильной клинической картины [10]. В связи c ранее описанными факторами безопасными являются проактивные режимы антиангиогенной терапии, включающие регулярные мониторинговые визиты [11]. Таким образом, остаются нерешенными вопросы о выборе наиболее эффективной стратегии лечения пациентов, перенесших хирургию по поводу СМК на фоне активной ВМД.
Цель исследования
Оценить морфофункциональные параметры сетчатки после антивазопролиферативной терапии у пациентов с активной формой ВМД после малоинвазивного хирургического лечения СМК.
Материалы и методы исследования
В проспективное исследование на базе Центра офтальмологии НМХЦ им. Пирогова (г. Москва) были включены 90 человек с активной формой ВМД. Средний возраст пациентов составил 71,3±8,5 лет, среди которых 50 женщин в возрасте от 61 до 82 лет и 40 мужчин от 74 до 78 лет. Критерии невключения: наличие фиброваскулярных изменений сетчатки по данным оптической когерентной томографии (ОКТ) или географической атрофии, максимально корригируемая острота зрения (МКОЗ) <0,1. Период наблюдения составил 12 месяцев. Пациенты были разделены на две группы:
1-я группа – 50 пациентов (50 глаз) – пациенты, ранее перенесшие малоинвазивную хирургию по поводу СМК площадью более 5 диаметров диска зрительного нерва на фоне активной формы ВМД с полной транслокацией геморрагического компонента из зоны фовеа;
2-я группа – 40 пациентов (40 глаз) – пациенты без наличия СМК, которым ранее не выполнялась малоинвазивная хирургия и антивазопролиферативная терапия.
В обеих группах проводилось лечение антивазопроли-феративными препаратами с тремя ежемесячными загрузочными инъекциями с последующим ведением в режиме treat and extend. В первой группе пациентов проводилась малоинвазивная хирургия СМК, которая заключалась в проведении двухпортовой 27 G хирургии без витреоэк-томии с контролируемым введением раствора рекомбинантной проурокиназы через канюлю 38 G субретинально с последующей тампонадой витреальной полости на 20% газовоздушной смесью [12]. Выполнение первой загрузочной интравитреальной инъекции анти-VEGF препарата проводилось в период с 14-го по 30-й день после проведенного витреоретинального вмешательства.
Пациентам до и после хирургического вмешательства выполнялись базовые офтальмологические обследования, включающие визометрию с определением МКОЗ, биомикроскопию, непрямую офтальмоскопию. Морфологические параметры оценивались с помощью данных оптической когерентной томографии (ОКТ): центральная толщина сетчатки (ЦТС) – расстояние между базальной и внутренней пограничной мембраной сетчатки в зоне фовеа; элевация пигментного эпителия сетчатки (ПЭС) – расстояние между базальной мембраной и внутренней поверхностью пигментного листка; целостность слоя ПЭС в пределах окружности диаметром 1500 мкм, соответствующей зоне фовеа; целостность эллипсоидной зоны фоторецепторов в зоне фовеа. Микропериметрия со стратегией тестирования 4–2 с из 68 стандартных паттернов применялась для исследования функциональных параметров. Оценка всех параметров проводилась до лечения и затем каждые 2 месяца на протяжении 1 года.
Статистическая обработка результатов осуществлялась при помощи программы IBM SPSS Statistics 23. Для определения различий между полученными результатами в различные сроки наблюдения относительно исходных значений в каждой группе применялся T–критерий Стьюдента. Различия считались статистически значимыми при р<0,05.
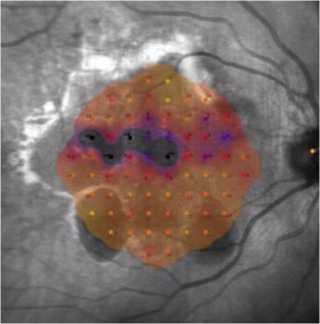
Рис. 3. Микропериметрия при субмакулярном кровоизлиянии.

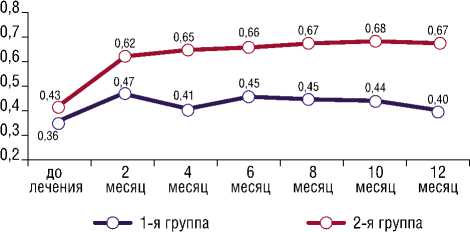
Рис. 4. Сравнительная динамика остроты зрения в течение 12 месяцев наблюдения локусов. При сравнении во 2-й группе наличие зон из 3 и более локусов только у 4% пациентов, а в большинстве случаев наблюдались только выпадения единичных участков.
25^
Q8 Q12 Q16
i i1 группа ■ ■ 2 группа
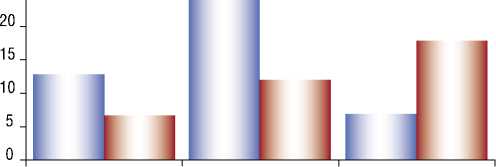
Рис. 5. Сравнение достигнутого интервала между интравитреальными инъекциями на 12-м месяце.
Результаты и обсуждение
Средние показатели МКОЗ до начала антиангиоген-ной терапии в 1-й и 2-й группах составили 0,37±0,15 и 0,47±0,12 соответственно. Последующая оценка остроты зрения проводилась через 2 месяца после первой инъекции, была продемонстрирована прибавка зрительных функций до 0,47±0,17 и 0,62±0,15 в 1-й и 2-й группе соответственно. На 4-м месяце отмечалась депрессия функциональных показателей до 0,40±0,12 в 1-й группе, что соответствует периоду увеличения межинъекционного интервала. При последующем контроле наблюдалось стабильное течение с незначительным снижением остроты зрения до 0,4±0,1 к концу первого года наблюдения. При этом результаты 2-й группы демонстрировали постепенную прибавку МКОЗ до 0,68±0,13 (p<0,05 в сравнении с показателями 1-й группы) до 12 месяцев наблюдения без резкого снижения данного показателя (Рис. 4).
При анализе данных, полученных при микропериметрии, в обеих группах продемонстрировано постепенное повышение данного показателя от исходных 17,6±4 и 21,4±3,5 до 19,1±3,2 и 25,2±4,1 (p<0,05 в сравнении с показателями 1-й группы) в 1-й и 2-й группах соответственно к концу 12 месяцев.
При анализе данных ОКТ отмечалось изменение ЦТС в обеих группах при исходном значении: в 1-й – 623,1±128,5 мкм, а во 2-й – 579,3±113,9 мкм. Продолжающаяся рецессия толщины центрального отдела сетчатки достигла показателей 298±73,9 в 1-й группе и 271±69,7 мкм (p>0,05 в сравнении с показателями 1-й группы) на 6-м месяце и затем имело стабильное течение на весь период наблюдения в обеих группах. По окончании 1 года изменения ЦТС достигли значений 294±74,7 в 1-й группе и 269±69,1 мкм (p>0,05 в сравнении с показателями 1-й группы) в 1-й и 2-й группе соответственно. У двух пациентов во 2-й группе и одного в 1-й была выявлена резистентность к вводимому анти-VEGF препарату без значительного изменения ЦТС.
Было также проанализировано среднее количество интравитреальных инъекций за год, которое составило в 1 группе 6,4 а во второй 5,7. При этом в 1-й группе отмечалось 2 случая рецидива СМК у пациентов с превышени- ем рекомендованных 14 суток начатой антиангиогенной терапии после витреоретинального вмешательства.
При обработке данных об изменении интервалов между интравитреальными инъекциями было установлено, что пациенты 1-й группы оставались на режиме q8 в 30% случаев, а в 53% и в 17% удалость увеличить промежуток до q12 и q16 соответственно. Согласно полученным результатам, во 2-й группе интервалы соответствовали: q8 – 20%; q12 – 32%; q16 – 48% случаев. На сегодняшний день имеется ряд научных работ, подтверждающих достижение наилучших морфофункциональных результатов после макулярной хирургии с полной элиминацией геморрагического компонента [3; 4]. Однако в публикациях не было проанализировано влияние ви-треоретинального вмешательства на дальнейшее течение ВМД при сохраненном стекловидном теле [12].
В данном исследовании выбор стратегии treat and extend обоснован меньшим количеством интравитреальных инъекций по сравнению с фиксированной, дающей аналогичные результаты зрительных функций, а также лучшей прибавкой МКОЗ в сравнении с режимом pro re nata [11; 13; 14]. Кроме того, наши данные подтверждают предположение о влиянии на остроту зрения прогрессирования атрофических изменений пигментного эпителия сетчатки [9; 15].
В проведенном исследовании был выполнен сравнительный анализ результатов антивазопролиферативной терапии у пациентов после успешной транслокации СМК на фоне активной ВМД. Ряд авторов в своих исследованиях достигали наилучших морфологических и функциональных результатов после макулярной хирургии с полным удалением геморрагического компонента. Используемая в ранних исследованиях малоинвазивная техника не предусматривает удаление ХНВ, что требует продолжения антиангиогенной терапии. При этом за время исследования не было выявлено значимых изменений со стороны витреомакулярного профиля.
У 1-й группы пациентов не потребовалось значительного сокращения интервалов между плановыми инъекциями. Однако меньшее количество пациентов достигают максимального интервала, а почти треть всех пациентов вынуждены получать интравитреальные вве-
дения каждые 2 месяца. По этой же причине пациентам в среднем потребовалось на 0,7 инъекции в год больше по сравнению со 2-й группой. Также отмечено снижение МКОЗ в 1-й группе на 4-м месяце, что соответствует периоду увеличения межинъекционного периода, который, вероятно, превышает сроки активации ХНВ. Исходя из этого, оптимальным является постепенное расширение интервалов не более чем на 2 недели.
Также при обработке данных пациенты 1-й группы продемонстрировали статистически значимо более низкие показатели МКОЗ. Ранее упомянутые деструктивные воздействия крови на фоторецепторы, вероятно, играют ключевую роль в ограничении дальнейшего роста зрительных функций. Немаловажно, что пациенты обеих групп имели схожие показатели ЦТС, однако этот показатель не коррелировал с конечной МКОЗ.
Хочется отметить, что успешная хирургия без ви-треоэктомии по поводу СМК позволяет придерживаться стандартизированной стратегии лечения больных с активной формой ВМД.
Заключение
Сохранение стекловидного тела во время витреоре-тинального вмешательства позволяет придерживаться режима treat and extend без уменьшения межинъекционного интервала. Это напрямую влияет на положительный комплаенс между пациентом и врачом и повышает приверженность к терапии. Соблюдение принципов проактивного ведения антиангиогенной терапии и регулярного мониторинга позволяет добиться улучшения морфофункциональных результатов после витреоретинального вмешательства. Несмотря на различия между группами, пациенты после макулярной хирургии могут получать лечение в стандартном режиме без значимых осложнений.
Список литературы Особенности антивазопролиферативной терапии после субмакулярной хирургии с сохранением стекловидного тела
- Wong W.L., Su X., Li X., Cheung C.M., Klein R., Cheng C.Y., Wong T.Y. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: a systematic review and meta-analysis. Lancet Glob Health. 2014;2(2):e106-e116. [URL].
- Файзрахманов Р.Р., Шишкин М.М., Босов Э.Д., Суханова А.В., Миронов А.В. Патоморфология субмакулярного кровоизлияния (обзор) // Саратовский научно-медицинский журнал 2021. Т. 17 (1). С. 28-32.
- Овчинникова А.Д., Миронов А.В., Дулгиеру Т.О. Хирургическое лечение массивных субмакулярных кровоизлияний при влажной форме возрастной макулодистрофии с автоматизированной субретинальной инъекцией. Офтальмохирургия. 2020;4:43–49. [URL].
- Файзрахманов Р.Р., Босов Э.Д., Шишкин М.М., Суханова А.В. Изменение морфофункциональных показателей сетчатки при хирургии субмакулярных кровоизлияний // Саратовский научно-медицинский журнал. 2021;17(2):388-392. [URL].
- Stanescu-Segall D., Balta F., Jackson T.L. Submacular hemorrhage in neovascular age-related macular degeneration: A synthesis of the literature. Surv Ophthalmol. 2016;61(1):18-32. [URL].
- Kim J.H., Kim C.G., Lee D.W. Intravitreal aflibercept for submacular hemorrhage secondary to neovascular age-related macular degeneration and polypoidal choroidal vasculopathy. Graefes Arch Clin Exp Ophthalmol. 2020;258(1): 107-116. [URL].
- Охоцимская Т.Д., Зайцева О.В. Афлиберцепт в результате последствий сетчатки. Обзор научных исследований. Российский офтальмологический журнал. 2017:10(2): 103-111. [URL].
- Haritoglou C., Boneva S., Schultheiss M., Sebag J., Binder S. Vitreoretinale Chirurgie bei altersabhangiger Makuladegeneration. Die Ophthalmologie. 2023;120(10): 1004-1013. [URL].
- Treumer F., Wienand S., Purtskhvanidze K., Roider J., Hillenkamp J. The role of pigment epithelial detachment in AMD with submacular hemorrhage treated with vitrectomy and subretinal co-application of rtPA and anti-VEGF. Graefes Arch Clin Exp Ophthalmol. 2017;255(6): 1115-1123. [URL].
- Matsunaga D.R., Su D., Sioufi K., Obeid A., Wibbelsman T., Ho A.C., Regillo C.D. The Timing of Large Submacular Hemorrhage Secondary to Age-Related Macular Degeneration Relative to Anti-VEGF Therapy // Ophthalmol. Retina. 2021;5(4): 342-347. [URL].
- Okada M., Kandasamy R., Chong E.W., McGuiness M., Guymer R.H. The Treat-and-Extend Injection Regimen Versus Alternate Dosing Strategies in Age-related Macular Degeneration: A Systematic Review and Meta-analysis. Am. J. Ophthalmol. 2018;192: 184-197. [URL].
- Edington M., Connolly J., Chong N.V. Pharmacokinetics of intravitreal anti-VEGF drugs in vitrectomized versus non-vitrectomized eyes. Expert Opin Drug Metab Toxicol. 2017:13(12): 1217-1224. [URL].
- Файзрахманов Р.Р., Босов Э.Д., Карпов Г.О., Богданова В.А. Способ малоинвазивной коррекции субмакулярных кровоизлияний // Патент No 2788357 C1 Российская Федерация, МПК A61B 17/00, A61F 9/007. No 2022111518: заявл. 27.04.2022: опубл. 17.01.2023 / заявитель Федеральное государственное бюджетное учреждение “Национальный медико- хирургический Центр имени Н.И. Пирогова” Министерства здравоохранения Российской Федерации.
- Босов Э.Д., Файзрахманов Р.Р., Карпов Г.О., Калинин М.Е., Миронов А.В. Морфофункциональная результативность оперативного лечения субретинальных геморрагий. Современные технологии в офтальмологии. 2022;1(41): 23-27. [URL].
- Файзрахманов Р.Р., Босов Э.Д., Богданова В.А., Ваганова Е.Е., Сехина О.Л. Морфофункциональные особенности пигментного эпителия сетчатки в норме и при возрастной макулярной дегенерации. Офтальмохирургия. 2023;3:106-111. [URL].


