Особенности деструкции дизельного топлива штаммом Rhodococcus sp. NDT23 в условиях повышенной солености
Автор: Назаров А.В., Пьянкова А.А., Корсакова Е.С.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2023 года.
Бесплатный доступ
Исследован процесс биодеструкции дизельного топлива (ДТ) в условиях повышенной солености среды с помощью галотолерантного штамма Rhodococcus sp. NDT23, выделенного из загрязненного ДТ образца почвы, отобранной на расстоянии 3 м от солеотвала предприятия ПАО «Уралкалий» (г. Соликамск, Пермский край, Россия). На основе анализа гена 16S рРНК показано, что штамм NDT23 филогенетически близок Rhodococcus fascians DSM 20669T и Rhodococcus cercidiphylli YIM 65003T (сходство 100%). Установлено наличие у штамма NDT23 гена алкан-1-монооксигеназы (alkB), имеющего наибольшее сходство (99.10-100%) с alkB-генами родококков, выделенных из почвы и тканей растений. Выявлено положительное влияние NaCl в концентрации 50 г/л на биодеструкцию длинноцепочечных (С14-С20) углеводородов в составе ДТ, обусловленное увеличением гидрофобности клеточной стенки родококков.
Дизельное топливо, деструкция, rhodococcus, хлорид натрия, засоление
Короткий адрес: https://sciup.org/147241924
IDR: 147241924 | УДК: 579.26: | DOI: 10.17072/1994-9952-2023-3-242-249
Текст научной статьи Особенности деструкции дизельного топлива штаммом Rhodococcus sp. NDT23 в условиях повышенной солености
В настоящее время нефтепродукты являются наиболее распространенными и опасными загрязнителями окружающей среды. Одним из перспективных биотехнологических направлений очистки окружающей среды от органических загрязнителей является биодеструкция с помощью микроорганизмов [Abatenh et al., 2017; Xu et al., 2018; Tarfeen et al., 2022]. Для разработки методов очистки загрязненных природных объектов большое значение имеют исследования деструкции нефтепродуктов микроорганизмами. В ряде случаев эффективность данного метода ограничивается экстремальными условиями среды, в частности высоким засолением [Abed, Al-Kharusi, Al-Hinai, 2015; Edbeib, Wahab, Huyop, 2016; Khalid et al., 2021]. Актинобактерии рода Rhodococcus характеризуются способностью к биодеградации самых разнообразных углеводородов, а также устойчивостью к экстремальным условиям среды, что обусловливает их потенциал в использовании в качестве биопрепаратов для очистки загрязненной среды от нефтепродуктов [Brzeszcz, Kaszycki, 2018]. Особенностью нефтепродуктов как загрязнителей является сложный состав. Так, в дизельном топливе (ДТ) обнаружены тысячи соединений с числом атомов углерода от 8–12 до 25–27, преимущественно – насыщенные углеводороды. Влияние засоления на биодеградацию ДТ, в том числе отдельных углеводородных фракций представителями рода Rhodococcus изучено недостаточно [Brzeszcz, Kaszycki, 2018].
Цель работы – исследование особенностей деструкции дизельного топлива галотолерантным штаммом Rhodococcus sp. NDT23 в условиях повышенной солености.
Материалы и методы
В качестве объекта исследования использовали штамм Rhodococcus sp. NDT23 из коллекции лаборатории микробиологии техногенных экосистем «ИЭГМ УрО РАН», выделенный из загрязненной ДТ дерново-подзолистой почвы с техногенным хлоридно-сульфатным натриево-кальциевым засолением. Образец почвы был отобран на расстоянии 3 м от солеотвала (г. Соликамск, Пермский край, Россия). Координаты участка отбора проб: широта 59°38′00.1′′, долгота 056°45′13.2′′. Концентрация ДТ в почве составляла 5.7%, pH – 7.6, содержание водорастворимых солей – 1.3%.
Для культивирования бактерий использовали минеральную среду Раймонда (МСР) следующего состава (г/л): NH 4 NO 3 - 2.0, MgSO 4 х 7H 2 O - 0.2, K 2 HPO 4 - 2.0, Na 2 HPO 4 - 3.0, CaCh х 6H 2 O - 0.01, Na 2 CO 3 - 0.1, дополненную 1% раствором MnSO4 х 2H 2 O - 2 мл/л и 1% раствором FeSO 4 х 7H 2 O - 1 мл/л среды [Raymond, 1961]. Для приготовления богатой среды Раймонда (БСР) в МСР добавляли 5 г/л триптона («VWR Life Science Amresco», США) и 2.5 г/л дрожжевого экстракта («Biospringer», Франция) в качестве ростовых субстратов. Для приготовления плотной среды вносили агар («Helicon», Россия) до конечной концентрации 15 г/л.
Морфологические и физиологические признаки бактерий определяли при выращивании на агаризо-ванной БСР с добавлением 30 г/л NaCl. Культивирование проводили в термостате при температуре 28°С. Характеристики роста штамма при разных значениях pH определяли при концентрации 30 г/л NaCl в буферных системах, приготовленных на основе БСР. Штаммы культивировали на агаризованной среде БСР при рН 5.0, 6.0, 7.0, 8.0, 9.0, 10.0. Для оценки роста при разных температурах штамм культивировали в диапазоне температур от 4 до 40 °С. Рост учитывали на седьмой день культивирования. [Методы …, 1983].
Рост бактерий на МСР с ДТ оценивали при культивировании в жидких средах без добавления NaCl и с содержанием 30, 50, 70, 100 г/л NaCl. ДТ вносили в МСР до конечной концентрации 1 г/л. Инокулятом служила культура, выращенная при 28°С на агаризованной БСР с 30 г/л NaCl. Биомассу бактерий ресус-пендировали в МСР, содержащей 30 г/л NaCl. Полученную суспензию бактериальных клеток (ОП 600 =1.0) добавляли в 100 мл среды в количестве 1% об./об.
Для оценки роста штамма на БСР без добавления NaCl и с содержанием 30, 50, 70, 100 г/л NaCl инокулят культуры готовили как описано выше.
Культивирование штамма осуществляли в колбах объемом 250 мл на термостатируемом шейкере Environmental Shaker Incubator ES-20/60 («BioSan», Латвия) при температуре 28°С и скорости вращения
140 об/мин. Рост бактериальных клеток оценивали при определении оптической плотности культуральной жидкости (ОП 600 ) на спектрофотометре UV-Visible BioSpec-mini («Shimadzu», Япония) при длине волны 600 нм в кювете с длиной оптического пути 1 см. Удельную скорость роста (μ, ч-1) рассчитывали по стандартной формуле
μ = (lnB2 – lnB1)/(t2 – t1), где В1 и В2 – оптические плотности культуры в моменты времени t1 и t2, соответственно [Нетрусов, 2005].
Через 14 сут. культивирования бактерий в МСР измеряли остаточную концентрацию ДТ в среде в хлороформенных экстрактах на газовом хроматографе Agilent 7890B («Agilent», США) с трехквадрупольным масс-спектрометром Agilent 7010B («Agilent», США) и кварцевой колонкой RESTEK RTx-5MS («Restek » , США). В качестве газа-носителя использовали гелий, скорость потока составляла 1 мл/мин, температура испарителя 260°С. Программирование подъема температуры от 130°С (3-минутная экспозиция), нагрев до 280°С со скоростью 10°С/мин. Анализ хроматограмм проводили с помощью программы MSD Productivity ChemStation («Agilent » , США). Содержание углеводородов оценивали по площадям пиков в сравнении с площадью пиков контрольного образца ДТ, а также хлороформенных растворов индивидуальных углеводородов.
Гидрофобность клеточной поверхности (Н, %) определяли с использованием МATH-теста [Rosenberg, 1984; Maneerat, Dikit, 2007].
Для амплификации гена alkB, кодирующего алкан-1-монооксигеназу, использовали вырожденные праймеры TS2S и Deg1RE [Smits et al., 1999]. В качестве положительного контроля использовали ДНК штамма Rhodococcus wratislaviensis КТ112-7, в геноме которого содержится alkB (GenBank CP072193). Амплификацию осуществляли на приборе C1000 TouchTM Thermal Cycler («Bio-Rad Laboratories», США) согласно условиям [Smits et al., 1999]. Определение нуклеотидной последовательности гена alkB проводили с использованием набора реактивов Big Dye Terminator Cycle Sequencing Kit v. 3.1 («Applied Biosystems», США) на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystems», США) согласно рекомендациям производителя. Анализ нуклеотидной последовательности осуществляли с применением программ Sequence Scanner v 2.0 и MEGA 6.0 . Поиск гомологичных последовательностей проводили в международной базе данных GenBank .
Статистическую обработку данных проводили с помощью программы Statistica 6.0.
Результаты и их обсуждение
Штамм NDT23 при культивировании на агаризованной БСР формировал округлые колонии оранжевого цвета диаметром 2–4 мм с ровным краем, гладкой поверхностью, выпуклым профилем, блестящей поверхностью, однородной структурой и мягкой консистенцией. Клетки штамма грамположительные, каталазо-положительные, оксидазо-отрицательные, имеют цикл развития «палочки-кокки». Исследуемый штамм рос при температуре 4–37°С, pH 5.0–9.0. На основе анализа фрагмента гена 16S рРНК (937 п.н.) установлено, что штамм NDT23 проявлял сходство на уровне 100% со штаммами Rhodococcus fascians DSM 20669T и Rhodococcus cercidiphylli YIM 65003T. Нуклеотидная последовательность гена 16S рРНК штамма NDT23 депонирована в базе данных GenBank под номером ON527782.
Как видно из данных, приведенных в табл. 1, штамм NDT23 способен к росту в жидкой МСР с ДТ в качестве единственного источника углерода и энергии.
Таблица 1
Параметры роста клеток Rhodococcus sp. NDT23 в БСР и МСР с дизельным топливом при различных концентрациях хлорида натрия
[Growth parameters of the Rhodococcus sp. strain NDT23 in NRM and MRM with diesel fuel at different concentrations of sodium chloride]
|
Параметры роста |
Рост штамма в БСР |
Рост штамма в МСР с ДТ (1 г/л) |
||||||
|
Концентрация NaCl, г/л |
||||||||
|
0 |
30 |
50 |
70 |
0 |
30 |
50 |
70 |
|
|
Удельная скорость роста (ч-1) |
0.052 ±0.002 |
0.058 ±0.003 |
0.047 ±0.002 |
0.019 ±0.002 |
0.030 ±0.004 |
0.017 ±0.003 |
0.007 ±0.002 |
0.003 ±0.001 |
|
Максимальное значение ОП 600 |
2.03 |
2.1 |
2.17 |
2.04 |
0.98 |
1.08 |
0.92 |
0.69 |
|
Лаг-фаза роста (ч) |
48 |
48 |
72 |
100 |
46 |
46 |
96 |
263 |
Амплификация гена алкан-1-монооксигеназы (alkB), ключевого фермента аэробной деградации н-алканов (компонентов ДТ), с использованием вырожденных праймеров TS2S и Deg1RE [Smits et al., 1999] приводила к наработке ПЦР-продукта ожидаемого размера (около 550 п.н.). Сравнительный анализ последовательности гена alkB штамма Rhodococcus sp. NDT23 с гомологичными последовательностями из базы данных GenBank показал наибольшее (99.10–100%) сходство с alkB-генами штаммов рода Rhodococcus, выделенных из почвы и тканей растений (рис. 1).
NDT23
Rhodococcusjascians 2D82 (AKP07081)
— Rhodococcus sp.Mt6 (QIM55905)
Rhodococcus sp.PBTS2 (AMY23505)
некупьтивируемый клон P29-3O_C1.1 l_HRB0-5m-200S (CCO96087)
__I Rhodococcusfascians JCM 10002т (AHA51157)
65 Rhodococcusfascians DISS (AMY52517)
----------------некупьтивируемый клон 13232191491 (AGQ21093)
Rhodococcusjasciarcs A25f (QII07998)
I— Rhodococcus sp. B7740 (AJW40969)
Rhodococcus sp. 3.3-VPr (AEH76915)
--------------------------------------Rhodococcus sp. 11/16a (ABD36389)
86 ' Rhodococcus cercidiphyihDSM 45141T (AIA96567)
0.01
Рис. 1. Положение alkB -гена Rhodococcus sp. NDT23 на филогенетическом дереве, построенном на основании сравнительного анализа транслированных аминокислотных последовательностей alkB -генов с использованием метода «neighbor-joining». Эволюционные расстояния рассчитаны с использованием метода «p-distance».
Цифрами показана статистическая достоверность порядка ветвления, установленная с помощью «bootstrap»-анализа 1 000 альтернативных деревьев (приведены значения выше 50%). Масштаб соответствует 1 аминокислотной замене на каждые 100 аминокислот. В скобках указаны номера в базе данных GenBank
[The position of the alkB gene of Rhodococcus sp. NDT23 on a phylogenetic tree constructed based on a comparative analysis of the translated amino acid sequences of the alkB genes using the “neighbor-joining” method. The evolutionary distances were computed using the “p-distance” method.
The numbers show the statistical significance of the branching order, established using a “bootstrap” test of 1000 alternative trees (values above 50% are given). The scale corresponds to 1 amino acid substitution for every 100 amino acids. Numbers in the GenBank database are given in parentheses]
Штамм NDT23 при культивировании в БСР и МСР способен расти как без NaCl, так и при концентрации соли до 70 г/л (рис. 2A, B). Наибольший рост культуры отмечен в БСР и МСР с ДТ без добавления хлорида натрия и при 30 г/л NaCl. Дальнейшее увеличение концентрации NaCl в обеих средах приводило к замедлению роста культуры. Однако в случае использования среды БСР повышение солености оказывало меньшее негативное воздействие на рост бактериальных клеток, чем в МСР с ДТ (см. табл. 1). Так, если при концентрации NaCl 70 г/л в БСР удельная скорость роста снижалась в 2.7 раза, максимальная ОП 600 не изменялась, лаг-фаза роста увеличивалась в 2.1 раза относительно роста штамма в БСР без NaCl, то при росте штамма NDT23 в среде МСР с ДТ при содержании NaCl 70 г/л удельная скорость роста уменьшалась в 10.0 раз, максимальная ОП 600 – в 1.4 раза, а продолжительность лаг-фазы роста культуры увеличивалась в 5.7 раза.
При культивировании Rhodococcus sp. NDT23 на среде с добавлением 30 и 70 г/л NaCl отличия в скорости деструкции ДТ в сравнении с вариантом опыта без добавления NaCl, не обнаружены, в то же время в присутствии 50 г/л NaCl в среде убыль углеводородов ДТ увеличивалась в 1.4 раза (рис. 3A). Наименьший (в 3.1 раза ниже в сравнении с культивированием штамма NDT23 в среде без NaCl) уровень утилизации углеводородов ДТ выявлен при содержании NaCl в среде 100 г/л, при этом рост бактериальной культуры не обнаруживался (рис. 2B).
Положительное влияние в среде NaCl в количестве 50 г/л на деструкцию ДТ проявлялось вследствие увеличения уровня разложения длинноцепочечных (С 14 –С 20 ) углеводородов, содержание которых в среде снижалось в 1.2–2.5 раза относительно контрольного варианта без добавления NaCl (табл. 2). В то же время положительный эффект повышенной солености среды на биодеградацию короткоцепочечных (С 9 – С 13 ) углеводородов не выявлен (табл. 2). Ранее [de Carvalho, 2012] при исследовании деструкции индивидуальных насыщенных (C 12 –C 16 ) углеводородов клетками Rhodococcus erythropolis было показано положительное воздействие NaCl в концентрациях до 5% на биодеградацию длинноцепочечных (C 12 –C 16 ) н -алканов при отсутствии аналогичного влияния NaCl в данных концентрациях на биодеструкцию короткоцепочечных (C 6 –C 11 ) н -алканов. Выявленную закономерность авторы связывали с повышением гидрофобности поверхности бактериальных клеток.
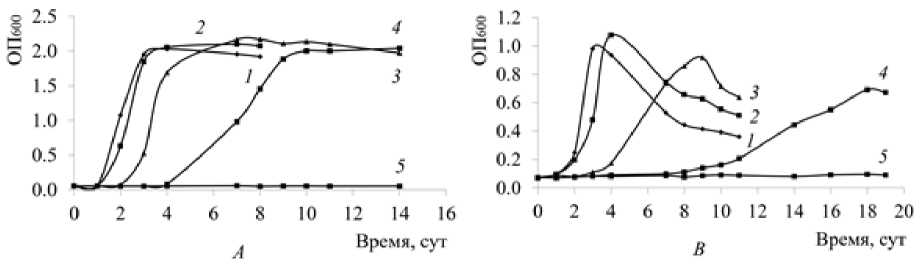
Рис. 2. Рост клеток Rhodococcus sp. NDT23 в питательной среде БСР ( А ) и МСР ( В ) с дизельным топливом (1 г/л) при различных концентрациях NaCl (г/л):
1 – 0; 2 – 30; 3 – 50; 4 – 70; 5 – 100
[Growth of the Rhodococcus sp. strain. NDT23 in NRM ( A ) and MRM ( B ) with diesel fuel (1 g/L) at different NaCl concentrations (g/L):
1 – 0; 2 – 30; 3 – 50; 4 – 70; 5 – 100]
Таблица 2
Остаточное содержание (% от начальной концентрации) углеводородов ДТ после 14 сут. роста клеток Rhodococcus sp. NDT23
[Residual content (% of the initial concentration) of DF hydrocarbons after 14 days of cultivation of the Rhodo-coccus sp. strain NDT23]
|
Концентрация NaCl в среде, г/л |
Количество атомов углерода в углеводороде |
|||||
|
9 |
10 |
11 |
12 |
13 |
14 |
|
|
0 |
13.0±4.5 |
17.1±4.7 |
32.3±3.0 |
38.8±3.3 |
65.2±5.9 |
75.4±4.9 |
|
30 |
10.3±1.8 |
17.4±4.6 |
33.5±3.0 |
41.8±2.1 |
54.8±5.1 |
70.5±5.4 |
|
50 |
14.5±2.2 |
20.4±2.3 |
33.4±4.6 |
31.4±4.4 |
52.8±6.5 |
65.5±5.9 |
|
70 |
11.4±2.6 |
26.0±3.1 |
16.7±3.9 |
66.6±3.3 |
61.0±4.9 |
63.1±4.6 |
|
100 |
63.7±8.1 |
59.1±5.2 |
80.1±8.7 |
93.6±11.6 |
94.7±16.3 |
95.1±10.2 |
|
Концентрация |
Количество атомов углерода в углеводороде |
|||||
|
NaCl в среде, г/л |
15 |
16 |
17 |
18 |
19 |
20 |
|
0 |
76.7±5.8 |
80.1±6.9 |
108.7±8.6 |
101.5±8.6 |
106.9±12.6 |
93.2±7.8 |
|
30 |
56.8±3.6 |
67.9±9.8 |
63.2±6.7 |
60.7±8.2 |
58.3±9.2 |
64.5±11.5 |
|
50 |
42.8±5.2 |
43.8±4.2 |
44.5±4.1 |
43.6±5.3 |
43.2±3.2 |
41.6±3.2 |
|
70 |
57.7±7.0 |
57.3±4.2 |
67.4±5.0 |
67.9±6.6 |
52.8±4.9 |
42.1±6.9 |
|
100 |
98.0±9.4 |
94.0±9.5 |
98.5±8.2 |
97.3±7.2 |
94.9±9.8 |
91.6±5.3 |
Как видно из рис. 3В, с повышением концентрации NaCl в средах БСР и МСР, содержащих ДТ, происходило увеличение гидрофобности поверхности клеток Rhodococcus sp. NDT23. Так, гидрофобность бактериальных клеток при культивировании в среде БСР, содержащей 50 и 70 г/л NaCl, увеличивалась в 1.7 и 1.9 раза в сравнении с таковой клеток, выращенных без добавления NaCl. Аналогичное повышение (в 1.3 и 1.6 раза) гидрофобности клеток Rhodococcus sp. NDT23 отмечено при культивировании их в среде МСР, содержащей 50 и 70 г/л NaCl, соответственно.
Согласно немногочисленным литературным данным, бактерии характеризуются различными изменениями степени гидрофобности клеточной поверхности под действием засоления. Снижение гидрофобности клеток в условиях засоления выявлено у Halomonas elongata [Hart, Vreeland, 1988], Erythrobacter sp . [Longang, Buck, Kirkwood, 2016], Exiguobacterium sp. [Cao et al., 2020], а увеличение – у представителей рода Rhodococcus [Рубцова, Куюкина, Ившина, 2012; Longang, Buck, Kirkwood, 2016] и у почвенных ак-тиномицетов [Zahir et al., 2016]. При этом гидрофобность клеточной поверхности галотолерантных штаммов родококков возрастала с увеличением концентрации NaCl в среде, тогда как гидрофобность клеток Rhodococcus spp., не устойчивых к повышенной солености среды, снижалась или не изменялась [Рубцова, Куюкина, Ившина, 2012].
Известно, что степень гидрофобности клеточной стенки играет важную роль в адсорбции микроорганизмами углеводородов и их поглощении, поэтому рост в присутствии углеводородных субстратов сопровождается повышением гидрофобности клеток у многих актинобактерий, в том числе представителей Dietzia и Rhodococcus [Bredholt et al., 2002; de Carvalho et al., 2007; Hvidstena et al., 2015]. В нашем случае, увеличение гидрофобности клеточной поверхности Rhodococcus sp. NDT23 при концентрации 50 г/л NaCl в среде (рис. 3А) способствовало повышению скорости биодеградации длинноцепочечных алканов
(C 14 –C 20 ) в составе ДТ, которые имеют большую гидрофобность, чем короткоцепочечные углеводороды (С 9 –С 13 ) (табл. 2).
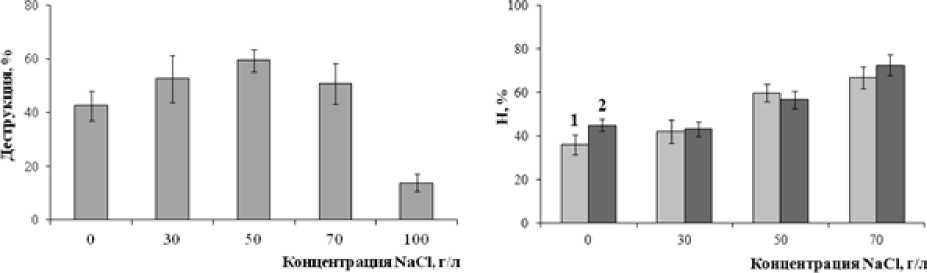
-
4 В
Рис. 3. Влияние различных концентраций NaCl на деструкцию ДТ ( А ) и гидрофобность клеточной поверхности (H, %) Rhodococcus sp. NDT23 ( В ) при росте на среде БСР (1) и МСР (2) с добавлением ДТ (1 г/л) через 14 сут. культивирования
[The influence of different concentrations of NaCl on the destruction of DF ( A ) and cell surface hydrophobicity (H, %) of Rhodococcus sp. NDT23 ( B ) on NRM (1) and MRM (2) with diesel fuel (1 g/L) after 14 days of cultivation ]
Уменьшение скорости биодеструкции ДТ при дальнейшем повышении содержания NaCl в среде до 70 и 100 г/л, очевидно, обусловлено снижением скорости роста и накопления биомассы Rhodococcus sp. NDT23 (рис. 2В). Таким образом, в нашей работе показано, что повышенная соленость среды влияет на процесс деструкции родококками углеводородов (C 9 –C 20 ) в составе ДТ аналогично биодеградации индивидуальных углеводородов (C 6 –C 16 ) клетками R. erythropolis [de Carvalho, 2012]. Подтверждено предположение о положительном влиянии солености среды на биодеструкцию углеводородов вследствие повышения гидрофобности клеточной поверхности Rhodococcus [de Carvalho, 2012]. Противоположная ситуация отмечена в работе [Cao et al., 2020], в которой при увеличении солености среды происходило снижение гидрофобности клеточной поверхности Exiguobacterium sp. N4–1P, что приводило к уменьшению скорости бактериальной деструкции длинноцепочечных алканов, однако, при этом повышалась степень деградация более водорастворимого нафталина.
Заключение
Таким образом, исследованный нами штамм Rhodococcus sp. NDT23 способен к эффективному росту на среде с ДТ в присутствии NaCl до 70 г/л и деградации углеводородов ДТ при концентрациях NaCl до 100 г/л. Показано, что с увеличением концентрации NaCl в среде возрастает гидрофобность клеточной поверхности штамма NDT23, что, в свою очередь, приводит к увеличению деструкции ДТ при содержании в среде NaCl в количестве 50 г/л. При этом наличие NaCl в среде в большей степени увеличивало разложение штаммом Rhodococcus sp. NDT23 длинноцепочечных углеводородов (С 14 –С 20 ), чем короткоцепочечных (С 9 –С 13 ). Штамм Rhodococcus sp. NDT23 может быть использован для разработки биотехнологических методов очистки засоленных экосистем, загрязненных ДТ.
Список литературы Особенности деструкции дизельного топлива штаммом Rhodococcus sp. NDT23 в условиях повышенной солености
- Методы общей бактериологии: пер. с англ. / под ред. Ф. Герхардта с соавт. М.: Мир, 1983. Т. 1–3.
- Нетрусов А.И. Практикум по микробиологии. М.: Академия, 2005. 608 с.
- Рубцова Е.В., Куюкина М.С., Ившина И.Б. Влияние условий культивирования на адгезивную активность родококков к н-гексадекану // Прикладная биохимия и микробиология. 2012. Т. 48, № 5. С. 501‒509.
- Abatenh E. et al. Application of microorganisms in bioremediation-review // J. Env. Microbiol. 2017. Vol. 1(1). P. 2–9.
- Abed R.M.M., Al-Kharusi S., Al-Hinai M. Effect of biostimulation, temperature and salinity on respiration activities and bacterial community composition in an oil polluted desert soil // Int. Biodeter. Biodegr. 2015. Vol. 98. P. 43–52.
- Bredholt H. et al. Hydrophobicity development, alkane oxidation, and crude-oil emulsification in a Rhodo-coccus species // Can. J. Microbiol. 2002. Vol. 48(2). P. 295–304.
- Brzeszcz J., Kaszycki P. Aerobic bacteria degrading both n-alkanes and aromatic hydrocarbons: an under-valued strategy for metabolic diversity and flexibility // Biodegrad. 2018. Vol. 29(4). P. 359–407.
- Cao Y. et al. Microbial eco-physiological strategies for salinity-mediated crude oil biodegradation // Sci. Total. Environ. 2020. Vol. 727. P. 1–7.
- de Carvalho C.C.C.R. Adaptation of Rhodococcus erythropolis cells for growth and bioremediation under extreme conditions // Res. Microbiol. 2012. Vol. 163. P. 125–136.
- de Carvalho C.C.C.R. et al. Adaptation of Rhodococcus erythropolis cells to high concentrations of tolu-ene // Appl. Microbiol. Biotechnol. 2007. Vol. 76. P. 1423–1430.
- Edbeib M.F., Wahab R.A., Huyop F. Halophiles: biology, adaptation, and their role in decontamination of hypersaline environments // World J. Microbiol. Biotechnol. 2016. Vol. 32(8). P. 1–23.
- Gharibzahedi S.M.T., Razavi S.H., Mousavi M. Potential applications and emerging trends of species of the genus Dietzia: a review // Ann. Microbiol. 2014. Vol. 64. P. 421–429.
- Hart D.J., Vreeland R.H. Changes in the hydrophobic-hydrophilic cell surface character of Halomonas elongata in response to NaCl // J. Bacteriol. 1988. Vol. 170. P. 132–135.
- Hvidsten I. et al. Fatty acids in bacterium Dietzia sp: grown on simple and complex hydrocarbons deter-mined as FAME by GC-MS // Chem. Phys. Lipids. 2015. Vol. 190. P. 15–26.
- Khalid F.E. et al. Bioremediation of diesel contaminated marine water by bacteria: a review and biblio-metric analysis // J. Mar. Sci. Eng. 2021. Vol. 9(2). P. 1–19.
- Longang A., Buck C., Kirkwood K.M. Halotolerance and effect of salt on hydrophobicity in hydrocar-bon-degrading bacteria // Environ. Technol. 2016. Vol. 37(9). P. 1133–1140.
- Maneerat S., Dikit P. Characterization of cell-associated bioemulsifier from Myroides sp. SM1, a marine bacterium // Songklanakarin J. Sci. Technol. 2007. Vol. 29(3). P. 769–779.
- Rosenberg M. Bacterial adherence to hydrocarbons: a useful technique for studying cell surface hydro-phobicity // FEMS Microbiol. Lett. 1984. Vol. 22. P. 289–295.
- Smits T.H.M. et al. Molecular screening for alkane hydroxylase genes in gram-negative and gram-positive strains // Environmental Microbiology. 1999. Vol. 1(4). P. 307–317.
- Tarfeen N. et al. Microbial remediation: a promising tool for reclamation of contaminated sites with spe-cial emphasis on heavy metal and pesticide pollution: a review // Proces. 2022. Vol. 10. P. 1–27.
- Xu X. et al. Petroleum hydrocarbon-degrading bacteria for the remediation of oil pollution under aerobic conditions: a perspective analysis // Front. Microbiol. 2018. Vol. 9. P. 1–11.
- Zahir H. et al. Effect of salinity on the adhesive power actinomycetes in soil // J. Mater. Environ Sci. 2016. Vol. 7(9). P. 3327–3333.


