Особенности гравидарной трансформации эндометрия при привычном невынашивании беременности
Автор: Траль Татьяна Георгиевна, Хобец Владислав Владимирович, Толибова Гулрухсор Хайбуллоевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.30, 2022 года.
Бесплатный доступ
Проблемы патоморфологической диагностики привычного невынашивания беременности являются актуальными в современной репродуктивной медицине. Один из важных маркеров гравидарного эндометрия - прогестерон-индуцированный блокирующий фактор, индуцируемый прогестероном под влиянием активированных лимфоцитов и оказывающий иммуномодулирующее влияние на имплантационные характеристики эндометрия. В процессе инвазии трофобласта особая роль принадлежит также молекулам стромального клеточного фактора, синтезируемому клетками эндометрия и трофобласта, как механизму, потенцирующему восприимчивость эндометрия к наступлению и развитию беременности, инвазии трофобласта и эмбриогенеза в целом. Цель исследования - изучение гистологических и иммуногистохимических особенностей гравидарной трансформации эндометрия при привычном невынашивании беременности. Исследовано 100 образцов гравидарного эндометрия при неразвивающейся беременности на сроке развития 5-8 недель, 85 образцов при привычном невынашивании беременности и 15 образцов при беременности, прерванной по желанию женщины хирургическим путем. Наличие 2 неразвивающихся беременностей верифицировано в 57 случаях (67,1%), наличие 3 неразвивающихся беременности в 28 случаях (32,9%). Выполнено гистологическое исследование абортного материала с окраской гематоксилином и эозином для верификации гравидарной трансформации эндометрия. Иммуногистохимическое исследование включало выявление рецепторов к эстрогену, и прогестерону, стромальному клеточному фактору (SDF1), прогестерон-индуцированному блокирующему фактору (PIBF). Результаты гистологического и иммуногистохимического исследования показали, что при полноценной гравидарной трансформации эндометрия в группе пациенток с привычным невынашиванием беременности отмечается нарушение рецепторного профиля. Снижение экспрессии PIBF в железах и стромальном компоненте и экспрессии SDF1 в железах компактного слоя эндометрия является отражением иммунологического дисбаланса в гравидарном эндометрии при привычном невынашивании. Разработка единого морфологического алгоритма с учетом базовых показателей процессов гравидарной трансформации эндометрия с оценкой его рецепторного профиля и диагностически значимых иммунологических факторов позволяет верифицировать патологию эндометрия на молекулярном уровне и обосновать необходимость проведения прегравидарной подготовки с использованием патогенетически обоснованной терапии.
Гравидарный эндометрий, привычное невынашивание беременности, прогестерон-индуцированный блокирующий фактор pibf, стромальный клеточный фактор sdf-1
Короткий адрес: https://sciup.org/143179726
IDR: 143179726 | DOI: 10.20340/mv-mn.2022.30(4).713
Текст научной статьи Особенности гравидарной трансформации эндометрия при привычном невынашивании беременности
Траль Т.Г., Хобец В.В., Толибова Г.Х. Особенности гравидарной трансформации эндометрия при привычном невынашивании беременности. Морфологические ведомости. 2022;30(4):713. (4).713
Tral' TG, Khobets VV, Tolibova GKh. Morphological features of the endometrium transformation in recurrent miscarriage. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(4):713. (4).713
Введение. Потеря желанной беременности является основным проявлением неблагоприятных репродуктивных исходов и длительно существующей актуальной проблемой гинекологии в современном мире [1-3]. Известно, что причинами привычного невынашивания беременности являются генетические, эндокринные, иммунологические и инфекционные факторы, а также сочетание нескольких факторов между собой [4-11] и у пациенток с привычным невынашиванием беременность наиболее часто прерывается путем перехода в неразвивающуюся беременность [12-13]. Однако у части пациенток причины невынашивания беременности вывить не удается, при этом около половины пациенток с невынашиванием беременности имеют не отягощенный гинекологический и соматический анамнез [1416]. Ключевыми факторами наступления и развития беременности является полноценная циклическая трансформация эндометрия, а именно - секреторная трансформация эндометрия необходимая для наступления и развития беременности при непосредственной синхронизации взаимодействия рецепторов к эстрогенам и прогестерону [17-18]. Показано, что при гистологическом исследовании в эндометрии женщин с привычным невынашиванием верифицируется нарушение секреторной трансформации и неполноценная децидуализация, у 22,5% женщин определяется нарушение гравидарной трансформации [19-21]. Если роль рецепторного профиля эндометрия в норме и патологии более или менее изучена с использованием иммуногистохимического анализа и внедрена, как показатель, в клиническую практику, то роль иммунологического фактора в генезе репродуктивных потерь остается не до конца ясной. Следует отметить, что важная роль для процессов имплантации эмбриона, роста, дифференцировки трофобласта и гравидарной трансформации эндометрия отводится паракринной регуляции с участием цитокинов и хемокинов,
Article received 07 May 2022
Article accepted 13 December 2022 обладающих модулирующим влиянием на общие и локальные иммунные процессы [22-26]. Одним из значимых маркеров является прогестерон-индуцированный блокирующий фактор – progesterone-induced-blocking factor (далее – PIBF), индуцированный прогестероном под влиянием активированных лимфоцитов и оказывающий иммуномодулирующее влияние на имплантационные характеристики эндометрия [27-28]. Кроме того, показано, что в процессе инвазии трофобласта, особая роль принадлежит молекулам стромального клеточного фактора – stromal cell-derived factor-1 (далее – SDF-1), синтезируемому клетками эндометрия и трофобласта, как фактору, потенцирующему восприимчивость эндометрия к наступлению и развитию беременности, инвазии трофобласта и эмбриогенезу в целом [29-30]. Следует признать, что многочисленные исследования потенциальных маркеров имплантационной восприимчивости и развития беременности остались на уровне экспериментальных (in vivo, in vitro, in silico) и внедрение их в клиническую практику для верификации патологии имплантации и гравидарного эндометрия так и не было осуществлено. В тоже время, комплексный морфологический подход к верификации патологии эндометрия с оценкой экспрессии рецепторов к эстрогенам и прогестерону, экспрессии PIBF и SDF-1 позволит выяснить их роль в патогенезе привычного невынашивания беременности и разработать новый алгоритм морфологической диагностики.
Цель исследования: изучить гистологические и иммуногистохимические особенности гравидарной трансформации эндометрия при привычном невынашивании беременности.
Материалы и методы исследования. Гистологическое и иммуногистохимическое исследование проведено на 100 образцах абортного материала, при сроке беременности 5-8 недель, поступивших в отдел патоморфологии НИИ акушерства, ги- некологии и репродуктологии имени Д.О. Отта. Было сформировано две группы образцов: основная группа – 85 образцов абортного материала от пациенток с привычным невынашиванием беременности и контрольная группа – 15 образцов абортного материала, после прерывания беременности (хирургическим путем) по желанию женщины на аналогичном сроке. Операционный материал фиксировали в 10% нейтральном формалине (рН=7,2), после стандартной гистологической проводки в гистопроцессоре Histo-Tek VP1 (Sakura, Япония) заливали в парафин на приборе модульной системы заливки TES 99 (Medite, Германия). Из полученных блоков изготавливали срезы толщиной 3-4 мкм на микротоме Rotary 3002 (PFM, Германия) и окрашивали их гематоксилином и эозином («Био-Витрум», Россия). Исследование проводили на микроскопе Olympus CX31 (Япония) при увеличении ×100, ×200, ×400. Оценивали наличие маточной беременности (инвазию трофобласта в зоне плацентарного ложа), полноценность гравидарной трансформации компактного и спонгиозного слоев эндометрия (стромы и желез), состояние спиральных артерий, наличие экссудативной или продуктивной инфильтрации и других изменений. Иммуногистохимическое исследование проводили на парафиновых срезах с использованием одноэтапного протокола с демаскировкой антигена. Иммуногистохимическое исследование оценки рецепторов к эстрогенам и прогестерону проведено во всех 100 образцах обеих группах. Для оценки во всех случаях использовали антитела к рецепторам эстрогена α (альфа) (клон 1D5) в стандартном разведении 1:35 и к рецепторам прогестерона (клон PgR 636) в стандартном разведении 1:50 производства Cytomation (Dako). Исследование экспрессии PIBF SDF-1 проводили на 20 образцах абортного материала основной группы и 15 образцах абортного материала контрольной группы с использованием первичных поликлональных кроличьих антител к рецепторам Anti-PIBF (клон ab 151491) в стандартном разведении (1:200) и первичных поликлональных кроличьих антител к Anti-SDF1 (клон ab 9797) в стандартном разведении (1:100) производства Abcam
(Великобритания). В качестве системы визуализации использовали abcam Mouse and Rabbit Specific HRP Plus (ABC) Detection IHC Kit RTU (ab93697), фирмы Abcam (Великобритания). Количественную и качественную оценку экспрессии рецепторов половых гормонов проводили полуколичественным методом по формуле: Histochemical Score=ΣP(i)×I, где I – интенсивность окрашивания, выраженная в баллах от 0 до 3; P(i) – процент клеток, окрашенных с разной интенсивностью. Визуализацию экспрессии маркеров проводили на микроскопе Olympus BX46 и программного обеспечения CellSens 47 Entry с последующей морфометрией в программе ВидеоТест-Морфология 5.2 (Россия).
Результаты исследования и обсуждение. Средний возраст пациенток в основной и контрольной группах составил 31,9±0,56 и 29,8±0,9 лет, соответственно. Наличие 2-х неразвивающихся беременностей верифицировано в 57 случаях (67,1%), наличие 3-х неразвивающихся беременности в 28 случах (32,9%).
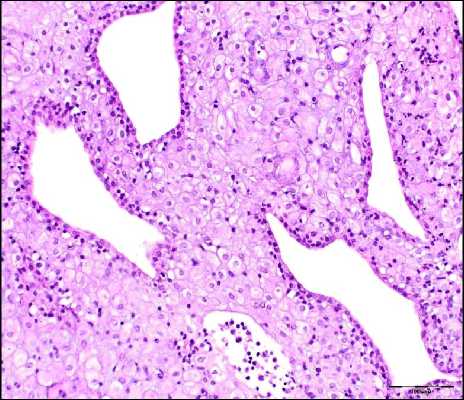
Рис. 1. Микрофото гистологического препарата матки человека при физиологически протекающей беременности. Полноценная трансформация стромы и желез эндометрия. Окр.: гематоксилином-эозином. Ув.: ×200
Гистологические характеристики полноценного гравидарного эндометрия подробно представлены в классических руководствах и характеризуются зрелыми де-цидуоцитами эпителиодного типа плотно прилежащими друг к другу с обильной ци- топлазмой и светлым пузырьковидным ядром, отмечается слабо выраженный отек и скудная лимфоидная инфильтрация (рис.
-
1). Железы компактного слоя со щелевидным или несколько эктазированным просветом, выстланы низким кубическим эпителием. Для спонгиозного слоя характерно
Таблица 1
Количественные показатели гистологической картины гравидарной трансформации эндометрия при привычном невынашивании беременности
Результаты гистологического исследования абортного материала у пациенток с привычным невынашиванием беременности представлены в таблице 1. Представленные данные в таблице указывают на то, что при привычном невынашивании беременности на гестационном сроке 5-8 недель в 83,5% случаев верифицируется полноценная гравидарная трансформация эндометрия.
Гистологические признаки хромосомной патологи трофобласта (нарушение дифференцировки ворсин, патология вас- куляризации стромы ворсин, гидропические изменения стромы ворсин с формированием гидропических булл, истончение хориального синцития ворсин хориона или очаговая пролиферация, синцитиальные инвагинаты) диагностированы в 40 (47,1%) случаях. Результаты цитогенетического исследования ворсин хориона показали, что в 46 (54,1%) образцах диагностированы хромосомные аномалии трофобласта – трисомии в 24 (52,2%), моносомия в 7 (15,2%), полиплоидии в 15 (32,6%), в 39 случаях хромосомных аномалий трофобласта не выявлено.
При сравнительном иммуногистохимическом исследовании экспрессии рецепторного профиля гравидарного эндометрия при привычном невынашивании беременности и в контроле верифицировано достоверное снижение экспрессии рецепторов к эстрогенам в железах (48,4±5,2 и 112,5±2,6, соответственно, p<0,05) и в стромальном компоненте гравидарного эндометрия (55,2±5,4 и 135,3±4,7, соответственно, p<0,05). Экспрессия рецепторов прогестерона в железах при привычном невынашивании составила 31,0±7,1 в контрольной группе экспрессия отсутствовала, что является нормой. В стромальном компоненте грави-дарного эндометрия экспрессия рецепторов прогестерона статистически в обеих группах значимо не различилась (196,8±4,2 и 228,5±6,8, соответственно, p>0,05). Сопоставление оценки экспрессии рецепторного профиля эндометрия в зависимости от наличия или отсутствия хромосомной патологии трофобласта статистически значимых отличий не выявило (p>0,05).
Следует отметить, что комплексное морфологические исследование всех структур гравидарного эндометрия не выявило патогномоничных признаков патологии гравидарной трансформации характерных для хромосомных аномалий трофобласта, в связи с чем, разделение на группы в зависимости от данных цитогенетического исследования является нецелесообразным.
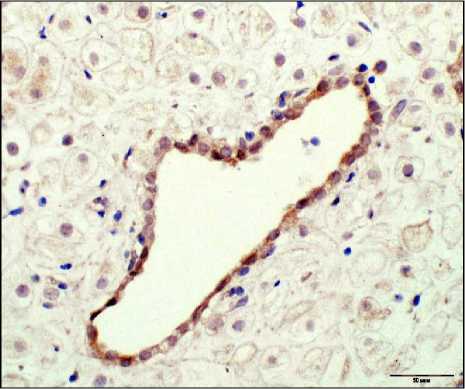
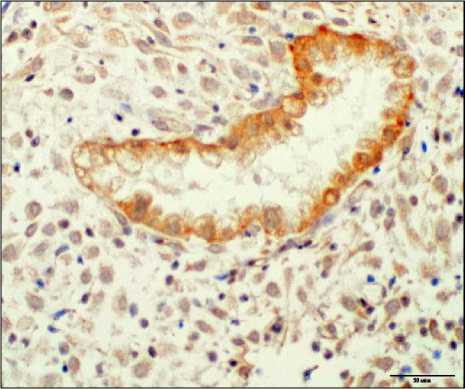
Экспрессия PIBF в гравидарном эндометрии при привычном невынашивании беременности и эндометрии контрольной группы верифицирована в железах и стромальном компоненте представлена на рис. 2.
а
б
а
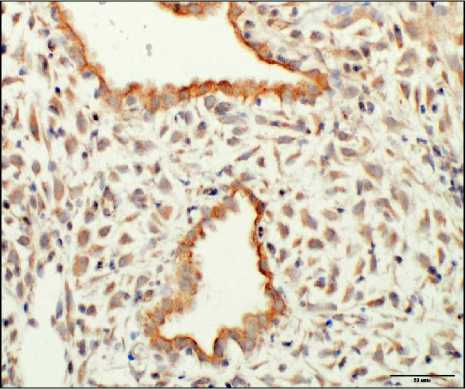
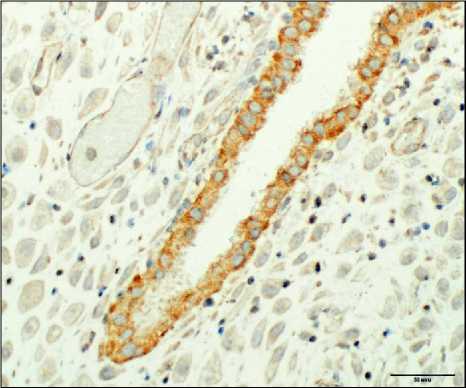
Рис. 3. Экспрессия SDF-1 в гравидарном эндометрии; а – при привычном невынашивании беременности; б – в группе контроля. Окр. иммуногистохимическим методом. Ув.: ×200
Рис. 2. Экспрессия PIBF в гравидарном эндометрии; а – при привычном невынашивании беременности; б – в группе контроля. Окр. иммуногистохимическим методом. Ув.: ×200
б
Таблица 2 Количественные показатели экспрессии прогестерон-индуцированного блокирующего фактора PIBF и стромального клеточного фактора SDF-1 в железах и строме гравидарного эндометрия
|
Группы |
Железы компактного слоя |
Стромальный компонент |
||
|
Относительная площадь экспрессии (%) |
Оптическая плотность экспрессии (усл. ед.) |
Относительная площадь экспрессии (%) |
Оптическая плотность экспрессии (усл. ед.) |
|
|
M±m |
M±m |
M±m |
M±m |
|
|
Прогестерон-индуцированный блокирующий фактор PIBF |
||||
|
Основная (n=20) |
8,6±0,63** |
0,09±0,001 |
19,6±1,21* |
0,12±0,006 |
|
Контрольная (n=15) |
24,1±0,74 |
0,13±0,001 |
31,5±0,81 |
0,10±0,001 |
|
Стромальный клеточный фактор SDF-1 |
||||
|
Основная (n=20) |
10,6±0,64** |
0,11±0,001 |
22,9±1,8 |
0,08±0,001 |
|
Контрольная (n=15) |
22,43±0,72 |
0,12±0,001 |
26,2±1,03 |
0,11±0,001 |
Примечание: * - уровень достоверности различий при сравнении между группами равен
- 56 - p<0,05; ** - равен p<0,01
При иммуногистохимическом исследовании экспрессии PIBF при привычном невынашивании беременности верифицировано статистическое значимое снижение экспрессии маркера в железах и строме эндометрия по сравнению с контрольной группой (*p<0,05; **p<0,01, соответственно). Оптическая плотность экспрессии в железах и стромальном компоненте гравидарного эндометрия статистически значимо не отличалась (табл. 2).
Экспрессия SDF-1 также верифицирована в обеих гистогенетических структурах гравидарного эндометрия (рис. 3). Оценка экспрессии SDF-1 в железах грави-дарного эндометрия при привычном невынашивании беременности верифицировала статистически значимое ее снижение по сравнению с контрольной группой (**p<0,01), в строме гравидарного эндометрия статистически значимых отличий не выявлено. Оптическая плотность экспрессии в железах и строме также статистически не отличалась (p>0,05). Полученные результаты комплексного морфологического исследования гравидарного эндометрия при привычном невынашивании свидетельствуют о том, что, несмотря на гистологическую полноценность грави-дарной трансформации эндометрия на молекулярном уровне имеется нарушение экспрессии PIBF в железах и строме грави-дарного эндометрия и экспрессии SDF-1 в стромальном компоненте.
Привычное невынашивание беременности, является актуальной проблемой современного общества, и, несмотря на многочисленные исследования в этой области, многие вопросы остаются дискуссионными. Этиология репродуктивных потерь давно известна и не претерпела изменений, по-прежнему она представлена генетическими, эндокринными, иммунологическими и инфекционными факторами. В тоже время многие вопросы остаются дискуссионными. С чем связаны репродуктивные потери при нормальном кариотипе абортуса, отсутствии инфекционной и эндокринной патологии гра-видарного эндометрия? Отсутствие единого алгоритма комплексного морфологического исследования абортного материала не позволяет в последующем прове- сти реабилитацию и прегравидарную подготовку пациенток. Результаты нашего исследования выявили полноценную гра-видарную трансформацию эндометрия при привычном невынашивании беременности в 83,5% случаев, при этом хромосомные аномалии трофобласта диагностированы в 54,1% случаев, что позволяет полагать, что хромосомная патология трофобласта не имеет решающего влияния на гравидарную трансформацию эндометрия.
Несмотря на полноценную трансформацию эндометрия, при привычном невынашивании методом иммуногистохимического исследования верифицировано снижение экспрессии рецепторов к эстрогенам и наличие экспрессии рецепторов к прогестерону в железах компактного слоя эндометрия. Прогестерон регулирует иммунотолерантность в эндометрии посредством экспрессии PIBF, который является необходимым условием для полноценной гравидарной трансформации эндометрия и развития беременности [31-32]. Результаты оценки экспрессии PIBF показали статистически значимое снижение ее в железах и строме гравидарного эндометрия при привычном невынашивании беременности по сравнению с контрольной группой. Наши результаты согласуются с исследованиями авторов, в которых было показано значительное снижение экспрессии PIBF и прогестероновых рецепторов в децидуальной оболочке у женщин с привычным невынашиванием по сравнению с беременностью, прерванной по желанию женщины, а также снижение экспрессии при преждевременных родах и эклампсии, что подтверждает существенное влияние PIBF на течение беременности [33].
Непосредственно прогестерон и эстрогены участвуют в полноценной циклической трансформации эндометрия и регуляции экспрессии SDF-1, влияющего на рост клеток, устойчивости к апоптозу, имплантации, децидуализации и дифференцировке ворсин хориона [34-36]. Единого мнения исследователей об экспрессии SDF-1 в циклическом и гравидарном эндометрии нет. Tsutsumi и соавт. (2011) не выявили экспрессии SDF-1 в железах эндометрия, однако обнаружили наличие экспрессии его рецептора (CXCR4) в строме, причем экспрессия в эпителии желез была выше по сравнению с клетками стромы. Авторы установили значимость паракринного влияния эстрадиола на SDF-1 в клетках стромы и активацию пролиферативных процессов в железах эндометрия под их влиянием [37]. В исследованиях Savova и соавт. (2020) показано в среднем 14-кратное увеличение экспрессии SDF-1 в децидуальной оболочке абортного материала при невынашивании беременности по сравнению с беременностями, прерванными по желанию женщины [38]. Экспериментальным исследованием Zhang и соавт. (2015), наоборот, показали более достоверно высокую экспрессию SDF-1 в децидуальных клетках эндометрия в группе без потери беременности по сравнению с эндометрием в группе с абортом [39]. Результаты нашего исследования показали статистически значимое снижение экспрессии SDF-1 в железах компактного слоя эндометрия при привычном невынашивании беременности по сравнению с контрольной группой и отсутствие статистических отличий в его экспрессии в стромальном компоненте.
Заключение. Таким образом, результатами проведенного гистологического и иммуногистохимического исследования установлено, что при полноценной гравидарной трансформации эндометрия в группе пациенток с привычным невынашиванием беременности отмечается нарушение его рецепторного профиля. Снижение экспрессии PIBF в железах и стромальном компоненте и экспрессии SDF-1 в железах компактного слоя эндометрия является отражением иммунологического дисбаланса в гравидарном эндометрии при привычном невынашивании. Разработка единого морфологического алгоритма с учетом базовых параметров морфогенеза гравидарной трансформации эндометрия (оценки рецепторного профиля, уровня экспрессии значимых иммунологических факторов, таких, как прогестерон индуцированного блокирующего фактора, стромального клеточного фактора) позволяет верифицировать патологию эндометрия на молекулярном уровне и обосновать необходимость проведения прегравидарной подготовки с использованием патогенетически обоснованной терапии.
Список литературы Особенности гравидарной трансформации эндометрия при привычном невынашивании беременности
- Molchanova OK, Ordiyants IM, Lutsenko IV, Podstavkina VA. Sovremennye predstavleniya o molekulyarnykh mekhanizmakh regulyatsii implantatsii. Akusherstvo i ginekologiya: novosti, mneniya, obuchenie. 2020;8(3):106-111. https://doi.org/10.24411/2303-9698-2020-13917. In Russian
- Tseng YF, Cheng HR, Chen YP et al. Grief reactions of couples to perinatal loss: A one-year prospective follow-up. J Clin Nurs. 2017;26(23-24):5133-5142. https://doi.org/10.1111/jocn.14059
- El Hachem H, Crepaux V, May-Panloup P, Descamps P, Legendre G, Bouet PE. Recurrent Pregnancy Loss: Current Perspectives. Int. J. Womens Health. 2017;9:331-345. https://doi.org/10.1093/humrep/dey362
- Bashmakova NV, Tret'yakova TB, Demchenko NS. Tsitogeneticheskie narusheniya u embriona pri nerazvivayushcheysya beremennosti. Rossiyskiy vestnik akush. gin. 2013;13(4):18-21. In Russian
- Boots CE, Bernardi LA, Stephenson MD. The frequency of euploid miscarriage is increased in obese women with recurrent early pregnancy loss. Fertil Steril. 2014;102(2):455-459. https://doi.org/10.1016/j.fertnstert.2014.05.005
- Mekinian A, Cohen J, Alijotas-Reig J et al. Unexplained Recurrent Miscarriage and Recurrent Implantation Failure: Is There a Place for Immunomodulation? Am J Reprod Immunol. 2016;76(1):8-28. https://doi.org/10.1111/aji.12493
- Peretyatko LP, Fateeva NV, Kuznetsov RA, Malyshkina AI. Vaskulyarizatsiya vorsin khoriona v pervom trimestre beremennosti pri fiziologicheskom techenii i privychnom nevynashivanii na fone khronicheskogo endometrita. Rossiyskiy mediko-biologicheskiy vestnik imeni akademika I.P. Pavlova. 2017:25(4):612-620. In Russian
- Cueva S, Burks C, McQueen D, Barkoff MS, Stephenson MD. Maternal antithyroid antibodies and euploid miscarriage in women with recurrent early pregnancy loss. Fertil Steril. 2018;110(3):452-458. https://doi.org/10.1016/j.fertnstert.2018.04.026
- Abusueva ZA, Omarpashaeva MI, Khashaeva TKh. Reabilitatsiya posle preryvaniya nerazvivayushcheysya beremennosti: izmenenie tsitokinovogo statusa v dinamike razlichnykh metodov terapii. Bezopasnost' zdorov'ya cheloveka. 2018;1:6-17. In Russian
- Bender Atik R, Christiansen OB, Elson J et al. ESHRE Guideline Group on RPL. ESHRE guideline: recurrent pregnancy loss. Hum Reprod Open. 2018;2018:hoy004
- Lucas ES, Vrljicak P, Muter J et al. Recurrent pregnancy loss is associated with a pro-senescent decidual response during the peri-implantation window. Commun. Biol. 2020;3:37. https://doi.org/10.1038/s42003-020-0763-1
- Arzhanova ON, Kosheleva ON, Pluzhnikova TA, Kosheleva NG. Profilaktika i lechenie nevynashivaniya beremennosti: uchebnoe posobie. Pod. red. E.K. Aylamazyana. 2-e izd. pererab. i dop. S-Pb.: N-L, 2013. S. 78-79. In Russian
- Prilepskaya VN. Infektsii, peredavaemye polovym putem. Klinicheskie lektsii. Pod red. V.N. Prilepskoy. Moskva: GEOTAR-Media, 2014.- 160s. In Russian
- Garrido-Gimenez C, Alijotas-Reig J. Recurrent Miscarriage: Causes, Evaluation and Management. Postgrad. Med. J. 2015;91:151-162. https://doi.org/10.1136/postgradmedj-2014-132672
- Ticconi C, Pietropolli A, Di Simone N et al. Endometrial Immune Dysfunction in Recurrent Pregnancy Loss. Int J Mol Sci. 2019;20(21):5332. https://doi.org/10.3390/ijms20215332
- Morita K, Ono Y, Takeshita T et al. Risk factors and outcomes of recurrent pregnancy loss in Japan. J Obstet and Gynaecol Res. 2019;45:1997-2006. https://doi.org/10.1111/jog.14083
- Young SL. Oestrogen and progesterone action on endometrium: a translational approach to understanding endometrial receptivity. Reprod BioMed Online. 2013;27:497-505. https://doi.org/10.1016/j.rbmo.2013.06.010
- Tral' TG, Tolibova GKh, Serdyukov SV, Polyakova VO. Morfofunktsional'naya otsenka prichin zamershey beremennosti v pervom trimestre. Zhurnal akusherstva i zhenskikh bolezney. 2013;62(3):83-87. In Russian
- Lucas ES, Dyer NP, Murakami K et al. Loss of Endometrial Plasticity in Recurrent Pregnancy Loss. Stem. Cells. 2016;34:346-356. https://doi.org/10.1002/stem.2222
- Peter Durairaj RR, Aberkane A, Polanski L et al. Deregulation of the endometrial stromal cell secretome precedes embryo implantation failure. Mol Hum Reprod. 2017;23:478-487
- Luchko EV, Shtabinskaya TT, Zubritskiy MG, Basinskiy VA. Osobennosti detsidualizatsii stromy endometriya pri nevynashivanii beremennosti rannikh srokov. Zhurnal Grodnenskogo gosudarstvennogo meditsinskogo universiteta. 2018;16(6):702-705. In Russian
- Liang Wang, Xueyi Li, Yilin Zhao et al. Insights into the mechanism of CXCL12-mediated signaling in trophoblast functions and placental angiogenesis. Acta Biochimica et Biophysica Sinica. 2015;47(9):663-672. https://doi.org/10.1093/abbs/gmv064
- Wang X, Wu SP, De Mayo FJ. Hormone dependent uterine epithelial-stromal communication for pregnancy support. Placenta. 2017;60(Suppl 1):20-26. https://doi.org/10.1016/j.placenta.2017.07.003. Epub 2017 Jul 6
- Okada H, Tsuzuki T, Murata H. Decidualization of the human endometrium. Reprod Med Biol. 2018;17:220-227. https://doi.org/10.1002/rmb2.12088
- Sharma S, Godbole G, Modi D. Decidual Control of Trophoblast Invasion. Am J Reprod Immunol. 2016;75:341-350. https://doi.org/10.1111/aji.12466
- Zanotta N, Monasta L, Skerk K et al. Cervico-vaginal secretion cytokine profile: A non-invasive approach to study the endometrial receptivity in IVF cycles. Am J Reprod Immunol. 2019;81(1):e13064. https://doi.org/10.1111/aji.13064
- Szekeres-Bartho J, Šućurović S, Mulac-Jeričević B. The Role of Extracellular Vesicles and PIBF in Embryo-Maternal Immune-Interactions. Front Immunol. 2018;9:2890. https://doi.org/10.3389/fimmu.2018.02890
- Pallinger E, Bognar Z, Bogdan A et al. PIBF+ extracellular vesicles from mouse embryos affect IL-10 production by CD8+ cells. Sci Rep. 2018;8(1):4662. https://doi.org/10.1038/s41598-018-23112-z
- Zheng J, Wang H, Zhou W. Modulatory effects of trophoblast-secreted CXCL12 on the migration and invasion of human first-trimester decidual epithelial cells are mediated by CXCR4 rather than CXCR7. Reprod Biol Endocrinol. 2018;16(1):17. https://doi.org/10.1186/s12958-018-0333-2
- Tral' TG, Tolibova GKh. Verifikatsiya stromal'nogo kletochnogo faktora SDF-1 v gravidarnom endometrii pri nerazvivayushcheysya beremennosti posle primeneniya tekhnologiy ekstrakorporal'nogo oplodotvoreniya. Morfologicheskie vedomosti. 2022;30(1):616. In Russian. https://doi.org/10.20340/mv-mn.2022.30(1).616
- Halasz M, Polgar B, Berta G et al. Progesterone-induced blocking factor differentially regulates trophoblast and tumor invasion by altering matrix metalloproteinase activity. Cellular and Molecular Life Sciences. 2013;70:4617-4630. https://doi.org/10.1007/s00018-013-1404-3
- Balassa T, Berta G, Jakab L et al. The effect of the Progesterone-Induced Blocking Factor (PIBF) on E-cadherin expression, cell motility and invasion of primary tumour cell lines. J Reprod Immunol. 2018;125:8-15. https://doi.org/10.1016/j.jri.2017.10.047
- Wu S, Zhang H, Tian J et al. Expression of kisspeptin/GPR54 and PIBF/PR in the first trimester trophoblast and decidua of women with recurrent spontaneous abortion. Pathol Res Pract. 2014;210(1):47-54. https://doi.org/10.1016/j.prp.2013.09.017
- Ren L, Liu YQ, Zhou WH, Zhang YZ. Trophoblast-derived chemokine CXCL12 promotes CXCR4 expression and invasion of human first-trimester decidual stromal cells. Hum. Reprod. 2012;27:366-374. https://doi.org/10.1093/humrep/der395
- Zhou WH, Wu X, Hu WD, Du MR. Co-expression of CXCR4 and CXCR7 in human endometrial stromal cells is modulated by steroid hormones. Int J Clin Exp Pathol. 2015;8(3):2449-2460
- Huang B, Faucette AN, Pawlitz MD et al. Interleukin33-induced expression of PIBF1 by decidual B cells protects against preterm labor. Nat Med. 2017;23:128-135. https://doi.org/10.1038/nm.4244
- Tsutsumi A, Okada H, Nakamoto T et al. Еstrogen induces stromal cell-derived factor 1 (SDF-1/CXCL12) production in human endometrial stromal cells: a possible role of endometrial epithelial cell growth. Fertil Steril. 2011;95(1):444-447. https://doi.org/10.1016/j.fertnstert.2010.08.037
- Savova M, Milachich T, Djonov V, Shterev A. Molecular pathogenesis of spontaneous abortions - Whole genome copy number analysis and expression of angiogenic factors. Taiwan J Obstet Gynecol. 2020;(1):99-104. https://doi.org/10.1016/j.tjog.2019.11.015
- Zhang Y, Wang J, Gu Y, Li Y. Relationship between the expression of chemokines and their receptors in the maternal-fetal interface and pathogenesis of unexplained recurrent spontaneous abortion. Zhonghua Fu Chan Ke Za Zhi. 2015;50(8):608-613


