Особенности изменения характеристик ротовой жидкости у курильщиков электронных сигарет и систем нагревания табака
Автор: Кишкань A.A.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Стоматология
Статья в выпуске: 1 т.19, 2023 года.
Бесплатный доступ
Цель: оценить влияние курения электронных сигарет (ЭС) и систем нагревания табака (СНТ) на особенности изменения характеристик ротовой жидкости. Материал и методы. Изучены результаты анализа проб ротовой жидкости 150 лиц: курящие ЭС/СНТ - по 50 человек в группе; контрольная группа - 50 клинически здоровых лиц, не употребляющих ЭС/СНТ. Результаты. Пациенты группы СНТ характеризуются более низкой скоростью секреции слюны, более высоким показателем вязкости ротовой жидкости при более нейтральном уровне рН слюны в сравнении с контрольной группой (р=0,002); тогда как пациенты группы ЭС в сравнении с группой СНТ характеризуются большей скоростью секреции слюны, менее высоким показателем вязкости ротовой жидкости при нейтральном уровне рН слюны (р>0,05). Наблюдались различия в биохимических показателях концентрации общего белка (р=0,001), концентрации кальция ротовой жидкости (р=0,005), малонового диальдегида (р=0,007), щелочной фосфатазы и каталазы в слюне (р=0,004 и р=0,006 соответственно) между курильщиками СНТ и контрольной группой. Заключение. Курение СНТ в большей степени в сравнении с ЭС, и особенно с контрольной группой, снижает скорость слюноотделения, повышает вязкость ротовой жидкости; у этой группы курильщиков в сравнении с курильщиками ЭС выявлено более нейтральное значение кислотности ротовой жидкости, повышена концентрация в слюне общего белка, малонового диальдегида, фосфатов и кальция при снижении концентраций щелочной фосфатазы и каталазы.
Вейпинг, здоровье полости рта, курение, система нагревания табака, электронная сигарета
Короткий адрес: https://sciup.org/149143890
IDR: 149143890 | УДК: 616.31 | DOI: 10.15275/ssmj1901013
Текст научной статьи Особенности изменения характеристик ротовой жидкости у курильщиков электронных сигарет и систем нагревания табака
EDN: BGMIRQ
Corresponding author — Alexey A. Kishkan
Тел.: +7 (925) 0166901
мире. По оценкам, к 2050 г. приблизительно 400 млн взрослых будут страдать от болезней, связанных с курением [1].
Проведенные более ранние исследования подтверждают сильную постоянную связь курения с ухудшением стоматологического здоровья, в том числе состояния пародонта, независимо от уровня зубного налета и других вероятных искажающих факторов, таких как как возраст, пол и социально-экономическое положение. Курение табака, по-видимому, снижает репаративную способность клеток пародонта, включая фибро-, остео- и цементобласты, снижая способность формировать новую ткань и потенциально препятствуя ответу на пародонтальную терапию. Курение сигарет повышает риск почти всех стоматологических заболеваний слизистой оболочки рта и снижает шансы на успех многих стоматологических процедур с доказательствами, подтверждающими зависимость «доза — реакция». Эти ассоциации сохраняются в проспективных исследованиях, демонстрирующих, что курение сигарет является основным фактором риска возможной потери зубов в будущем [2].
Помимо заболеваний пародонта, также сообщалось об ассоциации между курением сигарет и кариесом зубов, с измененным микробиомом полости рта и снижением слюноотделения, предложенными в качестве потенциальных механизмов развития стоматологических заболеваний, но с меньшей достоверностью причинно-следственной связи для этих результатов [3].
На протяжении многих десятилетий считалось, что бóльшая часть вреда от употребления табака исходит от процесса горения и образующегося в результате сложного коктейля ингредиентов, а не от никотина, вызывающего сильное привыкание [4]. В связи с этим в последнее десятилетие наблюдается расширение ассортимента никотиновых продуктов и его заменителей, представленных в первую очередь электронными сигаретами (e-cigarette) и системами нагревания табака [5]. ЭС иногда представляются как менее вредная альтернатива для курильщиков табака с никотиновой зависимостью, которые не хотят или не могут прекратить употребление никотина, поскольку продукты содержат гораздо более низкие уровни токсикантов по сравнению с сигаретным дымом [6]. ЭС не единственный класс недавно представленных продуктов, которые доставляют никотин без сгорания. СНТ нового состава создают вдыхаемый аэрозоль путем нагревания табакосодержащего материала до температуры ниже порога воспламенения, и, как сообщают их производители, они содержат более низкие уровни вредных химических веществ, чем обычные сигареты [7].
Учитывая хорошо известное влияние табачного дыма на пародонт и слизистую оболочку рта, важно понимать влияние аэрозоля ЭС и СНТ, который также проходит в непосредственной близости от этих тканей. В отечественной доказательной базе практически отсутствуют исследования о влиянии курения ЭС и СНТ на особенности изменения характеристик ротовой жидкости, чем обусловлена актуальность настоящего исследования.
Цель — оценить влияние курения электронных сигарет и систем нагревания табака на особенности изменения характеристик ротовой жидкости.
Материал и методы. Во время плановой санации или при обращении за стоматологической помощью проведен скрининг 150 лиц в возрасте от 18 до 55 лет. Пациенты в зависимости от анамнестических характеристик по употреблению ЭС/СНТ разделены на две равные группы по 50 человек. В 1-ю группу включены пациенты-курильщики ЭС (группа ЭС), 2-ю группу составили пациенты — курильщики СНТ (группа СНТ). Контрольная группа (n=50) состояла из визуально клинически здоровых лиц, не употребляющих ЭС/СНТ (группа контроля). Все пациенты подписали информированное согласие на участие в исследовании.
Проанализированы результаты анализа проб ротовой жидкости, полученной в процессе скрининга у пациентов всех групп сравнения, в виде кислотнощелочного равновесия в полости рта (рН), скорости естественного слюноотделения (мл/мин.), вязкости ротовой жидкости. Кроме того, проведен биохимический анализ ротовой жидкости с определением содержания белка, кальция, фосфатов, щелочной фосфатазы, каталазы и малонового диальдегида. Биохимический анализ ротовой жидкости осуществляли с использованием наборов готовых реагентов на автоматическом биохимическом и иммунофер-ментном анализаторе Labline-100, West Medica (Австрия).
Для подтверждения нормальности распределения использовали критерий W Шапиро — Уилка. Распределение соответствует нормальному (значение p теста равно 0,68). В данном исследовании вычисляли выборочную среднюю ( X ), стандартное отклонение ( S ). При анализе и интерпретации эмпирических данных применялись t -критерий Стьюдента и H -критерий Краскела — Уоллеса для несвязанных выборок. Все статистические расчеты выполняли при уровне значимости 95% ( р =0,05). Статистический анализ данных проводили на основании пакетов прикладных программ Microsoft Excel и с помощью специализированного программного обеспечения Statistica 64 ver. 20.0. (StatSoft Inc).
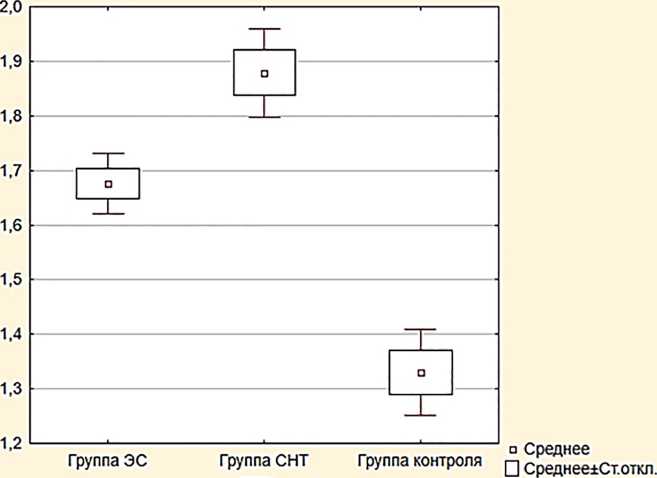
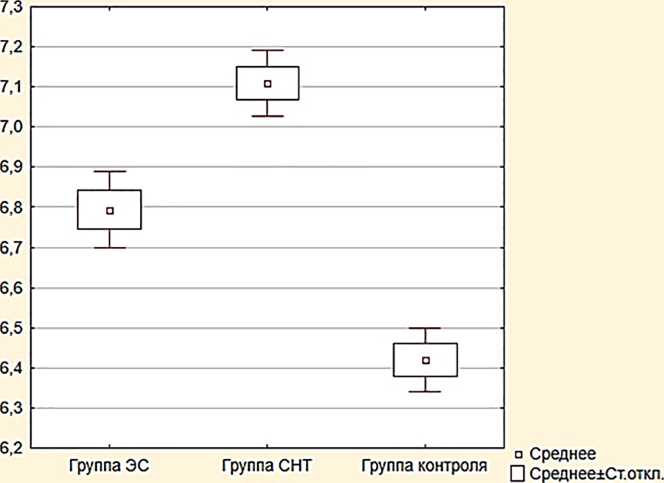
Результаты . Выявлено, что пациенты группы СНТ в большей степени характеризуются низкой скоростью секреции слюны (0,48±0,02 мл/мин.), более высоким показателем вязкости ротовой жидкости (1,87±0,04 мПа/сек.) при более нейтральном уровне рН слюны (7,1±0,04) в сравнении с контрольной группой; тогда как пациенты группы ЭС характеризуются в сравнении с группой СНТ большей скоростью секреции слюны (0,56±0,03 мл/мин.), менее высоким показателем вязкости ротовой жидкости (1,68±0,05 мПа/сек.) при нейтральном уровне рН слюны (6,79±0,06) без статистически значимых отличий между группами ЭС и СНТ (рис. 1–3).
Кроме того, проанализированы уровни концентрации общего белка, кальция, фосфатов, щелочной фосфатазы, каталазы и малонового диальдегида среди пользователей ЭС, курильщиков СНТ и некурящих пациентов. Так, концентрация общего белка в слюне у курильщиков ЭС составила 2,3±1,2 г/л, в группе курильщиков СНТ этот показатель составил 2,2±0,8 г/л, а среди некурящих — 1,7±0,5 г/л. Концентрация кальция в слюне у курильщиков ЭС составила 0,8±0,5 мМ/л, среди курильщиков СНТ — 0,6±0,3 мМ/л, а в группе у некурящих — 0,6±0,3 мМ/л.
Концентрация фосфатов в слюне у курильщиков ЭС составила 4,3±2,0 мМ/л, в группе курильщиков СНТ — 4,1±2,3 мМ/л и среди некурящих — 3,4±1,5 мМ/л.
Концентрация щелочной фосфатазы в слюне у курильщиков ЭС составила 50,2±25,14 МЕ/л, в группе курильщиков СНТ этот показатель былл 49,58±23,33 МЕ/л, а среди некурящих — 55,11±27,85 МЕ/л. Концентрация каталазы в слюне у курильщиков ЭС составила 1,33±0,34 мкат/л, среди курильщиков СНТ — 1,2±0,12 мкат/л, а в группе у некурящих — 10,2±0,45 мкат/л. Концентрация малонового диальдегида в слюне у курильщиков ЭС составила 14,4±1,67 мкМ/л, в группе курильщиков
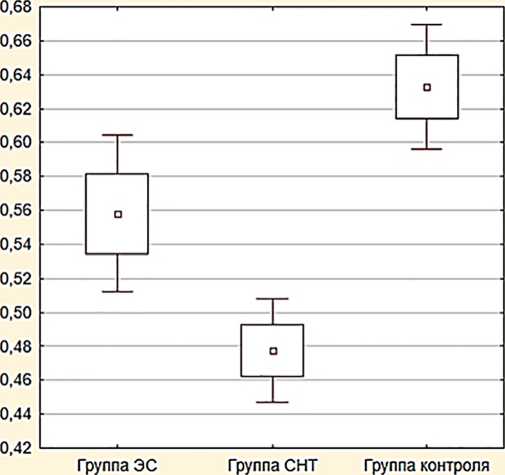
Рис. 1. Уровни показателя скорости естественного слюноотделения, мл/мин.
о Среднее
□ Среднее±Ст.откл.
I Среднее±1,96*Ст.откл.
I Среднее±1,96*Ст.откл.
Рис. 2. Уровни показателя вязкости ротовой жидкости, мПа/сек.
I Среднее±1.96*Ст.откл.
Рис. 3. Уровни показателя рН слюны
СНТ — 15,51±1,95 мкМ/л и среди некурящих — 3,23±0,29 мкМ/л.
Обсуждение. В данном исследовании влияние использования ЭС и СНТ на биологические профили ротовой жидкости оценивалось и сравнивалось с профилями некурящих. Исследование показывает то, что воздействие аэрозоля ЭС, который содержит различные ингредиенты, токсиканты и канцерогены, может оказывать вредное воздействие и вызывать изменения в здоровье полости рта человека. Измерение скорости слюноотделения, вязкости и кислотности ротовой жидкости позволило выявить у курильщиков ЭС и СНТ следующие изменения исследуемых параметров: скорость слюноотделения была ниже по сравнению с группой контроля ( р =0,002); среднее значение вязкости ротовой жидкости превышало этот показатель в группе контроля ( р =0,004).
Правильный рН слюны колеблется от 6,2 до 7,6. Поддержание рН среды полости рта связано как с буферной активностью слюны, так и с постоянным потоком слюны, что позволяет устранять кислоты, продуцируемые бактериями полости рта или поступающие с пищей и напитками. Никотиновая зависимость связана с абсорбцией никотина слизистой оболочкой щек, и установлено, что основным фактором, определяющим абсорбцию никотина, является рН слюны [8]. В исследовании, проведенном S. Baliga и соавт., рН слюны у пациентов с пародонтитом был ниже, чем в группе пациентов без заболеваний пародонта, что позволило сделать вывод, что рН слюны связан с заболеваниями пародонта и может восприниматься как диагностический биомаркер периодонтита [9]. На значение pH слюны может влиять употребление табака. По данным C. N. Kumar и соавт. [10], рН слюны показывает значительные изменения и, следовательно, имеет отношение к тяжести заболевания пародонта. При определении рН ротовой жидкости у лиц исследуемых групп ЭС и СНТ установлено более нейтральное значение показателя относительно значений в группе контроля ( р =0,009).
Концентрация общего белка в слюне у курильщиков группы ЭС и СНТ выше, чем в группе некурящих. Статистически значимые различия в биохимических показателях концентрации общего белка ротовой жидкости наблюдались между курильщиками СНТ и некурящими ( р =0,001).
Концентрация кальция в группе пользователей ЭС выше, чем среди курильщиков СНТ и некурящих. Наблюдались различия в биохимических показателях концентрации кальция ротовой жидкости между пользователями ЭС и некурящими ( р =0,005).
Концентрация фосфатов в группах пользователей ЭС и курильщиков СНТ выше, чем среди некурящих, однако статистически значимых различий не наблюдалось. Показатели концентраций щелочной фосфатазы и каталазы в слюне у курильщиков группы ЭС и СНТ ниже, чем в группе некурящих. Статистически значимые различия наблюдались между курильщиками ЭС и СНТ в сравнении с некурящими пациентами ( p =0,004 и p =0,006 соответственно). Концентрация малонового диальдегида в слюне у курильщиков группы ЭС и СНТ также выше, чем в группе некурящих. Статистически значимые различия наблюдались между курильщиками ЭС и СНТ в сравнении с некурящими пациентами ( p =0,007).
Наши данные схожи с результатами предыдущих исследований. Так, в исследовании D. Cichonska с соавт., проведенном среди пользователей ЭС, значение pH было ниже, а концентрация общего белка, кальция и фосфатов выше, чем в группе некурящих. Статистически значимые различия наблюдались в отношении кальция. Среди традиционных курильщиков значение рН было ниже, концентрации общего белка и фосфатов выше, чем в группе некурящих. Статистически значимые различия наблюдались в отношении общего белка [11]. По данным A. Fattahi Bafghi с соавт., курение табака снижает содержание общего белка, кальция и свинца в слюне, однако не влияет на содержание натрия, калия и магния в слюне [12]. В исследовании D. Cichonska с соавт. доказано, что использование ЭС влияет на антиоксидантную способность слюны в той же степени, что и традиционные сигареты, при сравнении курильщиков и некурящих [13]. Результаты исследования A. K. Pandarathodiyil с соавт. показали более высокие уровни фермента лактатдегидрогеназы в слюне при курении вейперов по сравнению с контрольной группой, что подтверждает цитотоксическое и вредное воздействие ЭС на слизистую оболочку полости рта [14].
В свете новых данных о потенциальных вредных последствиях вейпинга (ЭС) и СНТ крайне важно, чтобы молодые люди получали раннее просвещение с целью исправления любого неправильного представления об ЭС и СНТ по сравнению с пристрастием к курению и потенциальными рисками для здоровья, связанными с этими пагубными привычками.
Заключение. Статистически значимые различия в результатах изменения характеристик ротовой жидкости в виде рН, скорости естественного слюноотделения, вязкости ротовой жидкости, содержания белка, кальция, фосфатов, щелочной фосфатазы, каталазы и малонового диальдегида обнаружены как между группами с разным статусом курения, так и между курящими и некурящими пациентами. Это позволяет предположить, что курение ЭС/СНТ по-разному влияет на здоровье полости рта. При этом анализ полученных данных позволяет предположить то, что пародонтопатогенное влияние СНТ (которые содержат никотин) проявляется в более значительной мере, чем при курении ЭС, но в обеих группах реализуется через изменение свойств ротовой жидкости и влияет на гигиеническое состояние полости рота курильщиков как при курении ЭС, так и при курении СНТ.
По нашему мнению, дальнейшие клинические исследования в этом направлении будут перспективными для оказания профессиональной стоматологической помощи указанных групп пациентов.
Список литературы Особенности изменения характеристик ротовой жидкости у курильщиков электронных сигарет и систем нагревания табака
- Tobacco. WHO. URL: https://www.who.int / ru / newsroom / fact-sheets / detail / tobacco (18 Dec 2022). Табак. ВОЗ. URL: https://www.who.int / ru / news-room / fact-sheets / detail / tobacco (дата обращения: 18.12.2022).
- Mammadov FYu, Safarov DA, Aleskerova SM. Pathogenetic aspects of the effect of smoking on the condition of organs and tissues of the oral cavity. Bulletin of Biology and Medicine Problems. 2017; 1 (2): 367–72. (In Russ.) Мамедов Ф. Ю., Сафаров Д. А., Алескерова С. М. Патогенетические аспекты влияния курения на состояние органов и тканей полости рта. Вестник проблем биологии и медицины. 2017; 1 (2): 367–72. EDN: VKFMMJ.
- Alyavia OT, Nishanova AA, Gulyamova SP. Effect of smoking on secretory activity of salivary glands. Stomatologiya. 2018; 4 (73): 74–5. (In Russ.) Алявия О. Т., Нишанова А. А., Гулямова С. П. Влияние курения на секреторную активность слюнных желез. Stomatologiya. 2018; 4 (73): 74–5. DOI: 10.26739 / 2091‑5845‑2018‑1‑8. EDN: YYBLJJ.
- Antonov NS, Sakharova GM, Donitova VV. E-cigarettes: assessment of safety and health risks. Pulmonology. 2014; (3): 122–7. (In Russ.) Антонов Н. С., Сахарова Г. М., Донитова В. В. Электронные сигареты: оценка безопасности и рисков для здоровья. Пульмонология. 2014; (3): 122–7.
- Chaffee BW, Couch ET, Vora MV, Holliday RS. Oral and periodontal implications of tobacco and nicotine products. Periodontol 2000. 2021; 87 (1): 241–53. DOI: 10.1111 / prd.12395
- Abaykhanova MA. Effect of e-cigarettes on oral mucosa. Fundamental Aspects of Mental Health. 2018; (2): 22–5. (In Russ.) Абайханова М. А. Влияние электронных сигарет на состояние слизистой рта. Фундаментальные аспекты психического здоровья. 2018; (2): 22–5.
- Akiyama Y, Sherwood N. Systematic review of biomarker findings from clinical studies of electronic cigarettes and heated tobacco products. Toxicol Rep. 2021; (8): 282–94. DOI: 10.1016 / j.toxrep.2021.01.014.
- Ömeroğlu Şimşek G, Kılınç G, et al. Effects of oral pH changes on smoking desire. Balkan Med J. 2021; 38 (3): 165–70. DOI: 10.5152 / balkanmedj.2021.20125. PMID: 34142959. PMCID: PMC8880939.
- Baliga S, Muglikar S, Kale R. Salivary pH: A diagnostic biomarker. J Indian Soc Periodontol. 2013; 17 (4): 461–5. DOI: 10.4103 / 0972-124X.118317. PMID: 24174725. PMCID: PMC3800408.
- Kumar CN, Rao SM, Jethlia A, et al. Assessment of salivary thiocyanate levels and pH in the saliva of smokers and nonsmokers with chronic periodontitis — A comparative study. Indian J Dent Res. 2021; 32 (1): 74–8. DOI: 10.4103 / ijdr. IJDR_387_19. PMID: 34269241.
- Cichońska D, Kusiak A, Kochańska B, et al. Influence of electronic cigarettes on selected physicochemical properties of saliva. Int J Environ Res Public Health. 2022; 19 (6): 3314. DOI: 10.3390 / ijerph19063314. PMID: 35329001. PMCID: PMC8953991.
- Fattahi Bafghi A, Goljanian Tabrizi A, Bakhshayi P. The effect of smoking on mineral and protein composition of saliva. Iran J Otorhinolaryngol. 2015; 27 (81): 301–5. PMID: 26788479. PMCID: PMC4710883.
- Cichońska D, Król O, Słomińska EM, et al. Influence of electronic cigarettes on antioxidant capacity and nucleotide metabolites in saliva. Toxics. 2021; 9 (10): 263. DOI: 10.3390 / toxics9100263. PMID: 34678959. PMCID: PMC8538442.
- Pandarathodiyil AK, Ramanathan A, Garg R, et al. Lactate dehydrogenase levels in the saliva of cigarette and e-cigarette smokers (vapers): A comparative analysis. Asian Pac J Cancer Prev. 2021; 22 (10): 3227–35. DOI: 10.31557 / APJCP.2021.22.10.3227. PMID: 34710999. PMCID: PMC8858253.


