Особенности экспрессии AIF в гиппокампе крыс при экспериментальном моделировании стеноза общих сонных артерий
Автор: Смирнов А.В., Медников Д.С., Тюренков И.Н., Куркин Д.В., Волотова Е.В., Бакулин Д.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Статья в выпуске: 2 (66), 2020 года.
Бесплатный доступ
Представлены результаты иммуногистохимического исследования маркера каспазо-независимого апоптоза AIF в пирамидном слое гиппокампа крыс при экспериментальном моделировании стеноза общих сонных артерий. Достоверное усиление экспрессии выявлено в зонах СА1 и СА3 как в увеличении относительной площади иммунореактивного материала, так и в интенсивности реакции. Морфометрическое исследование выявило достоверное увеличение удельного количества поврежденных нейронов в зонах СА1 и СА3.
Гиппокамп, стеноз сонных артерий, апоптоз, крыса
Короткий адрес: https://sciup.org/142225953
IDR: 142225953 | УДК: 611.37-091.5-0.71.3
Текст научной статьи Особенности экспрессии AIF в гиппокампе крыс при экспериментальном моделировании стеноза общих сонных артерий
Несмотря на значительные успехи в изучении, цереброваскулярные болезни (ЦВБ) остаются на сегодняшний день во многом не решенной задачей. Постоянно растущая заболеваемость основными факторами риска, такими как артериальная гипертензия в сочетании с церебральным атеросклерозом обуславливают необходимость поиска новых, а также улучшения уже имеющихся подходов к диагностике, лечению и реабилитации больных ЦВБ [1, 2]. Учитывая частое развитие дисциркуляторной энцефалопатии различной степени тяжести, вплоть до деменции, при прогрессирующих хронических формах ЦВБ, особенную актуальность приобретает исследование закономерностей и особенностей повреждения структур головного мозга, отвечающих за когнитивные навыки [2, 3]. Несомненно, наиболее перспективным направлением изучения является исследование ранних прогностически значимых маркеров нейронального повреждения и гибели. В современной литературе описано множество путей нейрональной смерти при различных повреждениях, в том числе при ишемии, при этом нет строгой специфичности в выборе клеткой того или другого механизма и внутриклеточные взаимодействия на разных этапах могут как останавливать процесс, так и переключать его на другой путь реализации [4]. В последние годы все больший интерес привлекает исследование механизмов каспаз-независмого апоптоза, реализуемого при участии AIF (apoptosis inducing factor, апоптоз-индуцирующий фактор). AIF-опосредованная нейрональная смерть – уникальный механизм, имеющий также название партанатос – разновидность регулируемой клеточной гибели, которая зависит от активности PARP (poly-ADP-ribose polymerases, поли-АДФ-рибоза полимеразы) [4, 5]. PARP обуславливает перемещение митохондриального AIF к ядру, где происходит дальнейшая деградация хроматина и апоптоти- ческая гибель нейрона без участия эффекторных каспаз [5, 6]. Изучение AIF тем более актуально в свете большого разнообразия вариантов нейрональной смерти, ограниченной возможности регистрировать каспаз-зависимые формы апоптоза, а также имеющихся сообщений об исключительном участии AIF при некоторых формах ЦВБ [6].
ЦЕЛЬ РАБОТЫ
Качественными и количественными методами описать особенности экспрессии AIF в пирамидном слое гиппокампа крыс при экспериментальном моделировании стеноза общих сонных артерий.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследование выполнено на 25 белых аутбредных крысах-самцах (ФГУП ПЛЖ «Рап-полово», Ленинградская область) в возрасте 7– 8 месяцев. Животные были разделены на две группы: 1-я – контрольные крысы (n = 10), 2-я – крысы с моделируемым нарушением кровообращения (n = 15). Содержание животных соответствовало правилам лабораторной практики (GLP) и Приказу МЗ РФ № 267 от 19.06.2003 г. «Об утверждении правил лабораторной практики». Стеноз общих сонных артерий моделировался путем частичного ограничения кровотока с помощью наложения лигатур. Наркотизированное животное (хлоралгидрат, интраперитонеально, 400 мг/кг) фиксировали, область шеи выбривали, обрабатывали 0,05%-м раствором хлоргексидина биглюконата. Далее выделяли сосудисто-нервный пучок, образованный общей сонной артерией и блуждающим нервом, который орошали 2%-м раствором лидокаина. После выделения сонной артерии под нее подводили три лигатуры, располагаемые на расстоянии 2–3 мм друг от друга. Параллельно артерии закрепляли иглу (29G 1/2) от шприца (SFM Hospital Products GmbH, Германия), к которой привязывалась сонная артерия и которая затем убиралась таким образом, чтобы лигатуры оставались на заданном расстоянии. В результате описанных выше манипуляций кровоток по сонным артериям ограничивался в головном мозге на 40–50 % от изначальных значений. Оценку уровня локального кровотока (ЛМК, у. е.) осуществляли до и после стенозирования сонной артерии в двух точках, в месте сразу после наложения лигатур и в проекции средней мозговой артерии. После операции рану послойно ушивали, обрабатывали 0,05%-м раствором хлоргексидина биглюконата и 5%-м раствором йода, животных переносили в домашние клетки.
Через 20 дней после операции оценивалось психоневрологическое состояние, сохранность рефлексов и поведение и двигательная активность. На 22-е сутки животные выводились из эксперимента с применением в качестве наркоза хлоралгидрата (400 мг/кг, интраперитонеально), декапитировали гильотинным методом («Гильотина для крыс» AE0702, производитель «Open Science»), получали образцы головного мозга. Образцы головного мозга животных фиксировали в 10%-м растворе формалина, приготовленном на 0,2 mМ фосфатном буфере с дальнейшей гистологической проводкой и изготовлением серийных парафиновых срезов толщиной 5 мкм, которые окрашивали по стандартным методикам гематоксилином и эозином, тионином по Нисслю. Иммуногистохимическое исследование проводили непрямым перокси-дазно-антипероксидазным методом с использованием поликлональных антител к AIF (1:100) согласно протоколу производителя, с использованием полимерной системы (Thermo Scientific, Fremont, CA). В качестве хромогена использовали DAB (диаминобензидин).
Оценку изменения уровня экспрессии определяли путём подсчёта относительной площади иммунопозитивного материала (ИМ), а также интенсивности реакции в соответствии с 4-балльной адаптированной шкалой Allred (0 – отсутствие реакции, 1 – слабая интенсивность, 2 – умеренная интенсивность, 3 – выраженная интенсивность) во всех зонах гиппокампа с использованием модуля Image Analysis программы ZEN 1.1.2.0 (Carl Zeiss Microscopy GmbH, Germany). Исследование микропрепаратов проводилось с помощью микроскопа «Axio Lab. A1» (Carl Zeiss Microscopy GmbH, Germany), фотодокументирование осуществляли камерой «AxioCam 105 color» (Carl Zeiss Microscopy GmbH, Germany). Статистическую обработку данных проводили с использованием пакетов программ Statistica 6,0 (StatSoft, USA). Обобщенные данные представляли в виде медианы (Me) с указанием интерквартильного интервала [Q1;Q3]. Различия между группами оценивали по критерию Манна – Уитни (Mann – Whitney, U-test) и считали статистически значимыми при p < 0,05, о тенденции говорили при диапазоне 0,05 < p < 0,06.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
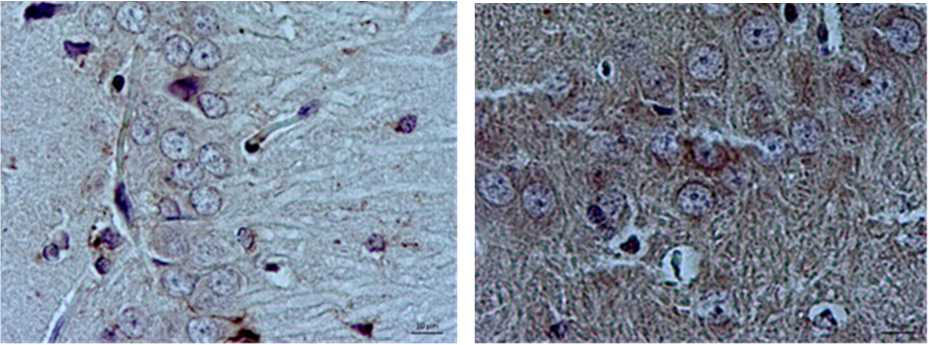
При гистологическом исследовании гиппокампа крыс 2-й группы наиболее выраженные изменения были обнаружены в пирамидном слое зоны СА1, где выявлено достоверное увеличение удельного количества пирамидных нейронов с признаками повреждения на 23 % по сравнению с контролем (p < 0,001) (см. табл.). Среди поврежденных нейронов доминировали гиперхромные, часть из которых сочетала в себе как гиперхромию ядра и цитоплазмы, так и деформацию перикариона. Сосудистые нарушения проявлялись умеренным периваскулярным отеком и эритроцитарными стазами в просветах микроциркуляторных сосудов. Иммуногистохимическое исследование зоны СА1 с применением антител к AIF выявило достовер- ное усиление экспрессии как в увеличении относительной площади иммунопозитивного материала на 3,1 % (р < 0,001) (рис. 1), так и в степени экспрессии по сравнению с 1-й группой. У контрольных животных степень экспрессии достигала 1 балла, тогда как в группе с моделируемым стенозом сонных артерий увеличивалась до 2 баллов (см. табл.). Иммунопозитивный материал носил равномерное мелкоглобулярное цитоплазматическое распределение в виде узкого ободка вокруг ядер перикарионов пирамидных нейронов (рис. 2).
Динамика изменения удельного количества пирамидных нейронов с признаками повреждения и изменение параметров экспрессии AIF-позитивного материала в пирамидном слое гиппокампа крыс с моделируемым стенозом общих сонных артерий
|
Параметр |
Контроль |
Моделируемый стеноз общих сонных артерий |
||||||
|
СА1 |
СА2 |
СА3 |
СА4 |
СА1 |
СА2 |
СА3 |
СА4 |
|
|
Удельное количество нейронов с признаками повреждения, % |
8,2 [6,8;9,7] |
6,8 [4,5;8,9] |
6,3 [4,6;9] |
4,4 [2,9;7,0] |
31,2 [22,4;41]*** |
10,2 [7,1;18] |
15 [8,2;22,1]** |
7,7 [3;10,2] |
|
Относительная площадь ИРМ, AIF, % |
4,1 [3,5;4,4] |
2,9 [1,8;3,4] |
4,7 [4;5,5] |
3 [2,3;3,5] |
7,2 *** [5,8;7,9]*** |
4,1 [3,2;4,5] |
7,5 *** [6,3;8,1]*** |
3,3 [2,9;3,8] |
|
Интенсивность ИРМ, AIF, баллы |
+ |
+ |
+ |
+ |
++ |
+ |
++ |
+ |
Примечание. ** – р < 0,01 – различия достоверны по сравнению с контрольной группой; *** – р < 0,001 – различия достоверны по сравнению с контрольной группой (использован критерий Манна – Уитни).
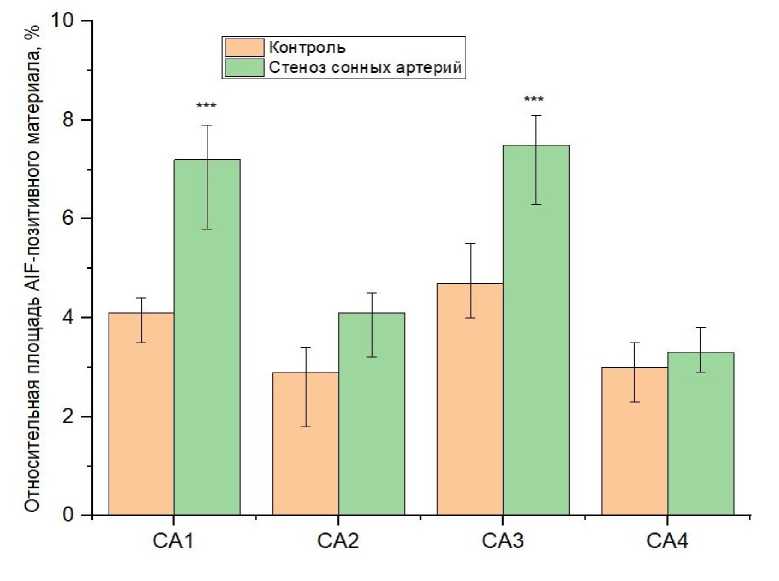
Рис. 1. Изменение относительной площади AIF-позитивного материала при моделировании стеноза общих сонных артерий:
*** – р < 0,001 – различия достоверны по сравнению с контрольной группой (использован критерий Манна – Уитни)
А Б
Рис. 2. Иммуногистохимическое исследование СА1 зоны гиппокампа крыс с применением антител против AIF: А – контрольная группа; Б – группа крыс с моделируемым стенозом общих сонных артерий, увеличение площади и усиление интенсивности ИРМ. Ув. х 400, докраска гематоксилином
Гистологическое исследование зоны СА2 гиппокампа крыс 2 групп не выявило достоверных отличий от контроля в удельном количестве нейронов с признаками повреждения. Встречались отдельные нейроны с комбинированной гиперхромией ядра и цитоплазмы и сморщенными перикарионами. При иммуногистохимическом исследовании с применением антител к AIF зоны СА2 крыс 2-й группы достоверных отличий от контроля не выявлено ни в относительной площади иммунопозитивного материала, ни в степени экспрессии, остававшейся на уровне 1 балла.
При гистологическом исследовании зоны СА3 гиппокампа крыс 2-й группы выявлено достоверное увеличение удельного количества пирамидных нейронов с признаками повреждения на 8,7 % по сравнению с контролем (p < 0,01) (см. табл.). Как и в зонах СА1 и СА2, для СА3 было характерно преобладание ги-перхромных или гиперхромных в сочетании с пикноморфно деформированными перикарионами пирамидных нейронов. Нарушения гистоархитектоники в данной зоне также проявлялось в умеренных сосудистых нарушениях. При иммуногистохимическом исследовании пирамидного слоя зоны СА3 обнаружено достоверное усиление экспрессии AIF-позитивного материала на 2,8 % по сравнению с 1-й группой (р < 0,001) (рис. 1). Кроме того, отмечено изменение степени экспрессии с преимущественно слабой (1 балл) в контрольной группе до умеренной (2 балла) в группе крыс с моделируемым стенозом сонных артерий (см. табл.).
При гистологическом исследовании зоны СА4 пирамидного слоя гиппокампа крыс 2-й группы достоверных отличий от 1-й группы в удельном количестве нейронов с признаками повреждения не обнаружено. При качественном исследовании обнаружены умеренный перицеллюлярный и периваскулярный отек, а также отдельные тотально гиперхромные нейроны в сочетании со сморщиванием перикариона. При иммуногистохимическом исследовании с применением антител к AIF пирамидного слоя зоны СА4 крыс из 2-й группы достоверных отличий от контроля не выявлено как в значениях относительной площади иммунопозитивного материала, так и в степени экспрессии, которая оставалась слабо выраженной (1 балл).
Обнаруженное нами достоверное увеличение удельного количества нейронов с признаками повреждения в зонах СА1 и СА3 свидетельствует, на наш взгляд, о большей уязвимости данных зон к длительной ишемии, вызванной стенозированием сонных артерий по сравнению с зонами СА2 и СА4. Так, признаки компенсаторно-приспособительных процессов в виде изменения формы и размеров перикарионов пирамидных нейронов, также как и изменения в микроциркуляторном русле, были характерны и равномерно выражены для всех зон, при этом признаки обратимо и необратимо поврежденных пирамидных нейронов значимо усиливались лишь в зонах СА1 и СА3, что соотносится с литературными данными, где сообщается о более выраженных изменениях именно в этих областях гиппокампа при различных воздействиях, в том числе при ишемии [7, 8]. Кроме того, необходимо отметить, что нами была выявлена межполушарная асимметрия повреждений гиппокампа, при сопоставимых по выраженности сосудистых нарушениях в виде умеренного перицеллюлярного и периваскулярного отека как в левом, так и в правом гиппокампе, количественные морфо- метрические параметры более выраженно изменялись в правом.
В ряде работ [7, 9] сообщается о неравномерной выраженности повреждений гиппокампа правого и левого полушарий, что связывают с индивидуальными особенностями сосудистой системы и подобную асимметрию выявляют у крыс с менее активным типом поведения. Сообщается о разной степени васкуляризации зон СА1 и СА3 по сравнению с зонами СА2 и СА4, а также вариабельности относительной площади сосудов микроциркуляторного русла в гиппокампе левого и правого полушарий, с чем, по-видимому, связаны менее выраженные компенсаторные способности зон СА1 и СА3 правого гиппокампа в условиях персистирующего отека, нарастающей гипоксии и эксайтотоксического повреждения. Важную роль в процессах повреждения, более характерных для зон СА1 и СА3, на наш взгляд, играет каспаз-независимый путь активации апоптоза, с чем мы связываем достоверное усиление экс-пресии маркера AIF-опосредуемой клеточной гибели в этих зонах у крыс с моделируемым стенозом сонных артерий. Необходимо отметить, что существует два внутриклеточных пула AIF: мито-хонриальный и цитозольный [6]. Высвободившийся из митохондрий и транслоцируемый при участии PARP к ядру клетки, АIF может расцениваться как уже запустивший необратимую деградацию хроматина и подобное повреждение считается необратимым [4, 6].
ЗАКЛЮЧЕНИЕ
Таким образом, при экспериментальном моделировании стеноза сонных артерий в пирамидном слое гиппокампа крыс отмечается достоверное усиление экспрессии AIF в зонах СА1 и СА3 в сочетании с достоверным увеличением количества поврежденных нейронов, что свидетельствует о большей уязвимости этих зон к длительной ишемии и большей выраженности процессов как обратимого, так и необратимого повреждения по сравнению с зонами СА4 и СА2.
Список литературы Особенности экспрессии AIF в гиппокампе крыс при экспериментальном моделировании стеноза общих сонных артерий
- Артюхина, Н. И. Межполушарная асимметрия повреждений гиппокампа после двусторонней перевязки общих сонных артерий [Текст] / Н. И. Артюхина, К. Ю. Саркисова // Российский физиологический журнал. - 2004. - Т. 90, № 2. -С. 146-156.
- Морфометрическое исследование гиппокампа правого полушария крыс при моделировании гипертензивной энцефалопатии.[Текст] / А. В. Смирнов [и др.] // Волгоградский научно-медицинский журнал. - 2016. - Т. 52, № 4. - С. 7-11.
- Нарушения мозгового кровообращения: диагностика, лечение, профилактика [Текст] / З. А. Суслина [и др.]. - М.: Медпресс-информ. - 2016. -536 с.
- Определение белков наружной мембраны митохондрий, взаимодействующих с белком AIF Acta Naturae [Текст] / Н. П. Фадеева [и др.]. - 2018. -Т. 10, № 4. - С. 100-109.
- Особенности экспрессии Beclin-1 и LAMP-2 в гиппокампе крыс при гравитационном воздействии в каудо-краниальном векторе [Текст] / А. В. Смирнов [и др.] // Бюллетень экспериментальной биологии и медицины. - 2018. - Т. 165, № 1. - С. 122-126.
- Особенности экспрессии HSP70, HSP90 и GFAP в гиппокампе крыс при моделировании гипертензивной энцефалопати [Текст] / А. В. Смирнов [и др.] // Клиническая и экспериментальная морфология. - 2017. - Т. 22, № 2. - С. 59-64.
- Шаповалова, В. В. Структурно-функциональная реорганизация гиппокампа правого и левого полушарий и функциональная межполушарная асимметрия в постреанимационном периоде [Текст] / В. В. Шаповалова, В. В. Семченко // Медицинский вестник Башкортостана. - 2009. -Т. 4, № 2. - С. 169-173.
- Cell death: a review of the major forms of apoptosis, necrosis and autophagy [Text] / M. S. D'Arcy // Cell. Biol. Int. - 2019. - Vol. 43, № 6. - Р. 582-592.
- Neuronal cell death [Text] / M. Fricker [и др.] // Physiol. Rev. - 2018. - Vol. 98, № 2. - Р. 813-880.


