Особенности экспрессии белка Клото в головном мозге крыс при экспериментальном моделировании сахарного диабета первого типа
Автор: Шмидт М.В., Смирнов А.В., Тюренков И.Н., Великородная Ю.И., Бакулин Д.А., Быхалов Л.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Статьи
Статья в выпуске: 3 т.21, 2024 года.
Бесплатный доступ
Цель исследования. Анализ взаимосвязей между характером и степенью патоморфологических изменений и экспрессией белка Клото в различных отделах головного мозга при экспериментальном воспроизведении стрептозотоцининдуцированного сахарного диабета. Моделирование стрептозотоцининдуцированного СД длительностью 6 месяцев проводилось на 30 белых беспородных лабораторных крысах-самках в возрасте 12 месяцев. Достоверное снижение иммуногистохимической экспрессии БК в нейронах и эпендиоцитах головного мозга, даже при отсутствии заметных патоморфологических изменений, позволяет рассматривать БК как многообещающий маркер ранних церебральных осложнений сахарного диабета, а его дефицит играет, по-видимому, существенную роль в развитии диабетической энцефалопатии.
Белок клото, сахарный диабет, диабетическая энцефалопатия
Короткий адрес: https://sciup.org/142242851
IDR: 142242851 | УДК: 616-005.4:611.813.14:616-092.9
Текст научной статьи Особенности экспрессии белка Клото в головном мозге крыс при экспериментальном моделировании сахарного диабета первого типа
Funding . The work was carried out with the financial support of the RSF grant No. 24-25-00247
На сегодняшний день сахарный диабет (СД) считается эпидемическим заболеванием и одной из ведущих причин смертности во многих странах мира. СД отрицательно влияет на качество и продолжительность жизни больных из-за большого количества осложнений [1]. В связи с ростом смертности и заболеваемости диабетом и его негативным влиянием практически на все органы
и ткани существует потребность в поиске биомаркеров ранней диагностики, оценки эффективности лечения и прогноза данного заболевания.
Белок Клото (БК), обнаруженный в результате исследований механизмов старения, был верифицирован как антивозрастной белок и назван в честь богини Клото, которая пряла нить жизни согласно греческой мифологии [1]. БК является важным ко-рецептором для фактора роста фибробластов, может подавлять окислительный стресс и регулировать ионные каналы и транспортеры [2]. Исследователи выделяют три относительно независимых пула БК: мозговой – вырабатываемый клетками различных отделов головного мозга; цереброспинальный – продуцируемый сосудистыми сплетениями и сывороточный – синтезируемый почками [3, 4].
Показано, что мыши, несущие дефектный ген БК, начинают быстро стареть, у них отмечаются атрофия кожи, остеопороз, атеросклероз, эмфизема и когнитивные нарушения [3, 5]. Уровни белка Клото в головном мозге и СМЖ человека также уменьшается с возрастом и при болезни Альцгеймера [6, 7]. Повышение экспрессии гена БК у трансгенных мышей, наоборот, увеличивает продолжительность их жизни, улучшает память и способность к обучению [3].
При СД БК защищает клетки от ускоренного старения и разрушения, вызванных окислительным стрессом, воспалением, нарушениями фосфатного и кальциевого обмена. Значительное снижение продукции БК выявлялось как у диабетиков, так и животных с экспериментальным сахарным диабетом. Подчеркивается, что такое снижение уровня БК существенно влияет на процессы формирования диабетической нефропатии, ишемической болезни сердца и цереброваскулярной патологии [1].
По литературным данным существует связь между обменом БК, гомеостазом глюкозы и секрецией инсулина. БК может снижать степень вазо-и нейропатических осложнений при возникновении сахарного диабета [1]. В связи с этим представляется чрезвычайно важной информация о взаимосвязи между характером и распределением БК в структурных образованиях головного мозга и степенью нейродегенеративных изменений при церебральных осложнениях СД.
ЦЕЛЬ РАБОТЫ
Определение взаимосвязей между характером и степенью экспрессии белка Клото в со- судистых сплетениях и различных структурах головного мозга с выраженностью патоморфо-логических изменений при экспериментальном воспроизведении сахарного диабета 1-го типа.
МЕТОДИКА ИССЛЕДОВАНИЯ
Экспериментальное исследование проведено на 30 белых беспородных лабораторных крысах-самках в возрасте 12 месяцев.
Моделирование стрептозотоцининдуциро-ванного СД длительностью 6 месяцев проводили по ранее описанной методике [8]. В качестве позитивного контроля использовали крыс без СД (интактных) той же партии животных. Забор тканей головного мозга проводили у наркотизированных (хлоралгидрат, 400 мг/кг, внутрибрюшинно) животных. Материал фиксировали в 10%-м нейтральном формалине, с дальнейшим обезвоживанием в батарее спиртов и изготовлением парафиновых блоков. Срезы толщиной 5–7 мкм окрашивали тионином по методу Ниссля.
Белок Клото (БК) выявляли с помощью иммуногистохимического исследования с использованием первичных антител к белку Клото в соответствии с инструкциями производителя (разведение 1 : 100) (Cloud-Clone Corp., КНР) и визуализирующей полимерной системы детекции с DAB (Elabsciences, КНР).
Для визуальной оценки интенсивности окраски срезы докрашивали гематоксилином. Интенсивность экспрессии на срезах оценивали с помощью программы анализа изображений ImageJ 1.54d. Определяли относительную площадь, занимаемую иммунопозитивным материалом в поле зрения микроскопа. Фотодокументирование осуществляли цифровой фотокамерой Olympus (Япония).
Статистическую обработку данных проводили с использованием пакета программ Statistica 6,0 (StatSoft, USA).
Различия между группами оценивали по критерию Манна – Уитни (Mann – Whitney, U-test) и считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
Проведенное нами ранее микроскопическое исследование структур головного мозга экспериментальных животных на данной модели стрепозотоцин-индуцированного сахарного диабета продемонстрировало наличие умеренных нейродегенеративных изменений в полях гип-покмпа (СА1, СА3).
В то же время в структурах неокортекса дистрофические изменения носили более интенсивный характер, с наибольшим количеством поврежденных нейронов в моторных и соматосенсорных отделах церебральной коры [9].
В группе интактных животных наиболее выраженная иммуногистохимическая экспрессия БК фиксировалась в структурах лимбической системы, различных функциональных отделах неокор-текса, а также сосудистых сплетениях головного мозга. БК выявлялся преимущественно в плаз-молемме и цитоплазме нейронов и в меньшей степени нейроглии.
Незначительное количество БК обнаруживалось также в нейропиле и белом веществе. В СА1 и СА3 гиппокампа иммунопозитивное окрашивание носило относительно мономорфный характер, в то время как в церебральной коре наблюдалось неравномерное распределение имунопозитивного материала: преобладали клетки с умеренной экспрессией белка в цитоплазме с наличием отдельных интенсивно окрашенных клеток. Цитоплазматическая экспрессия носила неоднородный, зернистый вид. Характерной чертой являлось формирование более крупных, интенсивно окрашенных гранул преимущественно в перинуклеарной области.
В группе животных с экспериментальным стрептозотоцининдуцированным сахарным диабетом иммуногостохимическое исследование продемонстрировало достоверное снижение относительной площади БК во всех исследуемых структурах головного мозга (см. табл.). При этом даже в областях с отсутствием каких-либо значимых нейродегенеративных изменений (СА1 поле гиппокампа), или наличием слабых признаков повреждения (СА3 поле гиппокампа), фиксировалось заметное уменьшение концентрации БК с преобладанием слабо позитивных и БК-негативных нейронов.
В различных функциональных отделах неокортекса также снижалась экспрессия БК в сохраненных нейронах, а в поврежденных клетках наблюдалось либо слабое, как правило, гомогенное иммунопозитивное окрашивание перикариона, либо его полное отсутствие (рис. 1).
Относительная площадь экспрессии белка Клото в различных функциональных отделах головного мозга при моделировании СД (M ± m %)
|
Структуры головного мозга |
Интакт |
СД |
|
CA1 поле гиппокампа |
0,91 ± 011 |
0,41 ±0,03 * |
|
CA3 поле гиппокампа |
1,50 ± 0,14 |
0,63 ± 0,04 * |
|
Моторная кора |
0,90 ± 0,08 |
0,55 ± 0,08 * |
|
Соматосенсорная кора |
1,15 ± 0,12 |
0,47 ± 0,02 * |
|
Аудиторная кора |
1,03 ± 0,06 |
0,43 ± 0,05 * |
* Показатели статистически значимо отличаются от группы интакт при р < 0,05; Критерий Манна – Уитни.
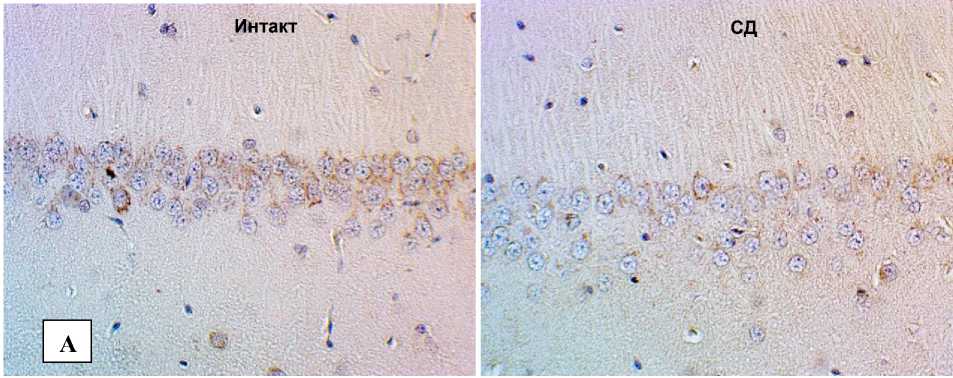
Рис. 1. Снижение экспрессии БК в структурах головного мозга при экспериментальной диабетической энцефалопатии: А – СА1 поле гиппокампа;
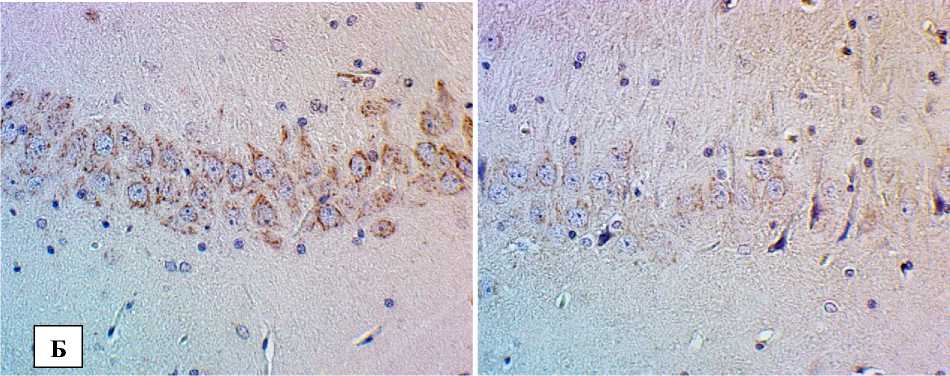
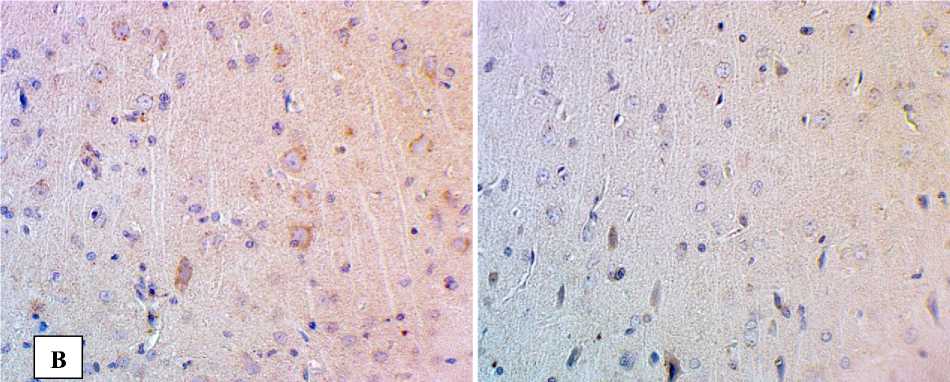
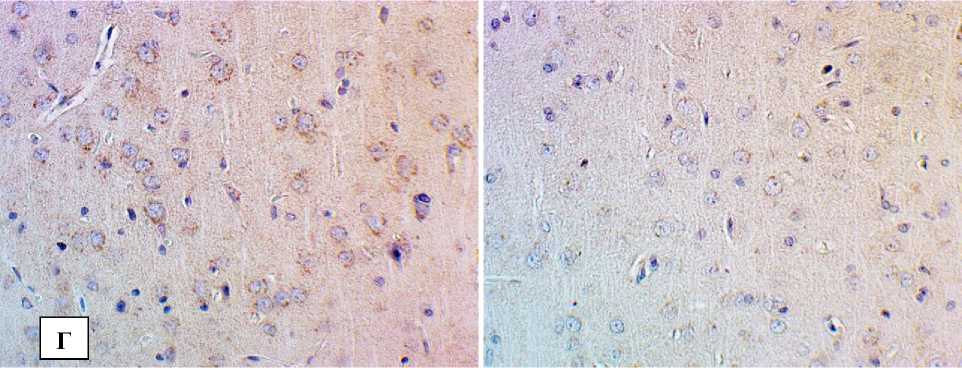
Рис. 1. Снижение экспрессии БК в структурах головного мозга при экспериментальной диабетической энцефалопатии:
Б – СА3 поле гиппокампа; В – моторная кора; Г– соматосенсорная кора. Иммуногистохимическое исследование, антитела против БК, докраска гематоксилином. Увеличение ×400
В хориоидальных сплетениях интактных животных БК визуализировался преимущественно в клетках эпендимы, в виде иммунопозитивных цитоплазматических гранул. В группе животных с экспериментальным СД 1-го типа отмечалось умеренное уменьшение интенсивности окраши- вания (рис. 2). Преобладали эпендимоциты со слабой и средней экспрессией БК, и лишь в единичных клетках отмечалось выраженное окрашивание цитоплазмы. По результатам морфометрического исследования относительная площадь иммунопозитивного материала в сосудистых сплетениях головного мозга составила (14,08 ± 1,15) % в группе интактных животных и (8,26 ± 1,19) % при моделировании стрептозотоцининду-цированного сахарного диабета (р = 0,028).
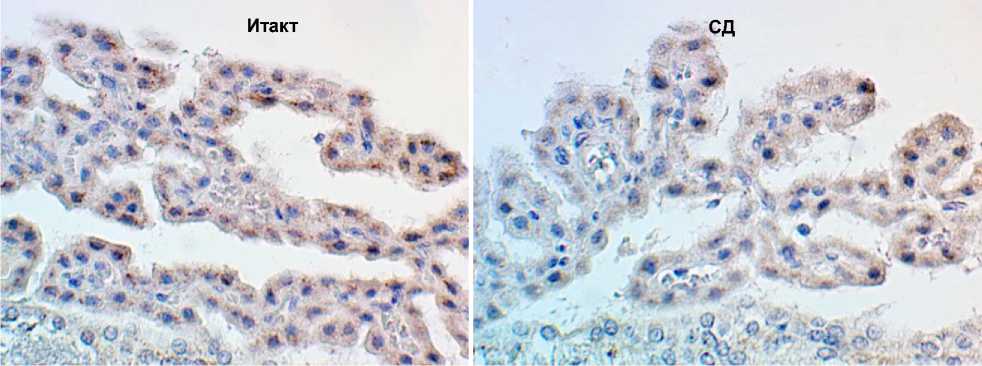
Рис. 2. Умеренное снижение экспрессии БК в эпендимальных клетках сосудистых сплетений головного мозга при экспериментальной диабетической энцефалопатии. Иммуногистохимическое исследование, антитела против БК, докраска гематоксилином. Увеличение ×400
Таким образом, результаты исследования свидетельствуют о корреляции уровня экспрессии БК cо степенью патоморфологических изменений в структурах головного мозга крыс при экспериментальном моделировании СД 1-го типа. По результатам иммуногистохимического исследования можно сделать вывод, что данная модель СД сопровождается значимым снижением экспрессии БК как в веществе головного мозга, так и сосудистых сплетениях, и, возможно, в цереброспинальной жидкости. Достоверное снижение иммуногистохимической экспрессии БК в структурах головного мозга, даже в отсутствие выраженных патоморфологических изменений, демонстрирует тот факт, что БК является маркером ранних церебральных осложнений сахарного диабета.
По данным литературы, БК обеспечивает регуляцию абсорбции глюкозы, улучшает чувствительность к инсулину, снижает окислительный стресс и подавляет воспаление, что значительно снижает тяжесть проявлений СД [1], поскольку нейровоспаление рассматривается как важнейший патогенетический механизм повреждения функций нейронов при диабетической энцефалопатии [10]. Следовательно, наблюдаемый в нашем эксперименте дефицит нейрональной и эпендимальной фракций БК играет, по-видимому, существенную роль в развитии диабетической энцефалопатии. С другой стороны, усиление экс- прессии белка, особенно на ранней стадии заболевания, будет способствовать профилактике церебральных осложнений СД, а также замедлению или прекращению их прогрессирования.
Список литературы Особенности экспрессии белка Клото в головном мозге крыс при экспериментальном моделировании сахарного диабета первого типа
- Haina Zhang, Lou Yu, Gai Yun. Reduced Serum Levels of Klotho are Associated with Mild Cognitive Impairment in Patients with Type 2 Diabetes Mellitus. Diabetes, Metabolic Syndrome and Obesity. 2023;16:129-137.
- Sarah M. Clinton, Matthew E. et al. Expression of klotho mRNA and protein in rat brain parenchyma from early postnatal development into adulthood. Brain Res. 2013;1527:1-14. 10.1016/j.brainres. 2013.06.044. DOI: 10.1016/j.brainres.2013.06.044
- Прохорова Т. А., Бокша И. С., Савушкина О. К. и др. Белок α-клото при нейродегенеративных и психических заболеваниях. Журнал неврологии и психиатрии. 2019;1:80-88. EDN: YWZVDV
- Shun-Ai Li, Masami Watanabe, Hiroshi Yamada et al. Immunohistochcmical Localization of Klotho Protein in Brain, Kidney, and Reproductive Organs of Mice. Сell structure and function. 2004;29:91-99.
- Kenneth Lim, Arnoud Groen, Guerman Molostvov et al. Klotho expressison in human tissues. The Journal of Clinical Endocrinology and Metabolism. 2015; 100(10):E1308-1318. DOI: 10.1210/jc.2015-1800
- Li D., Jing D., Liu Z. et al. Enhanced Expression of Secreted - Klotho in the Hippocampus Alters Nesting Behavior and Memory Formation in Mice. Front. Cell. Neurosci. 2019;13:133. 10.3389/fncel. 2019.00133. DOI: 10.3389/fncel.2019.00133
- Zhou H.-J., Li H., Shi M.-Q. et al. Effect of Klotho against Ischemic Brain Injury Is Associated with Inhibition of RIG-I/NF-kB Signaling. Front. Pharmacol. 2017;8:950. DOI: 10.3389/fphar.2017.00950
- Тюренков И. Н., Смирнов А. В., Бакулин Д. А. и др. Морфологические особенности миокарда при экспериментальном СД и его фармакологической коррекции мефаргином. Волгоградский научно-медицинский журнал. 2022; 4:25-29. EDN: QDYIZS
- Шмидт М. В., Смирнов А. В., Тюренков И. Н. и др. Особенности экспрессии BDNF в головном мозге крыс при экспериментальном моделировании сахарного диабета 1 типа. Волгоградский научно-медицинский журнал. 2023;3:58-63. EDN: FOLMRJ
- Смирнов А. В., Бисинбекова А. И., Бакулин Д. А. и др. Морфофункциональные изменения первичной соматосенсорной коры головного мозга при экспериментальном сахарном диабете 1-го типа. Вестник Волгоградского государственного медицинского университета. 2024;21(1):146-152. EDN: KQHYSY


