Особенности экспрессии белка LIMCH1, связанные с лимфогенным метастазированием при раке молочной железы
Автор: Алифанов В.В., Таширева Л.А., Завьялова М.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.22, 2023 года.
Бесплатный доступ
Лимфогенное метастазирование не только является вариантом прогрессирования при раке молочной железы, но и связано с развитием гематогенных метастазов. Белок LIMCH1 (LIM And Calponin Homology Domains 1) участвует в мезенхимальном типе миграции вследствие активации немышечного миозина IIA. Цель исследования - изучить ассоциацию различных вариантов экспрессии белка LIMCH1 с лимфогенным метастазированием. Материал и методы. В ретроспективное исследование было включено 53 больных с диагнозом инвазивной карциномы молочной железы неспецифического типа. В группу исследования были включены больные со всеми молекулярно-биологическими под-типами (люминальный А, люминальный Б, HER2-позитивный и трижды негативный). Средний возраст больных составил 55,4 ± 14 лет. По классификации TNM больные имели стадии T1-3N0-3M0. Предоперационного химиотерапевтического лечения больные не получали. Экспрессия белка LIMCH1 в опухолевых клетках оценивалась иммуногистохимическими методами. Использовались антитела anti-LIMCH1-Prestige (HPA004184, Sigma Aldrich, Germany) и anti-LIMCH1-C-term (SAB2700402, Sigma Aldrich, Germany). Результаты. Лимфогенные метастазы чаще развивались в группе больных с наличием экспрессии белка LIMCH1 в опухолевых клетках. Это справедливо для цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, но не для субмембранной экспрессии или экспрессии белка LIMCH1, определяемого по LIM домену, вне зависимости от локализации в клетке. Данный феномен не был ассоциирован с морфологической гетерогенностью рака молочной железы. Наиболее неблагоприятным фактором безметастатической выживаемости является сочетание наличия лимфогенных метастазов и цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену. Заключение. Развитие синхронных лимфогенных метастазов при раке молочной железы ассоциировано с наличием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену в ткани первичной опухоли.
Рак молочной железы, лимфогенное метастазирование, инвазия, морфологическая гетерогенность
Короткий адрес: https://sciup.org/140297283
IDR: 140297283 | УДК: 618.19-006.6-033.2:611-018.98:577.112 | DOI: 10.21294/1814-4861-2023-22-1-74-81
Текст научной статьи Особенности экспрессии белка LIMCH1, связанные с лимфогенным метастазированием при раке молочной железы
Метастазирование в лимфатические узлы является вариантом прогрессирования рака молочной железы и фактором, влияющим на развитие гематогенных метастазов. Изучение механизмов развития метастазов является одним из перспективных направлений современной онкологии [1]. Механизмы развития лимфогенных и гематогенных метастазов имеют некоторые различия. Известно, что развитие лимфогенных метастазов происходит преимущественно при коллективном типе миграции опухолевых клеток [2, 3]. Имеются данные о том, что лимфогенное метастазирование происходит с большей эффективностью вследствие более высокой проницаемости стенки лимфатических сосудов относительно стенки кровеносных сосудов [4].
Коллективная миграция представляет собой скоординированное движение группы клеток, которые связаны межклеточными контактами. При коллективном типе миграции клетки-лидеры демонстрируют мезенхимный механизм движения [5]. Отличительной чертой мезенхимального варианта инвазии клеток является формирование субклеточных структур ламеллоподий и филоподий при миграции. На молекулярном уровне такой механизм осуществляется благодаря полимеризации и ветвлению нитей актина [6]. В этих событиях принимает участие множество вспомогательных белков. В последнее время уделяется внимание изучению одного из таких белков – LIMCH1 (LIM And Calponin Homology Domains 1). Белок LIMCH1, регулируя активность немышечного миозина IIА типа, способствует ретроградному току актина в ламеллах, а также повышает прочность фокальных спаек, что характерно для мезенхимального типа клеточной миграции [7]. В связи с этим представляет интерес изучение ассоциации экспрессии белка LIMCH1 с лимфогенным метастазированием при раке молочной железы.
Цель исследования ‒ изучить ассоциацию различных вариантов экспрессии белка LIMCH1 с лимфогенным метастазированием.
Материал и методы
В ретроспективное исследование было включено 53 больных с инвазивной карциномой молочной железы неспецифического типа, проходивших лечение в клиниках НИИ онкологии Томского НИМЦ с 2007 по 2018 г. Средний возраст составил 55,4 ± 14 лет. Диагноз был установлен на основании клинических, морфологических и иммуногистохимических критериев в соответствии с рекомендациями ВОЗ (2019). В исследуемую группу были включены все молекулярно-биологические подтипы РМЖ (люминальный А, люминальный Б, HER2-позитивный и трижды негативный). По классификации TNM больные имели стадии T1–3N0–3M0 (табл. 1). Предоперационную химиотерапию не проводили. У всех обследованных лиц было получено добровольное информированное согласие в соответствии с требованиями локального этического комитета НИИ онкологии Томского НИМЦ (протокол № 7 от 24 мая 2021 г.).
Материалом для исследования служили фрагменты опухоли, полученные на хирургическом этапе лечения. Материал фиксировался в 10 % нейтральном формалине и помещался в парафин. Проводка материала и изготовление гистологических препаратов осуществлялись по стандартной методике.
Таблица 1/table 1
|
Параметр/Parameter |
Нет ЛМ/ Absence LM |
Есть ЛМ/ Presence LM |
Общая группа/ General group |
|
Возраст, лет/Age, years |
|||
|
<35 |
3,2% (1/31) |
4,5% (1/22), p=1,0000 |
3,7% (2/53) |
|
35–50 |
16,1% (5/31) |
50% (11/22), p=0,0142 |
30,2% (16/53) |
|
>50 |
80,6% (25/31) |
45,5% (10/22), p=0,0172 |
66,1% (35/53) |
|
Состояние менструальной функции/Menstrual function |
|||
|
Сохранена/In the norm |
29% (9/31) |
45,5% (10/22), p=0,2557 |
35,8% (19/53) |
|
Менопауза/Menopause |
71% (22/31) |
54,5% (12/22), p=0,2557 |
64,2% (34/53) |
|
Размер первичной опухоли, мм/Tumor size, mm |
|||
|
<20 |
35,5% (11/31) |
31,8% (7/22), p=1,0000 |
34% (18/53) |
|
20–50 |
64,5% (20/31) |
68,2% (15/22), p=1,0000 |
66% (35/53) |
|
Молекулярно-биологический подтип/Molecular type |
|||
|
Люминальный А/Luminal A |
29% (9/31) |
22,7% (5/22), p=0,7552 |
26,4% (14/53) |
|
Люминальный Б/Luminal B |
45,2% (14/31) |
40,9% (9/22), p=0,7861 |
43,4% (23/53) |
|
Трижды-негативный/Triple-negative |
12,9% (4/31) |
22,7% (5/22), p=0,4637 |
17% (9/53) |
|
HER2-позитивный/HER2-positive |
12,9% (4/31) |
13,6% (3/22), p=1,0000 |
13,2% (7/53) |
|
Степень злокачественности/Grade |
|||
|
2 |
90,3% (28/31) |
95,5% (21/22), p=0,6332 |
92,5% (49/53) |
|
3 |
9,7% (3/31) |
4,5% (1/22), p=0,6332 |
7,5% (4/53) |
|
T |
|||
|
T1 |
38,7% (12/31) |
27,3% (6/22), p=0,5570 |
34% (18/53) |
|
T2 |
58,1% (18/31) |
50% (11/22), p=0,7881 |
54,7% (29/53) |
|
T3 |
3,2% (1/31) |
22,7% (5/22), p=0,0709 |
11,3% (6/53) |
|
Гематогенные метастазы/Distant metastases |
|||
|
Наличие/Presence |
19,4% (6/31) |
59,1% (13/22), p=0,0041 |
35,8% (19/53) |
|
Лекарственная терапия/Drug therapy |
|||
|
Наличие/Presence |
35,5% (11/31) |
63,6% (14/22) p=0,0547 |
47,2% (25/53) |
|
Вариант лекарственной терапии/Type of drug therapy |
|||
|
Химиотерапия/Chemotherapy |
81,8% (9/11) |
57,1% (8/14), p=0,2167 |
68% (17/25) |
|
Химиотерапия + таргетная терапия/ Chemotherapy+Target therapy |
0% (0/11) |
7,1% (1/14), p=1,0000 |
4% (1/25) |
|
Таргетная терапия/Target therapy |
9,1% (1/11) |
7,1% (1/14), p=1,0000 |
8% (2/25) |
|
Гормональная терапия/Hormonal therapy |
9,1% (1/11) |
28,6% (4/14), p=0,3406 |
20% (5/25) |
Клинико-морфологическая характеристика пациентов
Clinical and morphological parameters of patients
Экспрессия белка LIMCH1 в опухолевых клетках оценивалась иммуногистохимическими методами. Использовались антитела anti- LIMCH1-Prestige (1:1000, HPA004184, Sigma Aldrich, Germany) для определения белка LIMCH1 по CH домену и anti-LIMCH1-C-term (1:1000, SAB2700402, Sigma Aldrich, Germany) для определения белка LIMCH1 по LIM домену. Визуализацию проводили с помощью системы детекции EnVision (Dako, Agilent, США). Затем срезы окрашивали гематоксилином и помещали в среду Витрогель (Биовитрум, Россия). Наличие экспрессии белка LIMCH1 в клетках оценивали с помощью световой микроскопии (AxioScope A1, Zeiss, Германия). Опухоли считались позитивными при обнаружении клеток с наличием экспрессии белка LIMCH1. Экспрессия белка LIMCH1 оценивалась в цитоплазме и субмембранно.
Морфологическая гетерогенность инвазивной карциномы неспецифического типа оценивалась путём выявления тубулярных, альвеолярных, солидных, трабекулярных структур и одиночных опухолевых клеток. Тубулярные структуры представлены одним рядом мономорфных опухолевых клеток, образующих замыкающуюся структуру с просветом в центре. Альвеолярные структуры представлены комплексом опухолевых клеток (15–20 штук) округлой или неправильно-округлой формы. К солидным структурам относили поля опухолевых клеток, плотно прилежащих друг к другу (рис. 1). Трабекулярные структуры представлены одним рядом клеток или двумя-тремя рядами параллельно расположенных клеток [8].
Проверка исследуемых параметров на соответствие нормальному закону распределения проводилась с помощью критерия Шапиро‒Уилка.
v f^'t > «» 7
Параметры, не подчиняющиеся нормальному закону распределения, описывали с помощью медианы и межквартильного размаха (Me (Q1:Q3)). Различия параметров между двумя независимыми выборками оценивались при помощи критерия Манна–Уитни. Различия частоты встречаемости оценивались при помощи критерия χ2 Пирсона и точного критерия Фишера. Исследование влияния независимых переменных на категориальный признак проводили методами однофакторного и многофакторного регрессионного анализа данных. Для оценки выживаемости использовались кривые Каплана–Майера и log-rank критерий. Безмета-статической выживаемостью считалось время от начала наблюдения за пациентами до обнаружения гематогенных метастазов или смерти от любой причины. Различия считались значимыми при уровне р<0,05.
Результаты
На первом этапе исследования была оценена связь между экспрессией белка LIMCH1 и лимфогенными метастазами (ЛМ) (рис. 2). Показано,
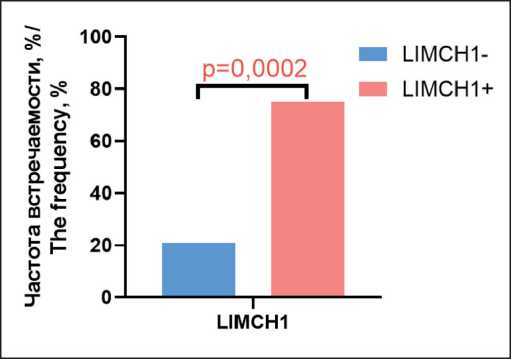
Рис. 2. Частота встречаемости лимфогенных метастазов в группах больных с отсутствием и наличием экспрессии белка LIMCH1 в опухолевых клетках
Fig. 2. The frequency of occurrence of lymphogenous metastases in groups of patients with the absence and presence of LIMCH1 protein expression in tumor cells
Рис. 1. Морфологическое строение инвазивной карциномы неспецифического типа: а – тубулярные структуры; б – альвеолярные структуры; в – солидные структуры; г – трабекулярные структуры; д – одиночные опухолевые клетки. Окраска гематоксилином и эозином, ×400
Fig. 1. Morphological structure of invasive breast carcinoma of no special type: a – tubular structures; б – alveolar structures; в – solid structures; г – trabecular structures; д – single tumor cells. Stained with hematoxylin and eosin, ×400
что лимфогенные метастазы чаще развивались в группе больных с экспрессией белка LIMCH1 опухолевыми клетками (75 % (15/20) против 21,2 % (7/33), p=0,0002). Далее оценивалась ассоциация частоты встречаемости лимфогенных метастазов у больных в зависимости от экспрессии белка LIMCH1, определяемого по LIM или Calponin доменам, с учетом локализации в клеточных ком-партментах (рис. 3).
Лимфогенные метастазы встречались с одинаковой частотой в группах больных с наличием и отсутствием цитоплазматической экспрессии белка LIMCH1, определяемого по LIM домену, ‒ у 39,6 % (19/48) больных в группе без экспрессии и у 60 % (3/5) больных в группе с экспрессией,
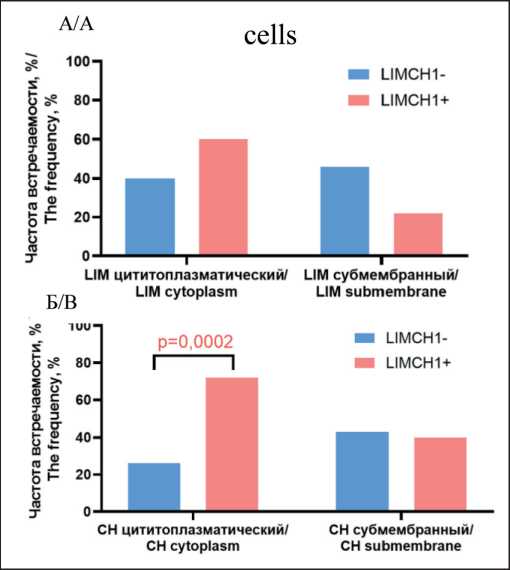
Рис. 3. Частота встречаемости лимфогенных метастазов в группах больных с отсутствием и наличием экспрессии опухолевыми клетками белка LIMCH1, определяемого по LIM (A) и CH (Б) доменам
Fig. 3. The frequency of occurrence of lymphogenous metastases in groups of patients with the absence and presence of expression of LIMCH1 protein detected by LIM (A) and CH (B) domains by tumor cells
Таблица 2/table 2
Частота развития лимфогенных метастазов в группах больных с отсутствием и наличием цитоплазматической экспрессии белка lIMCH1, определяемого по CH домену в опухолевых клетках морфологических структур the frequency of development of lymph node metastases in groups of patients with the absence and presence of cytoplasmic expression of the lIMCH1 protein detected by the CH domain in tumor cells of morphological structures
|
Структуры/Structures |
LIMCH1- |
LIMCH1+ |
|
Тубулярные/Tubular |
25% (4/16) |
100% (3/3) p=0,0361 |
|
Альвеолярные/Alveolar |
27,5% (11/40) |
88,9% (8/9) p=0,0011 |
|
Солидные/Solid |
32,4% (12/37) |
63,6% (7/11) p=0,0853 |
|
Трабекулярные/Trabecular |
29,4% (10/34) |
90% (9/10) p=0,0010 |
|
Одиночные опухолевые клетки/ Single tumor cells |
32,3% (10/31) |
81,8% (9/11) p=0,0114 |
Таблица 3/table 3
Однофакторный и многофакторный регрессионный анализ риска развития лимфогенного метастазирования univariate and multivariate analysis of the risk of lymph node metastases
При оценке частоты лимфогенных метастазов у больных в зависимости от отсутствия и наличия субмембранной экспрессии белка LIMCH1, определяемого по CH домену, различий обнаружено не было – 42,4 % (14/33) и 40 % (8/20) соответственно (р=1,0000). Иная картина наблюдалась при учете цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену. Чаще лимфогенные метастазы обнаруживались в группе больных с наличием экспрессии (72,2 % (13/18)), по сравнению с пациентами, у которых экспрессия белка LIMCH1, определяемого по CH домену, в цитоплазме опухолевых клеток первичной опухоли отсутствовала (25,7 % (9/35), p=0,0026).
Далее была проанализирована ассоциация частоты встречаемости лимфогенных метастазов у больных в зависимости от отсутствия и наличия цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, с учетом морфологической гетерогенности (табл. 2). Ассоциация наличия цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, с большей частотой лимфогенного метастазирования сохраняется при учете морфологической гетерогенности. Вне зависимости от морфологических структур лимфогенные метастазы чаще развивались в группе больных с экспрессией.
Прогностическая значимость цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, оценивалась методом однофакторного и многофакторного регрессионного анализа (табл. 3). Показано, что наличие цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, в опухолевых клетках является независи-
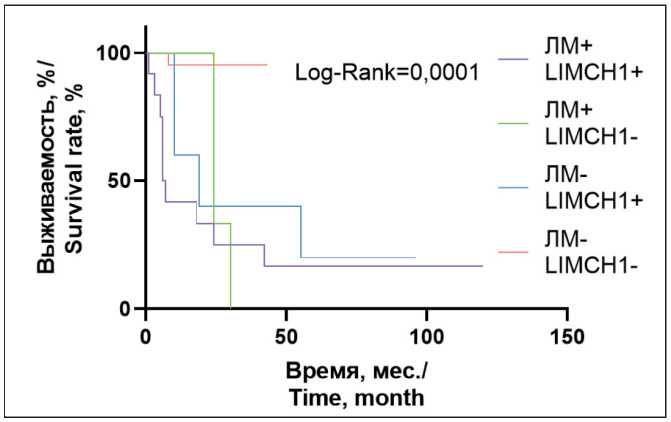
Рис. 4. Кривые безметастатической выживаемости Каплана– Мейера больных раком молочной железы. Кривые были статистически сопоставлены с помощью теста log-rank Fig. 4. Curves of non-metastatic survival of Kaplan–Meier patients with breast cancer. The curves were statistically matched using the log-rank test мым прогностическим признаком высокого риска развития лимфогенных метастазов (OR=26,6551, p=0,0122).
Была оценена безметастатическая выживаемость в группах больных с различными сочетаниями наличия/отсутствия лимфогенных метастазов и наличия/отсутствия цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену (рис. 4). Наиболее неблагоприятное влияние на безметастатическую выживаемость оказывает сочетание наличия лимфогенных метастазов и цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, медиана выживаемости – 6,5 мес. В группе больных без лимфогенных метастазов и с наличием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, медиана выживаемости составила 19 мес, в то время как в группе больных с наличием лимфогенных метастазов и без цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, медиана выживаемости 24 мес. Наиболее благоприятный для прогноза безметастатической выживаемости вариант – отсутствие лимфогенных метастазов и цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену. У таких пациентов медиана выживаемости не была достигнута. Безметастатическая выживаемость не различалась в группе больных с наличием лимфогенных метастазов в сочетании с отсутствием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, и в группе с отсутствием лимфогенных метастазов в сочетании с отсутствием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену (p=0,1026). Не было обнаружено различий в безметастатиче-ской выживаемости между группами больных с отсутствием лимфогенных метастазов в сочетании с наличием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, и с наличием лимфогенных метастазов в сочетании с наличием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену (p=0,3222). Наиболее значимые различия в безметастатической выживаемости были между группами больных с наличием лимфогенных метастазов в сочетании с наличием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, и с отсутствием лимфогенных метастазов в сочетании с отсутствием цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену (p=0,0073).
Обсуждение
Лимфогенные метастазы при раке молочной железы, как правило, развиваются синхронно с ростом первичной опухоли и имеют значение для стадирования и прогноза [9]. Механизмы развития ЛМ до конца не изучены. Открытый относительно недавно белок LIMCH1 играет роль в миграции клеток. Однако клинико-прогностическое значение экспрессии белка LIMCH1 при раке молочной железы является недостаточно изученным. Ранее нами было показано, что экспрессия белка LIMCH1 в опухолевых клетках ассоциирована с развитием гематогенных метастазов [10]. Настоящее исследование демонстрирует ассоциацию экспрессии белка LIMCH1 в опухолевых клетках и с лимфогенным метастазированием. Ассоциацию экспрессии белка LIMCH1 как с лимфогенным, так и с гематогенным метастазированием при раке молочной железы можно рассматривать как аргумент в пользу наличия общего звена в механизмах обоих вариантов метастазирования. Вероятно, этим звеном является инвазия, в которой белок LIMCH1 играет ключевую роль.
Результаты свидетельствуют о том, что только цитоплазматическая экспрессия белка LIMCH1, определяемого по CH домену, ассоциирована с лимфогенным метастазированием. По-видимому, это связано с тем, что именно CH домен участвует в активации немышечного миозина IIA благодаря кальций-связывающему центру [7].
Анализ экспрессии белка LIMCH1 в опухолевых клетках различных морфологических структур показал, что морфологическая гетерогенность не влияет на ассоциацию экспрессии белка LIMCH1 с развитием лимфогенных метастазов. Это отличает лимфогенное метастазирование от гематогенного метастазирования, при котором только наличие экспрессии белка LIMCH1 в опухолевых клетках альвеолярных, солидных и трабекулярных структур была ассоциировано с развитием гематогенных метастазов. Не исключено, что это обусловлено большей ролью коллективного типа инвазии при лимфогенном метастазировании и особенностями интравазации в лимфатические сосуды [4].
Заслуживают особого внимания результаты анализа связи лимфогенного метастазирования с безметастатической выживаемостью. Оказалось, что связь с выживаемостью значима при сочетании лимфогенного метастазирования и наличия цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену. В связи с этим сочетание наличия цитоплазматической экспрессии белка LIMCH1, определяемого по CH домену, и наличия лимфогенных метастазов может служить маркером более короткого периода безметастати-ческой выживаемости.
Список литературы Особенности экспрессии белка LIMCH1, связанные с лимфогенным метастазированием при раке молочной железы
- Шевченко Ю.А., Кузнецова М.С., Христин А.А., Сидоров С.В., Сенников С.В. Современная терапия рака молочной железы: от тамоксифена до Т-клеточной инженерии. Сибирский онкологический журнал. 2022; 21(5): 109-22.
- Graziani V., Rodriguez-Hernandez I., Maiques O., Sanz-Moreno V. The amoeboid state as part of the epithelial-to-mesenchymal transition programme. Trends Cell Biol. 2022; 32(3): 228-42. 10.1016/j. tcb.2021.10.004.
- Wong S.Y., Hynes R.O. Lymphatic or hematogenous dissemination: how does a metastatic tumor cell decide? Cell Cycle. 2006; 5(8): 812-7.
- Zavyalova M.V., Denisov E.V., Tashireva L.A., Savelieva O.E., Kaigorodova E.V., Krakhmal N.V., Perelmuter V.M.Intravasation as a Key Step in Cancer Metastasis. Biochemistry (Mosc). 2019; 84(7): 762-72.
- Yang Y., Zheng H., Zhan Y., Fan S. An emerging tumor invasion mechanism about the collective cell migration. Am J Transl Res. 2019; 11(9): 5301-12.
- Pearson G.W. Control of Invasion by Epithelial-to-Mesenchymal Transition Programs during Metastasis. J Clin Med. 2019; 8(5): 646.
- Lin Y.H., Zhen Y.Y., Chien K.Y., Lee I.C., Lin W.C., Chen M.Y., Pai L.M. LIMCH1 regulates nonmuscle myosin-II activity and suppresses cell migration. Mol Biol Cell. 2017; 28(8): 1054-65. 10.1091/mbc. E15-04-0218.
- Zavyalova M.V., Denisov E.V., Tashireva L.A., Gerashchenko T.S., Litviakov N.V., Skryabin N.A., Vtorushin S.V., Telegina N.S., Slonimskaya E.M., Cherdyntseva N.V., Perelmuter V.M. Phenotypic drift as a cause for intra-tumoral morphological heterogeneity of invasive ductal breast carcinoma not otherwise specified. Biores Open Access. 2013; 2(2): 148-54.
- Wittekind C. Diagnosis and staging of lymph node metastasis. Recent Results Cancer Res. 2000; 157: 20-8.
- Alifanov V.V., Tashireva L.A., Zavyalova M.V., Perelmuter V.M. LIMCH1 as a New Potential Metastasis Predictor in Breast Cancer. Asian Pac J Cancer Prev. 2022; 23(11): 3947-52. 10.31557/ APJCP.2022.23.11.3947.


