Особенности экспрессии CD133 и CD44 маркеров опухолевых стволовых клеток при метастатическом и неметастатическом раке желудка
Автор: Сагакянц Александр Борисович, Кит Олег Иванович, Ульянова Елена Петровна, Златник Елена Юрьевна, Новикова Инна Арнольдовна, Шульгина Оксана Геннадьевна, Геворкян Юрий Артушевич, Солдаткина Наталья Васильевна, Самойленко Николай Сергеевич, Дженкова Елена Алексеевна, Шапошников Александр Васильевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.20, 2021 года.
Бесплатный доступ
Введение. В структуре смертности рак желудка (РЖ) занимает второе место, что обусловлено поздней диагностикой в сочетании с агрессивным течением заболевания. Особую роль в патогенезе и метастазировании опухоли отводят опухолевым стволовым клеткам, ответственным за устойчивость к химио- и радиотерапии и обусловливающим прогрессию опухоли. Цель исследования - определение CD44 и CD133 маркеров опухолевых стволовых клеток в ткани опухоли при неметастатическом и метастатическом раке желудка с использованием иммуногистохимического метода. Материал и методы. Проведено проспективное исследование опухолевой ткани у больных раком желудка: 1-я группа - 20 больных РЖ Т3-4аШ-3М0, степень дифференцировки опухоли - G2, средний возраст - 58,9 ± 9,7 года; 2-я группа - 20 больных РЖ Т3-4аШ-3М1 с метастатическим поражением брюшины, степень дифференцировки опухоли - G2, средний возраст - 53,4 ± 11,9 года. Экспрессию CD44 и CD133 в ткани опухолей осуществляли иммуногистохимическим методом. Результаты. Выявлены отличия в количестве опухолевых клеток, экспрессирующих CD44 маркер при наличии и отсутствии метастазов у больных раком желудка - их количество составило 10,0 ± 3,08 % и 6,0 ± 2,3 % соответственно. При этом CD133 молекула при наличии метастазов выявлялась в 95 %, при их отсутствии - в 80 % случаев. Средний уровень CD133+-клеток при метастатическом раке желудка составил 21,3 ± 11,6 %, при локализованном -10,0 ± 2,4 %. Заключение. Степень экспрессии выбранных молекул имела характерные отличия у больных различными формами рака желудка, что может быть использовано в дальнейшем для понимания результатов лечения и прогноза течения заболевания.
Опухолевые стволовые клетки, рак желудка, иммуногистохимическая идентификация
Короткий адрес: https://sciup.org/140254453
IDR: 140254453 | УДК: 616.33-006.6-07-097:576.3 | DOI: 10.21294/1814-4861-2021-20-1-97-104
Текст научной статьи Особенности экспрессии CD133 и CD44 маркеров опухолевых стволовых клеток при метастатическом и неметастатическом раке желудка
В разных опухолях ОСК экспрессируют различные маркеры и их комбинации, которые выявляются также на нормальных стволовых клетках или клетках-предшественницах, элементах стромы опухоли или опухолевых клетках, не имеющих свойств стволовых, поэтому, возможно, только часть клеток, выбранных по их экспрессии, является ОСК. К настоящему моменту окончательно не решен вопрос о стабильности фенотипа ОСК в процессе прогрессирования опухоли или при переходе из систем in vivo к in vitro. Кроме того, разные подтипы опухолей одного органа могут иметь ОСК, экспрессирующие разные маркеры [5].
Для исследования осуществляли забор операционного материала, в котором производились несколько параллельных горизонтальных разрезов через всю опухоль. При этом избегали очагов некроза, так как для исследования были необходимы образцы визуально сохранной опухоли. Для фиксации материала использовали раствор 10 % нейтрального забуференного формалина с последующей стандартной проводкой дегидратантами; в конце образцы заключали в парафин. Приготавливали срезы толщиной 3–5 мкм с последующим окрашиванием гематоксилином и эозином.
Иммуногистохимическое исследование проводили на срезах с парафиновых блоков опухолей, предназначенных для стандартного морфологического исследования. Парафиновые срезы депарафинировали и регидратировали по стандартной методике. «Демаскировку» антигенов проводили в PT-LinkThermo.
Для определения экспрессии CD44 и CD133 на опухолевых клетках иммуногистохимическим методом использовали моноклональные мышиные антитела к CD44 клон 156-3С11 (Thermo Scientific) в разведении 1:2500 и поликлональные кроличьи антитела к CD133 (Cloud-Clone Corp.) в разведении 1:700 с использованием автостейнера Thermo Scientific; для демаскировки антигена CD133 применяли буфер 10 мМTris, 1 мМEDTA (рН 9,0), для CD44 – аналогичный буфер рН 6,0.
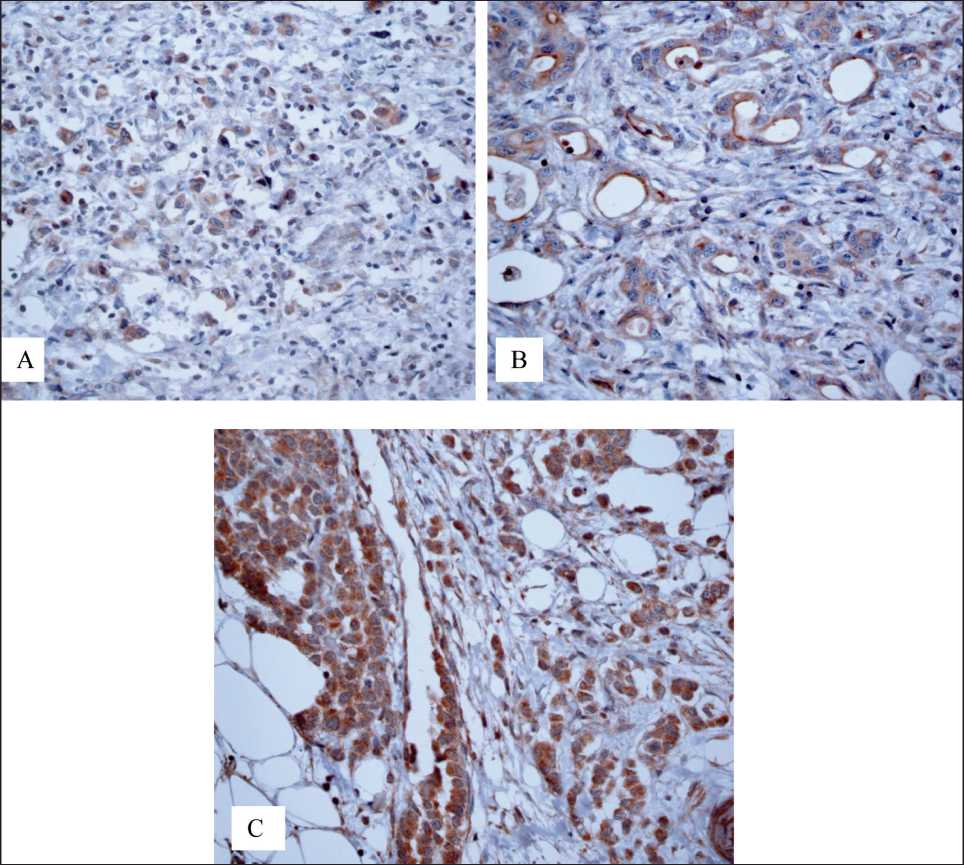
Оценивали мембранную окраску в 10 % и более всех опухолевых клеток; характеризовали интенсивность окрашивания клеточной мембраны: 0, + – слабое, ++ – умеренное, +++ – сильное окрашивание. При наличии интенсивности окрашивания ++ и +++ случай рассматривался как позитивный. Экспрессия белка CD44 имеет мембранную локализацию и определялась как положительная, когда окрашивание было выявлено в 10 % (cut-off) и более всех опухолевых клеток. Белок CD133 также имеет мембранную локализацию; его экспрессию считали положительной, когда окрашивание было выявлено в более 5 % всей опухоли. На рис. 1 и 2 представлены примеры результатов ИГХ окрашивания препаратов при РЖ для выявления CD44+- и CD133+-клеток.
Результаты измерений количественных показателей представлены в виде X ± m, где X – среднее значение, m – среднеквадратичное отклонение. Проверка на нормальность закона распределения показателей проводилась с использованием критерия Шапиро–Уилка. Для сравнения средних значений количественных показателей в группах, в случае нормального закона распределения, использовали параметрический критерий Стьюдента, в противном случае – непараметрический критерий Манна–Уитни. Для анализа связи между факторным и результативным признаками использовался критерий χ2 Пирсона. Различия считали статистически значимыми при р≤0,05.
Результаты
В нашем исследовании позитивная экспрессия CD44+ в клетках опухоли пациентов без метастазов выявлена в 4 (20 %), в то время как при метастатическом РЖ – в 13 (65 %) случаях. Следует отметить, что в группе с метастазами разброс позитивно-окрашенных клеток по экспрессии CD44 находился в пределах от 9 до 15 %, в среднем составив 10,0 ± 3,08 %, тогда как в группе без метастазов – этот показатель варьировал от 1 до 13 %, где средние значения CD44+ клеток составили 6,0 ± 2,3 %. В результате сравнения были отмечены статистически значимые по критерию χ2 различия в исследуемых группах – 8,256 при р=0,004.
При исследовании экспрессии CD133 установлено, что положительная реакция CD133 в клетках опухоли у больных с диссеминированным РЖ наблюдалась в 19 (95 %), тогда как при локализованном РЖ – в 16 (80 %) случаях. Разброс положительно окрашенных клеток в группе с метастазами был значительный и составлял от 10 до 40 %, в среднем – 21,3 ± 11,6 %, а в группе без метастазов – от 1 до 14 %, составив в среднем 10,0 ± 2,4 %. В результате были отмечены статистически значимые по критерию χ2 различия в сравниваемых группах – 4,444 при р=0,036.
Обсуждение
Несмотря на то, что до настоящего времени нет однозначных маркеров, позволяющих идентифицировать ОСК, в современных исследованиях накоплен опыт, подтвержающий целесообразность определения экспрессии ряда молекул, указывающих на наличие уникальных свойств данной группы клеток в гетерогенной опухолевой популяции. В качестве данных маркеров наиболее часто выступают такие молекулы, как CD44 и CD133.
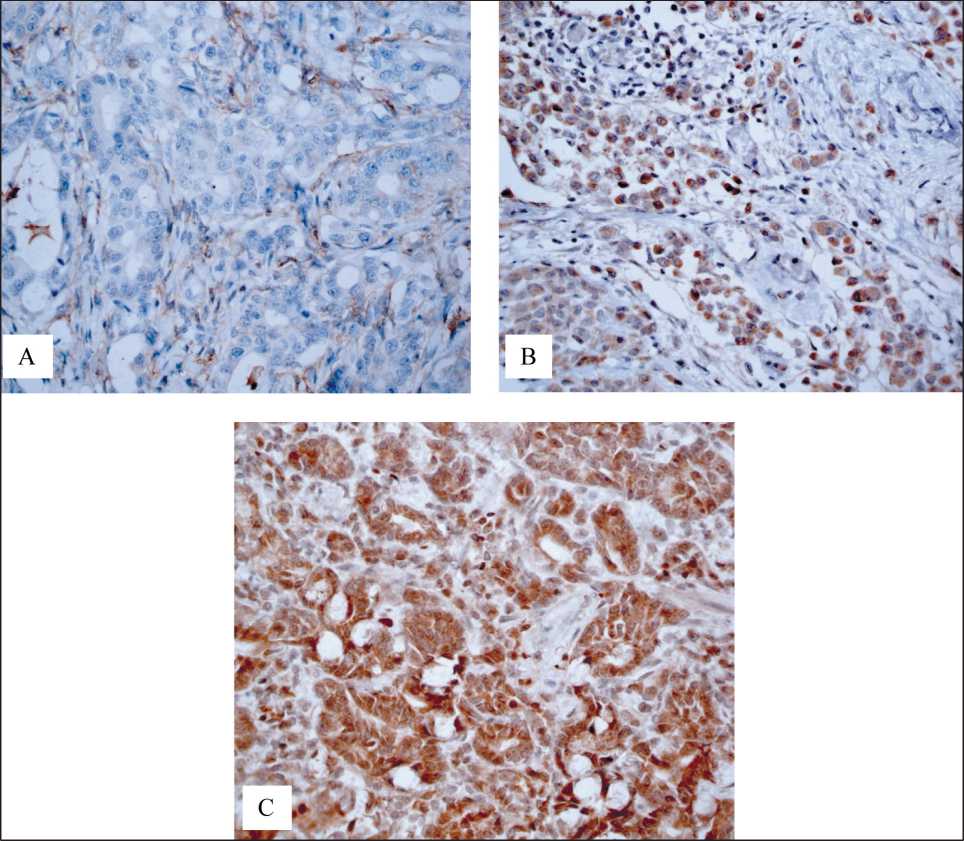
Рис. 1. Экспрессия CD44 маркера в препарате опухоли при РЖ:
B – positive expression of CD133 (2+) in tumor cells in GC. C – positive expression of CD133 (3+) in tumor cells in GC. ×400
Рядом авторов показаны антиапоптотические и прометастатические эффекты активации СD44. Влияя на интенсивность деградации гиалуроновой кислоты и определяя расположение на мембране матрикс-модифицирующих ферментов, СD44 может участвовать в моделировании опухолевого микроокружения, а его расщепление, которое отмечалось в ткани опухоли, способствует увеличению миграционной активности клеток [8, 9].
Функциональная роль увеличения количества CD44+-клеток в ткани опухоли с учетом факта различной её выраженности при различных формах злокачественных новообразований требует дальнейшего изучения. Но, вероятно, участвуя во взаимодействии с различными компонентами межклеточного матрикса, CD44 определяет адгезивные свойства клеток, их чувствительность к различным регуляторным факторам, а все это будет определенным образом влиять на формирование метастатического фенотипа опухолевых клеток.
Представляет особый интерес определение экспрессии CD44 маркера в региональных и отдаленных метастатических очагах у больных РЖ, так как в доступной литературе данный вопрос мало изучен. В проведенных нами исследованиях по определению данного маркера в опухолях и метастазах при колоректальном раке было показано, что экспрессия CD44 в опухолях, дающих отдаленные метастазы, выше в клетках первичной опухоли, чем в клетках метастазов [10].
Полученные нами результаты по экспрессии CD44 согласуются с данными некоторых авторов. В частности, в работе A. Afify et al. отмечается снижение экспрессии CD44 маркера в большинстве метастатических опухолей. Показано, что в 65 % случаев метастазов аденокарцином в лимфатические узлы отсутствует экспрессия CD44, в то время как в 92 % случаев первичной опухоли она выявляется [11].
Противоречивые данные получены относительно роли CD44 в прогрессировании опухоли и образовании метастазов при раке толстой кишки [12, 13]. Снижение экспрессии CD44, по одним данным, коррелирует с уменьшением метастатического потенциала клеток КРР [14], по другим – это приводит к увеличению метастатического и миграционного потенциалов [15]. Низкодифференцированные опухоли толстой кишки имеют более высокий уровень экспрессии CD44 по сравнению с высокодифференцированными, и сверхэкспрессия этого маркера ассоциирована с уменьшением выживаемости у пациентов [16].
Другим маркером ОСК наиболее часто выступает CD133 (АС133, проминин-1) – гликопротеин с пятью трансмембранными доменами молекулярной массой 120 кД, взаимодействующий с холестеролом [17], имеет 3 изоформы: CD133-1, CD133-2, CD133-3. Молекула ассоциирована с мембранными выпячиваниями, но её функция точно не известна.
Заключение
Список литературы Особенности экспрессии CD133 и CD44 маркеров опухолевых стволовых клеток при метастатическом и неметастатическом раке желудка
- Kaprin A.D., Starinskii V.V., Petrova G.V. Sostoyanie onkologicheskoi pomoshchi naseleniyu Rossii v 2016 godu. M., 2017. 236 s.
- Kit O.I., Gevorkyan Yu.A., Soldatkina N.V., Novikova I.A., Gusareva M.A., Kozhushko M.A.Molekulyarno-morfologicheskie effekty predoperatsionnoi luchevoi terapii krupnym fraktsionirovaniem dozy pri rake pryamoi kishki. Molekulyarnaya meditsina. 2017; 15(2): 39-43.
- Nikipelova E.A., Kit O.I., Shaposhnikov A.V., Zlatnik E.Yu., Novikova I.A., Vladimirova L.Yu., Pozdnyakova V.V., Lysenko I.B., Shevchenko A.N., Demidova A.A. Immunologicheskie kriterii razvitiya otdalennykh metastazov raka tolstoi kishki. Izvestiya vysshikh uchebnykh zavedenii. Severo-Kavkazskii region. Seriya: Estestvennye nauki. 2017; 3-2 (195-2): 96-101.
- Kim W.T., Ryu C.J. Cancer stem cell surface markers on normal stem cells. BMB Rep. 2017 Jun; 50(6): 285-298. https://doi.org/10.5483/bmbrep.2017.50.6.039.
- Meacham C.E., Morrison S.J. Tumour heterogeneity and cancer cell plasticity. Nature. 2013 Sep 19; 501(7467): 328-37. https://doi.org/10.1038/nature12624.
- Wang J.Y., Chang C.C., Chiang C.C., Chen W.M., Hung S.C. Silibinin suppresses the maintenance of colorectal cancer stem-like cells by inhibiting PP2A/AKT/mTOR pathways. J Cell Biochem. 2012 May; 113(5): 1733-43. https://doi.org/10.1002/jcb.24043.
- Yeung T.M., Gandhi S.C., Wilding J.L., Muschel R., Bodmer W.F. Cancer stem cells from colorectal cancer-derived cell lines. Proc Natl Acad Sci USA. 2010 Feb 23; 107(8): 3722-7. https://doi.org/10.1073/pnas.0915135107.
- Louderbough J.M., Schroeder J.A. Understanding the dual nature of CD44 in breast cancer progression. Mol Cancer Res. 2011 Dec; 9(12): 1573-86. https://doi.org/10.1158/1541-7786.MCR-11-0156.
- Puchinskaya M.V. Markery opukholevykh stvolovykh kletok i ikh prognosticheskoe znachenie. Arkhiv patologii. 2016; 2: 47-54.
- Zlatnik E.Yu., Kit O.I., Novikova I.A., Ul'yanova E.P., Sagakyants A.B., Teplyakova M.A., Egorov G.Yu., Chupanov G.M., Chernikova E.N. Vozmozhnaya rol' stvolovykh opukholevykh kletok v protsessakh metastazirovaniya kolorektal'nogo raka. Sovremennye problemy nauki i obrazovaniya. 2018. 6. [Internet]. URL: http://www.science-education.ru/ru/article/view?id=28217 (cited 28.05.2019).
- Afify A., Durbin-Johnson B., Virdi A., Jess H. The expression of CD44v6 in colon: from normal to malignant. Ann Diagn Pathol. 2016 Feb; 20: 19-23. https://doi.org/10.1016/j.anndiagpath.2015.10.010.
- Du L., Wang H., He L., Zhang J., Ni B., Wang X., Jin H., Cahuzac N., Mehrpour M., Lu Y., Chen Q. CD44 is of functional importance for colorectal cancer stem cells. Clin Cancer Res. 2008; 14(21): 6751-60. https://doi.org/10.1158/1078-0432.CCR-08-1034.
- Nagano O., Saya H. Mechanism and biological significance of CD44 cleavage. Cancer Sci. 2004; 95(12): 930-5. https://doi.org/10.1111/j.1349-7006.2004.tb03179.x.
- Harada N., Mizoi T., Kinouchi M., Hoshi K., Ishii S., Shiiba K., Sasaki I., Matsuno S. Introduction of antisense CD44S CDNA down-regulates expression of overall CD44 isoforms and inhibits tumor growth and metastasis in highly metastatic colon carcinoma cells. Int J Cancer. 2001 Jan 1; 91(1): 67-75. https://doi.org/10.1002/1097-0215(20010101)91:1-67::aidijc1011-3.0.co;2-d.
- Dallas M.R., Liu G., Chen W.C., Thomas S.N., Wirtz D., Huso D.L., Konstantopoulos K. Divergent roles of CD44 and carcinoembryonic antigen in colon cancer metastasis. FASEB J. 2012 Jun; 26(6): 2648-56. https://doi.org/10.1096/fj.12-203786.
- Ropponen K.M., Eskelinen M.J., Lipponen P.K., Alhava E., Kosma V.M. Expression of CD44 and variant proteins in human colorectal cancer and its relevance for prognosis. Scand J Gastroenterol. 1998 Mar; 33(3): 301-9. https://doi.org/10.1080/00365529850170900.
- Lingala S., Cui Y.Y., Chen X., Ruebner B.H., Qian X.F., Zern M.A., Wu J. Immunohistochemical staining of cancer stem cell markers in hepatocellular carcinoma. Exp Mol Pathol. 2010 Aug; 89(1): 27-35. https://doi.org/10.1016/j.yexmp.2010.05.005.
- Kojima M., Ishii G., Atsumi N., Fujii S., Saito N., Ochiai A. Immunohistochemical detection of CD133 expression in colorectal cancer: a clinicopathological study. Cancer Sci. 2008 Aug; 99(8): 1578-83. https://doi.org/10.1111/j.1349-7006.2008.00849.x.
- Zhao P., Li Y., Lu Y. Aberrant expression of CD133 protein correlates with Ki-67 expression and is a prognostic marker in gastric adenocarcinoma. BMC Cancer. 2010 May 20; 10: 218. https://doi.org/10.1186/1471-2407-10-218.
- Horst D., Kriegl L., Engel J., Kirchner T., Jung A. Prognostic significance of the cancer stem cell markers CD133, CD44, and CD166 in colorectal cancer. Cancer Invest. 2009 Oct; 27(8): 844-50. https://doi.org/10.1080/07357900902744502.
- Tan Y., Chen B., Xu W., Zhao W., Wu J. Clinicopathological significance of CD133 in lung cancer: A meta-analysis. Mol Clin Oncol. 2014 Jan; 2(1): 111-115. https://doi.org/10.3892/mco.2013.195.
- Sagakyants A.B., Frantsiyants E.M., Zlatnik E.Yu., Gevorkyan Yu.A., Soldatkina N.V., Bondarenko E.S., Samoilenko N.S., Ul'yanova E.P., Shul'gina O.G., Dashkov A.V., Kaimakchi D.O., Egorov G.Yu., Grechkin F.N. Ekspressiya markerov opukholevykh stvolovykh kletok pri razlichnykh formakh raka zheludka. Sovremennye problemy nauki i obrazovaniya. 2018; 5. [Internet]. URL: http://www.science-education.ru/article/view?id=28129 (cited 28.05.2019).


