Особенности клеточного состава опухолевой ниши инвазивной протоковой карциномы неспецифического типа молочной железы
Автор: Бузенкова А.В., Таширева Л.А., Завьялова М.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Рак молочной железы занимает ведущую позицию в структуре заболеваемости и смертности от злокачественных новообразований у женщин репродуктивного возраста. Прогрессия опухоли зависит от характера стромально-паренхиматозных отношений. Микроокружение опухоли во многом определяет вариант и степень выраженности прогрессии. Существенным элементом микроокружения является «опухолевая ниша», которая, по существующим представлениям, включает, кроме клеточных элементов иммунной системы, костномозговые клетки-предшественники. В нашем исследовании охарактеризованы параметры опухолевой ниши инвазивной протоковой карциномы молочной железы неспецифического типа (ИПКНТ), ассоциированные с лимфогенным метастазированием. Цель исследования - изучение особенностей клеточного состава опухолевой ниши ИПКНТ. Материал и методы. В исследование включено 128 больных с диагнозом ИПКНТ T1-3N0-3M0 стадии, в возрасте от 29 до 90 лет, прооперированных в объеме радикальной мастэктомии или секторальной резекции молочной железы с аксиллярной лимфодиссекцией. Морфологическое исследование операционного материала выполнялось по стандартным методикам. Для выявления костномозговых клеток-предшественников готовили суспензии из образцов свежезамороженного операционного опухолевого материала. Применяли антитела против CD34, CD133, CD90, CD11b, CD45, CD202. Результаты. Наличие совокупности гемопоэтических клеток-предшественников и клеток-предшественников макрофагов в количестве, превышающем 1,24 клетки на 100 опухолевых клеток, ассоциировано с риском развития лимфогенных метастазов и большим размером опухоли. Заключение. Результаты проведенного исследования могут быть полезны для понимания сущности опухолевой ниши и ее роли в росте опухоли и лимфогенной прогрессии ИПКНТ.
Рак молочной железы, опухолевая ниша, преметастатическая ниша, клетки-предшественники, лимфогенное метастазирование
Короткий адрес: https://sciup.org/140296679
IDR: 140296679 | УДК: 618.19-006.6-091.8 | DOI: 10.21294/1814-4861-2022-21-5-59-68
Текст научной статьи Особенности клеточного состава опухолевой ниши инвазивной протоковой карциномы неспецифического типа молочной железы
Инвазивная протоковая карцинома неспецифического типа молочной железы (РМЖ) является самой распространенной формой злокачественных новообразований у женщин репродуктивного возраста [1, 2]. В настоящее время метастатический потенциал опухоли связывают не только с ее паренхиматозным компонентом, но и с особенностями строения и функционирования опухолевой стромы, которая формирует микроокружение, способствующее прогрессии опухоли [3]. В микроокружении опухоли выделяют так называемые опухолевые ниши, которые представлены рекрутируемыми под влиянием опухолевых хемокинов костномозговыми клетками-предшественниками, в частности, гемопоэтическими клетками-предшественниками (HSPCs), эндотелиальными клетками-предшественниками (EPCs), предшественниками макрофагов (MPs) и мезенхимальными стволовыми клетками (MSCs), а также компонентами внеклеточного матрикса, сосудистой сетью, фибробластами и различными иммунными клетками [4]. Компоненты опухолевой ниши обладают разными функциями, однако общий вектор в конечном итоге направлен на прогрессию опухоли. Так, MSCs являются предшественниками фибробластов, формирующих строму опухоли [5]. Опухоль-ассоциированные фибробласты являются компонентом микроокружения, синтезируют и ремоделируют коллагеновые волокна и синтезируют белки межклеточного матрикса, включая фибронектин. Богатые фибронектином, ремоделированные участки ткани являются привлекательными для HSPCs, рекрутированных из костного мозга (КМ) [6]. Входя в состав опухолевых ниш, данная клеточная популяция синтезирует спектр цитокинов, способствующих повышенной проницаемости сосудов, усиленной пролиферации опухолевых клеток и мобилизации других клеток-предшественников из КМ [7]. EPCs способствуют процессам неоваскуляризации опухоли [8, 9]. Поскольку опухолевая ниша, как правило, формируется на фоне персистирующего воспаления, присутствие в ней MPs – закономерно. MPs дают начало опухоль-ассоциированным макрофагам (TAMs). TAMs секретируют эпидермальный фактор роста (EGF), который, в свою очередь, способствует поддержанию пролиферации опухолевых клеток [10]. Исходя из этих знаний, можно предположить, что HSPCs, MSCs, EPCs и MPs могут быть связаны, как минимум, с двумя показателями, характеризующими злокачественный потенциал опухоли, – ее ростом и способностью к метастазированию. Кроме того, опухолевые ниши, по сути, являются прототипом преметастатических ниш, идентификация которых в настоящее время недоступна для исследователя.
Цель исследования – изучение особенностей клеточного состава опухолевой ниши ИПКНТ (HSPCs, MSCs, EPCs и MPs) с клиническими проявлениями опухолевого процесса.
Материал и методы
В исследование включено 128 больных инвазивной протоковой карциномой неспецифического типа молочной железы (ИПКНТ) T1–3N0–3M0 стадии, в возрасте от 29 до 90 лет (средний возраст – 53,11 ± 10,2 года), получавших лечение в клиниках НИИ онкологии Томского НИМЦ с 2014 по 2020 г. Диагноз установлен на основании клинических, морфологических и иммуногистохимических критериев (табл. 1). Все пациентки подверглись хирургическому вмешательству в объеме радикальной мастэктомии или секторальной резекции молочной железы с аксиллярной лимфодиссекцией. Исследование проводилось при
Таблица 1/table 1
Характеристика больных инвазивной протоковой карциномой неспецифического типа молочной железы
Методом дезагрегации из 128 образцов свежезамороженного опухолевого материала с помощью BD Medimachine System (BD, USA) были изготовлены клеточные суспензии. Общая клеточность полученных суспензий определялась с помощью Scepter Cell Counter (Merck-Millipore, USA). После Fc-блокирования клеточного концентрата раствором Human TruStain FcX™ Fc Receptor Blocking Solution (Biolegend, San Diego, CA, USA) добавляли моноклональные антитела: APC/Cy7 anti-human CD45 (Clone: HI30, Sony Biotechnology, USA), APC anti-human CD34 (Clone: 581, Sony Biotechnology, USA), Alexa Fluor488 anti-human CD202b (Tie2/
Tek) (Clone: 33.1 (Ab33), Sony Biotechnology, USA), PE/Cy7 anti-human CD11b (Clone: ICRF44, Sony Biotechnology, USA), Purified anti-human CD90 (Thy1) (Clone: 5E10, Sony Biotechnology, USA), BV786 Mouse anti-Human CD133 (Clone: 293C3, BD Opti Build, USA), PerCP/Cy5.5 anti-human CD326 (EpCAM) (Clone:9C4, Sony Biotechnology, USA). Жизнеспособные клетки определяли с помощью 7-аминоактиномицина D (7-AAD, Sony Biotechnology, San Jose, CA, США). После инкубации эритроциты лизировали буфером OptiLyse (Beckman Coulter, Марсель, Франция) и промывали в буфере Cell Wash (BD Biosciences, Сан-Хосе, Калифорния, США). Был проведен контроль качества антител. К контрольному образцу добавляли изотипные контрольные антитела в той же концентрации. Иденти-
Таблица 2/table 2
Иммунофенотипирование клеток-предшественников immunophenotyping of progenitor cells
|
Популяция клеток-предшественников/ Progenitor cell subset |
Иммунофенотип/Immunpohenotype |
|
HSPCs |
CD45lowCD34 + CD202- |
|
EPCs |
CD45-CD133 + или CD34 + CD202 + |
|
MSCs |
CD45-CD133-CD90 + |
|
MPs |
CD45lowCD133 + CD11b + |
Таблица 3/table 3
Количество Hspcs, epcs, Mscs и Mps в первичной опухоли больных ИПКНТHspcs, epcs, Mscs and Mps count in primary tumor of patients with ic Nst
|
Тип клеток/Cells type |
Количество, Me (Q1-Q3)/Count, Me (Q1-Q3) |
|
|
HSPCs |
1 |
0,54 (0,22–3,06) p1–2=0,048; p1–3<0,001; p1–4=0,014 |
|
EPCs |
2 |
0,35 (0,19–0,93) p2–3<0,001; p2–4=0,733 |
|
MSCs |
3 |
4,47 (1,63–12,77) p3–4<0,001 |
|
MPs |
4 |
0,30 (0,14–1,07) |
Примечание: p – статистическая значимость различий количества популяций клеток-предшественников в первичной опухоли больных ИПКНТ.
Note: p – statistical significance of progenitor cells subsets’ count in primary tumor of patients with IC NST.
Таблица 4/table 4
Комбинации различных клеток-предшественников в ткани первичной опухоли менопаузальных больных ИПКНТ в зависимости от статуса лимфогенного метастазирования
combinations of various progenitor cells subsets in primary tumor of menopausal patients with ic Nst depending on the presence of lymphogenic metastasis
|
Комбинации клеток-предшественников/ Progenitor cells phenotype combinations |
Количество клеток, Me (Q1-Q3)/ Cell count Me (Q1-Q3) |
|
|
Лимфогенные метастазы отсутствуют/ Absence of lymphogenic metastasis (n=15) |
Лимфогенные метастазы присутствуют/ Presence of lymphogenic metastasis (n=9) |
|
|
HSPCs + EPCs + MSCs |
4,22 (1,82–12,64) |
6,23 (3,27–16,85) р=0,297 |
|
HSPCs + MPs + MSCs |
4,81 (1,77–12,98) |
6,74 (3,25–16,38) р=0,330 |
|
EPCs + MPs + MSCs |
4,63 (1,72–9,73) |
6,97 (2,89–13,07) р=0,525 |
|
HSPCs + EPCs + MPs |
0,93 (0,56–2,34) |
2,14 (1,40–5,07) p=0,110 |
|
HSPCs + EPCs |
0,59 (0,42–1,75) |
1,85 (0,94–4,25) р=0,088 |
|
HSPCs + MSCs |
4,07 (1,58–12,24) |
5,25 (3,15–16,12) р=0,365 |
|
HSPCs + MPs |
0,60 (0,26–1,46) |
1,93 (1,19–3,83) p=0,049 |
|
EPCs + MPs |
0,65 (0,42–1,32) |
0,63 (0,37–2,16) р=0,868 |
|
EPCs + MSCs |
3,90 (1,65–8,81) |
5,59 (2,43–12,62) р=0,664 |
|
MSCs + MPs |
4,48 (1,49–9,33) |
5,95 (2,73–11,83) р=0,616 |
Примечание: p – статистическая значимость различий по сравнению с группой без лимфогенных метастазов.
Note: p – statistical significance comparing to the patients group with absence of lymphogenic metastasis.
фикацию клеток проводили по иммунофенотипам, представленным в табл. 2. Относительное количество клеток-предшественников рассчитывали и выражали в клетках на 100 опухолевых клеток.
Для статистической обработки данных использован пакет программ IBM SPSS Statistics 22.0 (Armonk, USA). Нормальность распределения количественных показателей оценивали при помощи критерия Шапиро–Уилка. Параметры, не подчиняющиеся нормальному закону распределения, описывали с помощью медианы (Ме) и интерквартильного интервала (Q1–Q3). Для сравнения частот встречаемости использовался точный критерий Фишера. Оценка достоверности различий между двумя независимыми выборками осуществлялась при помощи критерия Манна–Уитни. Для оценки различий параметров нескольких независимых выборок применяли критерий Краскела–Уоллиса. Однофакторный и многофакторный регрессионный анализ использовался для оценки влияния факторов на риск события. Различия считались достоверными при уровне значимости р<0,05.
Результаты
Исследованы особенности клеточного состава опухолевой ниши ИПКНТ. Первоначально оценивались частота и количество HSPCs, EPCs, MSCs и MPs в ткани первичной опухоли. Установлено, что в исследуемых образцах первичной опухоли HSPCs, EPCs, MSCs и MPs присутствовали в 100 % случаев (p<0,05). Количество каждой популяции клеток-предшественников стандартизовано на 100 опухолевых клеток. Самой представительной клеточной популяцией являлись MSCs – 4,47 (1,63–12,77) клеток. Далее, в порядке убывания количества: HSPCs – 0,54 (0,22–3,06) клеток, EPCs – 0,35 (0,19–0,93) клеток и MPs – 0,30 (0,14–1,07) клеток (p<0,05) (табл. 3). Стоит отметить, что количество HSPCs было значимо больше, чем EPCs и MPs (p<0,05), а значения EPCs и MPs не различались между собой (p>0,05). Значительное преобладание MSCs в ткани первичной опухоли представляется закономерным, поскольку данная клеточная популяция является предшественником фибробластов, формирующих строму опухоли.
Индикатором прогрессирования опухолевого процесса были выбраны метастатический статус регионарных лимфатических узлов и размер первичного опухолевого узла. Следует подчеркнуть, что в исследовании оценивалась связь не только отдельных популяций клеток-предшественников, но и сумм их различных комбинаций с параметрами опухолевой прогрессии (табл. 4 и 7), поскольку, как полагают, опухолевая ниша – это, прежде всего, совокупность клеток.
Установлено, что количество отдельных популяций клеток-предшественников и количество различных комбинаций клеток-предшественников не были ассоциированы с метастатическим стату- сом регионарных лимфоузлов у больных ИПКНТ (p>0,05). Однако, учитывая возможное влияние отсутствия репродуктивной функции больных ИПКНТ на прогрессирование заболевания, в связи c резким изменением гормонального фона женщины, количественные показатели различных комбинаций клеток-предшественников также были рассчитаны в группе менопаузальных больных (табл. 4). Было установлено, что в ткани первичной опухоли у пациенток, находящихся в менопаузальном периоде, количество HSPCs + MPs было значимо большим при наличии лимфогенных метастазов по сравнению с пациентками, у которых лимфогенные метастазы отсутствовали (p=0,049). Стоит отметить, что в группе пациенток с сохраненной менструальной функцией разницы в количестве различных комбинаций клеток-предшественников не обнаружено (p>0,05).
Данные Roc-анализа подтвердили наличие ассоциативной связи между статусом регионарных лимфоузлов и количественным значением комбинации HSPCs + MPs в ткани ИПКНТ (рис. 1). С риском развития лимфогенных метастазов ассоциировано наличие в опухоли менопаузальных больных с люминальным РМЖ совокупности HSPCs и MPs в количестве, превышающем 1,24 клетки на 100 опухолевых клеток. Однофакторный и многофакторный анализ показали, что сумма HSPCs + MPs, превышающая 1,24 клетки на 100 опухолевых клеток, является независимым и не-
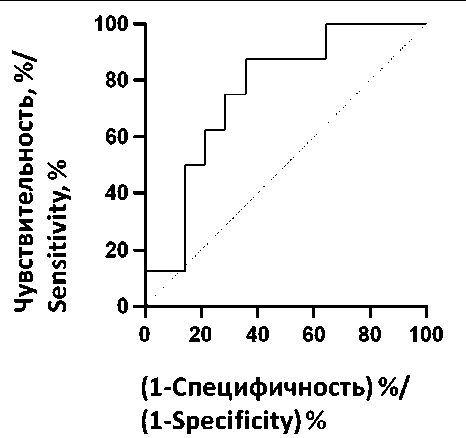
Рис. 1. ROC-кривая предиктивной значимости количества HSPCs + MPs для определения наличия лимфогенных метастазов.
Площадь под кривой – 0,758 (95 % ДИ 0,553–0,937), р=0,048. Пороговое значение параметра – 1,24 клетки, чувствительность – 75 %, специфичность – 71 %
Fig. 1. ROC curve of the predictive significance of HSPCs + MPs cells count for defining the presence of lymphogenic metastasis. Area under the curve – 0,758 (95 % CI 0,553 – 0,937), р=0,048.
Cut-off of the parameter – 1,24 cells, sensitivity – 75 %, specificity – 71 %
Таблица 5/table 5
Анализ предикторной значимости клинико-патологических параметров и отдельных компонентов опухолевой ниши в определении статуса лимфогенного метастазирования больных ИПКНТ analysis of predictive significance of clinicopathological parameters and certain elements of tumor niche in determination of lymphogenic metastasis in patients with ic Nst
|
Параметры/Parameters |
Однофакторный анализ/ Univariate analysis |
Многофакторный анализ/ Multivariate analysis |
||
|
ОШ (95 % ДИ)/ OR (95 % CI) |
p-value |
ОШ (95 % ДИ)/ OR (95 % CI) |
p-value |
|
|
Возраст больных <50 vs ≥ 50/ Patients’ age <50 vs ≥ 50 |
1,23 (0,69–2,15) |
0,498 |
1,23 (0,69–2,19) |
0,487 |
|
Распространенность опухолевого процесса T1–2 vs Т3–4 / Extension of the primary tumor T1–2 vs Т3–4 |
1,54 (0,96–2,47) |
0,075 |
1,55 (0,96–2,50) |
0,071 |
|
Степень злокачественности 1–2 vs 3 / Grade of malignancy 1–2 vs 3 |
1,34 (0,69–2,59) |
0,380 |
1,19 (0,24–5,83) |
0,831 |
|
Экспрессия Ki67 <20 vs ≥20 / Ki67 expession <20 vs ≥20 |
1,00 (0,98–1,02) |
0,733 |
1,04 (0,97–1,12) |
0,295 |
|
Her2/neu 1(нет) vs 2(есть) / Her2/neu 1(no) vs 2(yes) |
0,92 (0,63–1,35) |
0,680 |
0,44 (0,15–1,29) |
0,137 |
|
Сумма HSPCs + MPs, стандартизация на 100 опухолевых клеток <1,24 vs >1,24 / HSPCs + MPs total sum, standartization on 100 tumor cells <1.24 vs >1.24 |
3,29 (1,09–42,18) |
0,041 |
2,96 (1,05–41,73) |
0,040 |
Таблица 6/table 6
Количество Hspcs, epcs, Mscs и Mps в первичной опухоли больных ИПКНТ в зависимости от размера опухоли
Hspcs, epcs, Mscs and Mps count in primary tumor of patients with ic Nst depending on tumor size
|
Тип клеток/Cells type |
Количество клеток, Me (Q1-Q3)/Cell count, Me (Q1-Q3) |
|
|
До 2 см/<2 cm (n=33) |
2–5 см/2–5 cm (n=83) |
|
|
MSCs |
5,10 (1,46–16,83) |
5,01 (1,85–12,73) p=0,764 |
|
HSPCs |
0,32 (0,16–0,74) |
0,84 (0,25–3,99) p=0,126 |
|
EPCs |
0,23 (0,06–0,75) |
0,39 (0,22–1,16) p=0,214 |
|
MPs |
0,15 (0,03–0,50) |
0,50 (0,19–1,59) p=0,058 |
Примечание: p – статистическая значимость различий по сравнению с группой – размер первичной опухоли до 2 см.
Note: p – statistical significance comparing to the patients group with the primary tumor size of less than 2 cm.
благоприятным признаком высокого риска лимфогенного метастазирования (табл. 5).
Далее оценивалась связь количества отдельных популяций HSPCs, EPCs, MSCs и MPs в ткани ИПКНТ и размера первичного опухолевого узла (табл. 6). Установлено, что на уровне тенденции величина первичной опухоли связана с количеством MPs. Их большее количество наблюдалось у пациенток с большим размером первичной опухоли (р=0,058). Также важно было установить, ассоциированы ли количественные показатели различных комбинаций клеток-предшественников в ткани первичной опухоли с ее размером (табл. 7). Нами показано, что с большим размером первичного опу- холевого узла связано присутствие в опухолевой нише HSPCs и MPs (p=0,039). Кроме того, EPCs, в совокупности с вышеуказанными клеточными популяциями, также могут способствовать формированию опухоли большего размера на уровне тенденции (HSPCs + EPCs + MPs, p=0,058; EPCs + MPs, р=0,078; HSPCs + EPCs, р=0,088).
Предикторная ценность суммы HSPCs и MPs подтверждена методом Roc-анализа (рис. 2). Наличие в микроокружении опухоли совокупности HSPCs и MPs в количестве, большем или равном 1,24 клетки при стандартизации на 100 опухолевых клеток, ассоциировано с большим размером первичного опухолевого узла у больных ИПКНТ.
Таблица 7/table 7
Комбинации различных клеток-предшественников в ткани первичной опухоли больных ИПКНТ, взаимосвязь с размером опухоли combinations of various progenitor cells subsets in primary tumor of patients with ic Nst, association with tumor size
|
Комбинации клеток-предшественников/ Progenitor cells phenotype combinations |
Количество клеток, Me (Q1-Q3)/ Cell count, Me (Q1-Q3) |
|
|
До 2 см/< 2 cm (n=33) |
2–5 см/2–5 cm (n=83) |
|
|
HSPCs + EPCs + MSCs |
5,75 (1,66–18,66) |
6,95 (3,57–17,06) р=0,460 |
|
HSPCs + MPs + MSCs |
5,73 (1,57–18,37) |
7,29 (3,58–16,78) р=0,427 |
|
EPCs + MPs + MSCs |
5,74 (1,58–17,66) |
6,37 (3,24–14,96) р=0,604 |
|
HSPCs + EPCs + MPs |
0,96 (0,23–2,10) |
2,30 (0,95–6,29) p=0,058 |
|
HSPCs + EPCs |
0,65 (0,21–1,76) |
1,84 (0,60–5,09) р=0,088 |
|
HSPCs + MSCs |
5,42 (1,55–18,10) |
5,96 (3,43–15,51) р=0,530 |
|
HSPCs + MPs |
0,63 (0,18–1,34) |
2,02 (0,65–5,61) p=0,039 |
|
EPCs + MPs |
0,47 (0,13–1,09) |
0,91 (0,52–2,29) р=0,078 |
|
EPCs + MSCs |
5,43 (1,56–17,39) |
5,78 (2,25–13,90) р=0,139 |
|
MSCs + MPs |
5,41 (1,47–17,10) |
6,15 (2,91–13,79) р=0,196 |
Примечание: p – статистическая значимость различий по сравнению с группой – размер опухоли до 2 см.
Note: p – statistical significance comparing to the patients group with the primary tumor size of less than 2 cm.
Таблица 8/table 8
Анализ предикторной значимости клинико-морфологических параметров и отдельных компонентов опухолевой ниши в определении размера опухоли больных ИПКНТ analysis of predictive significance of clinicopathological parameters and certain elements of tumor niche in determination of tumor size in patients with ic Nst
|
Параметры/Parameters |
Однофакторный анализ/ Univariate analysis |
Многофакторный анализ/ Multivariate analysis |
||
|
ОШ (95 % ДИ)/ OR (95 % CI) |
p-value |
ОШ (95 % ДИ)/ OR (95 % CI) |
p-value |
|
|
Возраст больных <50 vs ≥ 50/Patients’ age <50 vs ≥ 50 |
1,46 (0,80–2,64) |
0,209 |
0,26 (0,02–3,69) |
0,319 |
|
Сохранена менструальная функция vs менопауза/ Premenopausal vs postmenopausal |
1,05 (0,53–2,07) |
0,884 |
0,33 (0,09–1,15) |
0,081 |
|
Экспрессия ER нет vs есть/ER expression no vs yes |
1,13 (0,44–2,87) |
0,797 |
0,36 (0,04–3,06) |
0,351 |
|
Экспрессия PR нет vs есть/PR expression no vs yes |
1,19 (0,56–2,53) |
0,660 |
2,06 (0,50–8,48) |
0,315 |
|
Экспрессия Ki67 <20 vs ≥20/Ki67 expession <20 vs ≥20 |
1,01 (0,99–1,03) |
0,584 |
1,02 (0,98–1,05) |
0,371 |
|
Her2neu нет vs есть/Her2/neu no vs yes |
0,68 (0,46–1,01) |
0,056 |
0,80 (0,49–1,31) |
0,387 |
|
Степень злокачественности 1–2 vs 3 / Grade of malignancy 1–2 vs 3 |
1,10 (0,54–2,22) |
0,790 |
0,85 (0,31–2,27) |
0,739 |
|
Молекулярно-генетический тип Люм. А vs Люм. В/ Molecular subtype Luminal A vs Luminal B |
0,96 (0,58–1,59) |
0,879 |
0,93 (0,31–2,76) |
0,893 |
|
НАХТ нет vs есть/Neoadjuvant chemotherapy no vs yes |
0,67 (0,31–1,45) |
0,314 |
0,91 (0,33–2,49) |
0,859 |
|
Сумма HSPCs + MPs, стандартизация на 100 опухолевых клеток <1,24 vs >1,24/ HSPCs + MPs total sum, standartization on 100 tumor cells <1.24 vs >1.24 |
3,37 (1,11–62,84) |
0,039 |
3,02 (1,03–73,82) |
0,036 |
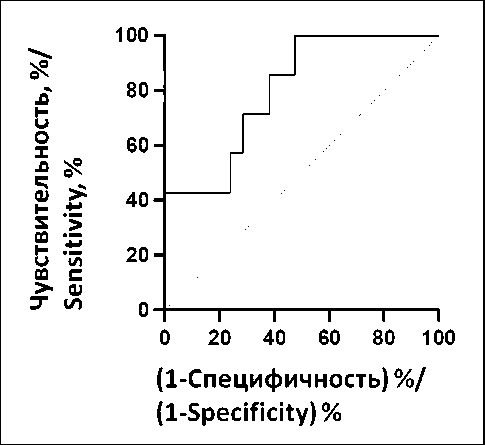
Рис. 2. ROC-кривая предиктивной значимости количества HSPCs + MPs для определения большего размера первичной опухоли. Площадь под кривой – 0,802 (95 % ДИ 0,627–0,978), р=0,018. Пороговое значение параметра – 1,24, чувствительность – 86 %, специфичность – 62 %
Fig. 2. ROC curve of the predictive significance count of HSPCs + MPs cells for defining the bigger size of tumor. Area under the curve – 0,802 (95 % CI 0,627–0,978), р=0,018. Cut-off of the parameter – 1,24 cells, sensitivity – 86 %, specificity – 62 %
Для того чтобы выявить предикторы большей величины первичной опухоли у больных ИПКНТ, был использован однофакторный и многофакторный регрессионный анализ (табл. 8), в результате которого были установлены параметры опухолевой ниши ИПКНТ, ассоциированной с прогрессированием заболевания, а именно: совокупное количество HSPCs и MPs в первичной опухоли пациенток более 1,24 клетки на 100 опухолевых клеток – независимый предиктор большего размера первичной опухоли (р=0,036), а также развития лимфогенного метастазирования (р=0,040).
Обсуждение
По данным литературы, в состав опухолевой ниши входят различные популяции клеток-предшественников, каждая из которых выполняет ряд определенных функций. Известно, что MSCs являются источником опухоль-ассоциированных фибробластов, которые участвуют в формировании стромы опухоли, синтезируют и моделируют волокнистый компонент стромы, а также синтезируют фибронектин. Кроме того, MSCs способствуют пролиферации и метастазированию опухолевых клеток, участвуя в процессах ангиогенеза и формирования иммуносупрессивного микроокружения опухоли [11, 12]. Ремоделированные участки, богатые фибронектином, являются привлекательными для HSPCs, рекрутированных из костного мозга [6]. HSPCs, в свою очередь, вырабатывают спектр цитокинов, под действием которых про- исходит рекрутирование различных популяций клеток-предшественников из костного мозга как в первичный опухолевый очаг, так и в области потенциального формирования метастазов [7].
Немаловажным фактором для развития опухоли является образование в ней собственной сосудистой сети, в связи с чем присутствие EPCs в опухолевой нише закономерно. Интересно отметить, что целенаправленное рекрутирование EPCs из костного мозга наблюдается на стадии опухолевой прогрессии и прекращается в тот момент, когда опухоль перестает расти [13]. MPs дают начало опухоль-ассоциированным макрофагам (TAMs). TAMs являются наиболее распространенной клеточной популяцией, участвующей в процессе воспаления и инициирующей различные стадии развития рака молочной железы за счет участия в процессах ангиогенеза, инвазии опухоли и ремоделировании матрикса [14, 15]. Кроме того, TAMs вырабатывают эпидермальный фактор роста (EGF), который благоприятствует неконтролируемому росту и делению опухолевых клеток [10].
Однако до настоящего времени не установлено, какие совокупности клеток-предшественников, формирующих опухолевые ниши, являются ключевыми в процессах роста первичного опухолевого узла и развития лимфогенных метастазов. По данным исследования установлено, что большее количество HSPCs и MPs в опухолевой нише ассоциировано с большим размером первичного опухолевого узла.
В условиях хронического воспаления в микроокружении опухоли эндотелий микроциркулятор-ного русла экспрессирует на своей поверхности VCAM1, обладающий способностью связывать ин-тегрин гемопоэтических клеток-предшественников (VLA4) [16]. Поступающие в очаг воспаления HSPCs секретируют спектр цитокинов, которые привлекают другие популяции клеток-предшественников, в том числе и MPs [17] как популяцию, вовлеченную в воспалительный процесс. Кроме того, имеются данные, согласно которым повышенное содержание М2 макрофагов в ткани опухоли молочной железы коррелирует с ее большим размером [18]. Формирование лимфогенных метастазов также было возможным только при наличии совокупности HSPCs и MPs, а не отдельных клеточных популяций в нише ИПКНТ. Данный результат подтверждает представления о том, что ниша – это совокупность клеток-предшественников, создающих оптимальные условия для роста и развития опухоли. Считается, что одной из причин смертности больных РМЖ является лимфогенная генерализация с канцероматозом плевры, поражением лимфоузлов средостения и массивным метастатическим поражением легких [19]. Полученные результаты могут послужить основой для понимания механизмов и разработки инструментов прогнозирования данной формы прогрессии.
Таким образом, две из четырех изучаемых популяций клеток-предшественников были значимо связаны с параметрами опухолевой прогрессии. Присутствие HSPCs и MPs в микроокружении опухоли было сопряжено с формированием первичного опухолевого узла большего размера и возникновением лимфогенных метастазов у больных ИПКНТ.
Список литературы Особенности клеточного состава опухолевой ниши инвазивной протоковой карциномы неспецифического типа молочной железы
- Harbeck N., Gnant M. Breast cancer. Lancet. 2017; 389(10074): 1134-50. https://doi.org/10.1016/S0140-6736(16)31891-8.
- Kaprin A.D., Aleksandrova L.M., Starinskii V.V., Mamontov A.S. Tekhnologii diagnostiki i skrininga v rannem vyyavlenii zlokachestvennykh novoobrazovanii. Onkologiya. Zhurnal im. P.A. Gertsena. 2018; 7(1): 34-40. https://doi.org/10.17116/onkolog20187134-40.
- Zalatnai A. Molecular aspects of stromal-parenchymal interactions in malignant neoplasms. Curr Mol Med. 2006; 6(6): 685-93. https://doi.org/10.2174/156652406778195053.
- Psaila B., Lyden D. The metastatic niche: adapting the foreign soil. Nat Rev Cancer. 2009; 9(4): 285-93. https://doi.org/10.1038/nrc2621.
- Augsten M. Cancer-associated fibroblasts as another polarized cell type of the tumor microenvironment. Front Oncol. 2014; 4: 62. https://doi.org/10.3389/fonc.2014.00062.
- Luo H., Tu G., Liu Z., Liu M. Cancer-associated fibroblasts: a multifaceted driver of breast cancer progression. Cancer Lett. 2015; 361(2): 155-63. https://doi.org/10.1016/j.canlet.2015.02.018.
- Karnoub A.E., Dash A.B., Vo A.P., Sullivan A., Brooks M.W, Bell G.W., Richardson A.L., Polyak K., Tubo R., Weinberg R.A. Mesenchymal stem cells within tumour stroma promote breast cancer metastasis. Nature. 2007; 449(7162): 557-63. https://doi.org/10.1038/nature06188.
- Sepúlveda P., Martinez-León J., García-Verdugo J.M. Neoangiogenesis with endothelial precursors for the treatment of ischemia. Transplant Proc. 2007; 39(7): 2089-94. https://doi.org/10.1016/j.transproceed.2007.07.009.
- Timmermans F., Plum J., Yöder M.C., Ingram D.A., Vandekerckhove B., Case J. Endothelial progenitor cells: identity defined? J Cell Mol Med. 2009; 13(1): 87-102. https://doi.org/10.1111/j.1582-4934.2008.00598.x.
- Lewis C.E., Pollard J.W. Distinct role of macrophages in different tumor microenvironments. Cancer Res. 2006; 66(2): 605-12. https://doi.org/10.1158/0008-5472.CAN-05-4005.
- Cuiffo B.G., Karnoub A.E. Mesenchymal stem cells in tumor development: emerging roles and concepts. Cell Adh Migr. 2012; 6(3): 220-30. https://doi.org/10.4161/cam.20875.
- Nishimura K., Semba S., Aoyagi K., Sasaki H., Yokozaki H. Mesenchymal stem cells provide an advantageous tumor microenvironment for the restoration of cancer stem cells. Pathobiology. 2012; 79(6): 290-306. https://doi.org/10.1159/000337296.
- Botelho M.C., Alves H. Endothelial Progenitor Cells in Breast Cancer. Int J Immunother Cancer Res. 2016; 2: 1-2.
- Sica A., Larghi P., Mancino A., Rubino L., Porta C., Totaro M.G., Rimoldi M., Biswas S.K., Allavena P., Mantovani A. Macrophage polarization in tumour progression. Semin Cancer Biol. 2008; 18(5): 349-55. https://doi.org/10.1016/j.semcancer.2008.03.004.
- Noy R., Pollard J.W. Tumor-associated macrophages: from mechanisms to therapy. Immunity. 2014; 41(1): 49-61. https://doi.org/10.1016/j.immuni.2014.06.010.
- Fox J.M., Chamberlain G., Ashton B.A., Middleton J. Recent advances into the understanding of mesenchymal stem cell trafficking. Br J Haematol. 2007; 137(6): 491-502. https://doi.org/10.1111/j.1365-2141.2007.06610.x.
- Oberoi P., Kamenjarin K., Ossa J.F.V., Uherek B., Bönig H., Wels W.S. Directed Differentiation of Mobilized Hematopoietic Stem and Progenitor Cells into Functional NK cells with Enhanced Antitumor Activity. Cells. 2020; 9(4): 811. https://doi.org/10.3390/cells9040811.
- Jayasingam S.D., Citartan M., Thang T.H., Mat Zin A.A., Ang K.C., Ch’ng E.S. Evaluating the Polarization of Tumor-Associated Macrophages Into M1 and M2 Phenotypes in Human Cancer Tissue: Technicalities and Challenges in Routine Clinical Practice. Front Oncol. 2020; 9: 1512. https://doi.org/10.3389/fonc.2019.01512.
- Klimek M. Pulmonary lymphangitis carcinomatosis: systematic review and meta-analysis of case reports, 1970-2018. Postgrad Med. 2019; 131(5): 309-18. https://doi.org/10.1080/00325481.2019.1595982.


