Особенности коррозионно-электрохимического поведения сталей с различным содержанием хрома в углекислотных низкотемпературных средах
Автор: Бирюков Александр Игоревич, Костицына Ирина Валерьевна, Батманова Татьяна Викторовна, Воробьева Дарья Александровна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.9, 2017 года.
Бесплатный доступ
Изучено влияние содержания хрома на скорость коррозии низколегированных сталей в углекислотных средах гравиметрическим методом. Определены особенности коррозионно-электрохимического поведения данных сталей в средах, содержащих углекислый газ.
Хромсодержащие стали, углекислотная коррозия, гравиметрия, поляризационные кривые
Короткий адрес: https://sciup.org/147160384
IDR: 147160384 | УДК: 620.193.27; | DOI: 10.14529/chem170203
Текст научной статьи Особенности коррозионно-электрохимического поведения сталей с различным содержанием хрома в углекислотных низкотемпературных средах
В процессе эксплуатации нефтяных скважин насосно-компрессорные трубы подвергаются интенсивному коррозионному воздействию [1]. К числу коррозионно-активных компонентов нефтяных скважин относится углекислый газ. Также факторами, ускоряющими коррозионное разрушение, являются достаточно высокое содержание солей, повышенное давление и температура. Те же факторы влияют и на растворимость углекислого газа в воде. При растворении углекислого газа происходит образование угольной кислоты и ее частичная диссоциация. При этом рН смещается в слабокислую область, а в растворе появляются гидрокарбонат-ионы. Присутствие углекислого газа ускоряет локальное повреждение металла, а также способствует образованию карбонатно-оксидных пленок на поверхности [2].
Углекислотная коррозия протекает по механизму с водородной деполяризацией, основной вклад в которую вносит прямое восстановление Н2СО3. Классическим считается подход, в котором предложено следующее уравнение деполяризации катодного процесса:
Н 2 СО 3 + е- → Н АДС. + НСО 3 - (1)
с дальнейшим удалением водорода путем рекомбинации или электрохимической десорбции [3]. В результате анодной реакции осуществляется ионизация атомов железа с образованием гидратированных ионов железа Fe2+∙mН 2 O, которые в растворе преобразуются в гидрокарбонат железа (II) – Fe(HCO 3 ) 2 . Катодный процесс происходит с участием как ионов гидроксония (Н 3 O)+ из объема электролита и приэлектродного слоя, так и ионов водорода (H+). Углекислотная коррозия протекает как сложный многостадийный процесс с образованием различных продуктов коррозии, таких как FeO*FeCO 3 (коррозит) [4], FeCO 3 (сидерит), Fe(HCO 3 ) 2 (гидрокарбонат железа) [5, 6].
В работе [7] изучено коррозионное поведение сталей с содержанием хрома от 1 до 13 % (26ХМФА, 20Х3М, 15Х5М) в средах, содержащих углекислый газ при повышенных температуре и давлении. Установлено, что скорость коррозии сталей 26ХМФА и 15Х5М часто не критично отличается при определенных параметрах среды. Основным продуктом коррозии, обнаруженным на поверхности данных сталей, является сидерит.
Целью данной работы является изучение коррозионно-электрохимического поведения сталей с содержанием хрома от 1 до 5 % в углекислотных средах. Это стали, применяемые для производства насосно-компрессорны труб (26ХМФА, 32ХГ, 20Х3М, 15Х5М).
Методика исследования
В качестве объектов исследования выбраны стали с различным содержанием хрома, химический состав которых представлен в табл. 1.
Таблица 1
Химический состав исследуемых сталей
|
Марка стали |
Массовая доля элементов, масс. % |
||||||||||
|
C |
Mn |
Si |
S |
P |
Cr |
Ni |
Mo |
Cu |
V |
Al |
|
|
26ХМФА |
0,25 |
0,55 |
0,23 |
0,007 |
0,005 |
0,89 |
0,12 |
0,52 |
0,18 |
0,04 |
0,02 |
|
32ХГ |
0,32 |
0,69 |
0,18 |
0,001 |
0,007 |
1,03 |
0,11 |
0,02 |
0,25 |
- |
0,02 |
|
20Х3М |
0,18 |
0,47 |
0,25 |
0,005 |
0,006 |
3,07 |
0,12 |
0,17 |
0,28 |
0,05 |
0,03 |
|
15Х5М |
0,15 |
0,32 |
0,5 |
0,005 |
0,012 |
4,75 |
0,14 |
0,47 |
0,11 |
0,03 |
0,03 |
Определение скорости коррозии исследуемых сталей в углекислых средах проводили гравиметрическим методом. Образцы выдерживали в течении 120 ч в коррозионной среде следующего состава: С(NaCl) = 50 г/л, P(CO 2 ) =0,02 МПа, начальная концентрация углекислого газа составила С нач (CO 2 ) = 0,281 г/л, конечная – С кон (CO 2 ) = 0,150 г/л. При этом соблюдались следующие условия: температура 90 °С, скорость потока жидкости 1 м/с. Перед началом эксперимента механически зачищали поверхность образцов, шлифовали наждачной бумагой, измеряли геометрические параметры и взвешивали с точностью до 0,0001 г. Перед погружением поверхность образца обезжиривали ацетоном. По истечении времени выдержки образцы вынимали из коррозионной среды, высушивали, счищали продукты коррозии и взвешивали также с точностью до 0,0001 г. Скорость коррозии вычисляли в размерности г/см2·час, а также пересчитывали в значения в мм/год. Также проводили исследование особенностей электрохимического поведения с помощью поляризационных измерений на образцах после автоклавных испытаний с очищенной поверхностью. Для снятия стационарных потенциалов и поляризационных кривых использовали прижимную ячейку, заполненную 3%-ным раствором NaCl без насыщения углекислым газом. Стационарные потенциалы снимали в течение 60 минут. В качестве электрода сравнения использовали хлорсеребряный электрод, затем потенциалы пересчитывались по стандартной водородной шкале. Поляризационные кривые получали в интервале потенциалов от (–1,5) до (+1,5)В (ХСЭ) со скоростью развертки 20 мВ/с. В качестве электрода сравнения также использовали хлорсеребряный электрод, а в качестве вспомогательного – платиновый.
Результаты и их обсуждение
Результаты гравиметрических испытаний представлены в табл. 2.
Таблица 2
Результаты гравиметрических испытаний
|
Марка стали |
Скорость коррозии, г/м2∙ч |
Скорость коррозии, мм/год |
|
26ХМФА |
2,44 ± 0,03 |
2,71 ± 0,03 |
|
32ХГ |
2,27 ± 0,01 |
2,52 ± 0,01 |
|
20Х3М |
1,06 ± 0,02 |
1,17 ± 0,02 |
|
15Х5М |
0,83 ± 0,03 |
0,92 ± 0,03 |
Из результатов определения скорости коррозии гравиметрическим методом видно, что увеличение содержания хрома в стали уменьшает скорость коррозии в исследуемой среде. При этом при увеличении содержания хрома в 5 раз скорость коррозии в исследуемой среде уменьшается в три раза. Разница в содержании хрома в 0,14 % между сталями 26ХМФА и 32ХГ не приводит к существенному изменению скорости коррозии.
Электрохимические измерения проводили в среде 3 % NaCl. Результаты определения стационарных потенциалов образцов представлены на рис. 1. Из представленных зависимостей видно, что потенциал сталей со временем смещается в более отрицательную область, что может свидетельствовать об активации поверхности металла. В табл. 3 представлены результаты определения стационарных потенциалов.
Поляризационные кривые исследуемых сталей представлены на рис. 2.
Сравнивая стационарные потенциалы исследуемых образцов между собой, видно, что разница в содержании хрома не приводит к существенным отличиям.
Физическая химия
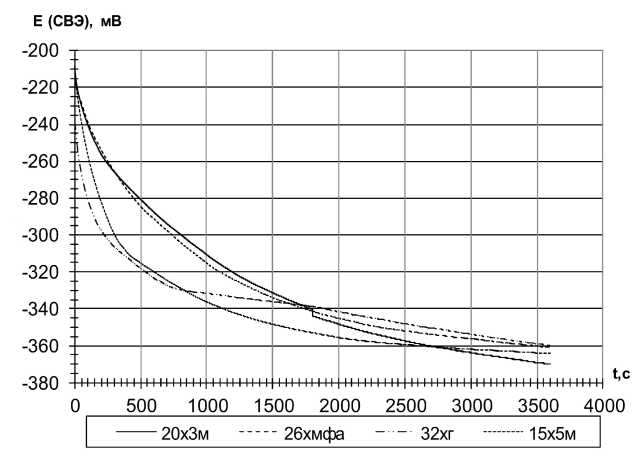
Рис. 1. Стационарные потенциалы исследуемых сталей в 3%-ном растворе NaCl
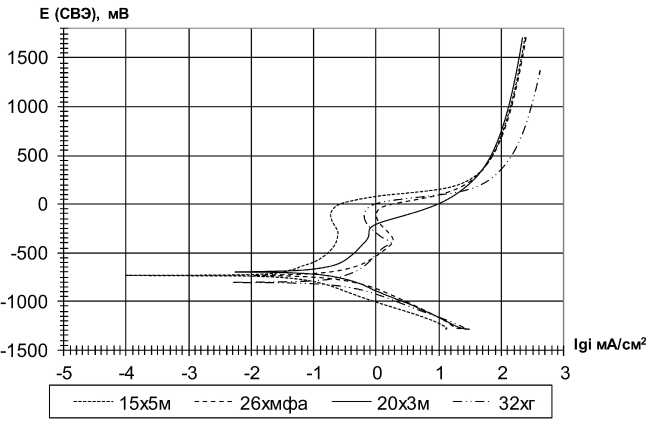
Рис. 2. Поляризационные кривые образцов в 3%-ном растворе NaCl
Сравнение потенциалов и плотностей тока исследуемых образцов
Таблица 3
|
Марка стали |
Потенциал образца, мВ |
Плотность коррозионного тока, мА/см2 |
|
26ХМФА |
–361,24 |
0,09 |
|
32ХГ |
–365,45 |
0,12 |
|
20Х3М |
–355,31 |
0,07 |
|
15Х5М |
–352,32 |
0,02 |
Катодные кривые исследуемых сталей имеют практически одинаковый наклон, несколько отличается лишь сталь 15Х5М. Стационарный потенциал на поляризационных кривых имеет более отрицательное значение по сравнению с измеренным в бестоковых условиях, что объясняется тем, что поляризационные кривые получены в потенциодинамическом режиме с определенной скоростью развертки потенциала. Анодные кривые сталей 32ХГ и 26ХМФА не отличаются друг от друга и имеют одинаковый наклон. По данным поляризационным кривым с помощью уравнений Тафеля рассчитана плотность тока коррозии (табл. 3). Видно, что сталь 15Х5М отличается наименьшим значением тока коррозии. Стали с содержанием хрома 1–3 % имеют небольшие раз- личия в коррозионном токе. В целом, можно сказать, что с увеличением содержания хрома ток коррозии уменьшается, а, следовательно, и скорость коррозии сталей в исследуемой среде.
Стали 26ХМФА и 32ХГ практически не отличаются друг от друга по коррозионному поведению. Они обладают почти одинаковым стационарным потенциалом в исследуемых средах, скорость коррозии по результатам автоклавных испытаний отличается на 0,2 г/см2·ч. Аналогично и в паре сталей 20Х3М и 15Х5М – скорость коррозии, определенная по результатам гравиметрии, отличается на 0,2 г/см2·ч, стационарный потенциал практически одинаков. В то же время между этими двумя группами наблюдаются различия в скорости коррозии в 2 раза. Однако, согласно поляризационным измерениям, при увеличении содержания хрома ток коррозии равномерно уменьшается в ряду: 32ХГ, 26ХМФА, 20Х3М, 15Х5М. При поляризационных измерениях поверхность металла активна и измеряемый ток коррозии отражает коррозионное поведение, не осложненное присутствием на поверхности различных образований.
Выводы
-
1. Гравиметрическим методом при проведении автоклавных испытаний, а также с помощью поляризационных измерений показано, что для исследованных сред, увеличение содержание хрома в стали с 1 до 5 % в целом имеет положительное значение: наблюдается снижение скорости коррозии в 3 раза и тока коррозии в 4,5 раза.
-
2. Изученные стали 32ХГ, 26ХМФА, 20Х3М и 15ХМ5 при проведении автоклавных испытаний в условиях: (С (NaCl) = 50 г/л, P (CO 2 ) = 0,02 МПа, температуре 90 °С, скорости потока жидкости 1 м/с) не обладают заметной коррозионной стойкостью: хотя скорость коррозии стали 15Х5М и снижается в 3 раза по сравнению со сталью 26ХМФА, но остается при этом достаточно высокой и составляет 0,92 мм/год.
-
3. В результате электрохимических исследований установлено, что ток коррозии уменьшается в ряду: 32ХГ, 26ХМФА, 20Х3М, 15Х5М, что согласуется с результатами измерений скорости коррозии, полученными гравиметрическим методом при проведении автоклавных испытаний.
Список литературы Особенности коррозионно-электрохимического поведения сталей с различным содержанием хрома в углекислотных низкотемпературных средах
- Тюсенков, А.С. Причины коррозии насосно-компрессорных труб нефтепромыслов и технологичное повышение их долговечности/А.С. Тюсенков, С.Е. Черепашкин//Наукоемкие технологии в машиностроении. -2016. -№ 6. -С. 11-16.
- Денисов, П.Ю. Исследование причин повышенной коррозии НКТ на Верх-Тарском месторождении и разработка мероприятий по ее снижению/П.Ю. Денисов, Ю.А. Кобка, С.Б. Якимов//Инженерная практика. -2011. -Спецвыпуск, № 1. -С. 37-42.
- Маркин, А.Н. СО2-коррозия нефтепромыслового оборудования/А.Н. Маркин, Р.Э. Низамов. -M.: ВНИИОЭНГ, 2003. -188 с.
- Кузнецов, В.П. Нефтяная промышленность РНТС. Коррозия и защита в нефтегазовой промышленности. К вопросу о механизме углекислотной коррозии углеродистой стали/В.П. Кузнецов, Н.Г. Черная. -М.: ВНИИОЭНГ, 1980. -Вып. 8. -С. 2-5.
- Моисеева, Л.С. Ингибирование углекислотной коррозии нефтегазопромыслового оборудования/Л.С. Моисеева, Ю.И. Кузнецов//Защита металлов. -1996. -Т. 32, № 6. -С. 565-572.
- Борисенкова, Е.А. Механизм образования защитного слоя продуктов углекислотной коррозии на низколегированных сталях с 1 % хрома/Е.А. Борисенкова, М.К. Ионов//Вестник СамГТУ. Серия «Технические науки». -2015. -№ 3(47). -С. 195-200.
- Влияние концентрации хрома, температуры и давления СО2 на коррозионную стойкость насосно-компрессорных труб/И.В. Костицына, А.Г. Тюрин, В.П. Паршуков, А.И. Бирюков//Вестник ЮУрГУ. Серия «Химия». -2012. -Вып. 8. -№ 13 (272). -С. 30-37.


