Особенности коррозионного поведения отливок из чугуна в агрессивных средах
Автор: Харина Галина Валерьяновна, Категоренко Юрий Иванович, Шихалев Иван Александрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Рубрика: Физическая химия и физика металлургических систем
Статья в выпуске: 1 т.18, 2018 года.
Бесплатный доступ
Работа посвящена изучению кинетики и механизма серого (СЧ) и хромированного чугунов (ЧХ28) в кислых и нейтральных средах. Актуальность работы обусловлена необходимостью подбора антикоррозионной защиты указанных сплавов при их эксплуатации в различных средах. Исследования проводились гравиметрическим, микроскопическим и фотометрическим методами. На основании анализа кинетических зависимостей коррозионного процесса отмечено, что разрушение сплавов СЧ и ЧХ28 в указанных средах протекает по электрохимическому механизму. Приведены результаты исследования микроструктуры исследуемых сплавов до и после коррозионных испытаний. Авторами установлено, что в структуре серого чугуна присутствуют феррит и графит, в то время как структура хромистого чугуна состоит из твердого раствора хрома в железе и карбидов. Особое внимание уделяется влиянию химического состава электролита на коррозионное поведение сплавов СЧ и ЧХ28. Установлено, что ванадат-ионы являются активаторами коррозионного процесса, а цистеин и метионин - ингибиторами. Показано, что использованные ингибиторы обладают достаточно высоким защитным действием по отношению к исследуемым сплавам. Полученные данные подтверждены результатами анализа продуктов коррозии сплавов, выполненного фотометрическим методом.
Чугун, структура сплава, скорость коррозии, ингибиторы, защитное действие
Короткий адрес: https://sciup.org/147157125
IDR: 147157125 | УДК: 620.193.4 | DOI: 10.14529/met180101
Текст научной статьи Особенности коррозионного поведения отливок из чугуна в агрессивных средах
Проблема повышения коррозионной стойкости конструкционных материалов, к числу которых относятся сплавы на основе железа, является по-прежнему актуальной. Изделия из чугунов эксплуатируются в различных коррозионных средах, содержащих хлориды, сульфаты, нитраты, ванадаты. Особенно высокой коррозионной активностью по отношению к чугунам отличается технологическая пульпа предприятий черной и цветной металлургии [1, с. 18]. Разрушительное воздействие различных ионов, накапливающихся в оборотной воде при переработке сырья, усиливается в присутствии растворенного кислорода. Существуют различные способы повышения коррозионной стойкости, одним из которых является изменение химического со- става среды путем введения ингибиторов [2]. Так, авторами [3, с. 440] рассмотрен защитный эффект ингибиторов на основе производных метионина при коррозионном разрушении стали. Однако данных о защитном влиянии серосодержащих аминокислот на коррозионное поведении чугунов в литературе нет.
В этой связи целью настоящей работы было изучение кинетики и механизма коррозии отливок из серого (СЧ20) и хромистого (ЧХ28) чугунов в растворах, содержащих ионы-активаторы коррозионного процесса и такие ингибиторы, как цистеин и метионин.
Экспериментальная часть
При выплавке расплавов для получения опытных образцов была использована индукционная тигельная печь ИСТ 006 с кислой
Таблица 1
Химический состав сплава СЧ20, %
|
C |
Si |
Mn |
P |
S |
Fe |
|
3,3 |
2,1 |
0,19 |
< 0,2 |
< 0,15 |
Остальное |
Таблица 2
Химический состав сплава ЧХ28, %
SiO 2 – не менее 97 %;
Al 2 O 3 – не более 1,3 %;
Fe 2 O 3 – не более 0,5 %;
CaO – не более 0,5 %;
Na 2 O + K 2 O – не более 0,3 %.
Основными шихтовыми материалами для выплавки серого чугуна марки СЧ20 ГОСТ 1412–85 являлись чугунный лом, стальной лом, чугун литейный Л3 ГОСТ 4832–95, а для раскисления и доводки химического состава по кремнию и марганцу использовали ферросилиций ФС45 ГОСТ 1415–93 и ферромарганец ФМн78 ГОСТ 4755–91 соответственно.
Для выплавки высоколегированного чугуна марки ЧХ28 ГОСТ 7769–82 в качестве шихтовых материалов использовали лом возврат ЧХ28 с известным химическим составом, литейный чугун Л3, феррохром ФХ005А ГОСТ 4757–91 и отходы стали 15Х13Л.
Составы исследуемых сплавов, полученных в лабораторных условиях, приведены в табл. 1, 2.
Исследования проводились гравиметрическим, микроскопическим и фотометриче- ским методами.
В качестве коррозионной среды использовались растворы на основе HCl, H 2 SO 4 (0,1 моль/дм3), NaCl (3 масс. %) с добавками анионов кислородсодержащих кислот: NO 3 – (2 масс. %), VO 3 – (0,2 масс. %). Функцию ингибиторов выполняли такие аминокислоты, как цистеин и метионин (0,2 масс. %).
Для измерения потери масс исследуемых образцов использовали аналитические весы CY-124C. Значения скорости коррозии K (г/см2·ч) были рассчитаны по формуле
K =^ m , T- s
где Δ m – изменение массы образца, г; s – площадь образца, см2;
τ – время, ч.
По полученным значениям скорости коррозии были построены кинетические зависимости K = f ( τ ) .
Микроструктуру используемых сплавов исследовали на вертикальном металлографическом микроскопе МИМ-7 предназначенного для визуального наблюдения и фотографирования микроструктуры металлов с увеличением от 60 x до 1440 x .
Эффективность использованных ингибиторов оценивали по степени их защитного действия:
Z = K о - K i . 100%, (2)
K 0
где K 0 – скорость растворения сплава в растворе без ингибитора, г/см2·ч;
K 1 – скорость растворения сплава в растворе с ингибитором, г/см2·ч.
Продукты коррозии исследуемых сплавов на содержание в них железа и хрома анализировали фотометрическим методом с использованием фотометра КФК-2.
Результаты и обсуждение
На рис. 1 и 2 представлены зависимости скорости коррозии от времени экспозиции образцов СЧ и ЧХ, находящихся в растворах 0,1 М H 2 SO 4 и растворах H 2 SO 4 , содержащих метионин и цистеин по 0,2 масс. %.
И серый, и хромистый чугун в растворе H2SO4 подвергается электрохимической коррозии с водородной деполяризацией. При этом возникает множество коррозионных гальванопар феррит – графит (рис. 1, а). Электродный потенциал графита положительнее феррита и остальных структурных составляющих данных сплавов, поэтому он выполняет функцию катода, на котором протекает реакция восстановления ионов водорода:
2Н+ + 2e– → Н 2 . (3)
Анодная реакция описывается схемой
Fe0 – 2e– → Fe2+. (4)
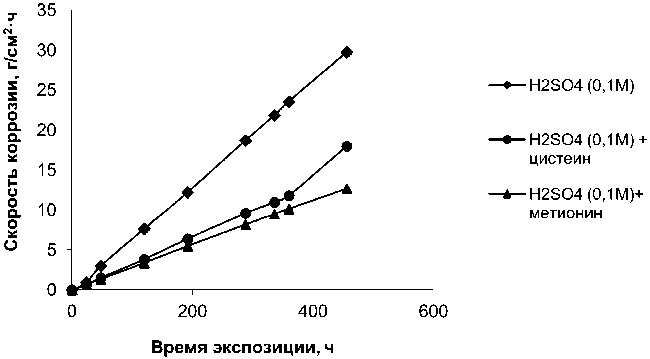
Рис. 1. Зависимость скорости коррозии образцов СЧ от времени экспозиции в растворах 0,1 М H 2 SO 4 ; 0,1 М H 2 SO 4 + метионин (0,2 масс. %);
0,1 М H 2 SO 4 + цистеин (0,2 масс. %)
-5
Время экспозиции, ч
—♦—H2SO4(O,1M)
—X— Н2$04(0,1М)+цистеин
• Н2504(0,1М)+метионин
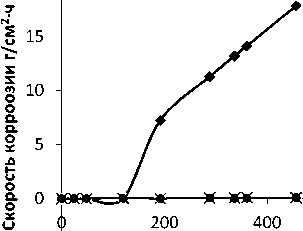
Рис. 2. Зависимость скорости коррозии образцов ЧХ от времени экспозиции в растворах 0,1 М H 2 SO 4 ; 0,1 М H 2 SO 4 + метионин (0,2 масс. %);
0,1 М H 2 SO 4 + цистеин (0,2 масс. %)
Из рис. 1 видно, что сплав СЧ неустойчив в кислой среде, скорость коррозии прямопропорционально зависит от времени экспозиции; перехода в пассивное состояние при этом не наблюдается. Автором [4, с. 124] также утверждается, что в кислых средах при протекании коррозии в водородной деполяризацией влияние графита достаточно велико.
Введение в раствор ингибирующих добавок метионина и цистеина практически не влияет на характер кинетических зависимостей СЧ.
В отличие от СЧ хромистый чугун (ЧХ) подвергается полной пассивации в присутствии и цистеина, и метионина (рис. 2) благодаря образованию и осаждению на поверхности сплава труднорастворимых тиолатов [5, с. 39] железа и хрома, выполняющих, таким образом, функцию анодных ингибиторов:
Fe2+ + RSH → Fe(SR) 2 + 2H+; (5)
Cr2+ + RSH → Cr(SR) 2 + 2H+. (6)
Более того, даже в отсутствие ингибирующих добавок активное растворение ЧХ начинается лишь по истечении 100 ч выдержки образца в коррозионной среде. Последнее, очевидно, связано с действием легирующей добавки хрома, способствующего, во-первых, образованию на поверхности более коррозионностойкого по сравнению с оксидом железа оксида хрома (III), а во-вторых, – процессу деполяризации катодных участков (карбидов хрома) в сплаве ЧХ.
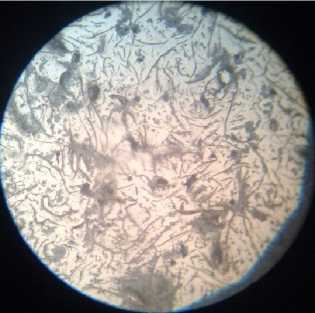
При рассмотрении в микроскоп микрошлифа серого чугуна (СЧ) хорошо видно, что структура представляет собой металлическую основу с графитом пластинчатой формы. Шлифы образцов серого чугуна травились в 3%-ном растворе азотной кислоты в спирте. Из рис. 3, а видно, что у исходного образца серого чугуна две структурные составляющие –
а)
б)
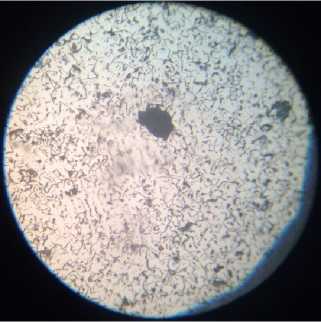
в)
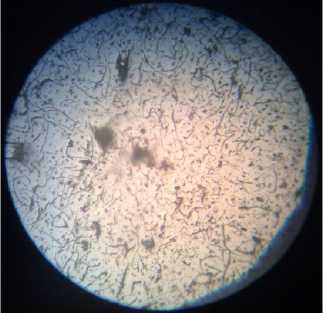
Рис. 3. Микроструктура серого чугуна: а) исходный образец; образцы, находившиеся: б) в 0,1 М растворе H 2 SО 4 ; в) в 0,1 М растворе H 2 SО 4 с добавкой цистеина; г) в 0,1 М растворе H 2 SО 4 с добавкой метионина
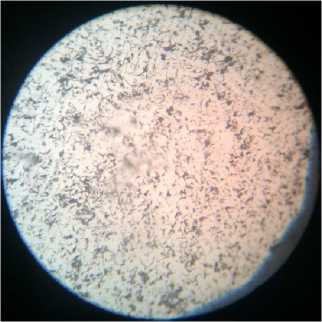
г)
феррит и графит . Светлый фон в поле микрошлифа - феррит, а темные крупные прожилки - графит.
Графит образуется в серых чугунах в результате распада хрупкого цементита. Пластинки включений графита играют роль концентратов напряжений в отливке, как следствие низкие характеристики механических свойств.
Из рис. 3, б видно, что в структуре образца серого чугуна после его выдержки в 0,1 М растворе H 2 SО 4 также присутствуют две составляющие – графит и феррит. Светлое поле микрошлифа - феррит, темные крупные прожилки (пластинки) - графит. Это означает, что процесс графитизации в твердом состоянии прошел полностью.
Графит и феррит присутствуют также в структуре образцов СЧ, находившихся в растворах H 2 SО 4 (0,1 М) + цистеин (рис. 3, в) и H 2 SО 4 (0,1М) + метионин (рис. 3, г).
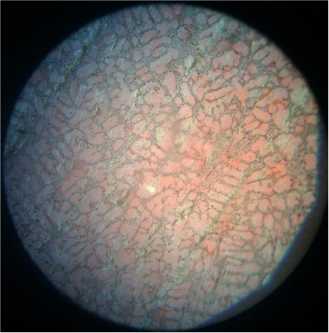
Структура высокохромистых чугунов состоит из твердого раствора хрома в α-железе и карбидов сложного состава (рис. 4а). Карбиды ухудшают обрабатываемость сплава и способны вызвать местные очаги коррозии [6, с. 69–70]. По данным автора [1, с. 71], разрушение сплавов происходит по границам зерен, т. е. по месту расположения карбидов (рис. 4, б, в, г), что можно объяснить обеднением твердого раствора.
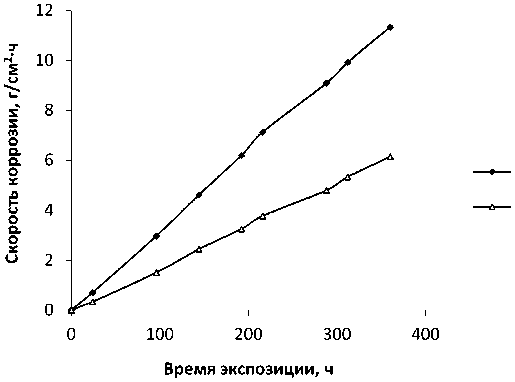
Поскольку изделия из СЧ и ЧХ могут эксплуатироваться в средах, содержащих продукты сгорания топлива, а также в водах буровых скважин и сточных водах металлургических предприятий, представляло интерес изучить коррозионное поведение исследуемых сплавов в присутствии ванадат-ионов как одного из компонентов указанных сред (рис. 5 и 6).
Известно [7, с. 60–61], что ванадат-ионы (VO 3 –), обладая окислительными свойствами, стимулируют коррозию сплава за счет усиления процесса деполяризации катодных (карбидных) участков сплава. Кроме того, стимулирующим действием обладают и хлорид-ионы, вызывая питтинговую коррозию.
Из рис. 5 и 6 видно, что образцы и СЧ и ЧХ равномерно растворяются в течение всего времени их выдержки в коррозионной среде вследствие высокой проникающей способности Cl–-ионов и развития питтингов, а также вследствие активации процесса деполяризации катода.
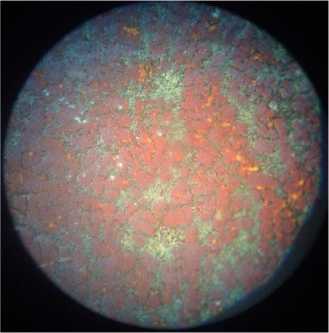
а)
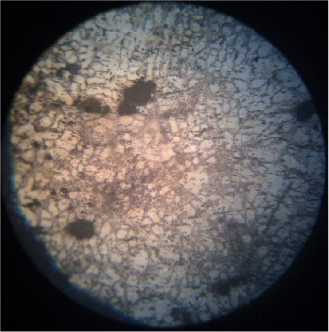
б)
в)
Рис. 4. Микроструктура хромированного чугуна: а) исходный образец; образцы, находившиеся: б) в 0,1 М растворе H 2 SО 4 ; в) в 0,1 М растворе H 2 SО 4 с добавкой цистеина; г) в 0,1 М растворе H 2 SО 4 с добавкой метионина
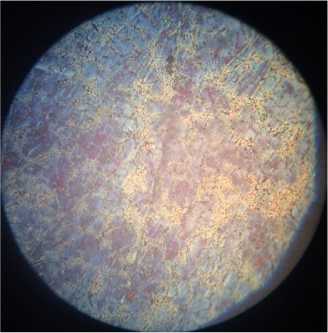
г)
HCI+NaV03
HCI+NaV03+UMCT
Рис. 5. Зависимость скорости коррозии образцов СЧ от времени экспозиции в растворах 0,1 М HCl + 0,2 масс. % NaVO 3 ; 0,1 М HCl + 0,2 масс. %
NaVO 3 + 0,2 масс. % цистеина
Время экспозиции, ч
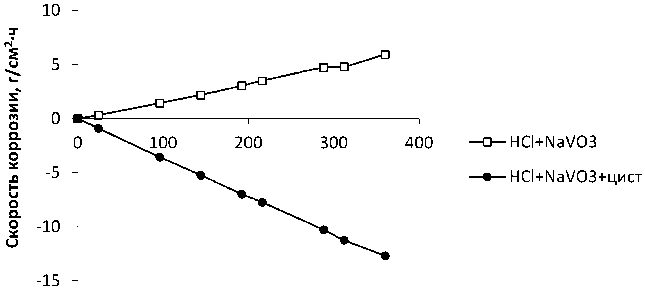
Рис. 6. Зависимость скорости коррозии образцов ЧХ от времени экспозиции в растворах 0,1 М HCl + 0,2 масс. % NaVO 3 ; 0,1 М HCl + 0,2 масс. % NaVO 3 + 0,2 масс. % цистеина
Введение в раствор цистеина способствует подавлению коррозионного процесса за счет экранирования поверхности образца труднорастворимыми тиолатами железа и хрома и, следовательно, торможения анодного процесса растворения основного металла железа как в кислой, так и в нейтральной среде (см. рис. 6).
Коррозионное поведение исследуемых сплавов в нейтральной среде (3%-ный раствор NaCl) практически не отличается от их поведения в кислой среде. Однако значения скорости в первом случае на несколько порядков ниже, что обусловлено менее выраженным процессом восстановления кислорода на катодных участках, функцию которых выполняют частицы цементита в сплаве:
О 2 + 2Н 2 О + 4e– → 4ОН–. (7)
Рост скорости коррозии объясняется активирующим действием хлорид-ионов, вызывающих питтингообразование за счет внедрения хлорид-ионов в различные дефекты поверхностной пленки (главным образом, железа) [8, с. 117]. Образующийся внутри питтинга хлорид железа гидролизуется, создавая кислую среду, в которой сплав растворяется быстрее:
FeCl 2 + Н 2 О ↔ Fe(ОН)Cl + HCl. (8)
По данным авторов [9, с. 89] железо и его сплавы невозможно запассивировать в нейтральных средах, содержащих хлорид-ионы.
В табл. 3 приведены максимальные значения скорости коррозии исследованных сплавов в коррозионных средах.
Из табл. 3 следует, что в присутствии NO3–-ионов скорость коррозии исследуемых сплавов как в кислых, так и в нейтральных растворах понижается вследствие их пассивирующего действия. Действие ингибитора метионина в присутствии нитрат-ионов менее выражено. Отрицательные значения скорости коррозии обусловлены увеличением массы образцов вследствие образования на их поверхности плотного слоя продуктов коррозии. По данным, приведенным в табл. 3, видно, что в присутствии использованных ингибиторов скорость коррозии существенно понижается.
Эффективность использованных ингибиторов оценивали по степени их защитного действия по формуле (2). Значения ингибирующего эффекта цистеина и метионина по отношению к сплавам СЧ и ЧХ приведены в табл. 4.
Из табл. 3 следует, что максимальным защитным действием цистеин и метионин обладают по отношению к сплавам СЧ и ХЧ в растворе H 2 SO 4 . Во всех использованных коррозионных средах защитный эффект указанных аминокислот по отношению к сплаву ЧХ достигался в большей степени, по сравнению со сплавом СЧ, что обусловлено, очевидно, большим содержанием различных металлов, способных образовывать с сульфгидрильными группами труднорастворимые тиолаты.
После проведения коррозионных испытаний все растворы были проанализированы на содержание железа в продуктах коррозии фотометрическим методом, основанном на образовании окрашенных комплексов железа с сульфосалициловой кислотой [10, с. 20].
Исследуемые растворы, содержащие комплексные соединения железа с сульфосалициловой кислотой, фотометрировали на фотоколориметре при 416 нм относительно раствора
Таблица 3
Максимальные значения скорости коррозии СЧ и ЧХ в коррозионных средах
|
Коррозионная среда |
Сплав |
Время экспозиции, ч |
Скорость коррозии, г/см2·ч |
|
H 2 SO 4 |
СЧ |
456 |
29,7 |
|
ЧХ |
17,8 |
||
|
H2SO4 + метионин |
СЧ |
12,6 |
|
|
ЧХ |
0,07 |
||
|
H 2 SO 4 + цистеин |
СЧ |
14,9 |
|
|
ЧХ |
0,11 |
||
|
HCl |
СЧ |
456 |
32,8 |
|
ЧХ |
17,1 |
||
|
HCl + цистеин |
СЧ |
9,5 |
|
|
ЧХ |
2,8 |
||
|
HCl + NaVO 3 |
СЧ |
360 |
11,3 |
|
ЧХ |
5,9 |
||
|
HCl + NaVO 3 + цистеин |
СЧ |
6,1 |
|
|
ЧХ |
–12,6 |
||
|
HCl + NaVO 3 + метионин |
СЧ |
8,2 |
|
|
ЧХ |
2,2 |
||
|
NaCl + NaVO 3 |
СЧ |
1,5 |
|
|
ЧХ |
1,1 |
||
|
NaCl + NaVO 3 + цистеин |
СЧ |
1,1 |
|
|
ЧХ |
–3,7 |
||
|
NaCl + NaNO 3 |
СЧ |
360 |
0,9 |
|
ЧХ |
0,1 |
||
|
NaCl + NaNO 3 + метионин |
СЧ |
360 |
0,7 |
|
ЧХ |
–0,1 |
||
|
H 2 SO 4 + NaNO 3 |
СЧ |
360 |
11,7 |
|
ЧХ |
0,2 |
||
|
H 2 SO 4 + NaNO 3 + метионин |
СЧ |
360 |
9,8 |
|
ЧХ |
–0,1 |
Таблица 4
Значения защитного действия ингибитора цистеина по отношению к СЧ и ЧХ, рассчитанные по максимальным значениям скорости коррозии
|
№ |
Растворы |
Сплав |
Ингибитор |
Z , % |
|
1 |
H 2 SO 4 |
СЧ |
Цистеин (0,2 масс. %) |
49,8 |
|
ЧХ |
99,4 |
|||
|
2 |
HCl |
СЧ |
71,0 |
|
|
ЧХ |
83,5 |
|||
|
3 |
HCl + NaVO 3 |
СЧ |
46,0 |
|
|
ЧХ |
– |
|||
|
4 |
NaCl + NaVO 3 |
СЧ |
21,6 |
|
|
ЧХ |
– |
|||
|
5 |
HCl + NaVO 3 |
СЧ |
Метионин (0,2 масс. %) |
27,4 |
|
ЧХ |
62,7 |
|||
|
6 |
H 2 SO 4 |
СЧ |
57,6 |
|
|
ЧХ |
99,6 |
|||
|
7 |
NaCl + NaNO 3 |
СЧ |
22,2 |
|
|
ЧХ |
– |
|||
|
8 |
H 2 SO 4 + NaNO 3 |
СЧ |
16,2 |
|
|
ЧХ |
– |
Таблица 5
Содержание железа в продуктах коррозии ЧХ и СЧ, найденное фотометрическим методом
|
№ п/п |
Состав коррозионной среды |
Содержание Fe, мг/л |
|
|
ЧХ28 |
СЧ |
||
|
1 |
H 2 SO 4 |
0,064 |
0,110 |
|
2 |
H2SO4 + цистеин |
0,015 |
0,044 |
|
3 |
H2SO4 + метионин |
0,025 |
0,064 |
|
4 |
HCl |
0,068 |
0,150 |
|
HCl + цистеин |
0,021 |
0,050 |
|
|
4 |
NaCl + NaNO 3 |
0,015 |
0,150 |
|
NaCl + NaNO 3 + метионин |
0,015 |
0,110 |
|
|
H 2 SO 4 + NaNO 3 |
0,008 |
0,021 |
|
|
5 |
H 2 SO 4 + NaNO 3 + метионин |
0,009 |
0,018 |
-
5. Торчинский, Ю.М. Сульфгидрильные и дисульфидные группы белков / Ю.М. Торчин-ский. – М.: Наука, 1971. – 228 с.
-
6. Юкалов, И.Н. Отливки из химически стойких сплавов / И.Н. Юкалов. – М.: Машиностроение, 1964. – 231 с.
-
7. Свойства ванадатов в водно-солевых системах и их практическое применение / В.В. Викторов, Т.П. Сирина, Т.И. Красненко, Г.В. Соловьев. – Челябинск: Изд-во Челяб. гос. пед. ун-та, 2015. – 136 с.
-
8. Ангал, Р. Коррозия и защита от коррозии / Р. Ангал. – М.: Интеллект, 2014. – 343 с.
-
9. Улиг, Г.Г. Коррозия и борьба с ней / Г.Г. Улиг, Р.У. Реви – Л.: Химия, 1989. – 456 с.
-
10. Воробьева, Е.В. Большой практикум: практ. пособие по спецкурсу / Е.В. Воробьева, Т.В. Макаренко. – Гомель: Гомельский государственный университет, 2005. – 88 с.
Список литературы Особенности коррозионного поведения отливок из чугуна в агрессивных средах
- Колокольцев, В.М. Влияние первичной литой структуры жароизносостойких железоуглеродистых сплавов на их коррозионную стойкость/В.М. Колокольцев, А.С. Гольцов, Е.В. Синицкий//Вестник МГТУ им. Г.И. Носова. -2011. -№ 2. -С. 18-23.
- Данякин, Н.В. Способы и механизмы применения ингибиторов коррозии металлов и сплавов/Н.В. Данякин, А.А. Сигида//Auditorium. Электронный научный журнал Курского государственного университета. -2017. -№ 2 (14). -С. 132-140.
- Zhe Zhang. Inhibition of the corrosion of carbon steel in HCl solution by metionine and its derivatives/Zhe Zhang, Ningchen Tian, Lingzhi Zhang, Ling Wu//Corrosion Science. -2015. -Vol. 98. -P. 438-449 DOI: 10.1016/j.corsci.2015.05.048
- Попова, А.А. Методы защиты от коррозии: курс лекций/А.А. Попова -М.: Лань, 2014. -271 с.
- Торчинский, Ю.М. Сульфгидрильные и дисульфидные группы белков/Ю.М. Торчинский. -М.: Наука, 1971. -228 с.
- Юкалов, И.Н. Отливки из химически стойких сплавов/И.Н. Юкалов. -М.: Машиностроение, 1964. -231 с.
- Свойства ванадатов в водно-солевых системах и их практическое применение/В.В. Викторов, Т.П. Сирина, Т.И. Красненко, Г.В. Соловьев. -Челябинск: Изд-во Челяб. гос. пед. ун-та, 2015. -136 с.
- Ангал, Р. Коррозия и защита от коррозии/Р. Ангал. -М.: Интеллект, 2014. -343 с.
- Улиг, Г.Г. Коррозия и борьба с ней/Г.Г. Улиг, Р.У. Реви -Л.: Химия, 1989. -456 с.
- Воробьева, Е.В. Большой практикум: практ. пособие по спецкурсу/Е.В. Воробьева, Т.В. Макаренко. -Гомель: Гомельский государственный университет, 2005. -88 с.


