Особенности криоконсервации алканотрофных актинобактерий рода Rhodococcus
Автор: Каменских Т.Н., Калашникова Е.А., Ившина И.Б.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2010 года.
Бесплатный доступ
Исследовано влияние долгосрочного низкотемпературного (-85С) хранения на жизнеспособность клеток и стабильность основных морфологических и физиолого-биохимических характеристик коллекционных культур актинобактерий рода Rhodococcus. Установлен высокий (70-90%) уровень жизнеспособности родококков с алканотрофным типом метаболизма после их восстановления из замороженного состояния. В результате сравнительного исследования криозащитных соединений показано преимущество использования 5% ДМСО для краткосрочного хранения представителей вида R. ruber и 10% глицерина в качестве универсального протектора, эффективного для длительной низкотемпературной консервации представителей всех исследованных видов родококков. Оценена пригодность экспрессных методов специфической окраски для оценки уровня жизнеспособности бактерий после криоконсервации.
Алканотрофные актинобактерии, криоконсервация, криопротекторы, жизнеспособность, респирометрия, специфическое окрашивание клеток
Короткий адрес: https://sciup.org/147204477
IDR: 147204477 | УДК: 579.873.6.
Текст научной статьи Особенности криоконсервации алканотрофных актинобактерий рода Rhodococcus
Практическое использование микроорганизмов в различных областях биотехнологии и медицины напрямую связано с применением эффективных методов поддержания гарантированно стабильных, жизнеспособных культур. Создание таких методов, пригодных для продолжительного хранения микроорганизмов, стало возможным благодаря расшифровке природы обратимой остановки жизнедеятельности клеток при глубоком замораживании и высушивании. Следует однако отметить, что ни один из существующих методов длительного поддержания коллекционных и производственных культур не является универсальным. Для хранения больших коллекций микробных ресурсов наиболее оправдано применение методов глубокого высушивания (лиофилизации) и криоконсервации (Ившина и др., 1994; Gherna, 1994; Каменских, 1998; Цуцаева и др., 2008;). Один из современных способов криоконсервации микроорганизмов – замораживание и хранение бактериальных культур в условиях специализированных морозильников сверхнизких (-85^96°С) температур. Литературные сведения об эффективности данного метода хранения весьма немногочисленны, а подобные исследования в отношении актинобактерий рода Rhodococcus ранее не проводились.
Цель настоящего исследования – оценка эффективности метода криоконсервации алканотрофных родококков при -85 ° С для длительного хранения генофонда коллекционных культур.
Методы исследования
Объектом исследования служили 15 штаммов родококков, принадлежащих к видам Rhodococcus erythropolis, R. rhodochrous, R. ruber, и поддерживаемых в Региональной профилированной коллекции алканотрофных микроорганизмов (акроним ИЭГМ, номер во Всемирной федерации коллекций культур #768, . Культуры выращивали на мясопептонном агаре (МПА), а также минеральной среде в пропано-воздушной атмосфере (1:5), либо в присутствии н-гексадекана (1.0 об. %) (Каталог штаммов..., 1994) в качестве единственного источника углерода. В работе использовали бактериальные взвеси плотностью 107-108 кл/мл. В качестве криопротекторов применяли 10% глицерин или 5% диметилсульфоксид (ДМСО). В контрольных опытах клетки родококков суспендировали в дистиллированной воде без добавления криопротектора. Замораживание культур проводили при -85°С в морозильнике сверхнизких температур
MDF-U4086S (Sanyo, Япония) с резервной системой для поддержания температуры Back-up System CVK-UB2. Процесс восстановления замороженных клеток осуществляли путем оттаивания при комнатной температуре.
Число жизнеспособных клеток определяли микрометодом точечных высевов по колониеобразующей способности (Веслополова, 1995). В сравнительных экспериментах жизнеспособность культур параллельно оценивали путем специфического окрашивания бактерий 0.2% раствором йо-донитротетразолия фиолетового (Packard, 1971) и двухкомпонентным красителем Live/Dead Bac-Ligth Bacterial Viability Kit L1352, в соответствии с инструкцией производителя (Molecular Probes, Inc.; . В первом случае на планшетном фотометре (X 492 нм) Multiskan Ascent 354 (Thermo, Китай) регистрировали концентрацию активно респирирующих клеток по содержанию не растворимого в воде формазана, образующегося при восстановлении бесцветной соли тетразолия (Haines et al., 1995; Uraizee et al., 1998). Во втором – подсчитывали живые и мертвые клетки с помощью люминесцентного микроскопа (возбуждающий фильтр EX545) MС-400 F (Micros, Австрия). Цитоморфологические исследования проводили с помощью светлопольного микроскопа с фазовоконтрастным устройством Axiostar plus (Carl Zeiss, Германия) с использованием системы визуализации и анализа микроскопического изображения ВидеоТест-Размер 5.0 (ВидеоТест, Россия), включающей цветную цифровую систему ввода изображения Pixera PRO-150ES (Pixera, США). Эффективность криоконсервации оценивали по показателю выживаемости. Процент жизнеспособных клеток родококков рассчитывали относительно числа клеток, определяемого до криоконсервации. Проверку сохранения физиолого-биохимичских свойств бактериальных культур осуществляли путем контрольного определения ключевых признаков (Ившина и др., 1994). Статистическую обработку результатов проводили с использованием пакета компьютерных программ Microsoft Office Excel 2003, принимая уровень вероятности 95%.
Результаты и их обсуждение
В результате проведенных исследований установлено, что родококки, суспендированные в дистиллированной воде, довольно хорошо переносят процесс низкотемпературного замораживания с последующим оттаиванием при комнатной температуре. Так, выживаемость клеток представителей видов R. erythropolis, R. rhodochrous и R. ruber составляет от 55 до 70% (рис. 1) при средней исходной концентрации 4.3x107 кл/мл. Для повышения устойчивости клеток к воздействию низких температур целесообразно применение защитных веществ – криопротекторов (Пучков, Говорунов, 1983; Kisidayova, 2005). Их действие связывают со способностью вступать во взаимодействие с гидратной оболочкой биологически активных макромолекул и воздействовать, таким образом, на их структуру.
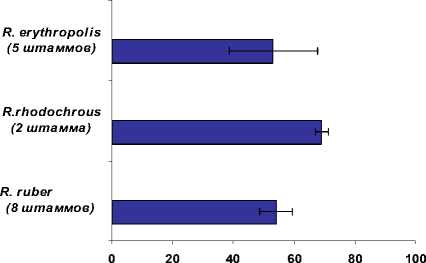
Выживаемость, % к контролю (до криоконсервации)
Рис. 1 . Влияние процесса криоконсервации на выживаемость коллекционных культур Rhodococcus spp .
Так механизм защитного действия глицерина, объясняется его адсорбцией на клеточной мембране и интерколяцией между молекулами липидов, способствующих лабильности мембран (Dyubko et al., 2006). При этом криозащитные вещества ослабляют эффект кристаллизации, изменяя ее характер (Волков, 1994).
По нашим данным, использование ДМСО в качестве криопротектора позволяет повысить показатель выживаемости замороженных клеток R. erythropolis в среднем до 80%, однако в течение 1-го года хранения численность жизнеспособных клеток в замороженной суспензии достоверно снижается до 45%. В то же время, при криоконсервации представителей данного вида с использованием глицерина высокий (80%) уровень выживаемости сохраняется в течение всего срока хранения (рис. 2). При этом показатель жизнеспособности отдельных штаммов R. erythropolis достигает 94%, что соответствует 8.3 x 10 7 кл/мл (табл. 1).
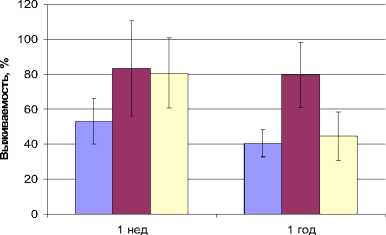
Срок хранения
Рис. 2. Динамика жизнеспособности коллекционных культур R. erythropolis при криоконсервации: 1 – контроль (без внесения протектора); 2 – в качестве протектора использовали глицерин; 3 – ДМСО
Изучение выживаемости коллекционных культур R. ruber после криоконсервации показало, что наибольшая (≥100%) степень жизнеспособности замороженных клеток регистрируется с использованием ДМСО сразу после низкотемпературного воздействия (рис. 3).
Таблица 1
Жизнеспособность коллекционных штаммов R. erythropolis после криоконсервации в течение 1 года
|
Штамм ИЭГМ |
Криопротектор |
Число жизнеспособных клеток/мл |
Выживаемость, % |
|
|
до криоконсервации |
через 1 год |
|||
|
200 |
Глицерин |
(1.7 ± 0.38) × 107 |
(8,3 ± 0.75) ×107 |
94.32 |
|
ДМСО |
(1.8 ± 0.38) × 108 |
(6.0 ± 0.59) ×107 |
66.67 |
|
|
267 |
Глицерин |
(9.6 ± 2.86) × 107 |
(4.5 ± 0.55) × 107 |
93.75 |
|
487 |
Глицерин |
(1.4 ± 0.34) × 108 |
(4.7 ± 0.36) × 107 |
69.12 |
|
ДМСО |
(1.1 ± 0.28) × 108 |
(2.4 ± 0.35) × 107 |
44.44 |
|
|
507 |
Глицерин |
(2.4 ± 0.43) × 108 |
(5.6 ± 0.33) × 107 |
46.67 |
|
ДМСО |
(7.6 ± 2.43) × 107 |
(1.4 ± 0.21) × 107 |
36.84 |
|
|
684 |
Глицерин |
(9.6 ± 2.88) × 107 |
(4.5 ± 0.30) ×107 |
93.75 |
|
ДМСО |
(2,0 ± 0.37) × 108 |
(3.0 ± 0.51) × 107 |
30.00 |
|
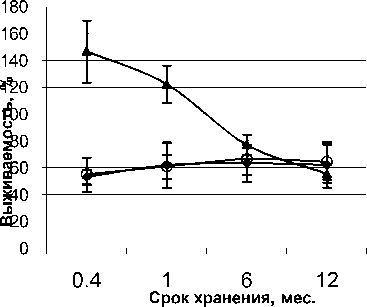
Рис. 3. Динамика жизнеспособности R. ruber после криоконсервации:
1 – криопротектор ДМСО; 2 – глицерин ; 3 – без внесения протектора
По-видимому, это объясняется биологической особенностью представителей R. ruber , проявляющейся в начале стационарной фазы роста клеток, как то, присутствием палочковидных фрагментов, наряду с доминированием кокковидных форм, и последующей фрагментацией клеточного мицелия (Нестеренко и др., 1985). В течение одного года хранения уровень жизнеспособности R. ruber в этом варианте опыта достоверно снижается до 40–50%. Полученные данные свидетельствуют о преимуществе использования протектора ДМСО для краткосрочного (до 6 мес.) хранения родококков вида R. ruber .
Интересно отметить, что выживаемость представителей R. ruber в вариантах без применения криопротектора и с использованием 10% глицерина, на протяжении всего срока хранения оставалась на одном уровне. При этом средний процент выживаемости к концу 1 года хранения составлял 60– 70% от первоначального (рис. 3). Таким образом, применение ДМСО и глицерина в качестве протек- торов позволяет повысить степень выживаемости родококков в процессе низкотемпературного хранения.
Учитывая способность родококков утилизировать широкий спектр углеводородных соединений, нами проведен сравнительный анализ жизнеспособности культур, предварительно выращенных на углеводных и углеводородных средах. Установлено, что степень устойчивости к низкотемпературному воздействию культур, использующих пропан в качестве единственного источника углерода и энергии на 20% выше по сравнению с клетками родококков, выращенными на МПА (табл. 2).
Исследование выживаемости замороженных родококков, предварительно выращенных в присутствии н -гексадекана, показало, что содержание жизнеспособных клеток в суспензии после 1-го года криоконсервации снижается до 0.7–47.0%, составляя в среднем 16.2% (рис. 4). Однако на наш взгляд, это не связано с гибелью клеток, использующих н -гексадекан, в результате воздействия низкотемпературного фактора. Так, по данным микроскопического анализа (рис. 5), клетки родо-кокков, предварительно выращенные на среде в присутствиии н -гексадекана, собраны в плотные агрегаты размером от 8 до 12 мкм.
Это приводит к заниженным результатам численности бактериальных клеток в связи с формированием на агаризованной питательной среде колоний, выросших не из одной клетки, а из агрегатов, образованных множеством жизнеспособных клеток. Выявленный факт подтверждается результатами дифференцирующего окрашивания живых и мертвых клеток после криоконсервации с использованием флуоресцентных красителей. Так, процентное содержание бактерий, окрашенных в зеленый цвет компонентным красителем «Syto 9» и регистрируемых как живые, в 3.6 раза превышает таковое, полученное методом высева на агари-зованную питательную среду.
Таблица 2
Жизнеспособность родококков, предварительно выращенных на разных средах, после 1 года хранения при -85°С
|
Штамм R. ruber |
Среда предварителного культивирования |
Число жизнеспособных кл/мл |
Выживаемость, % |
|
|
до криоконсервации |
1 год после криоконсервации |
|||
|
ИЭГМ 71 |
МПА |
(1.8 ± 0.27) × 108 |
(9.4 ± 0.52) × 107 |
52.22 |
|
С3* |
(1.4 ± 0.56) × 108 |
(1.4 ± 0.09) × 108 |
100.00 |
|
|
ИЭГМ 74 |
МПА |
(2.0 ± 0.28) × 108 |
(1.2 ± 0.08) × 108 |
60.00 |
|
С3 |
(4.4 ± 0.56) × 107 |
(3.5 ± 0.32) × 107 |
79.55 |
|
|
ИЭГМ 83 |
МПА |
(1.2 ± 0.22) × 108 |
(8.2 ± 0.57) × 107 |
68.33 |
|
С3 |
(3.3 ± 0.31) × 107 |
(1.9 ± 0.19) × 107 |
57.58 |
|
|
ИЭГМ 233 |
МПА |
(2.4 ± 0.31) × 108 |
(9.6 ± 0.57) × 107 |
40.00 |
|
С3 |
(2.7 ± 0.27) × 108 |
(1.7 ± 0.20) × 108 |
62.96 |
|
|
ИЭГМ 235 |
МПА |
(2.6 ± 0.32) × 108 |
(1.3 ± 0.10) × 108 |
50.00 |
|
С3 |
(5.9 ± 0.41) × 107 |
(4.0 ± 0.47) × 107 |
67.80 |
|
|
ИЭГМ 381 |
МПА |
(1.3 ± 0.23) × 108 |
(7.8 ± 0.58) × 107 |
60.00 |
|
С3 |
(5.6 ± 0.50) × 107 |
(4.0 ± 0.42) × 107 |
71.43 |
|
|
ИЭГМ 468 |
МПА |
(2.0 ±0.28) × 108 |
(1.3 ± 0.04) × 108 |
65.00 |
|
С3 |
(3.1 ± 0.37) × 107 |
(3.0 ± 0.26) × 107 |
96.77 |
|
* С3 – минеральная среда с пропаном.
ИЭГМ…ИЭГМ…
ИЭГМ…
ИЭГМ…
ИЭГМ…
■1 □ 2
ИЭГМ…
№1
ИЭГМ … ^^^^^^^^^^^^^^^^^^^^^^^
Выживаемость, %
Рис. 4. Выживаемость родококков, предварительно выращенных на разных средах, после 1 года криоконсервации: 1 – жидкая минеральная среда с н -гексадеканом; 2 – мясопептонный агар
По нашим данным, эффективным способом учета жизнеспособности углеводородокисляющих родококков после криоконсервации является экспрессный спектрофотометрический метод, основанный на окрашивании активно респирирующих клеток 0.2% раствором йодонитротетразолия фиолетового. Установлена сильная (r>0.71) степень корреляции между показателем интенсивности окрашивания тетразолием и числом жизнеспособных клеток родококков, регистрируемых методом точечных высевов с достоверной вероятностью 95% (рис. 6).
Важным аспектом при оценке эффективности криоконсервации родококков является проверка сохранения их основных морфологических и фи- зиолого-биохимических особенностей. Цитологические исследования с определением размеров клеток не выявили достоверных различий морфометрических характеристик с исходными показателями после воздействия низкотемпературного фактора. То же следует отметить и в отношении основных макроморфологических признаков, в частности, размеров и формы колоний, их структуры, консистенции, оптических свойств и т.п. Кроме того, учитывая способность представителей Rhodococcus spp. к биотрансформации практически всех классов органических соединений, проведены контрольные тесты на способность родокок-ков к окислению ряда природных и антропогенных углеводородных субстратов. Анализ результатов свидетельствует о сохранении каталитической активности, присущей интактным клеткам родо-кокков, и после длительного хранения культур в замороженном состоянии. Так, в частности, про-панокисляющая способность и уровень биотрансформации клетками R. ruber β-ситостерола до стигмаст-4-ен-3-она, а также выявленная ранее способность некоторых штаммамов R. rhodochrous к окислению тиоанизола до фенилметилового сульфоксида не изменилась и после 2-х лет хранения.
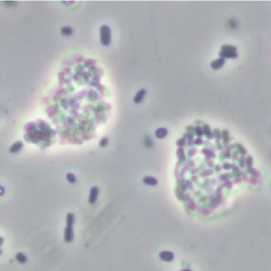
Рис. 5. Клеточные агрегаты R. ruber ИЭГМ 231 после криоконсервации (фазово-контрастная микроскопия, увеличение ×1000)
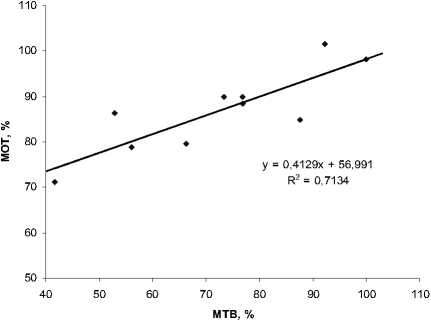
Рис. 6. Оценка степени корреляции показателя жизнеспособности (%) криоконсервированных клеток родококков, оцениваемых методами точечных высевов (МТВ) и окраски тетразолием (МОТ)
Таким образом, метод криоконсервации актинобактерий рода Rhodococcus при -85°С, предполагающий использование бактериальных клеток с предварительно индуцированным алканотрофным метаболизмом и применение 10% глицерина в качестве криопротектора, обеспечивает высокую (106–108 клеток/мл) степень выживаемости родо-кокков и способствует сохранению их основных морфологических и физиолого-биохимических характеристик. По-видимому, устойчивость исследуемых культур к воздействию низкой температуры определяется характерными структурными и физиологическими особенностями данных актинобактерий (Ившина, 1997), как то: наличие сложного морфогенетического цикла развития, способ- ность к смене фаз существования, присутствие специфических липидных компонентов в составе клеточной стенки, накопление гранул поли-β-оксибутирата, синтез жирных кислот с нечетным числом углеродных атомов, поверхностно-активных соединений (биосурфактантов) и аминокислот при росте на углеводородсодержащих средах. Полученные экспериментальные данные свидетельствуют о перспективности метода низкотемпературного хранения практически ценных культур, поддерживаемых в Региональной профилированной коллекции алканотрофных микроорганизмов ИЭГМ, гарантирующего сохранение их жизнеспособности и функциональной активности.
Исследование выполнено при поддержке грантов ФЦП «Научные и научно-педагогические кадры инновационной России на 2009-2013 годы» и Программы Президиума РАН «Биологическое разнообразие».
Список литературы Особенности криоконсервации алканотрофных актинобактерий рода Rhodococcus
- Веслополова, Е.Ф. Микрометод определения численности колониеобразующих микроорганизмов//Микробиология. 1995. Т. 64, № 2. С. 279-284.
- Волков, В.Я. К вопросу о физиологических и физико-химических механизмах устойчивости мик роорганизмов к замораживанию и высушиванию//Микробиология. 1994. Т. 63, вып. 2. С. 5-16.
- Ившина, И.Б. Бактерии рода Rhodococcus (иммунодиагностика, детекция, биоразнообразие): дис. д-ра биол. наук: 03.00.07/Ившина Ирина Борисовна. Пермь, 1997. 98 с.
- Ившина, И.Б. Методы консервации культур Rhodococcus spp. и их применение в практике поддержания специализированного фонда алканотрофных родококков/И.Б. Ившина, Т.Н. Каменских, М.С. Куюкина [и др.]//Микробиология. 1994. Т. 63, вып. 1. С. 118-127.
- Каменских, Т.Н. Консервация и гарантированное сохранение родококков ex situ: автореф. дис. канд. биол. наук: 03.00.07/Каменских Татьяна Никодимовна. Пермь, 1998. 20 с.
- Каталог штаммов региональной профилированной коллекции алканотрофных микроорганизмов/под ред. И.Б. Ившиной. М.: Наука, 1994. 163 с.
- Нестеренко, О.А. Нокардиоподобные и коринеподобные бактерии/О.А. Нестеренко, Е.И. Квасников, Т.М. Ногина. Киев: Наук. думка, 1985. 336 с.
- Пучков, Е.О. Проблемы криоконсервации бактериальных культур/Е.О. Пучков, И.Г. Говорунов//Консервация генетических ресурсов. Пущино, 1983. 24 с.
- Цуцаева, А.А. Опыт долгосрочного хранения промышленных штаммов микроорганизмов/А.А. Цуцаева, А.Е., Ананьина, Л.М. Балыбердина,//Микробиология. 2008. Т. 77, № 5. С. 696-700.
- Dyubko, T. Influence of freezing and low molecular weight cryoprotectants on microsomal membrane structure: a study by multiparametric fluorescent probe/T. Dyubko, E. Onishchenko, V. Pivovarenko//J. Fluoresc. 2006. Vol. 16. Р. 817-823.
- Gherna, R. Culture preservation//Methods for general and molecular bacteriology. Washington: American Society for Microbiology, 1994. P. 279-292.
- Haines, J.R. Measurement of hydrocarbon degrading microbial population by a 96-well plate mostprobable-number procedure/J.R. Haines, B.A. Wrenn, E.L Holder [et al.]//J. Ind. Microbiol. 1995. Vol. 16. P. 36-41.
- Kisidayova, S. Regeneration of cryoresistense of in vitro rumen ciliate cultures/S. Kisidayova, Z. Varadyova, T. Michalowski, C.J. Newbold//Cryobiology. 2005. Vol. 51, iss. 1. P. 76-84.
- Packard, T.T. The measurement of respiratory electron-transport activity in marine phytoplankton//J. Mar. Res. 1971. Vol. 29. P. 235-244.
- Uraizee, F.A. A model for diffusion controlled bioavailability of crude oil components/F.A. Uraizee, A.D. Venosa, M.T. Suidan//Biodegradation. 1998. Vol. 8. P. 287-296.


