Особенности лечения пациентов с нейроэндокринной опухолью поджелудочной железы в зависимости от дифференцировки
Автор: Исянгулова Алина Зульфатовна, Хасанов Рустем Шамильевич, Еникеев Рафаэль Фаридович, Гордиев Марат Гордиевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.18, 2019 года.
Бесплатный доступ
В последние десятилетия наблюдается рост заболеваемости нейроэндокринными опухолями, в связи с чем возрос интерес к методам лечения данной патологии. Целью исследования явился анализ результатов лечения пациентов с нейроэндокринными опухолями поджелудочной железы (НЭПЖ) в зависимости от гистологической дифференцировки опухоли. Материал и методы. Проведен ретроспективный анализ историй болезни 1077 пациентов с новообразованиями поджелудочной железы, у 50 из них была диагностирована нейроэндокринная опухоль. Проанализированы результаты лечения с учетом дифференцировки опухоли, стадии процесса, объема оперативного лечения и лекарственной терапии. Результаты. Самой гистологически частой формой нейроэндокринной опухоли поджелудочной железы является G1, при которой получены лучшие показатели 1- и 3-летней выживаемости вне зависимости от стадии процесса. Факторами, влияющими на прогноз течения опухолевого процесса нейроэндокринных опухолей поджелудочной железы, являются радикальное хирургическое лечение, уровень экспрессии Ki67, степень дифференцировки G1-3, стадия опухолевого процесса на момент постановки диагноза.
Нейроэндокринные опухоли поджелудочной железы, карциноид, степень дифференцировки, стадия процесса, таргетная терапия, соматостатин
Короткий адрес: https://sciup.org/140254290
IDR: 140254290 | УДК: 616.37-006.6-08 | DOI: 10.21294/1814-4861-2019-18-5-80-85
Текст научной статьи Особенности лечения пациентов с нейроэндокринной опухолью поджелудочной железы в зависимости от дифференцировки
Актуальность
Нейроэндокринные опухоли представляют собой редкую и гетерогенную группу новообразований с различными вариантами морфологической картины и клинических проявлений. Данные опухоли могут развиваться в клетках диффузной эндокринной системы различных органов. По данным реестра SEER (Surveillance, Epidemiology and End Results), в США заболеваемость нейроэндокринными опухолями на 1.01.2004 составила 5,25 на 100 000 населения в год. Самая частая локализация (более 60 %) – желудочно-кишечный тракт, в том числе в слепой кишке нейроэндокринные опухоли выявлены в 17 %, в прямой кишке – в 16 %, в поджелудочной железе – в 12 % случаев. Около 30 % нейроэндокринных опухолей встречаются в бронхопульмональной системе [1, 2].
Ежегодная заболеваемость нейроэндокринными опухолями поджелудочной железы колеблется от 0,2 до 0,4 случая на 100 000 населения и имеет тенденцию к росту [3–5]. Однако истинную частоту установить достаточно сложно, так как НЭПЖ обладают различной функциональной активностью, а некоторые из них имеют латентное течение, являясь случайной находкой при аутопсии. По данным мировой литературы, НЭПЖ составляют 1–2 % всех опухолей данной локализации [6–8]. Рост заболеваемости связан как с улучшением методов визуализации опухоли поджелудочной железы, так и с увеличением общей продолжительности жизни населения [9].
Основным методом лечения нейроэндокринных опухолей поджелудочной железы вне зависимости от дифференцировки является хирургическое вмешательство [3, 10–12]. Объем оперативного лечения определяется в зависимости от размеров и локализации опухоли, функционального статуса опухоли, наличия метастазов и осложнений опухолевого процесса. Адъювантная химиотерапия нейроэндокринных опухолей желудочно-кишечного тракта и поджелудочной железы для всех степеней дифференцировки не разработана. По данным литературы, стандартом лечения неоперабельных и распространенных форм нейроэндокринных опухолей поджелудочной железы с дифференци- ровкой G3 является химиотерапия. Частота ответа на химиотерапию у данной группы пациентов составляет 30–50 %. При НЭПЖ G1 и G2 химиотерапия малоэффективна [13–15].
Согласно действующим рекомендациям ENETS (Европейское общество нейроэндокринных опухолей) от 2016 г., при лечении распространенных и неоперабельных нейроэндокринных опухолей поджелудочной железы G1–2 показано назначение аналогов соматостатина (октреотид, ланреотид). Данные рекомендации основаны на двух масштабных клинических исследованиях, в которых изучался антипролиферативный эффект аналогов соматостатина при нейроэндокринных опухолях желудочно-кишечного тракта: CLARINET – плацебо-контролируемое исследование антипролиферативного эффекта ланреотида у пациентов с метастатическими нейроэндокринными опухолями поджелудочной железы и более ранняя работа PROMID – плацебо-контролируемое двойное слепое проспективное рандомизированное исследование по изучению эффекта октреотида LAR у пациентов с метастатическими нейроэндокринными опухолями средней кишки [16, 17].
Появление таргетной терапии дало новые возможности в лечении пациентов с НЭПЖ, в частности при высокодифференцированных опухолях. Изучение различных сигнальных путей выявило, что mTOR-протеинкиназа серин-треониновой специфичности является компонентом патогенеза нейроэндокринных опухолей. Данный факт послужил основой для изучения эффективности ингибиторов mTOR у больных с нейроэндокринными опухолями желудочно-кишечного тракта [18, 19].
Различные исследования показывают, что нейроэндокринные опухоли поджелудочной железы имеют высокую васкуляризацию, а также продуцирование и секрецию факторов роста, таких как VEGF, EGF, IGF, PDGF, HGF, FGF или TGF-α [20–26]. Сунитиниб, являясь низкомолекулярным ингибитором с мультитаргетной активностью в отношении VEGFR и тромбоцитарного фактора роста (PDGFR), показал свою эффективность в отношении лечения пациентов с высокодифференцированными НЭПЖ [27, 28].
Цель исследования – анализ отдаленных результатов лечения пациентов с нейроэндокринными опухолями поджелудочной железы в зависимости от гистологической дифференцировки опухоли.
Материал и методы
Проведен ретроспективный анализ результатов лечения больных с нейроэндокринными опухолями поджелудочной железы в условиях ГАУЗ «Республиканский клинический онкологический диспансер» Министерства здравоохранения Республики Татарстан (г. Казань) в 2011–18 гг. Всего за данный период наблюдалось 1077 пациентов с опухолями поджелудочной железы, из которых у 50 (4,6 %) пациентов установлен диагноз нейроэндокринные опухоли.
При анализе распределения пациентов с нейроэндокринными опухолями поджелудочной железы по полу соотношение мужчин и женщин составило, женщин – 58 %, мужчин – 42 %. Большинство больных относилось к возрастной группе 50–70 лет – 31 (62 %) пациент (табл. 1). Средний возраст вне зависимости от пола – 53 года (от 24 до 82 лет).
Распределение пациентов от стадиям опухолевого процесса, согласно классификации TNM (7-е издание, 2009 г.), представлено следующим образом: почти в половине случаев на момент постановки диагноза была определена IV стадия –
Таблица 1 распределение пациентов с нейроэндокринными опухолями поджелудочной железы по возрастным группам
|
Возраст, лет |
Количество пациентов |
|
18–30 |
4 (8 %) |
|
31–40 |
4 (8 %) |
|
41–50 |
8 (16 %) |
|
51–60 |
14 (28 %) |
|
61–70 |
17 (34 %) |
|
71–80 |
2 (4 %) |
|
81 и более |
1 (2 %) |
Таблица 2
распределение пациентов с нейроэндокринными опухолями поджелудочной железы по классификации TNM ( 7 -е издание , 2009 г.)
|
Стадия |
Количество больных |
|
|
IA |
T1N0M0 |
6 (12 %) |
|
IB |
T2N0M0 |
12 (24 %) |
|
IIA |
T3N0M0 |
4 (8 %) |
|
IIB |
T2N1M0 T3N1M0 |
3 (6 %) 1 (2 %) |
|
III |
T4N1M0 |
3 (6 %) |
|
IV |
T1–4N1M1 |
21 (42 %) |
21 (42 %) пациент, I стадия была у 18 (36 %), II стадия – у 8 (16 %), III стадия – у 3 (6 %) больных (табл. 2).
В зависимости от морфологии, уровня пролиферации, индекса Ki67 нейроэндокринные опухоли поджелудочной железы делятся на высоко- (G1), умеренно- (G2) и низкодифференцированные (G3) [29, 30]. В исследовании чаще всего встречались пациенты с НЭПЖ G1 – 22 (44 %), G2 – 16 (32 %), G3 – 8 (16 %) больных. У 4 пациентов (8 %) степень дифференцировки не была установлена – Gx. Пациентам с Gx необходимо исследование хромогранина А – наиболее информативного неспецифического маркера нейроэндокринных опухолей, чувствительность которого достигает 96 % [31]. Следует также отметить корреляцию уровня хромогранина А и опухолевой массы, что позволяет использовать этот маркер при злокачественных нейроэндокринных опухолях для контроля прогрессирования или эффективности терапии заболевания. В нашем исследовании не всем пациентам с Gx выполнялся анализ на хромогранин А.
Также нами проведен анализ распределения по стадиям в соответствии с классификацией TNM 7-е издание (2009) с учетом степени дифференцировки. На момент постановки диагноза при любой степени дифференцировки чаще всего встречалась IV стадия опухолевого процесса, но наибольшее количество при НЭПЖ с дифференцировкой G2 и G3 (табл. 3). Высокодифференцированная форма (G1) НЭПЖ I стадии была диагностирована у 13 (26 %) пациентов, II стадии – у 4 (8 %), III стадии – у 2 (4 %), IV стадии – у 3 (6 %) больных. У пациентов с НЭПЖ средней дифференцировки (G2) в большинстве случаев выявлялись новообразования IV стадии – в 9 (18 %) случаях, I и II стадии встречались с одинаковой частотой – по 3 (6 %) пациента, III стадия – в 1 (2 %) случае. Нейроэндокринные опухоли поджелудочной железы с низкой дифференцировкой (G3) на момент постановки диагноза имели IV стадию в 7 (14 %) случаях, только у 1 (2 %) пациента на момент постановки диагноза была I стадия (табл. 3).
Результаты
За анализируемый период, с 2011 по 2018 г., радикально был прооперирован 31 (62 %) пациент со всеми вариантами диференцировки НЭПЖ. У 27 (54 %) пациентов, которым проведено радикальное лечение, имелась высокодифференцированная форма (G1) нейроэндокринной опухоли поджелудочной железы. Самой частой операцией была дистальная резекция поджелудочной железы, которая выполнена 28 (56 %) пациентам (табл. 4). Реже проводились операции в объеме панкреатодуоденальной резекции поджелудочной железы – в 3 (6 %) случаях. Паллиативные операции (наложение обходных анастомозов) выполнены 6 (12 %) больным. Хирургическое лечение в связи
Таблица 3 распределение пациентов с нЭПЖ по стадиям в зависимости от степени дифференцировки опухоли
|
Дифференцировка |
I стадия |
II стадия |
III стадия |
IV стадия |
Всего |
|
G1 |
13 (26 %) |
4 (8 %) |
2 (4 %) |
3 (6 %) |
22 (44 %) |
|
G2 |
3 (6 %) |
3 (6 %) |
1 (2 %) |
9 (18 %) |
16 (32 %) |
|
G3 |
1 (2 %) |
- |
- |
7 (14 %) |
8 (16 %) |
|
Gx |
1 (2 %) |
1 (2 %) |
- |
2 (4 %) |
4 (8 %) |
Таблица 4 распределение пациентов с нЭПЖ в зависимости от объема операции и степени дифференцировки опухоли
Больным, которым хирургическое лечение не было показано, или при прогрессировании процесса после радикальных операций назначалась лекарственная терапия. В нашем исследовании лекарственное лечение было назначено 28 (56 %) пациентам с различными гистологическими вариантами НЭПЖ, чаще при G2 и G3.
Согласно рекомендациям Российского общества клинической онкологии (RUSSCO) от 2017 г. и European Society for Medical Oncology (ESMO), аналоги соматостатина как самостоятельная терапия применяются при высокодифференцированных нейроэндокринных опухолях поджелудочной железы [32]. Из 28 пациентов аналоги соматостатина и иммунотерапия были назначены 19 (67 %) больным с карциноидным синдромом и/или метастатическими НЭПЖ. У большинства пациентов, которым назначались аналоги соматостатина, имелись НЭПЖ умеренной дифференцировки (G2) – 5 (35 %) больных и высокой дифференцировки (G1) – 5 (35 %) пациентов.
В проведенном исследовании длительность приема аналогов соматостатина была различной, у 6 (40 %) пациентов она составила более 1 года при нейроэндокринной опухоли поджелудочной железы различной степени дифференцировки. У одного пациента длительность терапии составила более 4 лет, поэтому в связи со стабилизацией процесса было решено перевести его в группу наблюдения.
Пациентам с НЭПЖ низкой и умеренной степени дифференцировки при распространенном метастатическом процессе на первом этапе лекарственного лечения обычно назначается химиотерапия. В нашем исследовании химиоте- рапию получали 17 (34 %) больных, чаще всего использовались схемы XELOX – в 7 (41 %) и EC – в 7 (41 %) случаях. Большинство пациентов, которым была назначена химиотерапия, имели гистологический вариант G2 – 7 (41 %), G3 – 5 (29 %), G1 – 3 (17 %) больных.
Таргетную терапию (эверолимус/сунитиниб) получали 4 (8 %) пациента. Из них один пациент, наблюдавшийся с диагнозом: умереннодифференцированная форма (G2) нейроэндокринной опухоли поджелудочной железы более 15 лет, получал сунитиниб более двух лет. Данный пациент единственный в нашем исследовании, который наблюдался в течение такого длительного периода времени.
При анализе показателей 1-, 3- и 5-летней выживаемости в зависимости от степени дифференцировки нейроэндокринных опухолей поджелудочной железы установлено, что в группе с более благоприятным прогнозом с высокодифференцированной (G1) НЭПЖ 1-летняя выживаемость составила
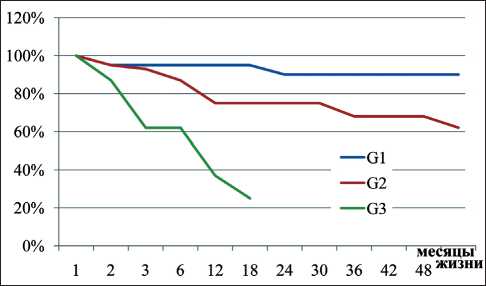
Рис. 1. Выживаемость пациентов с нейроэндокринными опухолями поджелудочной железы в зависимости от гистологической формы
83 %, 3-летняя – 75 %, 5-летняя выживаемость – 57 % (рис. 1). Однолетняя выживаемость у пациентов с G2 составила 100 %, 3-летняя выживаемость – 14 %. В группе с G3 1-летняя выживаемость не была рассчитана в связи со средней продолжительностью жизни, равной 5,1 мес. Один пациент с G3 наблюдается более 6 лет. По нашему мнению, данный факт связан с ранней стадией (I стадия) и радикальностью выполненной операции.
Заключение
Таким образом, самой частой гистологической формой нейроэндокринных опухолей поджелудочной железы является G1. На момент постановки
Список литературы Особенности лечения пациентов с нейроэндокринной опухолью поджелудочной железы в зависимости от дифференцировки
- Strosberg J.R., Coppola D., Klimstra D.S., Phan A.T., Kulke M.H., Wiseman G.A., Kvols L.K.; North American Neuroendocrine Tumor Society (NANETS). The NANETS consensus guidelines for the diagnosis and management of poorly differentiated (high-grade) extrapulmonary neuroendocrine carcinomas. Pancreas. 2010 Aug; 39(6): 799-800. DOI: 10.1097/MPA.0b013e3181ebb56f
- Yao J.C., Hassan M., Phan A., Dagohoy C., Leary C., Mares J.E., Abdalla E.K., Fleming J.B., Vauthey J.N., Rashid A., Evans D.B. One hundred years after "carcinoid": epidemiology of and prognostiс factors for neuroendocrine tumors in 35,825 cases in the United States. J Clin Oncol. 2008 Jun 20; 26(18): 3063-72. DOI: 10.1200/JCO.2007.15.4377
- Горбунова В.А. Нейроэндокринные опухоли. Общие принципы диагностики и лечения. М., 2015, 456.
- Ramage J.K., Davies A.H., Ardill J., Bax N., Caplin M., Grossman A., Hawkins R., McNicol A.M., Reed N., Sutton R., Thakker R., Aylwin S., Breen D., Britton K., Buchanan K., Corrie P., Gillams A., Lewington V., McCance D., Meeran K., Watkinson A.; UKNETwork for Neuroendocrine Tumours. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut. 2005 Jun; 54 Suppl 4: iv1-16. DOI: 10.1136/gut.2004.053314
- Halfdanarson T.R., Rabe K.G., Rubin J., Petersen G.M. Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival. Ann Oncol. 2008 Oct; 19(10): 1727-33. DOI: 10.1093/annonc/mdn351


