Особенности лимфогенного метастазирования в зависимости от внутриопухолевой гетерогенности немелкоклеточного рака легких у пациентов с разными морфологическими изменениями бронхиального эпителия
Автор: Завьялова М.В., Лоос Д.М., Письменный Д.С., Дурова А.А., Андрюхова Е.С., Родионов Е.О., Миллер С.В., Тузиков С.А., Панкова О.В., Таширева Л.А., Вторушин С.В., Перельмутер В.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - изучить связи морфологического разнообразия немелкоклеточного рака легкого с частотой лимфогенного метастазирования в группах больных с разным состоянием эпителия в смежных с опухолью бронхах. Материал и методы. Исследовали операционный материал от 90 больных немелкоклеточным раком легкого, проходивших лечение в торакоабдоминальном отделении НИИ онкологии Томского НИМЦ в период с 2009 по 2017 г. Гистологический тип рака определяли согласно классификации WHO (2020). В паренхиматозном компоненте аденокарциномы выделяли структуры типа lepidic, ацинарные, папиллярные, микропапиллярные, солидные и одиночные опухолевые клетки. В паренхиматозном компоненте плоскоклеточной карциномы выделяли 5 типов структур: (1) с ороговением, (2) состоящий из атипичных клеток шиповатого типа без ороговения, (3) состоящий из атипичных клеток базалоидного типа, (4) построенный из атипичных клеток с резко выраженным полиморфизмом, (5) одиночные опухолевые клетки. Результаты. В группе больных с изолированной базальноклеточной гиперплазией в случаях с метастатическим поражением регионарных лимфоузлов реже был обнаружен ацинарный (37 %), папиллярный (29 %) и солидный (27 %) паттерны по сравнению с наблюдениями, когда лимфогенных метастазов не было (63 %; р=0,05; 71 %; р=0,05; 73 %; р=0,01 соответственно). У пациентов с изолированной базальноклеточной гиперплазией бронхиального эпителия в случаях с наличием лимфогенного метастазирования в паренхиматозном компоненте плоскоклеточной карциномы реже выявлялись структуры 1-го (с ороговением) (17 %), 2-го (шиповатый паттерн) (33 %) и 4-го (полиморфный паттерн) (29 %) типов по сравнению со случаями, когда метастазов в регионарных лимфоузлах не было (83 %; р=0,01; 67 %; р=0,02 и 71 %; р=0,01 соответственно). В группе больных с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с метастатическим поражением лимфоузлов чаще были обнаружены шиповатый паттерн (65 %), базалоидный паттерн (100 %), полиморфный паттерн (82 %) и одиночные опухолевые клетки (89 %) по сравнению с наблюдениями, когда лимфогенных метастазов не было (35 %; р=0,04; 0 %; р=0,01; 18 %; р=0,01; 11 %; р=0,01 соответственно). Заключение. Полученные данные уточняют имеющиеся сведения о значении морфологической гетерогенности опухоли для прогноза течения аденокарциномы и плоскоклеточного рака легкого.
Немелкоклеточный рак легкого, плоскоклеточная карцинома, аденокарцинома, регенераторная гиперплазия, плоскоклеточная метаплазия, лимфогенное метастазирование, морфологическая гетерогенность, паттерны, внутриопухолевая гетерогенность
Короткий адрес: https://sciup.org/140296680
IDR: 140296680 | УДК: 616.24-006-091.8-033:611-018.98 | DOI: 10.21294/1814-4861-2022-21-5-69-81
Текст научной статьи Особенности лимфогенного метастазирования в зависимости от внутриопухолевой гетерогенности немелкоклеточного рака легких у пациентов с разными морфологическими изменениями бронхиального эпителия
Немелкоклеточный рак легкого (НМРЛ) занимает лидирующие позиции в структуре заболеваемости и смертности от онкологической патологии. В последнее время уделяется большое внимание поиску прогностических параметров, ассоциированных с риском лимфогенного метастазирования у пациентов, страдающих НМРЛ. Это имеет значение как для решения вопроса об объеме оперативного вмешательства, так и для прогноза течения заболевания в целом [1]. Локорегионарное метастазирование с последующей лимфогенной генерализацией опухолевого процесса может сопровождаться множественным поражением забрюшинных и внутрибрюшных лимфоузлов, канцероматозом плевры и брюшины, что в конечном итоге из-за возникающих осложнений ведет к летальным исходам пациентов с НМРЛ [2].
Наиболее распространенным вариантом немелкоклеточного рака легких является аденокарцинома [3]. В инвазивной аденокарциноме легкого различают пять гистологических паттернов: lepidic, ацинарный, папиллярный, микропапиллярный и солидный. Морфологическая гетерогенность опухоли при НМРЛ имеет прогностическое значение. Так, у пациентов с аденокарциномой легкого благоприятное течение заболевания связывают с наличием lepidic паттерна, а риск лимфогенного метастазирования и канцероматоза плевры – с присутствием в паренхиматозном компоненте новообразования микропапиллярных или солидных структур [4, 5].
Морфологическая гетерогенность плоскоклеточной карциномы описана при раке гортани. Рекомендовано выделять в паренхматозном компоненте данного гистотипа пять паттернов: первый – с ороговением, второй – шиповатый, третий – базалоидный, четвертый – полиморфный и пятый – одиночные опухолевые клетки [6]. Базалоидное строение плоскоклеточной карциномы считается неблагоприятным фактором прогноза. Однако N. An et al. получены противоположные результаты: оказалось, что в случаях с базалоидным строением плоскоклеточной карциномы показатель общей 5-летней выживаемости выше (50,4 %) по сравнению с таковым при ороговевающей и неороговевающей плоскоклеточной карциноме – 37,7 и 38,5 % соответственно [7].
В последнее время появилась информация о возможном значении для прогноза течения НМРЛ состояния эпителия мелких бронхов, смежных с опухолевым узлом. О.В. Панкова и соавт. установили, что сочетание базальноклеточной гиперплазии с плоскоклеточной метаплазией сопровождается повышением частоты рецидивов НМРЛ [8]. Полученные факты авторы объясняли особенностями эпителиально-стромальных взаимодействий, в основе которых лежит неблагоприятный вариант иммуно-воспалительных реакций в бронхах, который ассоциирован с типом воспаления в микроокружении опухоли, способствующим прогрессированию карциномы [9]. В связи с этим представляется интересным изучение связи морфологической гетерогенности аденокарциномы и плоскоклеточной карциномы легкого с частотой лимфогенного метастазирования у больных с разным состоянием бронхиального эпителия.
Цель исследования ‒ изучение связи морфологического разнообразия немелкоклеточного рака легкого с частотой лимфогенного метастазирования у больных с разным состоянием эпителия в смежных с опухолью бронхах.
Материал и методы
Изучен операционный материал от 90 больных немелкоклеточным раком легкого T1–3N0–2M0, проходивших лечение в торакоабдоминальном отделении НИИ онкологии Томского НИМЦ в период с 2009 по 2017 г. В исследование включено 50 пациентов с плоскоклеточной карциномой и 40 больных с аденокарциномой. Распространенность заболевания определялась согласно международной классификации по системе TNM [10]. У 19 (21 %) больных диагностирована IA, у 14 (16 %) – IB, у 45 (50 %) – IIB и у 12 (13 %) – IIIА стадия НМРЛ. Объем операции соответствовал лобэктомии с ипсилатеральной медиастенальной лимфодиссекцией. Неоадъювантной химиотерапии и интраоперационной лучевой терапии не было. По показаниям пациентам выполнялась адъювантная терапия по стандартным схемам винорелбин + цисплатин или паклитаксел + карбоплатин.
Материал фиксировался в 10–12 % растворе нейтрального формалина. Проводка материала и изготовление гистологических препаратов осуществлялись по стандартной методике. Препараты окрашивались гематоксилином и эозином. Морфологическую оценку выполняли с использованием светового микроскопа Axio Lab.A1 (Zeiss, Германия) и сканирующего микроскопа Mirax Midi (Zeiss, Германия). Гистотип опухоли установлен согласно классификации WHO 2020 г. [11]. В исследование включены только случаи с плоскоклеточной карциномой и аденокарциномой, для верификации которых выполнено иммуногистохимическое исследование по стандартной методике с использованием антител к Cytokeratine 7 (клон OV-TL 12/30, Novocastra), TTF (клон SPT24, Novocastra), Napsin A (клон NCL-L, Novocastra), р63 (клон 7JUL, Novocastra), Cytokeratine 5/6.
В паренхиматозном компоненте аденокарциномы выделяли структуры типа lepidic, ацинарные, папиллярные, микропапиллярные, солидные и одиночные опухолевые клетки. Lepidic паттерном называли структуры, представленные атипичными клетками кубической формы, выстилающими изнутри альвеолы; ацинарным паттерном – округлые или овальные железы, образованные атипичными клетками; папиллярным паттерном – сосочковые структуры с фиброваскулряной ножкой, выстланные атипичными кубовидными или столбчатыми клетками; микропапиллярным паттерном – мелкие сосочки с отсутствием фиброваскулярной ножки; солидным паттерном – крупные поля и гнезда опухолевых клеток.
В паренхиматозном компоненте плоскоклеточной карциномы выделяли 5 типов структур: первый тип – с ороговением; второй – состоящий из атипичных клеток шиповатого типа без ороговения; третий – состоящий из атипичных клеток базалоидного типа; четвертый – построенный из атипичных клеток с резко выраженным полиморфизмом; пятый – одиночные опухолевые клетки [6]. Определяли наличие перечисленных структур и общее число структур в опухоли (рис. 1).
Оценивали степень дифференцировки опухоли (высокая, умеренная, низкая) в соответствии с классификацией ВОЗ 2020 г. (ВОЗ, публикация: 2021). Изучали состояние стромы новообразования. Выраженность стромы в опухоли в общем и вокруг каждого из исследуемых вариантов структур паренхиматозного компонента новообразования определялась по трехбалльной системе (1 балл – слабо выражена, менее 30 % от ткани опухоли, 2 балла – умеренно выражена, составляет 30–70 % от ткани опухоли, 3 балла – выражена, со-
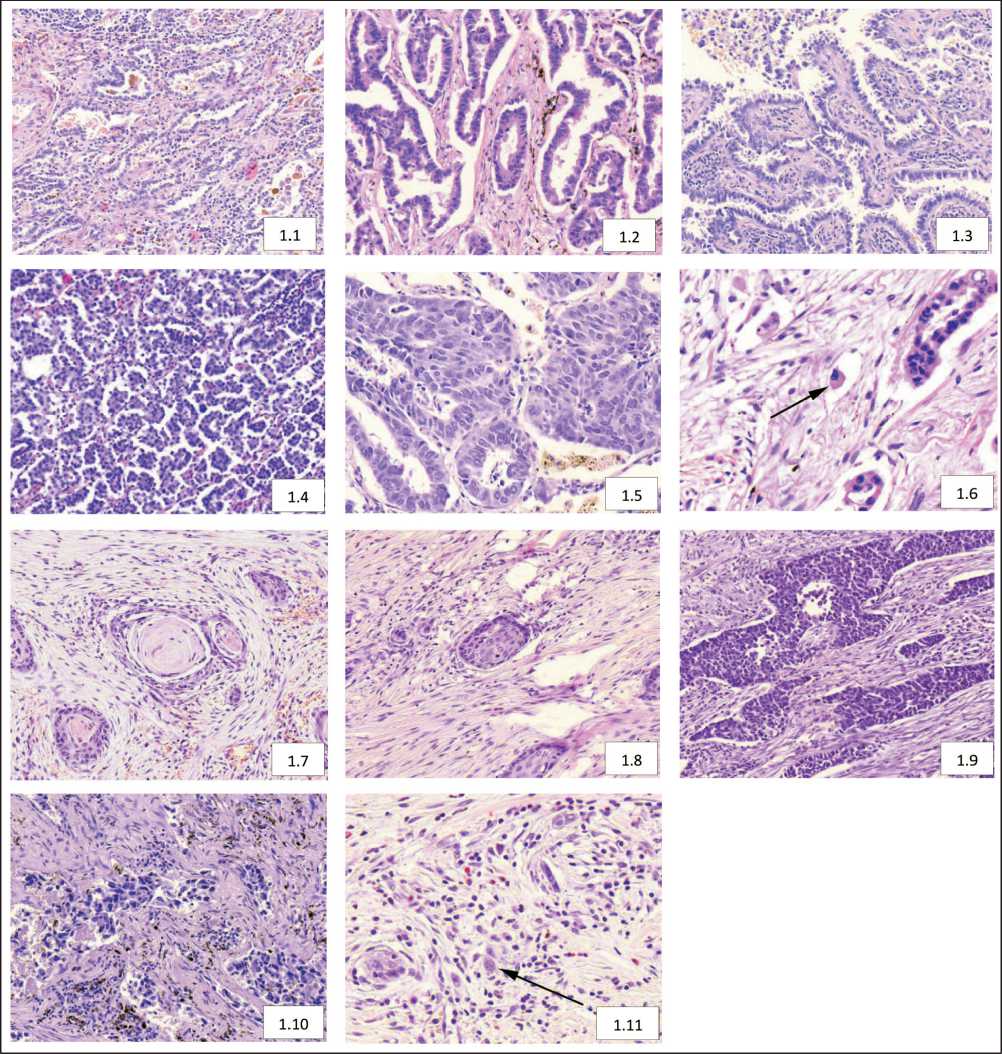
Рис. 1. Микрофото. Морфологические типы структур паренхиматозного компонента первичной опухоли: аденокарциномы (1.1 – lepidic; 1.2 – ацинарный; 1.3 – папиллярный; 1.4 – микропапиллярный; 1.5 – солидный; 1.6 – отдельные опухолевые клетки) и плоскоклеточной карциномы (1.7 – I тип; 1.8 – II тип; 1.9 – III тип; 1.10 – IV тип; 1.11 – V тип). Окраска гематоксилином и эозином, ×200
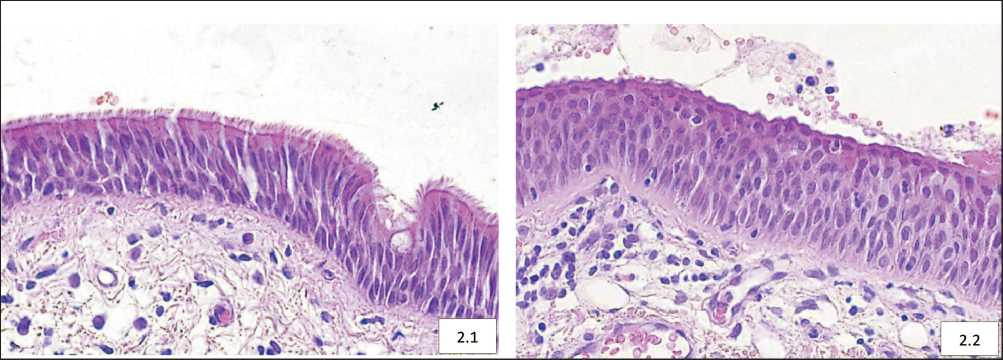
Рис. 2. Микрофото. Морфологические изменения бронхиального эпителия вне опухоли: 2.1 – базальноклеточная гиперплазия;
2.2 – плоскоклеточная метаплазия. Окраска гематоксилином и эозином, ×200
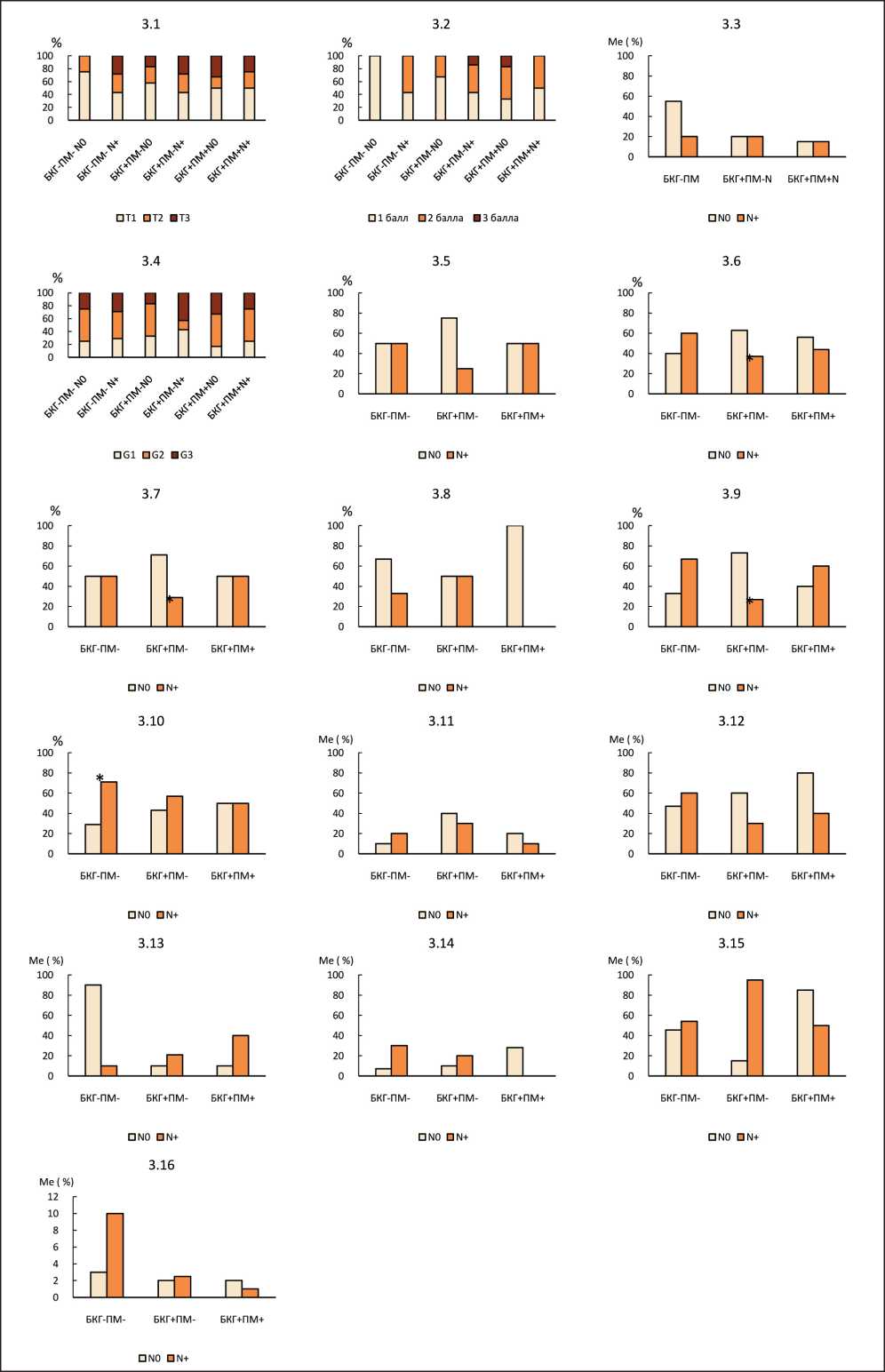
Рис. 3. Лимфогенное метастазирование у больных с аденокарциномой легкого с разными морфологическими изменениями бронхиального эпителия в зависимости от: 3.1 – размера опухоли (Т); 3.2 – выраженности стромы опухоли; 3.3 – процента воспалительной инфильтрации стромы опухоли; 3.4 – степени дифференцировки; 3.5 – наличия lepidic паттерна; 3.6 – наличия ацинарного паттерна; 3.7 – наличия папиллярного паттерна; 3.8 – наличия микропапиллярного паттерна; 3.9 – наличия солидного паттерна; 3.10 – наличия одиночных опухолевых клеток; 3.11 – процента lepidic паттерна; 3.12 – процента ацинарного паттерна; 3.13 – процента папиллярного паттерна; 3.14 – процента микропапиллярного паттерна; 3.15 – процента солидного паттерна; 3.16 – процента одиночных опухолевых клеток
Fig. 3. Lymph node metastasis in patients with lung adenocarcinoma with different morphological changes in the bronchial epithelium, depending on: 3.1 – tumor size (T); 3.2 – severity of the tumor stroma; 3.3 – percent of inflammatory infiltration of the tumor stroma; 3.4 – degree of differentiation; 3.5 – the presence of a lepidic pattern; 3.6 – the presence of an acinar pattern; 3.7 – the presence of a papillary pattern; 3.8 – the presence of a micropapillary pattern; 3.9 – the presence of a solid pattern; 3.10 – the presence of single tumor cells; 3.11 – percent of the pattern lepidik; 3.12 – percent of the acinar pattern; 3.13 – percentage of the papillary pattern; 3.14 – percent micropapillary pattern; 3.15 – percentage of a solid pattern; 3.16 – percentage of single tumor cells
Таблица 1/table 1
|
Параметр/Parameter |
БКГ- ПМ-/ BCH-SCM- (n=17) |
БКГ+/ BCH+ (n=45) |
БКГ+ ПМ+/ BCH+SCM+ (n=28) |
|
Возраст, лет/Age, years |
59,7 ± 5,3 |
58,4 ± 8,3 |
60,5 ± 6,1 |
|
Пол/Gender |
|||
|
Мужчины/Male |
14/17 (82 %) |
36/45 (80 %) |
25/28 (89 %) |
|
Женщины/Female |
3/17 (18 %) |
9/45 (20 %) |
3/28 (11 %) |
|
Локализация/Localization |
|||
|
Центральный/Central |
14/17 (82 %) |
30/45 (67 %) |
23/28 (82 %) |
|
Периферический/Peripheral |
3/17 (18 %) |
15/45 (33 %) |
5/28 (18 %) |
|
Размер/Size |
|||
|
Т1 |
7/17 (42 %) |
14/45 (31 %) |
8/28 (29 %) |
|
Т2 |
5/17 (29 %) |
16/45 (36 %) |
14/28 (50 %) |
|
Т3 |
5/17 (29 %) |
15/45 (33 %) |
6/28 (21 %) |
|
Аденокарцинома/Adenocarcinoma 11/17 (65 %) Типы структур аденокарциномы/Adenocarcinoma structure types |
19/45 (42 %) |
10/28 (36 %) |
|
|
Lepidic/Lepidik |
2/11 (18 %) |
4/19 (21 %) |
2/10 (20 %) |
|
Ацинарные/Acinar |
10/11 ( %) |
19/19 100 %) |
9/10 (90 %) |
|
Папиллярные/Papillary |
2/11 (18 %) |
7/19 (37 %) |
2/10 (20 %) |
|
Микропапиллярные/Micropapillary |
3/11 (27 %) |
6/19 (32 %) |
1/10 (10 %) |
|
Солидные/Solid |
6/11 (54 %) |
11/19 (58 %) |
5/10 (50 %) |
|
Одиночные клетки/Single cells |
7/11 (64 %) |
7/19 (34 %) |
2/10 (20 %) |
|
Количество типов структур/ Number of structure types, Ме (Q1÷Q3) |
3,0 (2,0÷3,0) (n=11) |
3,0 (2,0÷4,0) (n=19) |
2,0 (1,0÷3,0) (n=10) |
|
Степень дифференцировки/Degree of differentiation |
|||
|
Высокая/High/G1 |
3/11 (27 %) |
7/19 (37 %) |
2/10 (20 %) |
|
Умеренная/Intermediate/G2 |
5/11 (46 %) |
7/19 (37 %) |
5/10 (50 %) |
|
Низкая/Low/G3 |
3/11 (27 %) |
5/19 (26 %) |
3/10 (30 %) |
|
Общая выраженность стромы/ General severity of stroma, Ме (Q1÷Q3) |
1,0 (1,0÷2,0) (n=11) |
1,0 (1,0÷2,0) (n=19) |
2,0 (1,0÷2,0) (n=10) |
|
Общий процент воспалительной инфильтрации стромы/ Total percentage of stromal inflammatory infiltration, Ме (Q1÷Q3) |
20,0 (10,0÷90,0) (n=11) |
20,0 (10,0÷60,0) (n=19) |
15,0 (10,0÷60,0) (n=10) |
|
Наличие STAS/STAS presence |
3/11 (27 %) |
8/19 (42 %) |
3/10 (30 %) |
|
Вариант STAS/STAS variant |
|||
|
Ограниченный/Limited |
2/3 (67 %) |
0/8 (0 %) |
3/3 (100 %) |
|
Массивный/Massive |
1/3 (33 %) |
8/8 (100 %) |
0/3 (0 %) |
|
Лимфогенные метастазы/Lymphogenic metastases |
|||
|
Нет/No |
4/11 ( %) |
12/19 ( %) |
6/10 (60 %) |
|
Есть/Yes |
7/11 ( %) |
7/19 ( %) |
4/10 (40 %) |
|
Гематогенные метастазы/Hematogenous metastases |
|||
|
Нет/No |
11/11 (100 %) |
17/19 (89 %) |
10/10 (100 %) |
|
Есть/Yes |
0/11 (0 %) |
2/19 (11 %) |
0/10 (0 %) |
|
Рецидивы/Recurrence |
|||
|
Нет/No |
11/11 (100 %) |
19/19 (100 %) |
70/10 (7 %) |
|
Есть/Yes |
0/11 (0 %) |
0/19 (0 %) |
30/10 (3 %) |
|
Плоскоклеточный рак/Squamous cell cancer |
6/17 (35 %) |
26/45 (58 %) |
18/28 (64 %) |
Окончание таблицы 1/tend of table 1
|
Типы структур плоскоклеточного рака/Structure types squamous cell cancer |
|||
|
1-й тип (ороговение)/Type 1 (keratinization) |
0/6 (0 %) |
6/26 (23 %) |
2/18 (11 %) |
|
2-й тип (шиповатый)/Type 2 (spiky) |
4/6 (67 %) |
18/26 (69 %) |
17/18 (94 %) |
|
3-й тип (базалоидный)/Type 3 (basaloid) |
3/6 (50 %) |
13/26 (50 %) |
4/18 (22 %) |
|
4-й тип (полиморфный)/Type 4 (polymorphic) |
2/6 (33 %) |
14/26 (54 %) |
11/18 (61 %) |
|
Одиночные клетки/Single cells |
3/6 (50 %) |
17/26 (65 %) |
9/18 (50 %) |
|
Количество типов структур/ Number of structure types, Ме (Q1÷Q3) |
2,0 (1,0÷3,0) (n=6) |
3,0 (1,0÷4,0) (n=26) |
2,5 (1,0÷3,0) (n=18) |
|
Степень дифференцировки/Degree of differentiation |
|||
|
Высокая/High/G1 |
0/6 (0 %) |
2/26 (8 %) |
0/18 (0 %) |
|
Умеренная/Intermediate/G2 |
4/6 (67 %) |
17/26 (65 %) |
12/18 (67 %) |
|
Низкая/Low/G3 |
2/6 (33 %) |
7/26 (27 %) |
6/18 (33 %) |
|
Общая выраженность стромы/ General severity of stroma, Ме (Q1÷Q3) |
1,5 (1,0÷2,0) (n=6) |
2,0 (1,0÷2,0) (n=26) |
1,0 (1,0÷2,0) (n=18) |
|
Общий процент воспалительной инфильтрации стромы/ Total percentage of stromal inflammatory infiltration, Ме (Q1÷Q3) |
40,0 (20,0÷70,0) (n=6) |
20,0 (10,0÷70,0) (n=26) |
20,0 (5,0÷70,0) (n=18) |
|
Наличие STAS/STAS presence |
3/6 (50 %) |
8/26 (31 %) |
7/18 (39 %) |
|
Вариант STAS/STAS variant |
|||
|
Ограниченный/Limited |
3/3 (100 %) |
4/8 (50 %) |
5/7 (71 %) |
|
Массивный/Massive |
0/3 (0 %) |
4/8 (50 %) |
2/7 (29 %) |
|
Лимфогенные метастазы/Lymphogenic metastases |
|||
|
Нет/No |
5/6 (83 %) |
16/26 (61 %) |
6/18 (33 %) |
|
Есть/Yes |
1/6 (17 %) |
10/26 (39 %) |
12/18 (67 %) |
|
Гематогенные метастазы/Hematogenous metastases |
|||
|
Нет/No |
6/6 (100 %) |
18/26 (69 %) |
18/18 (100 %) |
|
Есть/Yes |
0/6 (0 %) |
8/26 (31 %) |
0/18 (0 %) |
|
Рецидивы/Recurrence |
|||
|
Нет/No |
6/6 (100 %) |
25/26 (96 %) |
17/18 (94 %) |
|
Есть/Yes |
0/6 (0 %) |
1/26 (4 %) |
1/18 (6 %) |
Таблица 2/table 2
Лимфогенное метастазирование в зависимости от степени дифференцировки опухоли у пациентов с аденокарциномой и плоскоклеточным раком легкого lymph node metastasis depending on the tumor grade in patients with adenocarcinoma and squamous cell cancer of the lung
|
Степень дифференцировки/ Degree of differentiation |
Аденокарцинома/ Adenocarcinoma |
Плоскоклеточный рак/ Squamous cell cancer |
||
|
N0 |
N+ |
N0 |
N+ |
|
|
Высокая/High/G1 |
6/22 |
6/18 |
2/27 |
0/23 |
|
(27 %) |
(33,3 %) |
(8 %) |
(0 %) |
|
|
Умеренная/Intermediate/G2 |
11/22 |
6/18 |
19/27 |
14/23 |
|
(50 %) |
(33,3 %) |
(70 %) |
(61 %) |
|
|
Низкая/Low/G3 |
5/22 |
6/18 |
6/27 |
9/23 |
|
(23 %) |
(33,4 %) |
(22 %) |
(39 %) |
|
Характеристика групп больных characteristics of the groups of patients
ставляет более 70 % ткани опухоли). Выраженность воспалительной инфильтрации стромы в опухоли в общем и вблизи каждого из перечисленных типов структур паренхиматозного компонента оценивали в процентах по R. Salgado et al. [12].
В слизистой оболочке бронхов, располагающихся в 3–4 см от границы опухоли, оценивали наличие базальноклеточной гиперплазии (БКГ) и плоскоклеточной метаплазии (ПМ) и их сочетания (рис. 2). С учетом изменений, обнаруженных в бронхиальном эпителии, сформировано 3 группы больных (табл. 1). Группу без базальноклеточной гиперплазии и плоскоклеточной метаплазии (БКГ-ПМ-) составили 17 пациентов; группу с базальноклеточной гиперплазией, без плоскоклеточной метаплазии (БКГ+ПМ-) – 45 больных; группу с базальноклеточной гиперплазией и плоскоклеточной метаплазией (БКГ+ПМ+) – 28 больных. В лимфатических узлах оценивали наличие метастатического поражения, подсчитывалось количество лимфоузлов с метастазами. Сроки наблюдения за больными составили 5 лет. Проанализированы истории болезни и амбулаторные карты. Учитывали информацию о наличии, сроках и локализации гематогенных метастазов и рецидивов.
Статистическая обработка полученных данных была выполнена с использованием пакета программ Statistica 10.0 for Windows. Применяли методы описательной статистики, критерий Манна–Уитни, Краскела–Уоллиса. Различия показателей между сравниваемыми группами считались статистически значимыми при уровне р<0,05.
Исследование проводилось на основании решения этического комитета ФГБОУ ВО «Сибирский государственный медицинский университет» Минздрава России № 5600 от 23.10.2017.
Результаты
Изучение особенностей лимфогенного метастазирования в группах больных с аденокарциномой легкого с разными морфологическими изменениями в бронхиальном эпителии вне новообразования показало, что частота лимфогенного метастазирования не была связана с размером опухолевого узла, выраженностью стромы, процентом воспалительной инфильтрации стромы новообразования (рис. 3.1–3.3). Степень дифференцировки аденокарциномы не была ассоциирована с лимфогенным метастазированием как без, так и с учетом характера морфологических изменений в слизистой оболочке мелких бронхов (табл. 2, рис. 3.4).
В группе больных без базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с наличием лимфогенных метастазов (N1) чаще (71 %) в паренхиматозном компоненте аденокарциномы были обнаружены одиночные опухолевые клетки по сравнению с наблюдениями, когда лимфогенных метастазов не было (N0) (29 %; р=0,05) (рис. 3.10).
В группе больных с изолированной базальноклеточной гиперплазией в случаях с метастатическим поражением регионарных лимфоузлов реже обнаруживались ацинарный (37 %), папиллярный (29 %) и солидный (27 %) паттерны по сравнению с наблюдениями, когда лимфогенных метастазов не было (63 %; р=0,05; 71 %; р=0,05; 73 %; р=0,01 соответственно). При сочетании в бронхиальном эпителии базальноклеточной гиперплазии и плоскоклеточной метаплазии значимых различий в частоте различных паттернов аденокарциномы в зависимости от наличия или отсутствия метастатического поражения лимфоузлов не было (рис. 3.6, 3.7, 3.9).
Процент представительства lepidic, ацинарного, папиллярного, микропапиллярного, солидного паттернов, одиночных опухолевых клеток в инфильтративном компоненте аденокарциномы легкого не различался в группах больных с разным состоянием бронхиального эпителия с наличием и отсутствием лимфогенных метастазов (рис. 3.11– 3.16). Общее количество разных типов структур в инфильтративном компоненте аденокарциномы не различалось в зависимости от наличия или отсутствия лимфогенных метастазов ни в одной из исследуемых групп.
Изучение особенностей лимфогенного метастазирования у больных с плоскоклеточной карциномой легкого показало, что в группе с наличием базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с наличием лимфогенных метастазов чаще наблюдалась Т2-стадия (84 %) по сравнению с наблюдениями, в которых размеры опухоли соответствовали критерию Т1 (8 %; р=0,0002) (рис. 4.1). Значимых различий в выраженности стромы и в проценте воспалительной инфильтрации стромы плоскоклеточной карциномы в зависимости от наличия или отсутствия лимфогенного метастазирования не обнаружено (рис. 4.2, 4.3).
Следует отметить, что при изучении частоты лимфогенного местатазирования в зависимости от степени дифференцировки новообразования без учета морфологических изменений бронхиального эпителия значимых различий в группе пациентов с плоскоклеточной карциномой не обнаружено (табл. 2). Вместе с тем, значимость низкой степени дифференцировки новообразования (G3) проявилась при учете варианта изменений эпителия в смежных с опухолью мелких бронхах. В группе больных с изолированной базальноклеточной гиперплазией и в группе с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с низкой степенью дифференцировки новообразования (G3) чаще обнаруживались лимфогенные метастазы по сравнению с наблюдениями, когда метастатического поражения не было (рис. 4.4).
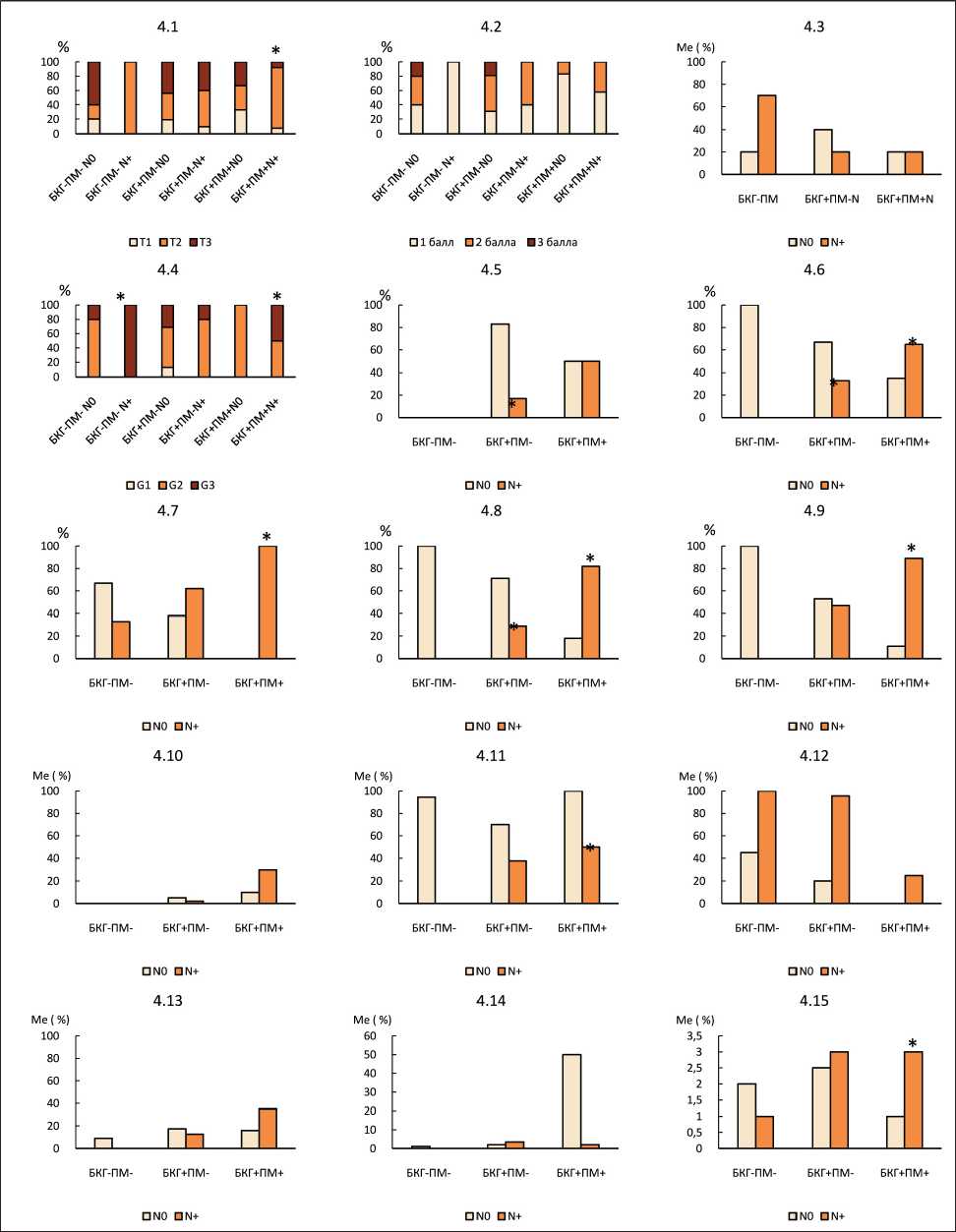
Рис. 4. Лимфогенное метастазирование у больных с плоскоклеточной карциномой легкого с разными морфологическими изменениями бронхиального эпителия в зависимости от: 4.1 – размера опухоли (Т); 4.2 – выраженности стромы опухоли;
4.3 – процента воспалительной инфильтрации стромы опухоли; 4.4 – степени дифференцировки; 4.5 – наличия структур 1-го типа; 4.6 – наличия структур 2-го типа; 4.7 – наличия структур 3-го типа; 4.8 – наличия структур 4-го типа; 4.9 – наличия структур 5-го типа; 4.10 – процента структур 1-го типа; 4.11 – процента структур 2-го типа; 4.12 – процента структур 3-го типа; 4.13 – процента структур 4-го типа; 4.14 – процента структур 5-го типа; 4.15 – от количества сочетающихся паттернов
Fig. 4. Lymph node metastasis in patients with squamous cell carcinoma of the lung with different morphological changes in the bronchial epithelium depending on: 4.1 – tumor size (T; 4.2 – severity of the tumor stroma; 4.3 – percentage of inflammatory infiltration of the tumor stroma; 4.4 – Degree of differentiation; 4.5 – presence of type 1 structures; 4.6 – presence of structures of type 2; 4.7 – presence of structures of type 3; 4.8 – presence of structures of type 4; 4.9 – presence of structures of type 5; 4.10 – percentage of structures of type 1; 4.11 – percentage of structures of type 2; 4.12 – percentage of structures of type 3; 4.13 – percentage of structures of type 4;
4.14 – percentage of structures of type 5; 4.15 – of the number of matching patterns
У пациентов с изолированной базальноклеточной гиперплазией бронхиального эпителия в случаях с наличием лимфогенного метастазирования в паренхиматозном компоненте плоскоклеточной карциномы реже были выявлены структуры 1-го (с ороговением) (17 %), 2-го (шиповатый паттерн) (33 %) и 4-го (полиморфный паттерн) (29 %) типов по сравнению со случаями, когда метастазов в регионарных лимфоузлах не было (83 %; р=0,01; 67 %; р=0,02 и 71 %; р=0,01 соответственно).
При сочетании базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с метастатическим поражением лимфоузлов чаще были обнаружены структуры 2-го (шиповатый паттерн) (65 %), 3-го (базалоидный паттерн) (100 %), 4-го (полиморфный паттерн) (82 %) типов и 5-го (одиночные опухолевые клетки) (89 %) типа по сравнению с наблюдениями, когда лимфогенных метастазов не было (35 %; р=0,04; 0 %; р=0,01; 18 %; р=0,01; 11 %; р=0,01 соответственно) (рис. 4.5–4.9).
В группе больных с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с метастатическим поражением лимфоузлов процент структур 2-го типа в паренхиматозном компоненте плоскоклеточной карциномы был меньшим (50,0 (30,0÷95,0)) по сравнению со случаями без лимфогенных метастазов (100,0 (98,0÷100,0); р=0,04). В других группах значимых различий в проценте представительства разных паттернов в зависимости от наличия лимфогенных метастазов не обнаружено.
В группе больных с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии в случаях с наличием лимфогенных метастазов было обнаружено большее число разных типов структур в паренхиматозном компоненте опухоли (3,0 (2,0÷3,0) по сравнению со случаями, когда метастазов не было (1,0 (1,0÷2,0); р=0,05). В других группах значимых различий в числе сочетающихся паттернов не обнаружено (рис. 4.10–4.15).
Обсуждение
Морфологическое разнообразие аденокарциномы и плоскоклеточной карциномы легких – феномен, который рекомендуется учитывать при гистологической диагностике с указанием присутствующих в опухолевой ткани паттернов. С риском лимфогенного метастазирования при аденокарциноме связывают наличие в инфильтративном компоненте новообразования микропапиллярных и солидных, а при плоскоклеточной карциноме – базалоидных структур [4, 5]. Связь морфологических изменений в бронхиальном эпителии с частотой локорегионарного рецидивирования описана в литературе [8]. Сущностью локоре-гионарных рецидивов по результатам данного исследования являются метахронные лимфогенные метастазы немелкоклеточного рака легких [9].
Представлялось интересным изучение возможной связи морфологического разнообразия изучаемых гистотипов НМРЛ с частотой синхронного лимфогенного метастазирования у больных с разным состоянием бронхиального эпителия.
В результате исследования оказалось, что состояние стромы новообразования, а именно ее выраженность и процент воспалительной инфильтрации стромы, не связано с риском лимфогенного метастазирования ни в одной из исследуемых групп ни при аденокарциноме, ни при плоскоклеточном раке. Вместе с тем, гистологическое строение паренхиматозного компонента немелкоклеточных карцином оказалось сопряженным с синхронным лимфогенным метастазированием при условии учета принадлежности случаев к группам с разным характером изменений эпителия в бронхах, смежных с опухолью. Подобная ассоциация наблюдалась как при аденокарциноме, так и при плоскоклеточном раке. Так, лимфогенное метастазирование у больных с аденокарциномой без изменений бронхиального эпителия связано с присутствием в паренхиматозном компоненте таких дедифференцированных структур, как одиночные опухолевые клетки.
Различия состояния эпителия мелких бронхов, смежных с опухолью, оказались действительно ассоциированными с лимфогенным метастазированием и с морфологическим строением первичного очага. В группе с изолированной базальноклеточной гиперплазией в бронхах большая частота лимфогенного метастазирования наблюдается при отсутствии определенных структур в опухоли. При аденокарциномах это касается ацинарных, папиллярных и солидных структур, при плоскоклеточных карциномах – структур с ороговением, с шиповатыми клетками без ороговения и структур, построенных полиморфными клетками. Противоположной была ассоциация в группах с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии. При плоскоклеточной карциноме, наоборот, лимфогенное метастазирование сочетается с большим числом разных типов структур за счет структур с шиповатыми клетками без ороговения, базалоидного, полиморфного типов и одиночных опухолевых клеток. Результаты исследования, с одной стороны, подтверждают ассоциацию изменений в мелких бронхах с прогрессированием НМРЛ, с другой стороны, подчеркивают различия такой ассоциации при разных вариантах сочетания базальноклеточной гиперплазии и плоскоклеточной метаплазии эпителия бронхов.
Заключение
Эпителиально-стромальные отношения в мелких бронхах, проявляющиеся в разных вариантах морфологических изменений эпителия ассоциированы с морфологическим строением аденокарциномы и плоскоклеточного рака легких, а также с частотой лимфогенного метастазирования. Механизмы, лежащие в основе этих ассоциаций, требуют дальнейших исследований. Полученные данные уточняют имеющиеся сведения о значении морфологической гетерогенности опухоли для прогнозирования течения аденокарциномы и плоскоклеточной карциномы легкого и могут быть рекомендованы как дополнительный параметр гистологической оценки операционного материала, ассоциированный с риском лимфогенной генера- лизации немелкоклеточного рака легкого. Факт обнаружения не одинаковых связей между параметрами первичной опухоли и метастатическим поражением лимфоузлов у больных без изменений бронхиального эпителия, с изолированной базальноклеточной гиперплазией и с сочетанием базальноклеточной гиперплазии и плоскоклеточной метаплазии может указывать на различные условия в респираторном тракте и разный патогенез данной формы опухолевой прогрессии.
Список литературы Особенности лимфогенного метастазирования в зависимости от внутриопухолевой гетерогенности немелкоклеточного рака легких у пациентов с разными морфологическими изменениями бронхиального эпителия
- Wu Y., Han C., Gong L., Wang Z., Liu J., Liu X., Chen X., Chong Y., Liang N., Li S. Metastatic Patterns of Mediastinal Lymph Nodes in SmallSize Non-small Cell Lung Cancer (T1b). Front Surg. 2020; 7. https://doi.org/10.3389/fsurg.2020.580203.
- Sereno M., Rodríguez-Esteban I., Gómez-Raposo C., Merino M., López-Gómez M., Zambrana F., Casado E. Lung cancer and peritoneal carcinomatosis. Oncol Lett. 2013; 6(3): 705-8. https://doi.org/10.3892/ol.2013.1468.
- Meza R., Meernik C., Jeon J., Cote M.L. Lung cancer incidence trends by gender, race and histology in the United States, 1973-2010. PLoS One. 2015; 10(3). https://doi.org/10.1371/journal.pone.0121323.
- Yuan M., Liu J.Y., Zhang T., Zhang Y.D., Li H., Yu T.F. Prognostic Impact of the Findings on Thin-Section Computed Tomography in stage I lung adenocarcinoma with visceral pleural invasion. Sci Rep. 2018; 8(1): 4743. https://doi.org/10.1038/s41598-018-22853-1.
- Lakha S., Gomez J.E., Flores R.M., Wisnivesky J.P. Prognostic significance of visceral pleural involvement in early-stage lung cancer. Chest. 2014; 146(6): 1619-26. https://doi.org/10.1378/chest.14-0204.
- Savenkova O.V., Zav'yalova M.V., Bychkov V.A., Choinzonov E.L, Perel'muter V.M. Svyaz' ekspressii matriksnykh metalloproteinaz s morfologicheskoi geterogennost'yu, differentsirovkoi opukholi i limfogennym metastazirovaniem ploskokletochnoi kartsinomy gortani. Sibirskii onkologicheskii zhurnal. 2015; 1(1): 51-8.
- An N., Leng X., Wang X., Sun Y., Chen Z. Survival comparison of Three histological subtypes of lung squamous cell carcinoma: A populationbased propensity score matching analysis. Lung Cancer. 2020; 142: 13-9. https://doi.org/10.1016/j.lungcan.2020.01.020.
- Pankova O.V., Denisov E.V., Ponomaryova A.A., Gerashchenko T.S., Tuzikov S.A., Perelmuter V.M. Recurrence of squamous cell lung carcinoma is associated with the co-presence of reactive lesions in tumor-adjacent bronchial epithelium. Tumour Biol. 2016; 37(3): 3599-607. https://doi.org/10.1007/s13277-015-4196-2.
- Pankova O.V., Rodionov E.O., Miller S.V., Tuzikov S.A., Tashireva L.A., Gerashchenko T.S., Denisov E.V., Perelmuter V.M. Neoadjuvant chemotherapy combined with intraoperative radiotherapy is effective to prevent recurrence in high-risk non-small cell lung cancer (NSCLC) patients. Transl Lung Cancer Res. 2020; 9(4): 988-99. https://doi.org/10.21037/tlcr-19-719.
- Amin M.B., Greene F.L., Edge S.B., Compton C.C., Gershenwald J.E., Brookland R.K., Meyer L., Gress D.M., Byrd D.R., Winchester D.P. The Eighth Edition AJCC Cancer Staging Manual: Continuing to build a bridge from a population-based to a more “personalized” approach to cancer staging. CA Cancer J Clin. 2017; 67(2): 93-9. https://doi.org/10.3322/caac.21388.
- Nicholson A.G., Tsao M.S., Beasley M.B., Borczuk A.C., Brambilla E., Cooper W.A., Dacic S., Jain D., Kerr K.M., Lantuejoul S., Noguchi M., Papotti M., Rekhtman N., Scagliotti G., van Schil P., Sholl L., Yatabe Y., Yoshida A., Travis W.D. The 2021 WHO Classification of Lung Tumors: Impact of Advances Since 2015. J Thorac Oncol. 2022; 17(3): 362-87. https://doi.org/10.1016/j.jtho.2021.11.003.
- Salgado R., Denkert C., Demaria S., Sirtaine N., Klauschen F., Pruneri G., Wienert S., Van den Eynden G., Baehner F.L., Penault-Llorca F., Perez E.A., Thompson E.A., Symmans W.F., Richardson A.L., Brock J., Criscitiello C., Bailey H., Ignatiadis M., Floris G., Sparano J., Kos Z., Nielsen T., Rimm D.L., Allison K.H., Reis-Filho J.S., Loibl S., Sotiriou C., Viale G., Badve S., Adams S., Willard-Gallo K., Loi S.; International TILs Working Group 2014. The evaluation of tumor-infiltrating lymphocytes (TILs) in breast cancer: recommendations by an International TILs Working Group 2014. Ann Oncol. 2015; 26(2): 259-71. https://doi.org/10.1093/annonc/mdu450.


