Особенности лучевой токсичности при проведении лучевой терапии с трастузумабом
Автор: Карабут Р.Ю., Важенин А.В., Мозерова Е.Я., Сарычева М.М., Ложков А.А., Максимовская А.Ю., Тимохина Д.М.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Целью исследования являлись определение и анализ наиболее значимых факторов, влияющих на развитие явлений кардио-, пульмо- и кожной токсичности среди пациенток, получавших лучевую терапию одновременно с введением трастузумаба. Материал и методы. В исследование вошли 66 пациенток с гистологически верифицированной инвазивной карциномой молочной железы умеренной и низкой степени дифференцировки, которые с 2018 по 2019 г. в ГБУЗ ЧОКЦО и ЯМ получали лучевую терапию с одновременной таргетной терапией трастузумабом. Средний возраст составил 53,1 ± 4,2 года. У 52 % пациенток диагностирован местнораспространенный рак молочной железы (iiia и iiiB стадии), у 36 % пациенток – iia и iiB стадий. Фракция выброса левого желудочка (ФВ ЛЖ) у всех пациенток составила ≥50 %. Все пациентки получили неоадъювантную химиотерапию с включением антрациклинов и/или таксанов. Явления токсичности оценивались по шкале Rtog/eoRtc для ранней лучевой токсичности. Гистограмма объема дозы (dVH) планов лучевой терапии соотносилась с критериями QuaNtec. Результаты. Лучевой пульмонит был зарегистрирован у 2 пациенток в сроки от 2 до 6 мес после окончания лучевой терапии. У 3 пациенток отмечалось снижение ФВ ЛЖ на 10 % от исходного значения, снижение ФВ на 20 % от исходного уровня не зарегистрировано. Удлинение интервала Qt зафиксировано у 3 пациенток, что у 2 больных сопровождалось клиническими проявлениями. При оценке протоколов ЭХО-КГ после проведения лечения у 39 пациенток отсутствовали нарушения функции ЛЖ, умеренная диастолическая дисфункция (ДД ЛЖ) зарегистрирована у 27, выраженная ДД ЛЖ – у 1 пациентки. Превышение средней дозы на миокард присутствовало и слева, и справа. Клинически значимые аритмии, нестабильная стенокардия и другие проявления ишемической болезни сердца в большинстве случаев наблюдались у пациенток с левосторонней локализацией рака молочной железы. Значимыми факторами кардиотоксичности стали левосторонняя локализация процесса, предшествующая полихимиотерапии антрациклинами и/или таксанами, а также доза, полученная миокардом. Возникновение лучевого пульмонита оказалось не связанным с какими-либо факторами, для возникновения лучевого дерматита значимым фактором оказался индекс массы тела пациенток >30 кг/м2. Заключение. Сочетание лучевой терапии и трастузумаба ассоциировано с приемлемым риском кардиотоксичности, при этом большое значение имеют мониторинг показателей сердечнососудистой системы в процессе лечения и диагностика ранних признаков кардиотоксичности.
Лучевая терапия, трастузумаб, лучевые реакции, лучевой пульмонит, лучевой дерматит, кардиотоксичность
Короткий адрес: https://sciup.org/140254538
IDR: 140254538 | УДК: 618.19-006.6-08-06:615.849.1 | DOI: 10.21294/1814-4861-2021-20-4-91-98
Текст научной статьи Особенности лучевой токсичности при проведении лучевой терапии с трастузумабом
Среди пациенток с инвазивным раком молочной железы (РМЖ) около 30 % имеют HER-2-позитивный фенотип [1]. Опухоли молочной железы с гиперэкспрессией HER-2 характеризуются агрессивным течением [2]. Явления кожной токсичности при комбинации лучевой терапии (ЛТ) и трастузумаба не имеют клинических отличий в сравнении с кожными реакциями, возникающими при лучевой терапии [3]. При лучевой терапии описаны единичные клинические случаи пульмонита, в то время как при комбинированной терапии с добавлением к ЛТ трастузумаба литературных данных об этом лучевом осложнении критически мало. Вместе с тем явление кардиотоксичности хорошо изучено. Европейским обществом кардиологов (ЕОК), определены факторы риска кардиотоксичности [4] при лучевой терапии, к которым относятся суммарная очаговая доза на миокард >30–35 Гр, разовая очаговая доза >2 Гр, большой объем облучения миокарда, возраст во время облучения ≤30 лет, наличие других факторов риска сердечно-сосудистых заболеваний (диабет, гипертензия, дислипидемия, ожирение, курение и др.). В крупном метаанализе [5], посвященном кардиотоксичности при лучевой терапии при РМЖ, по результатам анализа the surveillance, epidemiology, and results – реестра (SEER-реестра), включавшего 27 283 женщины, продемонстрировано увеличение риска возникновения ишемической болезни сердца от проведения лучевой терапии, а также выявлена значимая разница в 15-летней смертности от ишемической болезни сердца (ИБС) между пациентками с левосторонним (13,1 %, 95 % доверительный интервал [ДИ]=11,6–14,6) и правосторонним (10,2 %, 95 % ДИ=8,9–11,5) раком мо- лочной железы (p=0,02) [5, 6]. В 2015 г. A. Conway et al. в метаанализе, посвященном лучевой терапии медиастинального рака, установили, что уровень значимых коронарных событий увеличивается на 7,4 % на каждый дополнительный Грей на миокард, подведенный при дистанционной ЛТ [6].
Однако кардиотоксичность может быть обусловлена не только ЛТ, но и самостоятельной таргетной терапией трастузумабом [7]. Исходя из практических рекомендаций Российского общества клинической онкологии [8], определены факторы риска кардиальных осложнений при применении противоопухолевых препаратов, в том числе тар-гетных, к которым относятся: предшествующая/ одновременная терапия антрациклинами, фракция выброса левого желудочка (ФВ ЛЖ) <55 %, сердечно-сосудистые заболевания в анамнезе, возраст >50 лет, индекс массы тела (ИМТ) >25 кг/м2.
В метаанализе 2018 г., рассматривающем результаты лечения 12 000 пациенток, которым проводилась ЛТ одновременно с таргетной терапией, оценивался риск кардиотоксичности. Одногодичное применение трастузумаба по сравнению с более короткими режимами (6 мес и 9 нед) привело к улучшению показателей общей выживаемости и локорегионарного контроля в сравнении с более короткими режимами, однако при этом значимо увеличивался риск нежелательных кардиальных событий (р<0,001) [9]. Более того, сочетание комор-бидности и введений трастузумаба сопровождалось увеличением риска кардиальных событий. По данным метаанализа 2015 г. [10], кардиотоксичность выше у курильщиков (5,3 %), больных с дислипидемией (3,9 %), с ИМТ ≥25 кг/м2 (6,5 %), с диабетом (6,2 %), гипертонией (5,5 %), наличием в анамнезе сердечных заболеваний (19,1 %) в сравнении с пациентами без коморбидных факторов в анамнезе.
Изучением вопроса одновременного применения ЛТ и трастузумаба на биологическом уровне занималась группа китайских ученых, которые показали, что при такой комбинации в разы усиливается апоптоз in vitro во всех клеточных линиях рака молочной железы [11]. Сочетание лучевой терапии и трастузумаба in vitro анализировалось в исследования III фазы HERA (BIG 1-01), включавшем 35 102 женщины с HER-2-положительным ранним РМЖ, которые после первичного лечения (включая операцию, химиотерапию и лучевую терапию) получали трастузумаб в адъювантном режиме различной продолжительности: в течение года либо в течение 2 лет. Оказалось, что применение трастузумаба в течение 2 лет не улучшило показатели выживаемости по сравнению с 1-летним приемом. Частота ИБС при применении трастузумаба в течение года составила 122 (7,3 %) случая, тогда как при его приеме в течение 2 лет – 74 (4,4 %) [12].
Таким образом, рассматривая проблему токсичности ЛТ на фоне введения трастузумаба, необходимо отметить, что существуют определенные факторы риска каждого вида токсичности, обусловленные как отдельно лучевой терапией, так и таргетной терапией, а также комбинацией этих двух методов лечения. Вероятнее всего, при их сочетании реализуется эффект не просто суммации, а потенцирования в отношении риска каждого вида токсичности, а в особенности кардиотоксичности.
Целью исследования было определение и анализ наиболее значимых факторов, влияющих на развитие явлений кардио-, пульмо- и кожной токсичности среди пациенток, получавших лучевую терапию одновременно с введением трастузумаба.
Материал и методы
Ретроспективно оценены результаты лечения 66 пациенток с гистологически верифицированной инвазивной карциномой молочной железы, которым проведен послеоперационный курс лучевой терапии с одновременной таргетной терапией трастузумабом в период с 2018 по 2019 г. в ГБУЗ ЧОКЦО и ЯМ. Средний возраст пациенток составил 53,1 ± ± 4,2 года. Средний ИМТ – 24,81 ± 4,81 кг/м2.
У 36 (54 %) пациенток опухоль молочной железы была расположена слева, у 30 (46 %) – справа (табл. 1). Люминальный HER-2-положительный фенотип первичной опухоли был у 35 (53 %), HER-2 положительный – нелюминальный фенотип у 31 (47 %) больных. Распределение по стадиям: РМЖ IIIA, IIIB, IIIC стадии – у 52 % пациенток, IIA и IIB стадии – у 36 %, IA и IB стадии – у 12 % больных.
Перед началом лечения у всех пациенток при помощи ЭХО-КГ была исследована ФВ ЛЖ, диастолическая дисфункция миокарда. Критерии включения в исследование: ФВ ЛЖ ≥50 %; отсутствие диастолической дисфункции либо с умеренной диастолической дисфункцией. Все пациентки были осмотрены терапевтом/кардиологом перед началом терапии, абсолютных противопоказаний к планируемому лечению не выявлено.
При изучении профиля коморбидности (табл. 2) установлено, что 68 % женщин имели один или несколько факторов в виде сопутствующих заболеваний со стороны сердечно-сосудистой, эндокринной систем (ИБС, хроническая сердечная недостаточность (ХСН), метаболический синдром либо ожирение, сахарный диабет, дислипидемия).
Все пациентки получили неоадъювантную химиотерапию с включением антрациклинов и/ или таксанов (табл. 3). Конформная 3D лучевая терапия проводилась пучком фотонов на линейном ускорителе Electa Synergy с энергией 6 meV в традиционном режиме фракционирования до СОД 50 Гр в случае послеоперационного курса ЛТ, по показаниям (при наличии дополнительных факторов риска, таких как молодой возраст и проч.)
Таблица 1/table 1
Характеристика пациенток, вошедших в исследование characteristics of patients included in the study
|
Характеристика пациенток/Characteristics of patients |
Количество больных (n=66)/Number of patients (n=66) |
|
Локализация процесса/Tumor location |
|
|
Правосторонняя/Right-sided |
30 (46 %) |
|
Левосторонняя/Left-sided |
36 (54 %) |
|
Фенотип опухоли/Tumor phenotype |
|
|
Люминальный HER-2-положительный/Luminal HER-2 positive |
35 (53 %) |
|
HER-2-положительный-нелюминальный/HER-2-positive-non-luminal |
31 (47 %) |
|
Стадия опухолевого процесса/Tumor stage |
|
|
IA |
4 (6 %) |
|
IB |
5 (7 %) |
|
IIA |
5 (7 %) |
|
IIB |
18 (28 %) |
|
IIIA |
8 (12 %) |
|
IIIB |
14 (22 %) |
|
IIIC |
12 (18 %) |
|
Курс ЛТ/Radiation therapy |
|
|
Предоперационный/Preoperative RT |
7 (10 %) |
|
Послеоперационный/Postoperative RT |
59 (90 %) |
Таблица 2/table 2
Факторы коморбидности среди пациенток, получающих ЛТ+Тcomorbidity factors among patients receiving Rt+t
|
Сопутствующее заболевание/Concomitant disease |
Количество пациенток (n=66)/Number of patients (n=66) |
|
Сахарный диабет 2-го типа/Diabetes mellitus type 2 |
21 (31 %) |
|
Ожирение 2-й степени/Class 2 obesity |
24 (36 %) |
|
ИБС/Ischemic heart disease |
6 (9 %) |
|
ХСН/Chronic heart failure |
7 (10 %) |
Таблица 3/table 3
Режимы и препараты, входящие в состав неоадъювантной полихимиотерапииModes and drugs included in neoadjuvant polychemotherapy
Оценка ФВ ЛЖ по данным ЭХО-КГ evaluation of lVeF according to ecHo-Kg data
|
Препарат/схема/Drug/scheme |
Количество пациенток (n=66)/ Number of patients (n=66)%) |
|
АС (доксорубицин + циклофосфамид)/AC (doxorubicin + cyclophosphamide) |
51 (77 %) |
|
Паклитаксел (4 введения)/Paclitaxel (4 injections) |
12 (18 %) |
|
Паклитаксел (12 введений)/Paclitaxel (12 injections) |
33 (50 %) |
|
Эпирубицин/Epirubicin |
5 (7 %) |
|
Доцетаксел/Docetaxel |
4 (6 %) |
|
Пертузумаб/Pertuzumab |
2 (3 %) |
Гормонотерапия/Hormone therapy 26 (39 %)
Таблица 4/table 4
Явления токсичности оценивались по шкале RTOG/EORTC для ранней лучевой токсичности. Расчет доза-объем (DVH) планов лучевой терапии соотносился с критериями QUANTEC.
Результаты
При лучевой терапии с одновременным введением трастузумаба лучевой дерматит I степени по шкале EORTIC/RTOG выявлен у 46, II степени (влажный эпителиит) – у 20 пациенток. Обращает на себя внимание тенденция к ассоциации дерматита II степени с увеличением ИМТ – среди женщин с ИМТ >25 кг/м2 его частота была выше. Из 20 пациенток 14 имели ИМТ >25 кг/м2. Дерматит III степени не наблюдался.
Лучевой пульмонит в проекции полей облучения на одноименной стороне зарегистрирован у 2 пациенток в сроки от 2 до 6 мес после ЛТ. При анализе средних доз на легкие ни у одной пациентки не было превышения в соответствии с критериями QUANTEC. По данным МСКТ органов грудной клетки в проекции полей облучения визуализировались патогмоничные признаки лучевого пуль-монита, в том числе картина «матового стекла». Пациентки госпитализированы в терапевтический стационар по месту жительства, где получали специальное лечение, в том числе высокие дозы глюкокортикоидов с положительным эффектом.
При оценке кардиотоксичности мы исследовали несколько параметров: ФВ ЛЖ, интервал QTc и данные ЭХО-КГ для оценки диастолической дисфункции, а также дозы, полученные миокардом левого желудочка и клинические проявления ИБС. У 3 пациенток на фоне лечения отмечалось снижение ФВ ЛЖ на 10 % от исходного значения; снижения ФВ <54 % не наблюдалось. Вариабельность Δ % ФВ в большем среднем отклонении отмечалась после проведения лечения (табл. 4).
Нами был измерен скорректированный интервал QT по результатам ЭКГ. В соответствии с рекомендациями FDA удлиненным считается интервал QT, скорректированный по формуле Bazett, длительностью более 450 мс у мужчин и более 470 мс у женщин, нормальным – менее 430 мс и 450 мс, пограничным – от 430 мс до 450 мс и от 450 мс до 470 мс соответственно. Удлинение интервала QT зафиксировано у 3 пациенток (до 480, 486 и 490 мс соответственно), у 2 пациенток (486 и 490 мс) изменение QTc сопровождалось клиническими проявлениями в виде нарушения ритма сердца по типу пароксизмальной наджелудочковой тахикардии III и IV градаций по Лаун, а также манифестом фибрилляции предсердий.
При оценке протоколов ЭХО-КГ после лечения нормальная диастолической функция ЛЖ зарегистрирована у 39 пациенток, умеренная диастолическая дисфункция (ДД ЛЖ) – у 27, выраженная ДД ЛЖ – у 1 больной. Следует отметить, что оценка диастолической дисфункции – это «инструментальный» синдром и он не всегда ассоциирован с развитием систолической сердечной недостаточности. Однако для развития диастолической сердечной недостаточности и концентрической гипертрофии миокарда ДД ЛЖ имеет важное значение.
Клинически аритмии, нестабильная стенокардия и другие проявления ИБС в большинстве случаев были представлены среди пациенток с левосторонней локализацией (n=7), тогда как при правостороннем РМЖ кардиотоксичность отмечена в 2 случаях (табл. 5). Следует отметить, что объем кардиотропной терапии в процессе лечения незначительно менялся: у больных, получивших
Таблица 5/table 5
Клинические проявления у пациенток, получающих лучевую терапию одновременно с трастузумабом clinical manifestations in patients receiving radiation therapy concurrently with trastuzumab
|
Критерий/Criterion |
Левосторонняя локализация РМЖ (n=36)/ Left-sided localization (n=36) |
Правосторонняя локализация РМЖ (n=30)/ Right-sided localization (n=30) |
|
Аритмия: любое нарушение ритма/ Arrhythmia: any disturbance in the rhythm |
4 (11 %) |
2 (6 %) |
|
Ишемия: безболевая ишемия миокарда по данным ЭКГ/ Ischemia: painless myocardial ischemia as measured by ECG |
2 (5,5 %) |
- |
|
Ишемия: острый коронарный синдром, нестабильная стенокардия/ Ischemia: acute coronary syndrome, unstable angina |
1 (2,7 %) |
- |
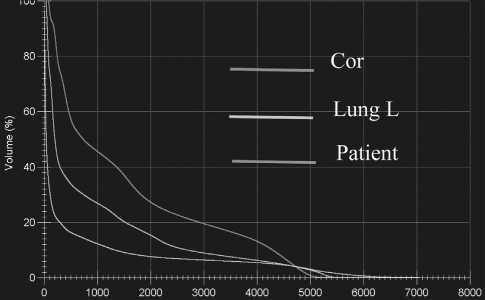
Рис. 1. DVH- гистограмма пациентки, с превышением критерия V25
Fig. 1. DVH-histogram exceeding V25 criterion
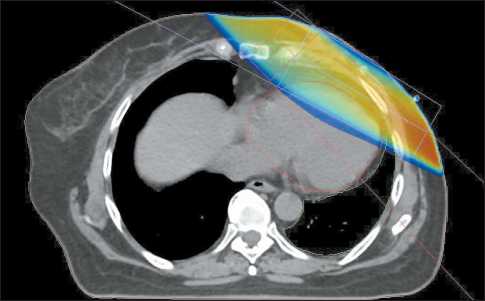
Рис. 2. Изображение тангенциальных полей у пациентки, с превышением критерия V25
Fig. 2. Image of tangential fields, exceeding the V25 criterion
базисную терапию ИБС и/или ХСН ингибиторами АПФ и бета-блокаторами, требовалась коррекция дозы препаратов либо присоединение третьего компонента (диуретика).
При анализе DVH планов лучевой терапии, оценив среднюю дозу на миокард и на легкое, можно заключить, что средняя доза на легкие не превышала критериев QUANTEC, в то время как превышение средней дозы на миокард присутствовало и слева, и справа. Только в 16 % случаев облучение миокарда слева соответствовало критерию V25. DVH-гистограмма пациентки с превышением критерия V25 представлена на рис. 1 и 2, остальные данные по распределению доза-объем – в табл. 6.
Обсуждение
В представленном исследовании уровень каждого из видов токсичности, возникшей в процессе и после лечения, оказался приемлемым: кожная токсичность в большинстве случаев представлена дерматитом I степени, лучевой пульмонит развился только в 2 случаях, а при ЛТ в сравнении с ЛТ + Т частота кумулятивных кардиальных эффектов оказалась сопоставимой с данными литературы. Значимых факторов для возникновения лучевого пульмонита не было выявлено. Среди значимых факторов, определяющих кожную токсичность, оказался ИМТ пациенток >30 кг/м2. Для развития кардиотоксичности самыми значимыми факторами риска оказались левосторонняя локализация процесса, предшествующая полихимиотерапии антрациклинами и/или таксанами и доза, полученная миокардом. Проведение лучевой терапии одновременно с таргетной терапией при HER-2-позитивным РМЖ оправдано, однако особое внимание следует обращать на пациенток старше 70 лет с предшествующей терапией антрацикли-нами и/или таксанами, с наличием в анамнезе сердечной недостаточности, ИБС и с левосторонней локализацией процесса. Возможно, у данной категории пациенток наиболее оптимальным методом лечения является последовательное проведение ЛТ и адъювантной таргетной терапии.
Лучевая терапия в сочетании с таргетной терапией ассоциирована с высоким уровнем кардиальной токсичности, поэтому необходима ее профилактика, которая может включать: ограничение кумулятивной дозы антрациклинов в рекомендуемых пределах, отказ от одновременного назначения антрациклинов и трастузумаба, лечение сердечно-сосудистых заболеваний и коррекция модифицируемых факторов риска (ингибиторы-
Таблица 6/table 6
Данные распределения доза-объем при оценке планов лучевой терапии, дозы на миокард и легкие с обеих сторон data of dose-volume distribution in the assessment of radiation therapy schedules, doses to the myocardium and lungs on both sides
|
Локализация/ Location |
Средняя доза на миокард, Гр/ Average dose for myocardium, Gr |
Соответствие критерию V25Гр <10 %/ Compliance with the criterion V25Gy <10 % |
Средняя доза на легкие, Гр/ Average dose for lungs, Gy |
Соответствие критерию V20 Гр ≤30 %/ Compliance with the criterion V20 Gy ≤30 % |
|
Слева/ Left side |
5,76 ± 3,78 |
+ (16%) – (84%) |
4,2 ± 1,76 |
+ |
|
Справа/ Right side |
1,6 ± 1,75 |
+ |
2,11 ± 0,89 |
+ |
АПФ, сартаны, бета-блокаторы), использование современных методик лучевой терапии, соблюдение требований QUANTEC, адекватное дозиметрическое планирование.
При анализе явлений лучевой токсичности мы столкнулись с рядом сложностей, особенно при оценке кардиотоксичности: возникла трудность в унификации пациентов по группам риска (предшествующая химиотерапия, ЛТ, таргетная терапия), как правило, за счет большого интервала между лучевой терапией и возникновением кардиотоксичности; при лучевой и таргетной терапии наблюдался комбинированный характер поражения миокарда (миокард, перикард, клапаны и др.), кроме того, часто отмечались бессимптомное течение радиоиндуцированной ИБС, диастолический характер кардиомиопатии с нормальной ФВ ЛЖ, снижение способности миокарда к ремодуляции.
Список литературы Особенности лучевой токсичности при проведении лучевой терапии с трастузумабом
- Ryabchikov D.A., Titov K.S., Vorotnikov I.K. Biologicheskie osobennosti lyuminal'nogo V fenotipa raka molochnoi zhelezy. Zlokachestvennye opukholi. 2016; 4(20): 15-20. https://doi.org/10.18027/2224-5057-2016-4-15-20.
- Cameron D.A. Herceptin - from bedside to bench to clinic. EJC. 2009; 5: 372-374.
- Jacob J., Belin L., Gobillion A., Daveau-Bergerault C., Dendale R., Beuzeboc P., Campana F., Bollet M.A., Fourquet A., Kirova Y.M. Prospective monocentric study of the toxicity and the efficacy of concurrent trastuzumab and radiotherapy. Cancer Radiother. 2013 Jun; 17(3): 183-90. https://doi.org/10.1016/j.canrad.2012.12.006.
- Zamorano J.L., Lancellotti P., Rodriguez Muñoz D., Aboyans V., Asteggiano R., Galderisi M., Habib G., Lenihan D.J., Lip G.Y., Lyon A.R., Lopez Fernandez T., Mohty D., Piepoli M.F., Tamargo J., Torbicki A., Suter T.M., Zamorano J.L., Aboyans V., Achenbach S., Agewall S., Badimon L., Barón-Esquivias G., Baumgartner H., Bax J.J., Bueno H., Carerj S., Dean V., Erol Ç., Fitzsimons D., Gaemperli O., Kirchhof P., Kolh P., Lancellotti P., Lip G.Y., Nihoyannopoulos P., Piepoli M.F., Ponikowski .P, Roffi M., Torbicki A., Vaz Carneiro A., Windecker S.; Authors/Task Force Members; ESC Committee for Practice Guidelines (CPG); Document Reviewers. 2016 ESC Position Paper on cancer treatments and cardiovascular toxicity developed under the auspices of the ESC Committee for Practice Guidelines: The Task Force for cancer treatments and cardiovascular toxicity of the European Society of Cardiology (ESC). Eur J Heart Fail. 2017 Jan; 19(1): 9-42. https://doi.org/10.1002/ejhf.654.
- Giordano S.H., Kuo Y.F., Freeman J.L., Buchholz T.A., Hortobagyi G.N., Goodwin J.S. Risk of cardiac death after adjuvant radiotherapy for breast cancer. J Natl Cancer Inst. 2005; 97(6): 419-24. https://doi.org/10.1093/jnci/dji067.
- Conway A., McCarthy A.L., Lawrence P., Clark R.A. The prevention, detection and management of cancer treatment-induced cardiotoxicity: a meta-review. BMC Cancer. 2015 May 7; 15: 366. https://doi.org/10.1186/s12885-015-1407-6.
- Yu A.F., Mukku R.B., Verma S., Liu J.E., Oeffinger K.C., Steingart R.M., Hudis C.A., Dang C.T. Cardiac safety of non-anthracycline trastuzumab-based therapy for HER2-positive breast cancer. Breast Cancer Res Treat. 2017 Nov; 166(1): 241-247. https://doi.org/10.1007/s10549-017-4362-x.
- Trushin A.Yu. Trastuzumab-indutsirovannaya kardiotoksichnost' - mezhdistsiplinarnaya problema sovremennoi meditsiny. Mezhdunarodnyi nauchno-issledovatel'skii zhurnal. 2019; 4(82): 118-123.
- Mavroudis D., Saloustros E., Malamos N., Kakolyris S., Boukovinas I., Papakotoulas P., Kentepozidis N., Ziras N., Georgoulias V.; Breast Cancer Investigators of Hellenic Oncology Research Group (HORG), Athens, Greece. Six versus 12 months of adjuvant trastuzumab in combination with dose-dense chemotherapy for women with HER2-positive breast cancer: a multicenter randomized study by the Hellenic Oncology Research Group (HORG). Ann Oncol. 2015 Jul; 26(7): 1333-40. https://doi.org/10.1093/annonc/mdv213.
- Mantarro S., Rossi M., Bonifazi M., D'Amico R., Blandizzi C., La Vecchia C., Negri E., Moja L. Risk of severe cardiotoxicity following treatment with trastuzumab: a meta-analysis of randomized and cohort studies of 29,000 women with breast cancer. Intern Emerg Med. 2016 Feb; 11(1): 123-40. https://doi.org/10.1007/s11739-015-1362-x.
- Liang K., Lu Y., Jin W., Ang K.K., Milas L., Fan Z. Sensitization of breast cancer cells to radiation by trastuzumab. Mol Cancer Ther. 2003 Nov; 2(11): 1113-20.
- Cameron D., Piccart-Gebhart M.J., Gelber R.D., Procter M., Goldhirsch A., de Azambuja E., Castro G.Jr., Untch M., Smith I., Gianni L., Baselga J., Al-Sakaff N., Lauer S., McFadden E., Leyland-Jones B., Bell R., Dowsett M., Jackisch C.; Herceptin Adjuvant (HERA) Trial Study Team. 11 years’ follow-up of trastuzumab after adjuvant chemotherapy in HER2- positive early breast cancer: final analysis of the HERceptin Adjuvant (HERA) trial. Lancet. 2017 Mar 25; 389(10075): 1195-1205. https://doi.org/10.1016/S0140-6736(16)32616-2.


