ОСОБЕННОСТИ МАСС-СПЕКТРОМЕТРИЧЕСКОЙ ДЕТЕКЦИИ БЕТА-АМИЛОИДНЫХ ПЕПТИДОВ (ПЕПТИДОВ АЛЬЦГЕЙМЕРА)
Автор: О. А. Миргородская, А. В. Протасов, Ю. П. Козьмин, P. А. Бубляев, Й. Гобом
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение для биологии и медицины
Статья в выпуске: 4 т.32, 2022 года.
Бесплатный доступ
Масс-спектрометрия в сочетании с использованием изотопно-меченных стандартов является одним из популярных методов количественного измерения концентрации бета-амилоидов в биологических средах. Данная статья посвящена предупреждению типичных систематических ошибок таких измерений, возникающих вследствие пренебрежения возможностью превращения бета-амилоидов в денатурированную форму, которая дает в масс-спектрах сигналы в 3 раза более интенсивные, чем нативная форма. Степень этой денатурации определялась по способности нативной формы образовывать комплекс с α-2-макроглобулином, чего денатурированная форма лишена. Показано, что денатурация может происходить при нагревании в кислой среде или при использовании диметилсульфоксида в качестве растворителя. Ошибка измерения возникает, когда изотопно-меченный стандарт и аналит относятся к разным формам. Предложены рекомендации для преодоления систематических ошибок количественного анализа этих соединений посредством принудительной денатурации смеси аналита со стандартом перед анализом.
Количественная масс-спектрометрия, бета-амилоиды, α-2-макроглобулин
Короткий адрес: https://sciup.org/142235504
IDR: 142235504 | УДК: 543.51: 577.1: 66.096.3 | DOI: 10.18358/np-32-4-i3548
Текст научной статьи ОСОБЕННОСТИ МАСС-СПЕКТРОМЕТРИЧЕСКОЙ ДЕТЕКЦИИ БЕТА-АМИЛОИДНЫХ ПЕПТИДОВ (ПЕПТИДОВ АЛЬЦГЕЙМЕРА)
Количественное определение бета-амилоидов (Aβ) в биологических пробах имеет важное значение для диагностики болезни Альцгеймера. Одним из важных методов анализа Aβ является масс-спектрометрия с изотопно-меченным стандартом Aβ (15N или 18O). Эта статья является предупреждением о возникновении систематических ошибок такого определения в свете открывшихся обстоятельств. А именно, возможности существования Aβ в виде двух форм — нативной и денатурированной. Последняя образуется при нагревании Aβ в кислой среде или растворении его в DMSO. Причем денатурированная форма дает в масс- спектрах сигнал в несколько раз (примерно в 3 раза) более интенсивный, чем нативная.
Однако столь значительное изменение интенсивности сигналов в масс-спектре явилось для нас неожиданностью, побудившей предпринять исследование этого феномена. Эта задача представлялась нам тем более важной, что при анализе бе-та-амилоидов в крови человека в целях диагностики болезни Альцгеймера такая ошибка могла бы привести к ошибочному отнесению патологии к норме.
Принципиальные ошибки измерения концентрации Aβ методом количественной масс-спектрометрии возникают тогда, когда определяемый Aβ относится к нативной форме, а его изотопно-меченный стандарт — к денатурированной. Такая ситуация типична, когда анализируемый Aβ имеет природное происхождение, а стандарт используется в виде раствора в DMSO (этот растворитель часто применяется для приготовления растворов Aβ, поскольку он не летуч и хорошо растворяет Aβ в отличие от других растворителей). При этом DMSO действует как денатурирующий агент. Ранее в работе [1] 2015 г. уже отмечалось, что при использовании DMSO в качестве растворителя могут происходить изменения физико-химических свойств пептидов, однако конкретно бета-амилоиды в ней не были упомянуты.
В предыдущей нашей работе [2] было обнаружено, что нативные Aβ образуют комплекс с α2M, вследствие чего тот перестает взаимодействовать с трипсином. Т.е. Aβ способны выступать в роли ингибитора этого взаимодействия, тогда как денатурированные Aβ теряют такую способность. Это обстоятельство позволяет называть нативную форму Aβ активной, а денатурированную — неактивной. Кинетика дезактивации Aβ была нами ранее [2] изучена на основании измерения количества фрагмента Pep-α2M, отщепляемого трипсином от человеческого α2M (у мышиного α2M такого отщепления не наблюдается). Метод работы с α2M и трипсином [2] позволил точно определять соотношение активной и неактивной форм Aβ в их смеси, а следовательно, и следить за процессом дезактивации Aβ в различных условиях. Недостатками указанного метода являются его трудоемкость и нетехнологичность.
МАТЕРИАЛЫ И МЕТОДЫ
Материалы
Пептид VGFYESDVMGR, синтезированный в ООО "НПФ Верта". Трипсин свиной "Promega". DMSO "Sigma-Aldrich". H 2 18O (97% 18O) "Sigma-Aldrich". TFA "Sigma-Aldrich". α-1-антитрипсин "Abcam". Низкомолекулярный ингибитор трипсина PMSF "Sigma-Aldrich". α-циано-4-гидрокси-коричная кислота "Bruker". Деионизированная вода Li Chrosolv "Merck". Пептиды Aβ и их 15N-содержащие стандарты фирмы "rPeptide".
α2M выделен из сыворотки крови человека гель-фильтрацией и любезно предоставлен сотрудником ФГБУ "НИИ гриппа им. А.А. Смородин-цева" Арамом Шалджяном.
Масс-спектрометрия
Масс-спектры получены с помощью масс-спектрометра Ultraflex II MALDI-ToF/ToF (Bruker Daltonics, Германия), оборудованного Nd:YAG (Neodymium-doped Yttrium Aluminium Garnet; Nd:Y3Al5O12) лазером.
Пептиды детектировали в виде положительных ионов с использованием в качестве матрицы α-циано-4-гидроксикоричной кислоты (HCCA) (BrukerDaltonics, Германия). Точность измерения моноизотопных масс была не хуже 50 миллионных долей (ppm).
Растворы пептидов Альцгеймера
Все анализируемые пептиды были растворены в буфере, содержащем 20% ацетонитрила и 1% NH 4 OH. Концентрация пептидов в растворах составляла 23 мкM. 15N-изотопно-меченные стандарты пептидов Альцгеймера были растворены в 100% DMSO. Концентрация составляла 11.5 мкM.
Получение 18О-изотопно-меченного стандарта пептидов Альцгеймера
Растворы пептидов Альцгеймера в концентрации 23 мкM смешивались с H 2 18O, ацетонитрилом и 100% трифторуксусной кислотой в соотношении 1:4:4:1 об. (пептид : H 2 18O : ацетонитрил : TFA). Смесь инкубировалась в твердотельном термостате при температуре 50 °C в течение 30 мин для протекания изотопного обмена. После инкубации стандарт оставался в растворе, высушивание не производилось.
Термоактивация пептидов Альцгеймера в TFA
Растворы пептидов Альцгеймера в концентрации 23 мкM смешивались с водой, ацетонитрилом и 100% трифторуксусной кислотой в соотношении 1:4:4:1 об. (пептид : вода : ацетонитрил : TFA). Смесь инкубировалась в твердотельном термостате "Гном" ("ДНК-Технология", Россия) при температуре 50 °C в течение 30 мин.
Термоактивация в растворе матрицы
Растворы пептидов Альцгеймера в концентрации 23 мкM смешивались с раствором матрицы (α-циано-4-гидроксикоричной кислотой) в 70% ацетонитриле с 1% TFA и добавлением 10 нM ок-тил-β-D-глюкопиранозида. Смесь инкубировалась в течение 30 мин при температуре 50 °C.
Термоактивация в буферном растворе
Растворы пептидов Альцгеймера в концентрации 23 мкM смешивались с буфером, в котором они растворены (20% ацетонитрил, 1% NH 4 OH). Раствор инкубировался в течение 30 мин при температуре 50 °C.
Инкубация пептидов Альцгеймера в DMSO
Исходный раствор пептида в буфере (20% ацетонитрила, 1% NH 4 OH) разбавлялся в 10 раз 100% DMSO. Пептид в DMSO выдерживался в течение 4, 24 и 48 ч при температуре 23 °C. Часть раствора пептида, выдержанная в течение 24 и 48 ч, подвергалась инкубированию в течение 1 ч при температуре 50 °C.
РЕЗУЛЬТАТЫ ЭКСПЕРИМЕНТА И ИХ ОБСУЖДЕНИЕ
Общее описание
В экспериментах использовался ряд пептидов Альцгеймера. В качестве изотопного стандарта применялись как синтетические их аналоги с изотопом 15N, так и аналоги с изотопом 18O, получаемые изотопным обменом с тяжелой водой H 2 18O.
Табл. 1. Пептиды, испо л ьзо в анные в экспе ри менте (обо з начен и я, аминоки с лотн ые посл е доват е льнос т и, мо-н о изотоп н ые в е личи н ы м олек у лярн ой м асс ы и отн ош ен и е ин т ен с ивн ос ти сигнал а в м а с с-спе к тре посл е терм ообра ботк и в п ри сутствии TFA к исходному сигналу)
|
Пепт и ды |
Аминокислотная последовательность |
Mr |
I тер м. /о |
|
Aβ(1–21)* |
DAEFRH DS GYEV HHQ KKLVFF |
2588.3 |
1 . 0 |
|
Aβ(1–3 8) |
DAEFRH DS GYEV HHQ KLVFFAEDVGS N KGAII GLM VG G |
4129.0 |
3 . 1 |
|
Aβ(1–4 0) |
DAEFRH DS GYEV HHQ KLVFFAEDVGS N KGAII GLM VG G |
4327.2 |
3 . 1 |
|
15N-Aβ(1– 40) |
VV |
4381.2 |
1 . 0 |
|
Aβ(1–4 2) |
DAEFRH DS GYEV HHQ KLVFFAEDVGS N KGAII GLM VG G |
4511.3 |
2 . 5 |
|
15N-Aβ(1– 42) |
VVIA |
4567.3 |
1 . 0 |
|
α2М- hum an (705– 7 17) |
VGFYESD VM GR |
1259.7 |
1 . 0 |
Примечан ие : * — анал ог пе п тид а Aβ(1–20)
Поми мо э того на ми был п ол у че н п еп ти дны й ф ра г ме нт Pep-α2M п утем трипсинолиза человеческого α2M. С п и сок ис п ользова н ны х пе п тид о в и от дельн ые х а р ак т ерис т ики представлены в табл. 1.
Полученный нами стандарт с изотопом 18O не является гомогенным, поскольку представляет собой смесь пептидов с разным числом замещенных атомов кислорода, число которых зависит как от продолжительности обмена с тяжелой водой H218O, так и от изотопной чистоты самой воды. В нашем случае не требуется, чтобы стандарт был индивидуальным соединением, а является вполне достаточным, чтобы смесь с разным числом включенных атомов 18O давала в масс-спектре сигналы, не перекрывающиеся с сигналами аналита. В нашем случае статистическое распределение вклада каждого индивидуального компонента в зависимости от числа включенных в его состав атомов 18O приведено на рис. 1. Масс-спектр такого стандарта в смеси с незамещенным пептидом Aβ(1–40) приведен на рис. 2.
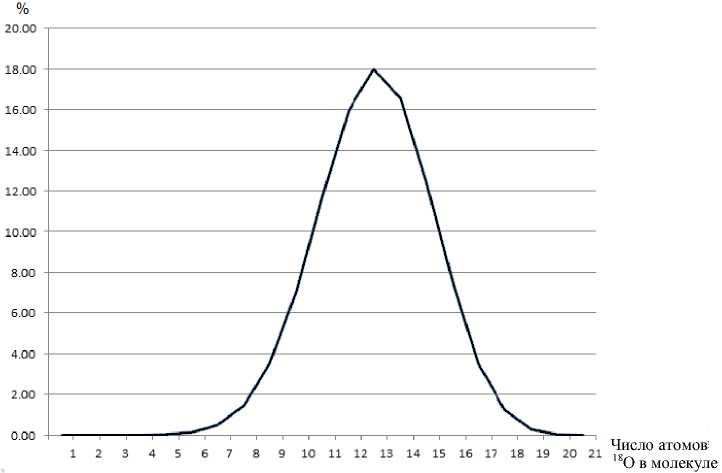
Рис. 1. Проце н тное содержание 18O-з а м е щенных компонентов стандарта в зависимости от чи с ла в к л ю че нн ых в е го состав атомов 18O
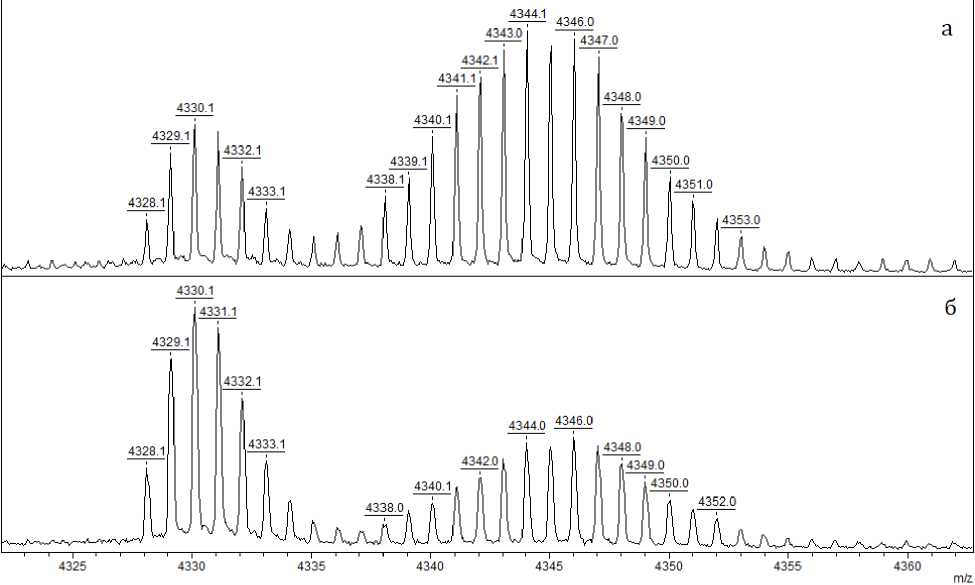
Рис. 2. Изотопное распределение пептида Aβ(1–40) в смеси со стандартом.
а — исходное соотношение; б — соотношение после инкубации пептида в смеси 10% TFA и 40% ацетонитрила в течение 30 мин при температуре 50 °C
Табл. 2. Оценка влияния инкубации пептида Aβ(1–38) в 10% TFA + 40% ацетонитрил при 50 °C на соотношение интенсивностей молекулярных ионов аналита и его стандарта
|
Проба |
Инкубация в 10% TFA + 40% ацетонитрил |
Отношение сумм площадей пептид/стандарт |
|
1 |
– |
1.02 |
|
2 |
30 мин, 50 °C |
2.99 |
Вместе с тем выяснилось, что при смешивании эквимолярных количеств анализируемого образца и полученного из него стандарта интенсивность стандарта в спектре оказалась примерно в 3 раза выше интенсивности исходного пептида. Однако если анализируемый образец выдержать в условиях, аналогичных получению стандарта, то его интенсивность вырастет (см. рис. 2, б) и их интенсивности станут равными. В этой связи нами было предпринято детальное изучение этого эффекта как имеющего важнейшее значение для количественного анализа этих пептидов.
Изменение интенсивности сигнала пептида Aβ(1–40) в кислых средах (в присутствии TFA)
Известно, что TFA традиционно используется в составе растворов при приготовлении матриц при масс-спектрометрической детекции пептидов. Кроме того, 10% TFA при повышенной температуре используется для получения 18О-содержащих стандартов пептидов Aβ. В то время как при получении 18О-содержащего стандарта применяются исключительно жесткие условия — высокая концентрация TFA и повышенная температура. Вместе с тем использование TFA при работе с пептидами часто необходимо при масс-спектрометрической детекции (в наших экспериментах около 9% TFA в составе растворителя для матриц). В связи с этим представляло интерес оценить возможность предподготовки проб с использованием достаточной концентрации TFA и в том числе использовать непосредственно предподготовку образцов в матрице при одномоментном присутствии как анализируемого образца, так и его стандарта.
Температурное воздействие на пептид Aβ(1– 40), находящийся в кислой среде, привело к увеличению интенсивности иона пептида относительно стандарта в 2.5 раза (см. табл. 2).
Специальными экспериментами было показано, что одинаковое возрастание интенсивности всех используемых пептидов достигается, начиная с использования 1–2% TFA при инкубации при 50 °C в течение 30 мин для всех образцов, и достигает тех же значений при инкубации в растворе матриц. При этом, как показали дополнительные эксперименты с пептидом, представленные на рис. 3, для достижения аналогичного эффекта увеличения интенсивности можно при этой же температуре ограничиться добавлением TFA в концентрации 1–2%.
Таким образом, при использовании полученного путем изотопного обмена стандарта пептида для получения корректных данных количественного анализа пептидов имеются два пути: либо ввести коэффициент пропорциональности, либо перед масс-спектрометрической детекцией провести термообработку анализируемого образца.
Из полученных результатов два вывода. Первый заключается в том, что интенсивность пептидов при масс-спектрометрической детекции зависит от предобработки анализируемых образцов. В частности, увеличение интенсивности при термостатировании при 50 °C в течение 30 мин в присутствии TFA с концентрацией более 1%. Учитывая, что в состав матрицы входит 7%-я TFA, представляется целесообразным просто термостатировать образец в этом растворе в течение 30 мин. Экспериментально показано, что в этих условиях достигается максимальное увеличение интенсивности, близкое к З.0.
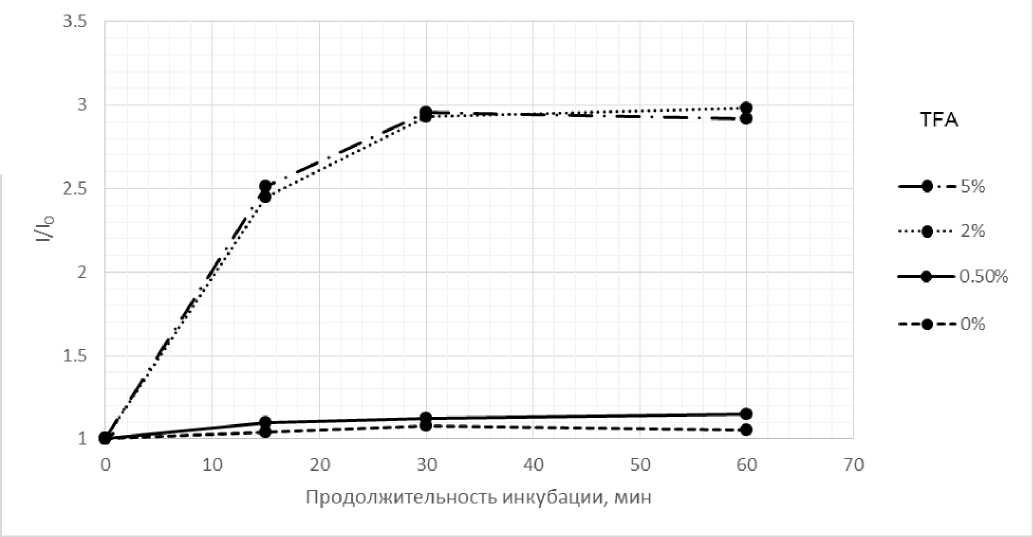
Рис. 3. Изменение в интенсивности при масс-спектрометрическом анализе пептида Aβ(1–38) относительно его стандарта после инкубации пептида в TFA.
По вертикальной оси отложено отношение интенсивности после инкубации к начальной интенсивности
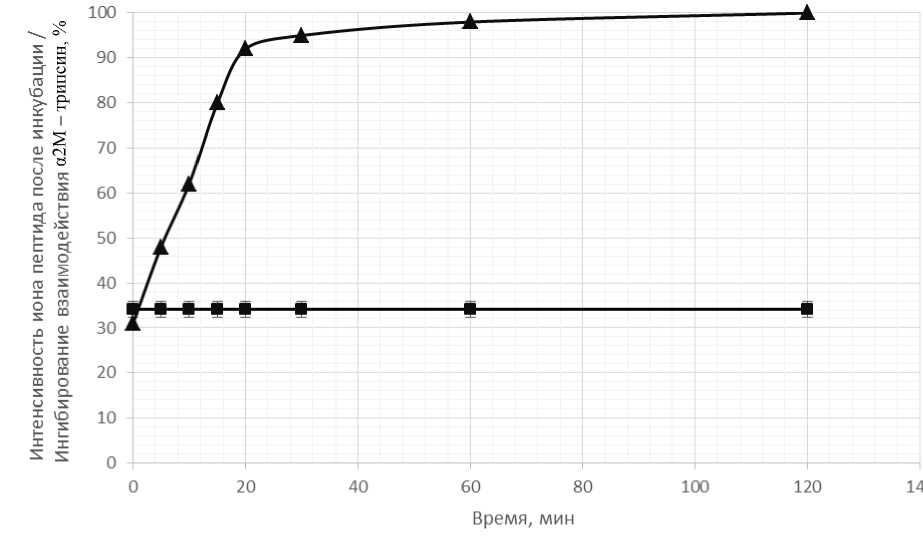
Рис. 4. Способность пептида Aβ(1–40) к ингибированию взаимодействия α2M с трипсином при термостатировании пептида при 50 °C.
■ — активность ингибирования a2M; ▲ — изменение масс-спектрометрической интенсивности иона пептида Aβ(1–40) при термостатировании
Влияние термообработки пептида на активность Aβ(1–40)
В представленном следующем эксперименте проведена термообработка пептида Aβ(1–40) и его триптического гидролизата при 50 оС. Повышение температуры было выбрано из необходимости ускорения процесса, поскольку даже при 50 °C время полуинактивации пептида Aβ(1–40) составляет примерно 24 ч. В связи с этим предстояло оценить устойчивость этого пептида при термообработке при 50 °C в отсутствие DMSO. Результаты этого эксперимента при инкубации пептида при 50 °C представлены на рис. 4.
Из полученных данных следует: при масс-спектрометрической детекции при полном сохранении активности быстро возрастает интенсивность сигнала по отношению к стандарту (растворенному в DMSO), внесенному после термоактивации уже в матрицу (см. Материалы и методы). Этот факт необходимо учитывать при использовании масс-спектрометрии для количественного определения концентраций этих пептидов с использованием изотоп-содержащих стандартов (в представленном выше случае ошибка в определении может составлять порядка 300%).
Влияние термообработки на смесь пептидов Aβ(1–38), Aβ(1–40) и Aβ(1–42)
В тех же условиях была подвергнута термообработке смесь всех трех имеющихся пептидов β-амилоида — Aβ(1–38), Aβ(1–40) и Aβ(1–42) — в надежде, что инкубация смеси этих пептидов в кислой среде позволит выровнять детектируемые интенсивности. Однако на деле соотношение интенсивностей пептидов осталось тем же. Тем не менее детектируемость пептидов от этой операции все же улучшилась, что особенно ценно в отношении пептида Aβ(1–42), интенсивность иона которого обычно мала.
В сравнении со стандартом каждый из пептидов показал одинаковое увеличение интенсивности (табл. 3).
Изменение активности пептида Aβ(1–40) при инкубации в DMSO
DMSO — часто используемый растворитель для гидрофобных пептидов, в том числе и для растворения пептидов Альцгеймера. Именно этот растворитель был использован нами для приготовления растворов 15N-стандарта.
Табл. 3. Изменения в соотношении интенсивностей пептидов Aβ по отношению к стандарту 18O – Aβ(1–40)
|
Пептид |
Соотношение сумм площадей пептид / стандарт до инкубации |
Соотношение сумм площадей пептид / стандарт после инкубации |
|
Aβ(1–38) |
1.83 |
3.63 |
|
Aβ(1–40) |
0.38 |
0.70 |
|
Aβ(1–42) |
0.04 |
0.08 |
Экспериментально выяснилось, что стандарты пептидов не обладают способностью ингибировать α2M. В связи с этим нами была проведена проверка влияние DMSO на активность пептида Aβ(1–40). Для этого пептид Aβ(1–40) из буферного раствора (20% ацетонитрил, 1% аммиак) разбавлялся в 10 раз 100%-м DMSO. Пептид с DMSO выдерживался в течение 4, 24 и 48 ч. После этого часть пробы подвергалась дополнительному инкубированию в течение 1 ч при температуре 50 °C.
В качестве контроля количества α2M в сыворотке была подготовлена проба из сыворотки без добавления пептида Aβ(1–40). Вместо пептида добавлялся бикарбонатный буфер. В качестве контроля за протеканием ингибирования была приготовлена проба из сыворотки с добавлением пептида без DMSO. Результаты измерения активности α2M после инкубации с Aβ(1–40), предварительно выдержанным в DMSO, представлены на рис. 4. Как следует из представленных данных, ингибирующая способности пептида Aβ(1–40) существенно снижается со временем и в конечном итоге получается полностью неактивный пептид, что и наблюдается у стандартов, растворенных в DMSO.
Полученные результаты указывают на то, что инкубация пептидов Альцгеймера с DMSO приводит к утрате способности ингибировать взаимодействие α2M с трипсином. Нагревание при этом не оказывает существенного влияния. Подобный результат, возможно, объясняется изменением пространственной структуры пептида. Это согласуется с результатами, ранее полученными при инкубации сыворотки с 15N-изотопно-меченными стандартами пептидов Aβ, которые, будучи растворенными в 100% DMSO, не обладали ингибирующей способностью. Это не противоречит данным по термоактивации пептидов, которая не приводила к утрате ингибирующей способности, но приводила к увеличению интенсивности при масс-спектрометрической детекции.
Показано, что Aβ при выдерживании в растворе DMSO теряет способность связываться с α2M и, соответственно, ингибировать его способность к взаимодействию с протеазами на примере трипсина. Скорость инактивации зависит от концентрации DMSO. Это, в свою очередь, позволило по взаимодействию с α2M предложить метод, дающий количественную оценку содержания пептидов Aβ, способных (активных) или теряющих способность (неактивных) ингибировать α2M.
В качестве примера использования этого подхода на рис. 5 представлен процесс потери ингибирующей способности по отношению к α2M для пептида Aβ(1–38) в растворе, содержащем 20% DMSO.
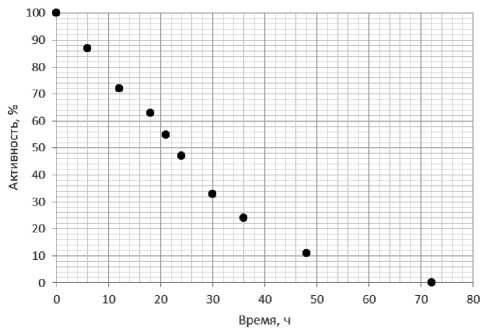
Рис. 5. Кинетика ингибирования пептида Aβ(1–38) в 20% DMSO
Тот факт, что DMSO дезактивирует возможность Aβ связываться с α2M, позволяет предположить, что такой Aβ теряет способность взаимодействия с теми рецепторами, с которыми он взаимодействует в организме больного. Об этом косвенно свидетельствует и то, что DMSO может служить полезным адъювантом для противодействия Aβ-опосредованной синаптотоксичности [3].
Зависимость масс-спектрометрической детекции пептида Aβ(1–38) от его активности
Влияние состояния пептида Aβ(1–38) на его масс-спектрометрическую детекцию проверялось относительно 15N-стандарта этого пептида. Стандарт растворен в 100% DMSO, и его интенсивность стабильна независимо от проводимых с ним манипуляций.
Небольшой объем каждого из образцов пептида, инактивированного в DMSO, смешивался с равным объемом стандарта и анализировался масс-спектрометрически. В качестве контроля максимального изменения интенсивности был взят не подвергавшийся инкубации в DMSO пептид, который инкубировался в 2.5% TFA (равные объемы раствора пептида и 5% TFA) в течение 30 мин при температуре 50 оС. Все образцы, инкубированные в DMSO, также смешивались с TFA для оцен- ки изменения интенсивности вследствие действия TFA. Для каждого образца было сделано 3 повторных измерения.
У не подвергавшихся действию DMSO образцов наблюдалось увеличение интенсивности в 3 раза относительно неинкубированных в TFA. При этом образцы после воздействия DMSO показали четкую зависимость в изменении интенсивности ионов в зависимости от активности этих пептидов (рис. 6).
Эта зависимость позволяет оценить активность пептида Aβ по интенсивности его сигнала в масс-спектрометре. Для этого достаточно получить масс-спектры образца относительно стандарта без инкубации в TFA и после инкубации. После инкубации в TFA достигается максимальная интенсивность, соответствующая троекратной интенсивности по сравнению с активным пептидом Aβ. Если пептид был частично неактивен, то изменение интенсивности после инкубации в TFA будет меньше 3. В последнем случае делением на 3 изменения интенсивности мы получим активность исследуемого пептида. Например, если после инкубации с TFA изменение интенсивности составило 1.8 раза, то на графике необходимо отложить значение по оси изменения интенсивности 3/1.8 = = 1.67, что соответствует активности 60%.
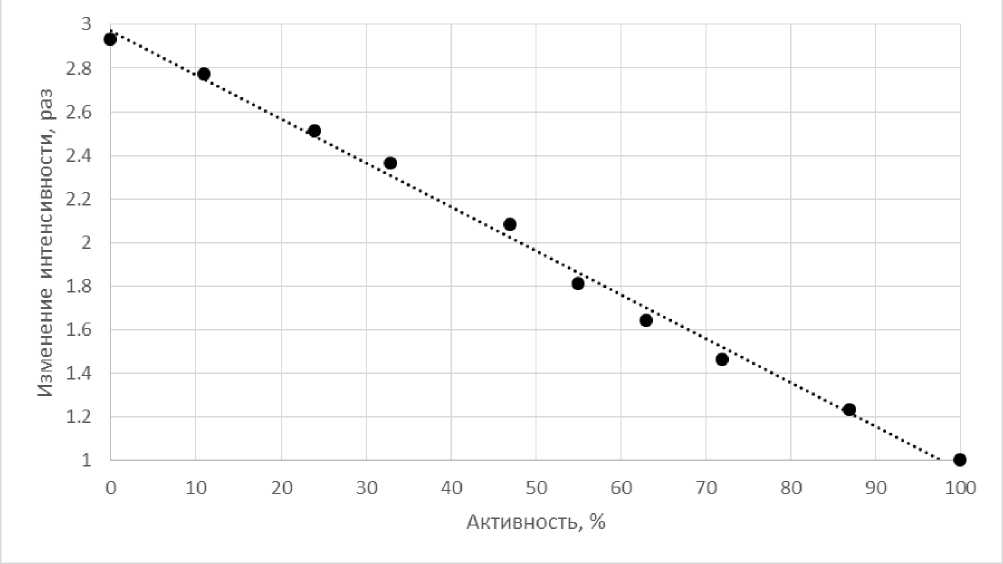
Рис. 6. Зависимость интенсивности масс-спектрометрической детекции пептида Aβ(1–38) от активности пептида
ЗАКЛЮЧЕНИЕ
Из нашего исследования логически вытекает рекомендация: перед анализом прогревать смесь аналита Aβ со стандартом в присутствии 0.5% TFA, что ведет к денатурации обоих компонентов смеси. Этим способом достигается единообразие их форм, заодно повышая интенсивность их сигналов в масс-спектре.
При анализе необходимо учитывать различную интенсивность сигналов от Aβ(1–38), Aβ(1–40) и Aβ(1–42) — в этом ряду она убывает. Что не позволяет количественно измерить всех их с помощью одного изотопно-меченного стандарта.
Список литературы ОСОБЕННОСТИ МАСС-СПЕКТРОМЕТРИЧЕСКОЙ ДЕТЕКЦИИ БЕТА-АМИЛОИДНЫХ ПЕПТИДОВ (ПЕПТИДОВ АЛЬЦГЕЙМЕРА)
- 1. Laurents D.V., Pantoja-Uceda D., Lopez C., Carrodeguas A., Mompean M., Jimenez M.A., Sancho J. DMSO affects Aβ(1–40)' s conformation and interactions with aggregation inhibitors as revealed by NMR // Rsc Advances. 2015. Vol. 5, is. 85, P. 69761–69764. DOI: 10.1039/C5RA12100K
- 2. Protasov A.V., Mirgorodskaya O.A., Kozmin Y.P., Gobom J. A mass spectrometric approach to study the interaction of amyloid β peptides with human α-2-macroglobulin // Biochimie. 2021. Vol. 191. P. 62–68. DOI: 10.1016/j.biochi.2021.08.008
- 3. Penazzi L., Lorengel J., Sundermann F., Golovyashkina N., Marre S., Mathis C.M.B., Lewejohann L., Brandt R., Bakota L. DMSO modulates CNS function in a preclinical Alzheimer's disease model // Neuropharmacology. 2017. Vol. 113, Part A. P. 434–444. DOI: 10.1016/j.neuropharm.2016.10.020


