Особенности морфологической реакции тучных клеток при репаративной регенерации в коже под влиянием региональных факторов
Автор: Алексеева Наталия Тимофеевна, Никитюк Дмитрий Борисович, Глухов Александр Анатольевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.22, 2014 года.
Бесплатный доступ
Проведено экспериментальное исследование морфологической реакции тучных клеток при селективном и комбинированном влиянии обогащенной тромбоцитами плазмы крови на асептическое и гнойное течение раневого процесса в коже. В эксперименте установлено, что тучные клетки реагируют изменением морфофункционального состояния на воспалительную реакцию в зоне раневого дефекта. Наибольшая выраженность данной реакции определяется в асептических ранах при селективном действии обогащенной тромбоцитами плазмы крови, а также при комбинированном влиянии гидроимпульсной санации и обогащенной тромбоцитами плазмы крови на гнойное течение раневого процесса.
Асептические раны, гнойные раны, тучные клетки, обогащенная тромбоцитами плазма крови
Короткий адрес: https://sciup.org/143176996
IDR: 143176996
Текст научной статьи Особенности морфологической реакции тучных клеток при репаративной регенерации в коже под влиянием региональных факторов
Введение. Участие различных клеточных дифферонов при репаративной регенерации проявляется морфологическими реакциями. Это определяется не только особенностями структурно-функционального состояния данных клеток, но и зависит от фазы регенерации. При раневом процессе формируется единый комплексный ответ на повреждение, включающий в себя воспалительную реакцию и репаративную регенерацию [1]. Тучные клетки или тканевые базофилы обеспечивают условия, необходимые для борьбы с травмой купирования воспаления и способствуют восстановлению целостности кожных покровов. Для регенерации характерен сложнейший клеточный состав, который может служить прогностическим критерием оценки процесса заживления. Особое место в этом процессе занимают тучные клетки. Эти клетки являются регуляторами не только сосудистых реакций в зоне травмы, но и иммунологических, защитных и репаративных процессов в ране [2]. В цитоплазме тучных клеток образуются биологически активные вещества – гепарин, гистамин, серотонин, которые накапливаются в метахроматических гранулах и выделяются при дегрануляции. В процессе регенерации особое место занимают нейтральные протеазы: триптаза и химаза. Триптаза увеличивает сосудистую проницаемость микроциркуляторного русла, обладая однонаправленным действием с гистамином, и расщепляет фибриноген [3]. Тучным клеткам свойственен мерокриновый тип секреции, так как выделение биологически активных веществ не ведет к их гибели, а стимулирует перестройку ядра и цитоплазмы.
Цель исследования - определить структурно-функциональные особенности тучных клеток в процессе заживления кожных ран при селективном и комбинированном влиянии обогащенной тромбоцитами плазмы крови.
Материал и методы исследования. Ис- следования проведены на 224 белых лабораторных крысах-самцах массой 240±12,5 г. Животных содержали в условиях клиники НИИ экспериментальной биологии и медицины Воронежской государственной медицинской академии им. Н.Н.Бурденко. Содержание, кормление, уход за животными и выведение их из эксперимента осуществляли в соответствии со строгим соблюдением принципов, изложенных в Конвенции по защите позвоночных животных, используемых для экспериментальных и других целей (г. Страсбург, Франция, 1986) и согласно правилам лабораторной практики Российской Федерации (приказ МЗ РФ № 267 от 19.06.2003 г.).
Оценку репаративной регенерации проводили в асептических и гнойных кожных ранах на фоне селективного и комбинированного применения обогащенной тромбоцитами плазмы крови (ОТПК). Для моделирования асептической раны под наркозом [«Золитил-100» в дозе 8 мк/кг (согласно инструкции производителя)] на выбритом от шерсти участке наружной поверхности средней трети бедра производили линейный разрез кожи и подкожной жировой клетчатки длиной 1,0 см. Рану закрывали давящей марлевой асептической повязкой. Лечение начинали сразу после моделирования.
Для изучения процессов регенерации при заживлении асептических кожных ран при использовании ОТПК после моделирования раневого дефекта животные были разделены на три группы: контрольную и две опытные. В первой опытной группе проводили гидроимпульсную санацию (ГИС) дефекта тканей 0,9% раствором хлорида натрия. Во второй опытной группе на ткани наносили ОТПК. Для получения ОТПК из хвостовой вены каждого животного проводили забор 4 мл крови, которую центрифугировали при 6000 оборотов в минуту, затем наносили на рану. Для моделирования гнойной раны применяли суточную культуру Staphylococcus aureus в дозе 1010 в одном мл физиологического раствора. На третьи сутки развивалась модель острого гнойного воспаления с обильным гнойным отделяемым, используемая в эксперименте. После формирования гнойной раны во всех группах осуществляли её хирургическую обработку, а затем на рану накладывалась асептическая повязка. Для оценки репаративных процессов при заживлении гнойных кожных ран животные разделены на четыре группы: контрольную и три опытные. В экспериментальный блок была включена группа виварного контроля, для оценки тучноклеточной популяции в пределах интактной кожи.
Для забора материала животных выводили из эксперимента на 1, 3, 5, 7 сутки. Биологический материал забирали таким образом, чтобы захватывалась область раны и неизмененных тканей. Полученный материал фиксировался в 10% нейтральном формалине с последующим обезвоживанием и заливкой в парафин. Для выявления общей гистологической картины в зависимости от сроков заживления ран была использована окраска гематоксилином и эозином. Тучные клетки (ТК) подсчитывали в тканях, окружающих рану, с учетом общего числа и морфофункциональных типов при окраске толуидиновым синим при рН=5,6. Плотность тучных клеток определяли с помощью светового микроскопа при увеличении 40х10. Подсчет клеток и их типирование проводили в 20 полях зрения с последующим перерасчетом на единицу площади (S=0,01 мм2). Функциональную активность тучных клеток оценивали по индексу дегрануляции, который представляет собой отношение числа дегранулированных клеток к общему числу анализируемых клеток, выраженное в процентах. Значение индекса дегрануляции в дальнейшем сравнивалось в экспериментальных и контрольных группах.
Для анализа данных использовались статистические пакеты Statistica 6.1 фирмы StatSoft и S-plus 2000 Professional фирмы MathSoft. Для оценки характера распределения использовались графический метод построения диаграмм и критерий Колмогорова-Смирнова. В качестве методов статистического анализа для оценки значимости различий между средними выборочными значениями были использованы одномерный и многомерный дисперсионный анализ (ANOVA и MANOVA) как методы, наиболее адекватные с математической точки зрения; в качестве апостериорного критерия применялся критерий Шеффе как более строгий.
Результаты исследования и их обсуждение. Через сутки после нанесения асептической раны морфологическая картина характеризуется наличием дефекта кожи. Эпителий у края раны обрывается, краевой участок немного утолщен, дефект заполнен некротическим содержимым, края раны инфильтрированы нейтрофильными лейкоцитами. Экссудация и интерстициальный отёк выражен в дерме и распространяется в нижележащие ткани. В воспалительном процессе в результате сосудистой реакции, которая выражается в расширении сосудов и выходе жидкой части крови, развивается фаза экссудации или реакции микроциркуляторного русла. Эта фаза наступает за фазой альтерации. Интерстициальный отёк уменьшает плотность межклеточного вещества и улучшает условия для миграции клеток к очагу воспаления. Наблюдается преобладание дегра-нулированных ТК (рис. 1). Некоторые клетки не имеют сплошной четкой клеточной мембраны, отдельные клетки окружены метахроматическими
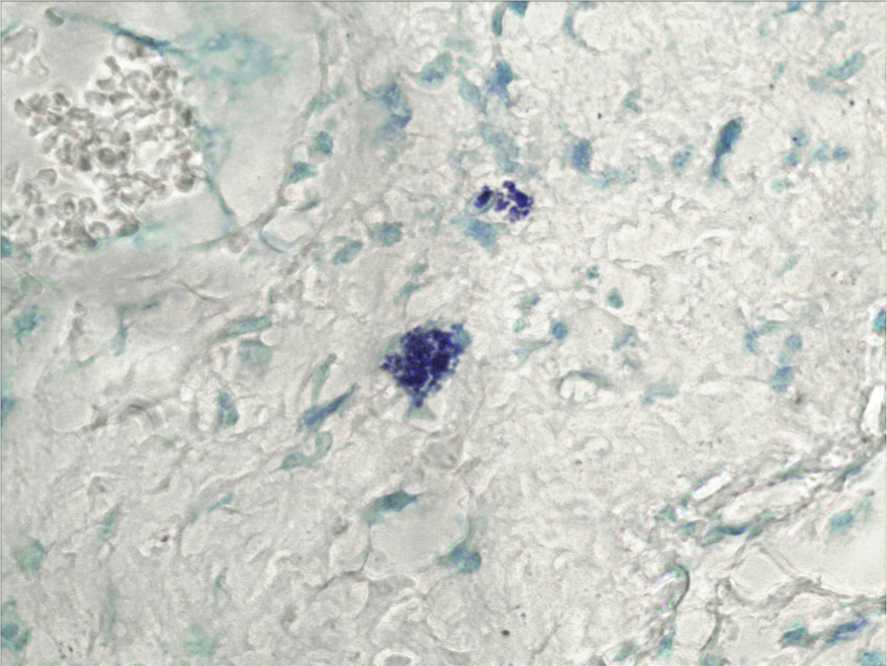
Рис. 1. Различные формы дегранулированных тучных клеток. Контрольная группа. 1 сутки эксперимента. Окраска толуидиновым синим. Ув. 1000.
100,00%
90,00%
80,00%
70,00%
60,00%
50,00%
40,00%
30,00%
20,00%
10,00%
0,00%
1 сут 3 сут 5 сут 7 сут
^^^^^^^™ Интактный контроль
АР контроль ГИС ОТПК
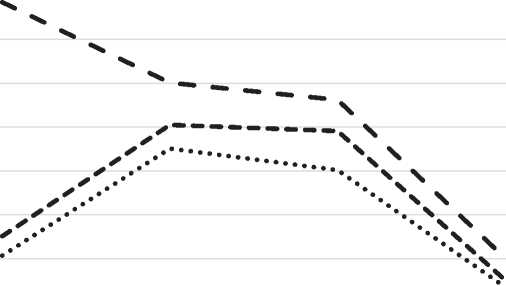
Рис. 2. Индекс дегрануляции ТК в дерме околораневой зоны в различные сроки регенерации асептических ран под влиянием ОТПК. По оси абсцисс – сроки заживления; по оси ординат – % дегранулированных ТК.
ореолами в результате нарушения целостности клетки и рассеивания гранул. Индекс дегрануляции составляет 30,7% (рис. 2). В 1-й опытной группе после применения гидроимпульсной санации морфологическая картина не отличается от контрольной группы. На всём протяжении тканей в зоне дефекта характерно полнокровие сосудов и стаз форменных элементов в расширенных капиллярах. В субэпидермальных и глубоких участках дермы в области раны преобладают ТК с различным уровнем дегрануляции. Индекс дегрануляции составляет 35,1% (рис. 2). Через сутки после применения ОТПК в области асептической раны отмечается заполнение дефекта тканей некротическими массами. Краевой участок эпидермиса несколько утолщен. Воспалительная инфильтрация из нейтрофильных лейкоцитов формирует демаркационный вал, который чаще всего образуется к третьим суткам. По преобладающему клеточному компоненту данный экспериментальный срок соответствует лейкоцитарной фазе клеточных реакций [4]. Миграция лейкоцитов из крови через сосудистую стенку в ткани обеспечивает формирование границы между повреждёнными и интактными тканями и способствует локализованности воспалительного процесса. Диапедез нейтрофильных лейкоцитов через сосудистую стенку осуществляется под действием хемотаксических веществ. В этом процессе активирующую роль играет гистамин, который выделяется при дегрануляции тучных клеток. Увеличение гистамина при травме и увеличение индекса дегрануляции тучных клеток в ране может рассматриваться как хороший прогностический признак [5]. Развитие воспалительной реакции сопровождается увеличением количества ТК в состоянии дегрануляции различной степени (рис. 3). Глубокие отделы дермы в области раны содержат значительное количество метахроматических гранул и опустошенные клетки. Индекс дегрануляции ТК составляет 88,5 % (рис. 2).
Через 3-е суток после моделирования раны у животных контрольной группы отмечаются морфологически сходные изменения, которые наблюдались через сутки, но степень выраженности более высокая. Начинает формироваться демаркационный вал, сформированный из нейтрофильных лейкоцитов, но, в отличие от морфологической картины после первых суток применения ОТПК, демаркационная линия размыта и не даёт чёткого разделения изменённых и неповреждённых тканей. На фоне увеличения общего количества ТК повышается индекс дегрануляции до 55,1% (рис. 2). В 1-й опытной группе на 3-и сутки после применения ГИС на дне дефекта определяются скопления грануляционной ткани, но участки этой новообразованной ткани по размеру меньше, чем в контрольной группе. При морфологическом исследовании ТК обнаруживается увеличение их количества по сравнению с контрольной группой и с предыдущим экспериментальным сроком (рис. 4). Намечается тенденция к повышению индекса дегрануляции (60,5%), по сравнению с контрольной группой (рис. 2). На 3-и сутки после применения ОТПК сохраняется чёткий лейкоцитарный вал. В пределах дермы в околоране-вой зоне отмечается полиморфный клеточный компонент, представленный многочисленными макрофагами, тучными клетками, что характеризует трансформацию лейкоцитарной фазы в макрофагальную. Для пролиферации и дифференцировки макрофагов необходимы факторы роста, которые вырабатываются собственными клетками (тромбоцитарный фактор роста; щелочной фактор роста фибробластов; фактор роста, секретируемый лимфоцитами), а также поступают вместе с ОТПК. С точки зрения фаз воспалительного процесса под действием ОТПК ускоряется переход фазы альтерации в фазу экссудации, и в течение последней начинаются пролиферативные реакции, которые выражаются в количественном увеличении фибробластов в дерме, снижении числа клеток воспалительного ряда, активным ангиогенезом и коллагеногенезом. На 3-и сутки во 2-й опытной группе определяется достоверное увеличение количества ТК на субэпидермальном уровне и в глубоких отделах дермы в околоране-вой области, преобладают клетки с явлениями частичной и полной дегрануляции (рис. 4). Индекс дегрануляции ТК составляет 70,1% (рис. 2).
На 5-е сутки у животных контрольной группы в области раневого дефекта определяется увеличение объема грануляционной ткани. Клеточный компонент содержит незначительное количество макрофагов, лейкоцитов на фоне увеличения содержания тучных клеток и фибробластов. Контракция раны обеспечивает сближение краев раневого дефекта. Новообразованный эпидермис наползает на грануляционную ткань. Количество ТК незначительно превышает предыдущий экспериментальный срок. Индекс дегрануляции составляет 50,2% (рис. 2). На 5-е сутки после применения гидроимпульсной санации отмечается выраженная реэпителизация дефекта по направлению от периферии к центру. Увеличивается содержание грануляционной ткани, но, по сравнению с другими группами данного экспериментального срока, остается повышенным содержание клеток фазы воспаления. Повышено содержание дегранулиро-ванных ТК по сравнению с контрольным уровнем на фоне увеличения количества ТК в стенках раны. Индекс дегрануляции составляет 59,1% (рис. 2). На 5-е сутки после применения ОТПК во 2-й экспериментальной группе увеличивается коли-
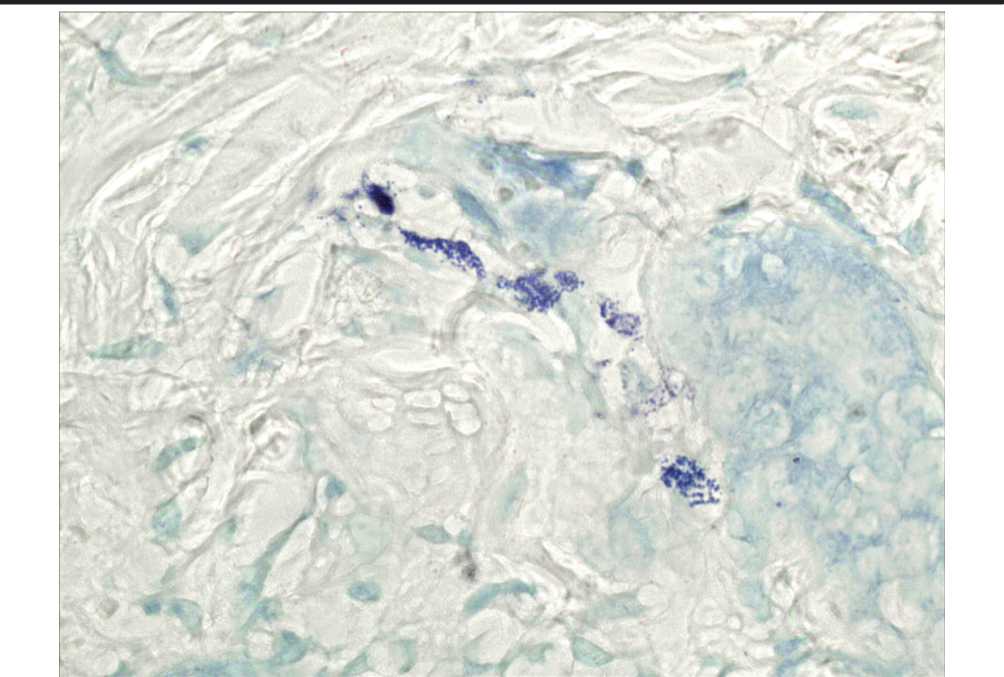
Рис. 3. Увеличение количества тучных клеток в состоянии дегрануляции различной степени. 2 опытная группа. Окраска толуидиновым синим. Ув. 1000.

3,5
2,5
1,5
0,5
1 сут 3 сут 5 сут 7 сут
^^^^^^w Интактный контроль АР контроль ГИС ОТПК
Рис. 4. Общее число ТК в дерме околораневой зоны в различные сроки регенерации асептических ран под влиянием ОТПК. По оси абсцисс – сроки зажвиления; по оси ординат – число ТК в одном поле зрения.
чество грануляционной ткани, что обусловлено стимулирующим влиянием ОТПК на репаративную регенерацию. Формирование грануляционной ткани – это многоэтапный процесс, выраженность которого нарастает во времени и проявляется ангиогенезом, пролиферацией фибробластов, коллагеногенезом. Клеточный компонент преимущественно представлен фибробластами и тучными клетками, что указывает на преобладание пролиферативных процессов. Увеличение количества тучных клеток и их функциональное состояние обеспечивает повышение выделяемых биологически активных веществ, влияющих на сосудистую стенку и активирующих транспорт необходимых составляющих для образования коллагеновых волокон. Индекс дегрануляции ТК составляет 66,2% (рис. 2).
На 7-е сутки у контрольных животных отмечается почти полное заполнение раневого дефекта грануляционной тканью, в глубине дермы встречаются очаги инфильтрации клетками воспалительного ряда. В случае полного заполнения раневого дефекта грануляционной тканью толщина эпидермиса приближается к уровню интактного, но преобладают раны, в которых эпидермис не полностью покрывает дефект. Среди ТК отмечается понижение содержания дегранулированных форм на уровне предыдущего экспериментального срока. Индекс дегрануляции составляет 23,5% (рис. 2). На 7-е сутки после применения гидроим-пульсной санации наблюдается заполнение зоны дефекта грануляционной тканью. Имеются раны, содержащие очаги воспалительной инфильтрации и явления отека, что может свидетельствовать о травмирующем воздействии гидроимпульсной санации на ткани. Количественно содержание ТК превышает уровень контрольной группы и предыдущего срока (рис. 4). Индекс дегрануляции ТК составляет 25,1%, незначительно превышая контрольный уровень (23,5%) (рис. 2). После применения ОТПК на 7-е сутки в глубине раны встречаются единичные клетки воспалительного ряда, но преобладают пролиферативные процессы. Визуально определяется максимум фибробластической реакции. Наряду с активными фибробластами появляются фиброциты с темными ядрами, в которых отсутствуют ядрышки. Эти превращения свидетельствуют об изменениях соотношения дифферона фибробластов в грануляционной ткани в процессе заживления раны. Почти во всех препаратах отмечается полная эпидермизация, толщина слоев приближается к уровню интактной эпидермы. Усиление эпителизации соответствует повышению митотической активности в эпидермисе, что подчеркивает широкие возможности покровных тканей к различным пластическим изменениям. Количественно содержание ТК не отличается от предыдущего экспериментального срока, но превышает контрольный уровень (рис. 4). Полиморфизм ТК выражается в различной функциональной активности клеток – встречаются клетки, имеющие попарное или цепочное расположение, что указывает на повышение пролиферативных свойств ТК. Возрастание функциональной активности ТК выражается в повышении уровня дегрануляции клеток и, соответственно, в повышении содержания продуктов секреции в околораневой зоне. Индекс дегрануляции ТК составляет 30,1%, превышая контрольный уровень (23,5%), но значительно ниже предыдущего экспериментального срока (66,2%) (рис. 2).
Исследование восстановительных процессов при заживлении гнойных ран показывает, что в препаратах контрольной группы животных через сутки после моделирования гнойной раны в полости дефекта определяются гнойно-некротические массы. Лейкоцитарная инфильтрация глубоко проникает в дерму. В глубжележащих тканях наблюдается выраженный отек, полнокровие расширенных капилляров. Среди ТК определяются клетки с различной степенью дегрануляции. Больше дегранулированных клеток в глубоких слоях дермы. Индекс дегрануляции составляет 55,8% (рис. 5). В 1-й опытной группе через сутки после применения ГИС отмечается дефект тканей, заполненный гнойно-некротическими массами. Края ран содержат многочисленные нейтрофильные лейкоциты и единичные макрофаги. Для тканей в области раневого дефекта характерен интерстициальный отек и полнокровие расширенных капилляров. В качественном отношении морфологическая картина не отличается от контрольной группы, но наблюдается большая выраженность сосудистой реакции, что проявляется расширением сосудов дермы. Общее количество ТК понижается по сравнению с контролем (рис. 6), но индекс дегрануляции превышает контрольные значения и составляет 60,2% (рис. 5). В препаратах 2-й опытной группы через сутки после применения ОТПК определяется преобладание воспалительных проявлений. Общее количество клеток существенно не изменяется по сравнению с контролем, но индекс дегрануляции значительно превышает уровень контрольных значений и составляет 74,8% (в контрольной группе – 55,8%) (рис. 5). Через сутки после комбинированного применения ГИС и ОТПК отмечается, что полость раны заполнена некротическими массами. Ткани содержат большое количество нейтрофильных лейкоцитов. На уровне дермы определяется выраженный отек и расширенные капилляры. Выделяя гистамин и серотонин, тучные клетки увеличивают проницаемость сосудов, вызывают их расширение, что проявляется интерстициальным отеком,
100,00%
90,00%
80,00%
70,00%
60,00%
50,00%
40,00%
30,00%
20,00%
10,00%
0,00%
1 сут 3 сут 5 сут 7 сут
^^^^^^^™ ГН контроль ГН ГИС ГН+ОТПК ГН+ГИС+ОТПК
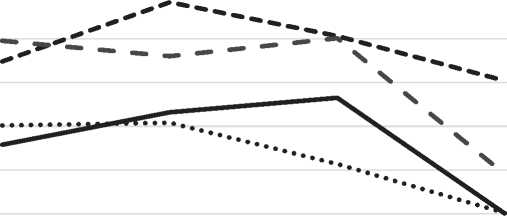
Рис. 5. Индекс дегрануляции ТК в дерме околораневой зоны в различные сроки регенерации гнойных ран под влиянием ОТПК. По оси абсцисс – сроки заживления; по оси ординат – % дегранулированных ТК.
3,5

2,5
1,5
0,5
1 сут 3 сут 5 сут 7 сут
^^^^^^^е ГН контроль ГН ГИС ГН+ОТПК ГН+ГИС+ОТПК
Рис. 6. Общее число ТК в дерме околораневой зоны в различные сроки регенерации гнойных ран под влиянием ОТПК. По оси абсцисс – сроки зажвиления; по оси ординат – число ТК в одном поле зрения.
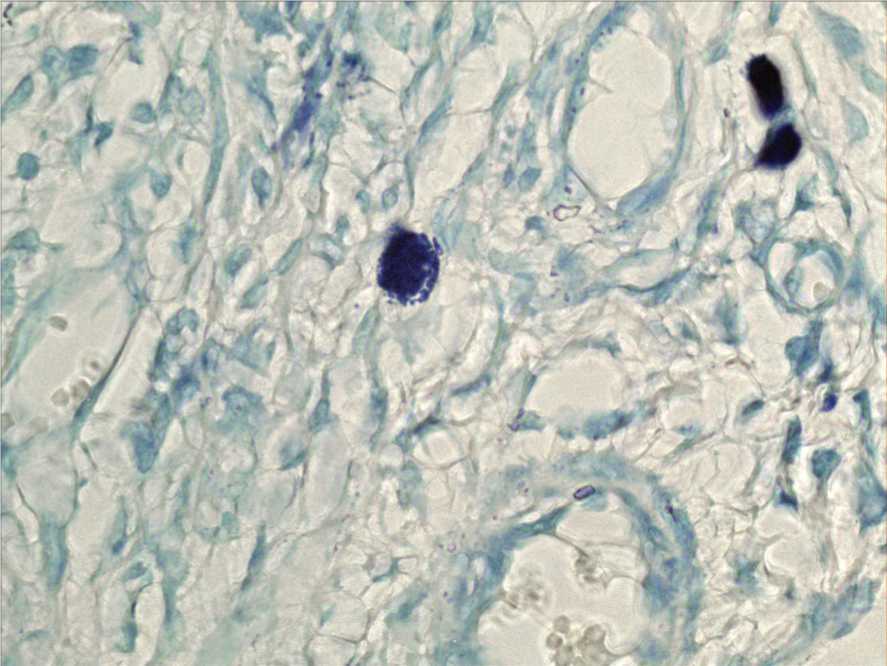
Рис. 7. Незначительное снижение содержания тучных клеток на фоне уменьшения количества дегранулированных форм. Контрольная группа. Окраска толуидиновым синим. Ув. 1000.
на фоне которого отмечается лейкоцитарная инфильтрация. Сохранение отека под действием медиаторов, выделяемых тучными клетками, обуславливает гипоксию тканей в области раны, что поддерживает воспалительную реакцию [6, 7].Об-щее количество ТК ниже контрольных значений, не отличается от 2-й группы, на фоне значительного повышения функциональной активности ТК, на что указывает повышение индекса дегрануляции до 79,5% (рис. 5).
На 3-и сутки в гнойных ранах у животных контрольной группы нарастает воспалительная реакция, что проявляется полиморфным воспалительным инфильтратом, содержащим многочисленные нейтрофильные лейкоциты, макрофаги, тучные клетки. Для этого периода характерно расплавление некротизированных тканей, удаление их и частичное очищение раневого дефекта. В результате повышения проницаемости сосудистой стенки в глубине раны сохраняется интерстициальный отек. В глубоких слоях дермы наблюдается единичные микроабсцессы. Общее количество ТК в околораневой зоне понижается по сравнению с предыдущим экспериментальным сроком на фоне повышения индекса дегрануляции 63,2% (рис. 5). На 3-и сутки в препаратах ран 1-й опытной группы животных отмечается формирование лейкоцитарного вала, отделяющего зону воспаления. Воспалительный инфильтрат, кроме нейтрофильных лейкоцитов, содержит макрофаги, ТК, фибробласты. Данный факт подтверждает, что лейкоцитарная фаза регенеративного воспаления сменяется макрофагальной. В области дна раны появляются участки молодой грануляционной ткани. Общее количество ТК в околораневой зоне превышает контрольный уровень (рис. 6), но их функциональная активность достоверно не отличается от контрольной группы, индекс дегрануляции ТК составляет 60,8%, не отличается от уровня предыдущего экспериментального срока (рис. 5). Во 2-й опытной группе на 3-и сутки опытные образцы характеризуются наличием широкого демаркационного вала с размытыми границами. Клеточный компонент представляем преимущественно клетками воспалительного ряда – лейкоцитами, макрофагами, а также единичными фибробластами. В дне раны появляются мелкие единичные участки грануляционной ткани. Сохраняется
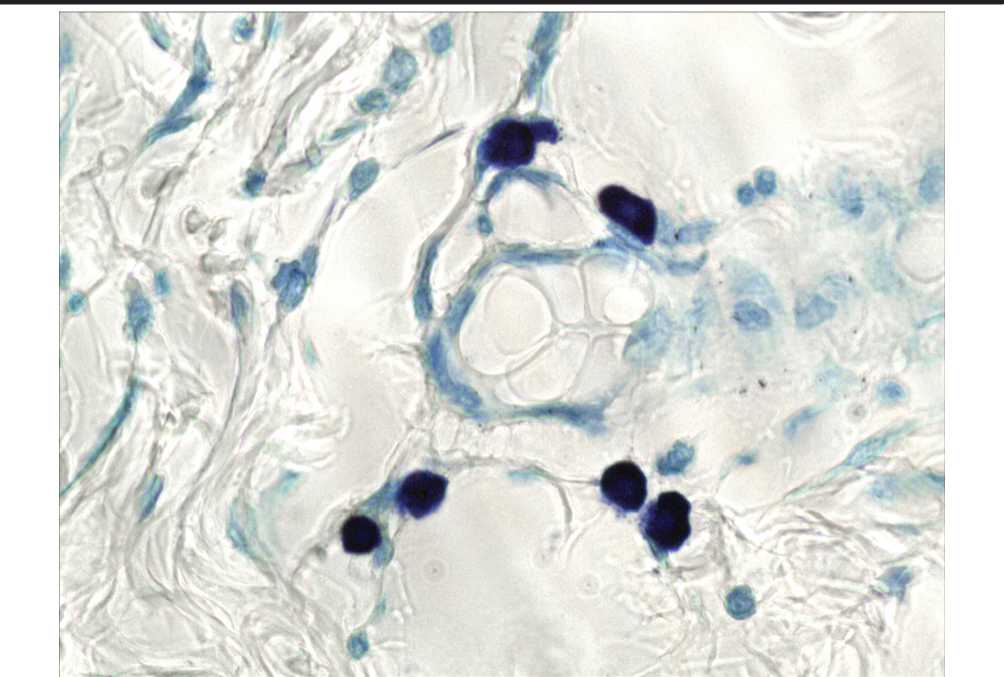
Рис. 8. Повышение общего количества тучных клеток на фоне уменьшения содержания дегранулированных форм. 3 опытная группа. Окраска толуидиновым синим. Ув. 1000.
интерстициальный отек тканей в околораневой зоне. Для тучноклеточной популяции характерно увеличение общего числа ТК в околораневой зоне, которое превышает содержание этих клеток в контрольной группе, но ниже уровня во 1-й опытной группе (рис. 6). Индекс дегрануляции ТК на данном экспериментальном сроке значительно превышает уровень контрольной и 1-й опытной групп и составляет 88,3% (рис. 5). На 3-и сутки в 3-й опытной группе после применения ГИС и ОТПК регенеративные процессы отличаются локализованным характером воспалительной реакции, появляется грануляционная ткань, покрывающая дно раны. Общее количество ТК повышается, значительно превышая контрольный уровень. Индекс дегрануляции ТК составляет 76,0%, превышая контрольный уровень (63,2%), но ниже индекса во 2-й опытной группе (88,3%) (рис. 5).
Через 5 суток после моделирования гнойной раны морфологическая картина контрольной группы отличается сохранением большого количества клеток воспаления. Молодая грануляционная ткань расположена тонким слоем в области дна раны. В глубоких слоях дермы сохраняется воспалительная инфильтрация и интерстициальный отек. Общее количество ТК в околораневой зоне понижено по сравнению с предыдущим экспериментальным сроком, но возрастает индекс дегрануляции до 66,5% (рис. 5). На 5-е сутки в большинстве препаратов 1-й опытной группы наблюдается увеличение слоя грануляционной ткани, уменьшается количество клеток воспалительного ряда, явления отека стихают. Края раны сближаются, увеличивается протяженность эпидермального пласта, покрывающего дефект. Общее количество ТК значительно превышает контрольный уровень, показывая тенденцию к повышению по сравнению с предыдущим экспериментальным сроком (рис. 6). Индекс дегрануляции понижен и составляет 51,4% (рис. 5). На 5-е сутки во 2-й опытной группе усиливаются пролиферативные процессы, что проявляется увеличением количества грануляционной ткани с большим содержанием фибробластов, но сохраняется выраженная воспалительная реакция в пределах дермы с вовлечением макрофагов, ТК. Общее число ТК значительно превышает контрольный уровень, что сочетается с высоким значением индекса дегрануляции – 80,6% (рис. 5). Через 5 суток раневой дефект в 3-й опытной группе заполняется грануляционной тканью, которая достигает сосочкового слоя. На фоне активных процессов ангиогенеза уменьшаются отек, воспалительная инфильтрация. Эпителий нарастает на грануляционную ткань. Толщина эпителия превышает уровень интактной кожи. Содержание ТК в околораневой зоне превышает уровень контрольной и опытных групп, индекс дегрануляции превышает уровень контрольной группы, а также предыдущего экспериментального срока и составляет 80,1% (рис. 5).
На 7-е сутки в контрольной группе отмечается заполнение раневого дефекта грануляционной тканью, в глубине раны сохраняются слабовы-раженные явления отека. Общее количество ТК незначительно понижается по сравнению с предыдущим экспериментальным сроком, что сопровождается снижением индекса дегрануляции, который составляет 40,1% (рис. 5, рис. 7). В 1-й опытной группе на 7-е сутки грануляционная ткань почти полностью заполняет раневой дефект. Клеточный полиморфизм в пределах дермы в основном представлен клетками, характерными для фибробластической фазы клеточных реакций раневого процесса. Выраженный ангиогенез обеспечивает улучшение трофических процессов. Общее число ТК превышает контрольный уровень, но отмечается понижение по сравнению с предыдущим экспериментальным сроком. Индекс дегрануляции ТК не отличается от контрольных значений и составляет 40,2% (рис. 5). Во 2-й опытной группе сохраняется дефект тканей, в краях раны определяются клетки воспалительного ряда на фоне отека тканей. Эпителий нарастет на грануляционную ткань без признаков окончательной дифференцировки эпидермиса. Общее количество ТК превышает контрольный уровень, не отличаясь от уровня 1-й опытной группы и от уровня предыдущего экспериментального срока (рис. 6). Индекс дегрануляции ТК превышает значение всех групп на данном сроке, составляет 70,4% (рис. 5). По сравнению с предыдущим сроком в данной группе отмечается понижение индекса дегрануляции. В 3-й опытной группе через 7 суток после комбинированного воздействия ГИС и ОТПК на гнойную рану в пределах раневого дефекта воспалительный инфильтрат и отек почти полностью исчезают. Образуется значительное количество грануляционной ткани. Обогащенная тромбоцитами плазма крови обеспечивает пролиферацию фибробластов и образование коллагена типа 1, потенцируя восстановление раневого дефекта, что согласуются с мнением ряда авторов [8, 9]. В некоторых препаратах эпидермис полностью закрывает раневой дефект, стратификация эпидермиса соответствует уровню интактной кожи, но сохраняется деформация кожных покровов.
Общее количество ТК повышается по сравнению со всеми группами данного экспериментального срока, но сохраняется уровень предыдущего экспериментального срока, определяемый в данной группе (рис. 6, рис. 8). Индекс дегрануляции ТК понижается, достоверно превышая контрольные значения, и составляет 49,1% (рис. 5).
Заключение. Сопоставление описанных морфологических изменений в области раны с морфофункциональными характеристиками тучных клеток этой зоны позволяет констатировать, что с первых суток после нанесения раны отмечается процесс дегрануляции тучных клеток. Наибольшая выраженность данной реакции определяется в асептических ранах при селективном действии ОТПК, а также при комбинированном влиянии ГИС и ОТПК на гнойное течение раневого процесса. Применение метода ГИС, отличающегося высокой очищающей способностью, при асептическом течении раневого процесса, характеризующегося минимальным некротическим компонентом, нецелесообразно из-за повышенной травматизации тканей. В гнойных ранах применение ГИС позволяет купировать интенсивную воспалительную реакцию и создать условия для пролиферативных процессов. ОТПК играет роль каркаса, обеспечивающего регенерацию и создающего условия для раскрытия репаративных способностей тканей. В ответ на применение ОТПК происходит активация процесса дегрануляции тучных клеток, регионально это создает предпосылки для стимуляции неоангиогенеза за счет выделения протеаз, гепарина. Это приводит к усилению образования грануляционной ткани, заполняющей дефект. При заживлении кожных ран процесс дегрануляции тучных клеток и изменение численной данной популяции следует рассматривать как составную часть компенсаторно-приспособительной реакции на повреждение.
Список литературы Особенности морфологической реакции тучных клеток при репаративной регенерации в коже под влиянием региональных факторов
- Пальцев М.А. Патологическая анатомия: в 3 кн./М.А. Пальцев, Н.М. Аничков. -Москва: Медицина, 2001. -Кн. 1. -527 с.
- Патогенез и гистоморфологические особенности рубцовых изменений кожи/О.В. Жукова //Клиническая дерматология и венерология, 2009. -Т. 3, № 4. С. 4-9.
- Быков В.Л. Секреторные механизмы и секреторные продукты тучных клеток/В.Л. Быков//Морфология. -1999. -Т. 115, № 2. -С. 64-72.
- Маянский Д.Н. Лекции по клинической патологии: руководство для врачей/Д.Н. Маянский. -Москва: ГЭОТАР-Медиа, 2008. -464 с.
- Mast cell involvement in normal human skin wound healing: expression of monocyte chemoattractant protein-1 is correlated with recruitment of mast cell which synthesize interleukin-4 in vivo/A. Trautmann //J. Pathol., 2000. -Vol. 190. -P. 100-106.
- Nathan C. Oxygen and the inflammatory cell/C. Nathan//Nature, 2003. -Vol. 422. -P. 675-676.
- Haynesworth S.E. Mitogenic stimulation of human mesenchymal stem cells by platelet release suggest a mechanism for enhancement of bone repair by platelet concentrates/S.E. Haynesworth //Presented at the 48th Meeting of the Orthopedic Research Society, Boston, MA. -2002.
- Liu Y. Fibroblast proliferation due to exposure to a platelet concentrate in vitro is pH dependent/Y. Liu //Wound Repair Regen., 2002. -Vol. 10. -P. 336-340.
- Sen C.K. Wound healing essentials: let there be oxygen/C.K. Sen//Wound Rep Reg., 2009. -Vol. 17. -P. 1-18.


