Особенности морфологии тимуса крыс при индуцировании рака молочной железы N-метил-N-нитрозомочевиной
Автор: Котелкина Анастасия Андреевна, Меркулова Лариса Михайловна, Стручко Глеб Юрьевич, Москвичев Евгений Васильевич, Кострова Ольга Юрьевна, Стоменская Ирина Станиславовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.28, 2020 года.
Бесплатный доступ
Иммунная система в целом занимает ведущее значение в формировании адекватного иммунного ответа при возникновении и развитии опухолей. Цель исследования - выявить особенности изменения морфологии и содержания биогенных аминов в тимусе крыс при экспериментальном канцерогенезе рака молочной железы путем введения N-метил-N-нитрозомочевины. В работе использованы люминесцентногистохимические, общегистологические и иммуногистохимические методы исследования, которые позволили получить важную информацию о функциональной активности клеточных элементов тимуса, количественном составе макрофагов, дендритных клеток, лимфоцитов и о качественной характеристике тучных клеток. Эксперимент выполнен на 85 белых нелинейных крысах-самках, которым вводили канцероген N-метил-N-нитрозомочевину, индуцирующий опухоль молочной железы. Животные были разделены на две группы: интактные (n=30) и крысы, которым вводили канцероген (n=45). Структуру тимуса исследовали через 1, 2 и 3 месяца после окончания инъекций. В ходе исследования отмечаются изменения морфометрических показателей органа. Через месяц после введения препарата увеличивается площадь мозгового и толщина коркового вещества, которые с увеличением срока исследования уменьшаются. Замещение паренхимы тимуса жировой и соединительной тканью начинается уже через 2 месяца и прогрессирует с увеличением срока исследования. Выявлена тенденция к волнообразным изменениям биогенных аминов, через 1 месяц наблюдается достоверный рост уровня гистамина и снижение серотонина и катехоламинов, через 2 месяца увеличение всех биогенных аминов, особенно гистамина (в 1,5 и более раз) в премедуллярных и тучных клетках, тимоцитах коркового вещества. Через 3 месяца, напротив, отмечается снижение гистамина и возрастание уровня моноаминов. Соотношение (серотонин+гистамин)/катехоламины через 1 месяц свидетельствует о снижении функциональной активности тимуса, а через 3 месяца - об ее увеличении. На всех сроках исследования преобладают дегранулированные формы тучных клеток. В динамике эксперимента выявлен рост числа дендритных клеток, лимфоцитов, и, вдвое числа макрофагов и Bcl-2+клеток. Полученные в ходе исследования данные позволили предположить, что введение №метил-№нитрозомочевины и последующее развитие опухоли молочной железы отражается на изменении морфофункционального состояния тимуса. При этом наибольшие изменения наблюдались через 2 месяца после окончания введения канцерогена еще до формирования опухоли молочной железы. Полученные данные могут иметь определенное значение при определении иммунного статуса в моделях экспериментального канцерогенеза.
Тимус, биогенные амины, экспериментальный канцерогенез, n-метил-n-нитрозомочевина
Короткий адрес: https://sciup.org/143177441
IDR: 143177441 | DOI: 10.20340/mv-mn.2020.28(2)55-63
Текст научной статьи Особенности морфологии тимуса крыс при индуцировании рака молочной железы N-метил-N-нитрозомочевиной
Котелкина А.А., Меркулова Л.М., Стручко Г.Ю., Москвичев Е.В., Кострова О.Ю., Стоменская И.С. Особенности морфологии тимуса крыс при индуцировании рака молочной железы n-метил-n-нитрозомочевиной// Морфологические ведомости.- 2020.- Том 28.- № 1.- С. 55-63. (2:55-63
Kotyolkina AA, Merkulova LM, Struchko GYu, Moskvichev EV, Kostrova OYu, Stomenskaya IS. Features of rat thymus morphology at the induction of the breast cancer by n-methyl-n-nitrosourea. Morfologicheskie Vedomosti – Morphological Newsletter. 2020; 28(1):55-63. (2):55-63
Введение . Механизмы развития злокачественных опухолей по-прежнему остаются актуальной проблемой экспериментальной и клинической онкологии [1-3]. Отдельным классом канцерогенных факторов следует рассматривать химические канцерогены [4-6]. Их воздействие исследуется преимущественно при экспериментальном канцерогенезе на моделях с лабораторными животными. Существенное значение в таких моделях уделяется детальному анализу процессов в иммунной системе животных. Риск развития злокачественной опухоли повышается при любом виде экзогенной химической иммуносупрессиии, а исход процесса напрямую зависит от состояния иммунитета [7-10]. Важным звеном в этих процессах является тимус, в котором дифференцировка Т-лимфоцитов происходит с участием биогенных аминов (гистамина, серотонина, катехоламинов. Уникальность тимуса заключается в том, что его структуры – тимические лимфоциты и эпителиальные клетки, а также выделяемые ими биогенные амины, непосредственно участвуют в обеспечении нейроэндокринных процессов [11]. Известно, что серотонин усиливает активность и взаимодействие клеток иммунной системы, их миграцию, а катехоламины активируют Т-хелперы и усиливают функциональную активность тучных клеток [12]. Гистамин, наоборот, угнетает фагоцитоз, усиливает цитотоксичность Т-клеток.
Цель исследования - выявить особенности динамики морфологических и имунногистохимических изменений тимуса крыс при экспериментальном канцерогенезе молочной железы на фоне введения N-метил-N-нитрозомочевины.
Материалы и методы исследования. Эксперименты выполнены на 85 белых нелинейных крысах-самках. Уход за животными, содержащимися в виварии, осуществлялся в соответствии с «Правилами проведения работ с использованием экспериментальных животных», с разрешения локального этического комитета Чувашского государственного университета имени И.Н. Ульянова (протокол 2/2 от 8 октября 2015 года). Крысы были разделены на две группы. Первая группа (n=30) – интактные животные. Вторая группа (n=45) – животные, которым проводили инъекции канцерогена N-метил-N-нитрозомочевины в молочную железу из расчета 2,5 мг 1 раз в неделю в течение 5 недель. Выведение животных из эксперимента проводилось через 1, 2 и 3 месяца после завершения курса инъекций под кетаминовым наркозом из расчета 4,4 мг/кг путем декапитации в соответствии с международными правилами проведения работ с экспериментальными животными [13]. Объект морфологического исследования был тимус. При взятии тимуса его массу выражали в мг на 100 г массы крысы. Были использованы следующие методы исследования: люминесцентно-гистохимический параформальдегидный метод Фалька-Хилларпа в модификации Крохиной [14] – для избирательного выявления серотонина и катехоламинов в тимусе; флуоресцентно-гистохимический ортофталево-альдегидный метод Кросса, Эвена, Роста [15] – для идентификации гистаминсодержащих структур тимуса; метод цитоспектрофлуориметрии – для количественной оценки уровней серотонина (далее - СТ), катехоламинов (далее - КА) и гистамина (далее - ГСТ). Измерения проводили с помощью насадки ФМЭЛ-1А, установленной на люминесцентный микроскоп ЛЮМАМ-4 при выходном напряжении 600 В. Для характеристики суммарно- направленного действия биогенных аминов вычислялось соотношение (СТ+ГСТ)/КА, свидетельствующее о функциональном состоянии клеточных элементов. Повышение этого соотношения косвенно свидетельствует о подавлении физиологической активности клеток, снижение соотношения - о ее стимуляции [12]. Уровень биогенных аминов выражался в условных единицах (у.е.). Препараты окрашенные гематоксилином и эозином подвергались последующей морфометрии на автоматизированном морфометрическом комплексе «Микро-Анализ». Тучноклеточную популяциию тимуса выявляли методом окраски полихромным толуидиновым синим по Унна для качественного и количественного определения. Тучные клетки подсчитывали в десяти полях зрения микроскопа при увеличении в 600 раз. Тучные клетки классифицировали на 4 типа в зависимости от степени дегрануляции: Т-0 — тучные клетки с плотно заполненными неразличимыми гранулами и ядром; Т-1 — клетки с отдельно идентифицируемыми гранулами и неполностью замаскированным гранулами ядром; Т-2 — формы клеток с отчетливо различимыми гранулами как внутри, так и вокруг клетки и видимым ядром; Т-3 — опустошенные клетки с единичными гранулами внутри и рассеянными гранулами за пределами клетки. Для определения отдельных популяций клеток использовали иммуногистохимический метод со следующими типами моноклональных (далее - МКАТ) и поликлональных (далее - ПКАТ) антител: МКАТ к кластеру дифференцировки лимфоцитов 68 типа (CD68), клон ED-1 (Abcam, Великобритания), МКАТ к Pan-cytoceratin, клон АЕ1/AE3 (NovoCastra, Великобритания) – для неселективного распознавания эпителиальных клеток долек тимуса и ПКАТ к кластеру дифференцировки лимфоцитов CD3, к белку S-100, Rtu (DAKO, Дания) -маркер клеток нейроэктодермального происхождения и незрелых дендритных клеток и к антиапоптотическому белку Bcl-2 (Santa Cruze, США).
Для проведения иммуногистохимического исследования тимус фиксировали 10% нейтральным забуференным формалином в течение 24 ч, выполняли стандартную спирт-ксилоловую проводку. Образцы органа заливали в парафин, готовили срезы толщиной 4 мкм, которые наносили на высокоадгезивные стекла и подвергали сушке при температуре 370С в течение 18 ч. Демаскировка и иммуногистохимическая окраска производилась с использованием системы визуализации NovoLink polymer. Для контроля иммуногистохимической реакции использовалась сыворотка интактных животных. Компьютерная оценку интенсивности мембранной иммуногистохимической реакции оценивали автоматическим выделением и подсчетом площади изучаемого цветового спектра по отношению к площади снимка в системе «Микро-Анализ». Расчет количества иммуноположительных клеток производили на 1 мм2. Для определения значимости межгрупповых различий переменных использовали критерий Стьюдента. Оценку различия проводили при уровне доверительной вероятности 95% (p<0,05).
Результаты исследования и обсуждение. По данным литературы использованный канцероген индуцирует рак молочной железы [16-17]. При морфологическом исследовании через 1 и 2 месяца после введения канцерогена структура молочной железы не отличается от таковой у животных интактной группы. Через 3 месяца в молочной железе отмечаются многочисленные солитарные, реже мультифокальные очаги пролиферации долек и протоков. В отдельных препаратах степень клеточной атипии характерна для не инвазивного рака in situ (рис. 1).
В гистологической картине тимуса интактных крыс визуализируется паренхима, разделенная соединительнотканными перегородками, дольки округлой или овальной формы, в которых различимо корковое и мозговое вещество. При люминесцентной микроскопии мозговое вещество долек обладает темно-зеленым свечением. Корковое вещество окружает мозговое, оно более светлое из-за высокого содержания биогенных аминов в его клеточных структурах. В тимусе располагаются люминесцирующие гранулярные клетки (далее - ЛГК), которые преимущественно занимают корковое вещество. Все ЛГК можно разделить на крупные ярко-желтого свечения клетки премедуллярной зоны, расположенные хаотично мелкие клетки с гранулами зелено-желтой люминесценцией – клетки субкапсулярной зоны. По периферии коркового вещества и в соединительно-ткан -
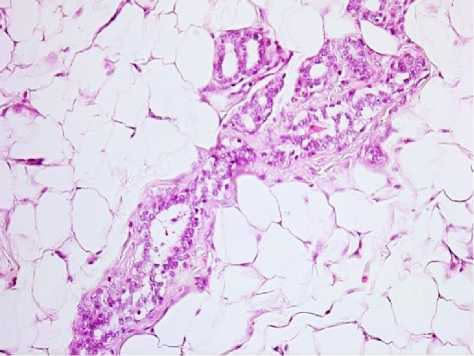
Рис. 1. Молочная железа крысы через 3 месяца после введения канцерогена. Окр.: гематоксилином-эозином. Ув.: х200.
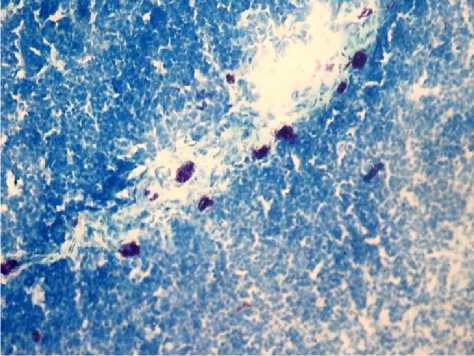
Рис. 2. Тучные клетки тимуса интактных животных. Окр.: метод Унна. Ув.: x400.
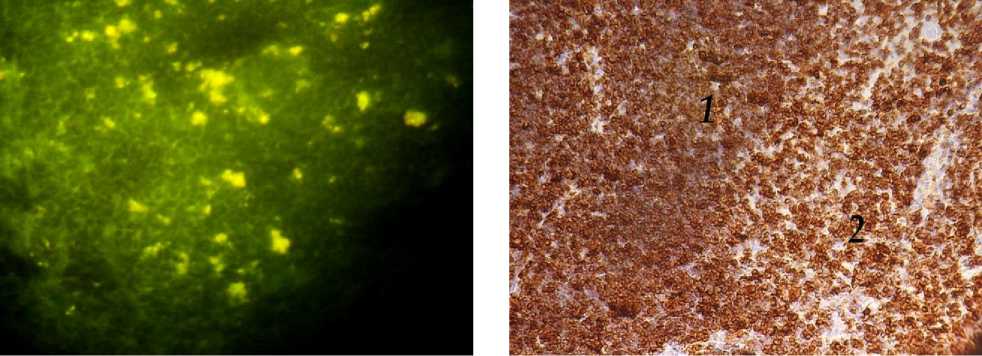
Рис. 3. Тимус крысы через 1 месяц после окончания введения канцерогена N-метил-N-нитрозомочевины. Окр.: метод Кросса. Ув.: х400.
Рис. 4. Тимус крысы через 1 месяц после окончания введения канцерогена N-метил-N-нитрозомочевины. CD3+-клетки в корковом (1) и мозговом веществе (2) дольки. Окр: иммуногистохимический метод. Ув.: х400.
ных перегородках определяются овальной формы тучные клетки с гранулами, обладающие беловато-желтым свечением.
На окрашенных гематоксилином и эозином срезах в дольках тимуса четко различимо светлое мозговое и темное корковое вещество. Тучные клетки на гистологических срезах располагаются преимущественно в междольковых септах, единичные клетки локализованы в корковом веществе. Среди этих клеток преобладают недегранулирующие и слабодегранулирующие формы (рис. 2). Клетки мозгового вещества и премедуллярной зоны у интактных животных дают позитивную реакцию на белок S-100. Помимо этого, в тимусе выявляются единичные макрофаги – CD68+. Среди всех популяций Т-лимфоцитов число CD3+- клеток в мозговом веществе составляет 35%, а в корковом веществе - 50%.
Через 1 месяц после введения канцерогена относительная масса тимуса по сравнению с животными интактной группы уменьшается в 1,6 раза. Площадь мозгового и толщина коркового вещества увеличивается в 3 и 2 раза, соответственно, за счет замещения паренхимы жировой тканью. Количество люминесцирующих гранулярных клеток возрастает в 1,5 раза (рис. 3). Начинает изменяться уровень биогенных аминов. Так, уровень серотонина в клетках премедуллярной зоны достоверно снижается в 2,3 раза. Содержание гистамина, напротив, увеличивается в 1,3 раза. Соотношение (СТ+ГСТ)/КА в клетках субкапсулярной зоны возрастает в 1,4 раза, а в тимоцитах коркового и мозгового вещества -почти в 2 раза, что по данным литературы свидетельствует об угнетении функциональной активности клеточных элементов органа [12]. Отмечается незначительное увеличение количества тучных клеток, среди которых преобладают дегранулированные и полностью опустошенные клетки. Дендритные клетки мозгового вещества и премедуллярной зоны дают позитивную реакцию на белок S-100. Их количество снижается в мозговом веществе в 2 раза, в кортико-медуллярной зоне – в 3 раза по сравнению с интактной группой. Количество CD68+-макрофагов снижается в зоне коркового и мозгового вещества в 4,5 и в 3,6 раза, соответственно. Число Bcl-2+ клеток достоверно снижается в мозговом веществе в 1,8 раза. Количество CD3-позитивных лимфоцитов достоверно увеличивается в 1,5 раза в корковом веществе дольки (рис. 4).
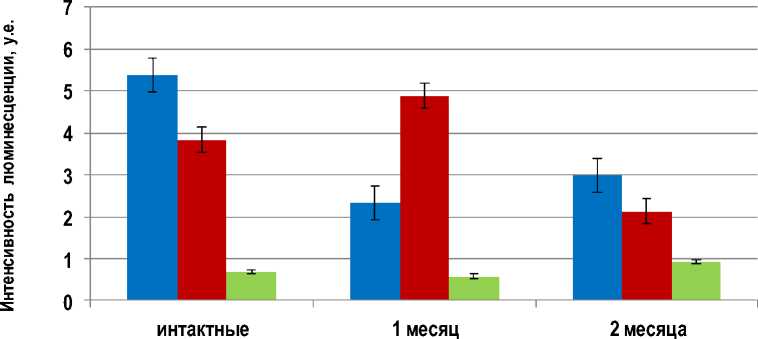
Через 2 месяца площадь мозгового вещества практически не изменяется, толщина коркового вещества начинает уменьшаться в 1,6 раза, визуализируются единичные участки, заполненные жировой и соединительной тканью (рис. 5). Рост уровня гистамина отмечается в премедул-лярных клетках, в тимоцитах коркового вещества и в тучных клетках в 1,5 и более раз. Уровень катехоламинов и серотонина также возрастает (рис. 6). Соотношение (СТ+ГСТ)/КА в разных структурах тимуса изменяется неоднозначно. При обработке полихромным толуидиновым синим больше
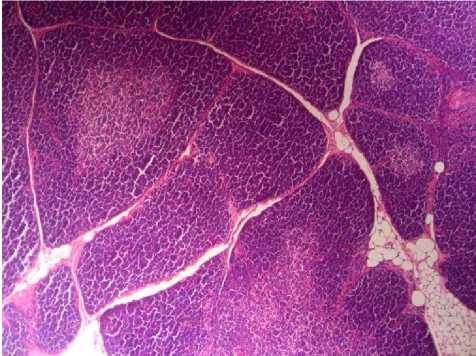
Рис. 5. Тимус крысы через 2 месяца после введения канцерогена. Уменьшение толщины коркового вещества, единичные включения жировых клеток в междольковых промежутках. Окр: гематоксилином-эозином. Ув.: x100.
половины всех
клеток
составляют
дегранулированные и полностью опустошенные формы, индекс дегрануляции возрастает в 2 раза по сравнению с интактными животными.
Иммуногистохимически отмечается возрастание количества Bcl-2+-клеток: в корковом веществе в 7 раз, а в мозговом - в 3 раза по сравнению с предыдущим сроком. С увеличением срока исследования количество S-100+-клеток по всему веществу дольки увеличивается, наиболее достоверно в мозговом веществе - в 1,7 раза, однако не достигает показателей интактных крыс. Нарастает число макрофагальных клеток, их количество увеличивается в мозговом веществе в 5 раз, а в корковом - в 2,7 раза и число Pan-cytokeratin+- клеток по всей дольке.
Через 3 месяца масса тимуса в динамике увеличивается на 7% по сравнению с предыдущим сроком, но не достигает исходных цифр. Достоверно уменьшается площадь мозгового вещества в 1,6 раз, а толщина коркового вещества приближается к данным предыдущей группы. В тимусе при исследовании содержания биогенных аминов в клетках премедуллярной зоны и субкапсулярных клетках выявляется повышение уровня серотонина (в 2,2 и 1,6 раза, соответственно) и катехоламинов (в 1,6 и в 2 раза, соответственно). Уровень гистамина снижается в премедуллярных клетках, Т-клетках коркового и мозгового вещества. Снижение соотношения (СТ+ГСТ)/КА в премедуллярных клетках и клетках субкапсулярной зоны происходит в 1,5 раза, тимоцитах коркового вещества - в 2 раза, что свидетельствует об увеличении функциональной активности клеточных элементов. По общему количеству тучных клеток на этом сроке исследования достоверных отличий от интактных крыс нет. При этом вновь преобладают дегранулированные и полностью опустошенные формы тучных клеток (рис. 7).
-
■ СТ
-
■ ГСТ
-
■ КА
Рис. 6. Интенсивность люминесценции биогенных аминов в условных единицах в
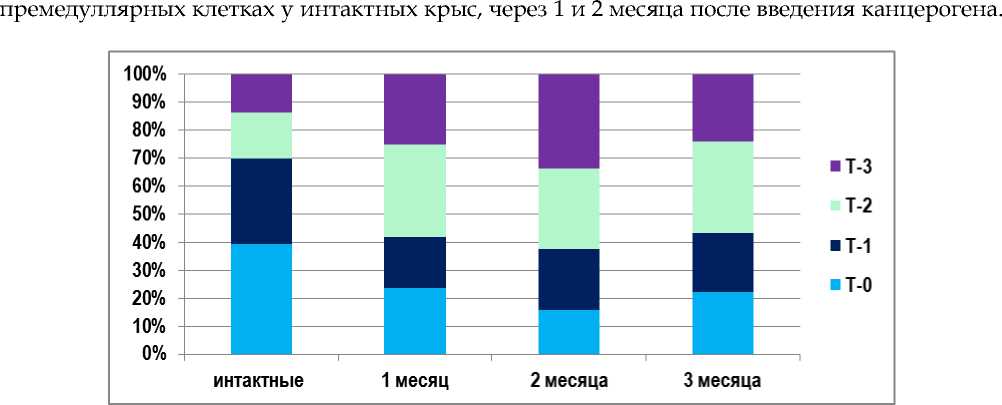
Рис. 7. Процентное содержание тучных клеток по степени дегрануляции у интактных крыс, через 1, 2 и 3 месяца после введения канцерогена.
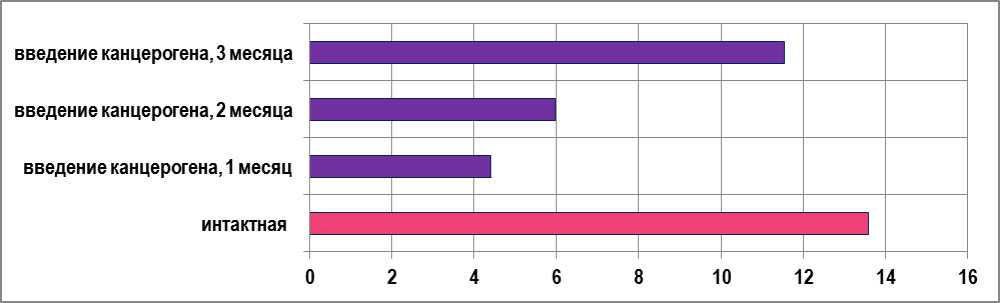
Рис. 8. Экспрессия S-100 в кортико-медуллярной зоне у интактных крыс и после введения канцерогена в условных единицах.
Иммуногистохимическое исследование показало, что количество CD3-позитивных клеток в динамике начинает возрастать в дольках тимуса в 1,3 раза, в 2 раза увеличивается число макрофагов в корковом веществе. S-100+-клетки по мере увеличения срока исследования продолжают возрастать, их число увеличивается вдвое (рис. 8). Отмечено достоверное снижение в 2 раза Bcl-2+-клеток в мозговом и корковом веществе дольки. В мозговом веществе число Pan-cytokeratin+-клеток превышает в 6 раз. Можно предположить, что это связанно с напряженностью иммунного ответа.
Таким образом, на фоне развития опухоли молочной железы, индуцируемой введением N-метил-N-нитрозомочевины, наблюдается увеличение выброса гистамина уже на ранних сроках исследования. На позднем сроке, через 3 месяца уровень гистамина, напротив, начинает снижаться, при этом возрастают показатели серотонина и катехоламинов и все это сопровождается увеличением функциональной активности клеточных элементов на фоне развивающихся признаков акцидентальной инволюции. В нашем эксперименте именно через 3 месяца зафиксировано развитие опухоли молочной железы, что возможно послужило пусковым механизмом для активации защитных свойств иммунной системы. Дегрануляция тучных клеток, наблюдаемая в эксперименте, сопровождается выбросом биогенных аминов, что оказывает непосредственное влияние на процесс акцидентальной инволюции органа [18].
На фоне развивающихся изменений цитоархитектоники тимуса с признаками акцидентальной трансформации в динамике наблюдались волнообразные изменения количества CD3+-клеток: увеличение их числа через 1 и 3 месяца и снижение через 2 месяца после выведения крыс из эксперимента. Т-лимфоциты, мигрировавшие из тимуса, участвуют на периферии в образовании противоопухолевой защиты. Наблюдаемая недостаточная миграция Т-клеток, возможно, оказывает влияние на стимуляцию роста опухоли, что подтверждено морфологическим исследованием [19]. Можно предположить, что достоверное снижение Bcl-2+-клеток вероятнее всего указывает на уменьшение интенсивности процессов апоптоза.
Дендритные клетки способны секретировать иммунорегулирующие факторы и биогенные амины и являются посредниками во взаимодействии между иммунной и эндокринной системами, а также выступают в качестве антигенпрезентирующих клеток [2021]. В тимусе дендритные клетки участвуют в процессах позитивной и негативной селекции. Наблюдаемое на раннем сроке достоверное снижение числа дендритных клеток в тимусе может быть связано с перераспределением клеток тимуса, а на более поздних сроках -следствием их миграции в место локализации патологического процесса [20-21]. Также отмечается постепенное возрастание числа дендритных клеток в динамике. По данным литературы известно, что увеличение количества дендритных клеток может быть связано с активацией антигенной стимуляции, связанной с процессом опухолевого роста [22]. В эксперименте было выявлено увеличение числа макрофагов, которые по данным литературы участвуют в созревании Т-лимфоцитов, а также регулируют межклеточные взаимодействия и реакции клеток на патогенные компоненты [23].
Нитрозосоединения (нитрозоэтилмочевина, нитрозометилмочевина и другие) относятся к прямым канцерогенам. Их токсическое действие на организм наступает без предварительного метаболического преобразования [24]. Кроме того, показано, что N-нитрозамины – это группа высокоактивных канцерогенов с мощным эмбриотоксическим и органоспецифическим действием [25], а N-метил-N-нитрозомочевина оказывает выраженный токсический эффект на гемопоэз, лимфоидную ткань. Ее введение у большинства крыс приводит к росту гормонозависимой опухоли молочной железы [15, 26], злокачественной эпителиальной опухоли прямой кишки [27], опухолей почек, нервной системы и крови [28]. Часть наблюдаемых в эксперименте эффектов, возможно, была вызвана прямым воздействием этого канцерогена на клетки тимуса.
Заключение. Таким образом, наиболее выраженные изменения в тимусе при экспериментальном канцерогенезе, вызванном введением N-метил-N-нитрозомочевина в ткань молочной железы крыс, наблюдаются через 2 месяца после окончания введения канцерогена, до видимых морфологических изменений в молочной железе. В целом, можно сделать вывод о том, что введение N-метил-N-нитрозомочевины и последующее развитие опухоли молочной железы отражается на морфофункциональном состоянии тимуса и уровне содержания в нем биогенных аминов.
Список литературы Особенности морфологии тимуса крыс при индуцировании рака молочной железы N-метил-N-нитрозомочевиной
- Tjuljandin S.A., Zhukov N.V. Pravda o rossijskoj onkologii: problemy i vozmozhnye reshenija, pod redakciej.: M.: Obshherossijskaja obshhestvennaja organizacija «Rossijskoe obshhestvo klinicheskoj onkologii», 2018. 28s.
- Grinevich V.N., Kudajbergenova A.G., Sencova E.Ju. Rak molochnoj zhelezy - geterogennoe zabolevanie Onkopatologija. 2018;1(2):39-43.
- Nazliev D.K., Sudakov D.V., Belov E.V., Shevcov A.N., Tishinov E.N. Vybor implanta molochnoj zhelezy posle provedennoj radikal'noj operacij pri rake molochnoj zhelezy. Central'nyj nauchnyj vestnik. 2018;3(22):7-9.
- Fedorov V.Je., Chebukaeva M.Ju. Rasprostranennost' i faktory riska raka molochnoj zhelezy. Fundamental'nye issledovanija. 2015;1:414-419.
- Shirokova I. Rak molochnoj zhelezy: vzgljad jekspertov. Zhurnal o rossijskom rynke lekarstv i medicinskoj tehniki. 2016;10:53-58.
- Schiller JT, Lowy DR. Virus infection and human cancer: an overview. Recent Results Cancer Res. 2014;193:1-10.
- Penn I, Starzl TE. Immunosuppression and cancer. Transplant Proc. 1973;5(1):943
- I.I. Andrejashkina, V.N. Plohov. Izmenenie kletochnogo zvena immuniteta u bol'nyh s rakom molochnoj zhelezy s metastazami v legkie. Medicinskaja immunologija. 2011;13(4-5):446.
- Tilljashajhov M.N., Kamyshov S.V. Osobennosti kletochnogo statusa immuniteta u bol'nyh rakom shejki matki. European Science. 2018;5(37):75-80.
- Parahonskij A.P. Mehanizmy povyshenija jeffektivnosti protivoopuholevogo immuniteta. V mire nauchnyh otkrytij. Materialy XVI Mezhdunarodnoj nauchno-prakticheskoj konferencii: sbornik nauchnyh trudov. Izd-vo «Centr nauchnoj mysli», 2015; 21-26.
- Pal'cev, M.A., Kvetnoj, I.M. Rukovodstvo po nejroimmunojendokrinologii. M.:Medicina, 2006; 384.
- European convention for the protection of vertebrate animals used for experimental and other scientific purpose: Council of Europe 18.03.1986. Strasbourg, 1986. 52c.
- Krohina E.M., Aleksandrov P.N. Simpaticheskij (adrenergicheskij) komponent jeffektornoj innervacii serdechnoj myshcy. Kardiologija. 1969;3:97-102.
- Cross SAM, Ewen SWB, Rost EWD. A study of the methods owailable for the cytochemical Fnflammatory of histamine by fluorescence induced with o-phthalaldehyde or acetaldehyde. J Histochem. 1971;6:471-476.
- Struchko G.Ju., Merkulova L.M., Drandrova E.G., Kostrova O.Ju., Kotelkina A.A. Tuchnokletochnaja populjacija timusa pri kancerogeneze patomstva samok so vtorichnym immunodeficitom. Vestnik novyh medicinskih tehnologij. 2018;25(4):199-206.
- Chochieva, A.R. Ingibirujushhij jeffekt limonena v otnoshenii razvitija opuholej molochnoj zhelezy, inducirovannyh N-metil-N-nitrozomochevinoj u krys. Sovremennye naukoemkie tehnologii. 2006;6:80-81.
- Bojková B, Kajo K, Kubatka P, Solár P, Pés M, Adamkov M. Metformin and melatonin improve histopathological outcome of NMU-induced mammary tumors in rats. Pathol Res Pract. 2019; 215(4):722-729 https://doi.org/s://doi:10.1016/j.prp.2019.01.007
- Simbircev A.S., Totoljan A.A. Citokiny v laboratornoj diagnostike Klinicheskaja laboratornaja diagnostika: nacional'noe Rukovodstvo, pod red. V.V. Dolgova, V.V. Men'shikova. M.: GOJeTAR-Media, 2012. C. 193-229.
- Clarke SL, Betts GJ, Plant A, et al. SD4+CD25+FOXP3+ regulatory T cells suppress anti-tumor immune responses in patients with colorectal cancer PLoS One. 2006;27(1):129.
- Nikipelova E.A., Kit O.I., Shaposhnikov A.V., Zlatnik E.Ju., Novikova I.A Kolokancerogenez: onkoimmunologija lokal'nyh izmenenij. Zlokachestvennye opuholi. 2016;4:81-86.
- Pages F, Galon J, Dieu Nosjean MC, Tartour E, Saut s-Fridman C, Fridman WH. Immune infiltration in human tumors: a prognostic factor that should not be ignored. Oncogene. 2010;29:1093-1102. https://doi.org/10.1038/onc.2009.416.
- Drandrova E.G., Struchko G.Ju., Merkulova L.M., Moskvichev E.V. Morfologija timusa pri jeksperimental'nom kancerogeneze potomstva samok s vtorichnym immunodeficitom. Cheboksary: Izd-vo Chuvash. un-ta. 2018. 140s.
- Kashhenko S.A. Zaharov A.A. Sovremennye predstavlenija o stroenii timusa. Perspektivy medicini ta biologii. 2010;2(1):22-32.
- Hismatullina, Z.N. Osobennosti jetapov himicheskogo, fizicheskogo i virusnogo kancerogeneza. Vestnik Kazanskogo tehnologicheskogo universiteta. 2013;7. URL:https://cyberleninka.ru/article/n/osobennosti-etapov-himicheskogo-fizicheskogo-i-virusnogo-kantserogeneza.
- Osipenko B.G. Poljakova L.O. Nitrozodimetilamin (NDMA) - gepatotropnyj jad i kancerogen: toksikologo-gigienicheskie aspekty ego biologicheskogo dejstvija (soobshhenie 1). Sibirskij medicinskij zhurnal. 2005;4:5-9.
- Lykov A.P. Bondarenko N.A., Poveshhenko O.V., Kabakov A.V., Rajter T.V., Kazakov O.V., Strunkin D.N., Poveshhenko A.F., Konenkov V.I. Sravnitel'nyj analiz soderzhanija v limfe gormonov, vovlechennyh v patogenez raka molochnoj zhelezy u krys linii Wistar. Sibirskij onkologicheskij zhurnal. 2015;1. URL: https://cyberleninka.ru/article/n/sravnitelnyy-analiz-soderzhaniya-v-limfe-gormonov-vovlechennyh-v-patogenez-raka-molochnoy-zhelezy-u-krys-linii-wistar.
- Isakova N.B., Starkova E.V. Bryzheechnye limfaticheskie uzly pri modelirovanii raka prjamoj kishki i v uslovijah himioterapii. Sibirskij onkologicheskij zhurnal. 2013;4:50-57.
- Bespalov V.G. Aleksandrov V.A. Vlijanie ryb'ego zhira na razvitie opuholej molochnoj zhelezy i tolstoj kishki, vyzyvaemyh metilnitrozmochevinoj v organah mishenjah u krys. Sibirskij onkologicheskij zhurnal. 2015;2:53-57.


