Особенности обмена кальция в кишечнике и костной ткани крыс при глюкокортикоид-индуцированном окислительном стрессе
Автор: Луканина С.Н., Сахаров А.В., Просенко А.Е., Аношина Н.А., Букреева Л.Н.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария
Статья в выпуске: 7, 2012 года.
Бесплатный доступ
Установлено, что в условиях глюкокортикоид-индуцированного окислительного стресса происходит нарушение транспорта Ca 2+ в тонком и толстом кишечнике крыс, а также снижение содержания данного катиона в костной ткани. Обнаруженные изменения в органах и тканях в значительной степени происходят под действием активных кислородных метаболитов.
Окислительный стресс, активные кислородные метаболиты, обмен ca 2+, кишечник, костная ткань
Короткий адрес: https://sciup.org/14082511
IDR: 14082511 | УДК: 59
Текст научной статьи Особенности обмена кальция в кишечнике и костной ткани крыс при глюкокортикоид-индуцированном окислительном стрессе
Кальций является одним из структурных компонентов костной ткани, играющих важную роль в процессе минерализации костного матрикса, механизмах мышечного сокращения и внутриклеточной передаче сигналов. В этой связи у позвоночных животных в процессе эволюции возникла сложная система, обеспечивающая поддержание постоянства концентрации Ca2+ в плазме крови [2]. Считается, что нарушение одного или нескольких звеньев этой системы, в том числе прямое повреждение клеток эпителия слизистой оболочки кишечника и нефроцитов почек глюкокортикоидами при стрессе приводит к развитию остеопороза [4, 7]. В публикациях, посвященных изучению механизмов развития остеопороза при стрессе, указывается на ингибирование глюкокортикоидами активности остеобластов и угнетение всасывания Ca2+ в кишечнике [1, 10]. Вместе с тем, в [6, 9] авторы отмечают важную роль свободнорадикальных процессов при повышенном содержании в крови глюкокортикоидов в развитии остеопороза. Значение свободнорадикальных механизмов в регуляции минерального обмена, процессов моделирования и ремоделирования костной ткани остается недостаточно изученным.
Целью настоящего исследования явилось изучение влияния глюкокортикоид-индуцированного окислительного стресса на особенности транспорта Ca2+ в кишечнике и его содержание в костной ткани крыс.
Материал и методы исследования. Исследование проведено на крысах-самцах линии Вистар весом 250–300 г. Животные содержались в условиях вивария без ограничения доступа к корму и воде. Все манипуляции с крысами осуществляли в соответствии с международными принципами Хельсинской декларации о гуманном отношении к животным и решением Этического комитета (протокол заседания № 7 от 2010 г.). В соответствии с дизайном эксперимента животные были распределены на 4 группы: интактная, контрольная и две опытные (по 15 особей в каждой). У крыс всех групп воспроизводили модель окислительного стресса путем внутрижелудочного введения один раз в сутки синтетического глюкокортикоида преднизолона в дозе 50 мг/кг веса, содержащиегося в 2 мл водопроводной воды, в течение 14 суток [3]. Через три часа после перорального введения преднизолона животные первой опытной группы внутрижелудочно получали водопроводную воду в объеме 0,2 мл, крысы второй опытной группы – антиоксидант тиофан (100 мг/кг веса), растворенный в 0,2 мл растительного масла. В связи с тем, что тиофан растворяли в растительном масле, крысам контрольной группы после приема преднизолона внутрижелудочно вводили только растительное масло в объеме 0,2 мл.
Особенности транспорта ионов Са2+ через структуры слизистой оболочки органов желудочнокишечного тракта (ЖКТ) крыс исследовали методом перфузии кишечника in vivo [12] на 15 сутки эксперимента. У крыс под эфирным наркозом производили ляпаротомию по белой линии живота и выделяли участки соответствующих отделов кишечника для перфузии. Подготовленный участок тощей кишки и дистального отдела толстого кишечника (ДОТК) перфузировали теплой минеральной водой «Ессентуки-17» с помощью микронасоса («Radelkis», Budapest) в течение 20 мин при скорости 15 мл/ч.
После перфузии кишечника у крыс всех групп прижизненно забирали пробы крови из нижней полой вены ех tempore , а затем выводили из эксперимента путем передозировки ингаляционного наркоза. Для изучения содержания Са2+ в костной ткани у животных всех групп забирали тела позвонков грудного отдела позвоночного столба.
Для оценки соотношения секреторных и абсорбционных процессов в кишечнике рассчитывали изменение содержания ионов Са2+ в перфузате на единицу массы высушенного образца перфузируемого участка тонкого кишечника и ДОТК. Расчет проводили по следующей формуле: ΔС Са 2+ = (ΔС*1000)/m, где ΔС Са 2+ – изменение содержания ионов (мкг/1 г с.в.); m – масса высушенного перфузируемого участка кишечника (мг), 1000 – переводной коэффициент; ΔС – разница в содержании ионов в перфузате и во вводимом растворе, рассчитываемая по формуле (C*[ Са2+])-(C 1 *[ Са2+] 1 ), где С и С 1 – объем перфузата и вводимого раствора (мл); [Са2+] и [Са2+] 1 – концентрация ионов кальция в перфузате и во вводимом растворе (мкг/мл).
В пробах перфузата, плазмы крови и костной ткани тел позвонков определяли содержание ионов Са2+ методом атомно-эмиссионного анализа с индуктивно связанной плазмой (спектрометр «OPTIMA», шифр методики КХА: МУК 4.1.1482-03).
Математическую обработку результатов осуществляли методами вариационной статистики. Достоверность отличий между показателями определяли с использованием t-критерия Стьюдента (р≤ 0,05).
Результаты исследования и их обсуждение. В сериях предшествующих экспериментальных исследований по изучению механизмов окислительного стресса [8, 11] нами было установлено, что в условиях хронической глюкокортикоидной нагрузки у крыс в плазме крови увеличивается по сравнению с контролем уровень свободнорадикального перекисного окисления липидов (СПОЛ) и отмечается депрессия системы антиоксидантной защиты. Использование антиоксиданта тиофана приводило к статистически достоверному снижению показателей окислительного стресса в образцах крови, гомогенатах тканей кишечника, а также коррекции структурно-функциональных нарушений костной ткани у экспериментальных животных. Полученные результаты явились основанием считать повышение активности свободнорадикальных процессов в организме лабораторных животных одним из важных механизмов в повреждении клеток слизистой оболочки кишечника и нарушении транспорта Са2+ в его соответствующих отделах. Для доказательства влияния активных кислородных метаболитов (АКМ) на функциональную активность тонкого и дистального отдела толстого кишечника крыс при моделировании глюкокортикоид-индуцированного окислительного стресса (ОС) исследовали особенности транспорта Са2+ в данных отделах кишечника. Возможность управления свободнорадикальными процессами в организме животных оценивали при сочетанном использовании в данной модели остеопороза антиоксиданта тиофана.
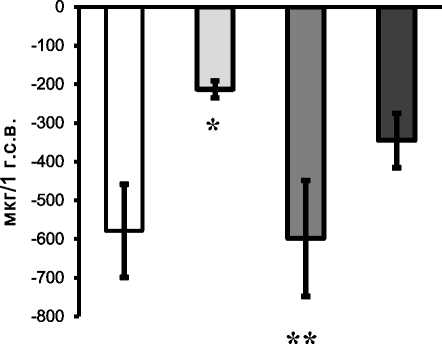
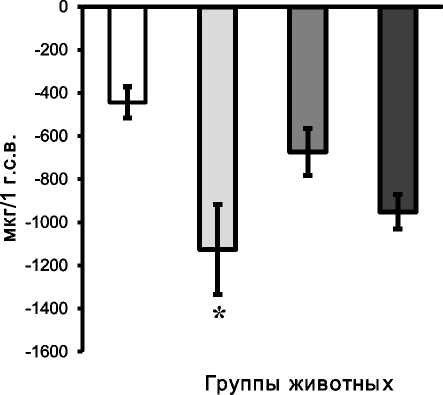
Анализ полученных результатов показал, что у крыс всех групп в тонком и толстом кишечнике транспорт Са2+ осуществляется преимущественно за счет его абсорбции (рис. 1 а, б). Согласно полученным результатам, абсорбция данного катиона в тонком отделе кишечника крыс интакной группы преобладает по сравнению с толстым на 24,5%. В группе животных с моделью остеопороза интенсивность абсорбции Са2+ в тонком кишечнике крыс к 14 суткам наблюдения снижается в 2,7 раза, а в ДОТК абсорбция этого катиона превышает значения крыс интактной группы в 2,5 раза. Схожая закономерность в отношении транспорта Са2+ в обоих отделах кишечника наблюдается и у крыс контрольной группы. Известно, что тонкий отдел кишечника является основным компартментом желудочно-кишечного тракта, обеспечивающим поступление Са2+ в организм за счет активного транспорта. Обнаруженное нами снижение интенсивности абсорбции этого катиона в данном отделе кишечника при глюкокортикоидной нагрузке согласуется с литературными данными [5, 13, 14] и связывается авторами не с прямым действием глюкокортикоидов на эпителиоциты кишечника, а опосредованно через механизм повреждения специфических транспортных систем плазматической мембраны энтероцитов активными кислородными метаболитами (АКМ). Считается, что всасывание
Са2+ в толстом кишечнике осуществляется главным образом пассивно, через специализированные белковые каналы. Перераспределение функций между тонким и толстым кишечником в отношении транспорта Са2+ при глюкокортикоид-индуцированном ОС, а именно более, чем двукратным повышением интенсивности его абсорбции в толстом отделе, с нашей точки зрения, может объясняться более выраженным повреждением данного отдела кишечника АКМ. Как известно, процесс пищеварения сопровождается окислением органических соединений, в том числе с участием АКМ. В этой связи участие энтероцитов в ограничении СПОЛ за счет активации собственных антиоксидантных систем является необходимым условием их функционирования и защиты от летального повреждения. Толстый отдел кишечника эволюционно не приспособлен к пищеварению. В этой связи можно полагать, что адаптационные возможности колоноцитов к действию АКМ уступают энтероцитам, что определяет их более низкую устойчивость к повреждениям при ОС. В связи с тем, что толстый кишечник не является основным участком всасывания Са2+, его избыточное поступление является неадекватным для клеток и может запускать механизм активации Ca-зависимых протео- и липолитических процессов в клетке. Считается, что повышение активности деградации белков и липидов в клетке сопровождается повышением уровня СПОЛ и в условиях снижения активности системы антиоксидантной защиты приводит к свободнорадикальному повреждению колоноцитов.
Использование антиоксиданта тиофана для оптимизации СПОЛ при глюкокортикоид-индуцированном ОС позволило увеличить уровень абсорбции Са2+ в тонком кишечнике и, как следствие, снизить на 64,4% содержание данного катиона в перфузате по сравнению с аналогичными показателями крыс первой опытной группы (рис. 1, а). При анализе проб перфузата толстого кишечника установлено снижение уровня абсорбции Са2+ по сравнению с образцами крыс первой опытной группы на 40,1% (рис. 1, б). Отсутствие достоверных различий по содержанию Са2+ в перфузате крыс второй опытной и интактной групп доказывает преобладание свободнорадикального механизма повреждения клеток слизистой оболочки желудочно-кишечного тракта по сравнению с прямым действием глюкокортикоидов. Полученые результаты позволяют считать обоснованным использование антиоксиданта тиофана для коррекции нарушений транспорта Са2+ в кишечнике крыс при ОС.
Интактная 1 опытная 2 опытная Контрольная
Группы животных
Интактная 1 опытная 2 опытная Контрольная
а
б
Рис. 1. Содержание Са2+ в перфузате тонкого (А) и толстого (Б) кишечника, мкг/1г с.в.: * отличие показателей крыс 1-й опытной группы от значений интактных крыс;
** различия показателей животных 1-й и 2-й опытных групп (р < 0,05)
В соответствии с классическими представлениями физиологии, транспорт элементов в организм из ЖКТ осуществляется преимущественно через кровь. В этой связи нарушение абсорбции Са2+ в кишечнике крыс 1-й опытной группы и оптимизация данного процесса под влиянием антиоксиданта тиофана должны подтверждаться анализом содержания Са2+ в плазме крови животных исследуемых групп. При исследовании содержания Са2+ в плазме крови, полученной из русла нижней полой вены животных 1-й опытной группы, его содержание было на 11,2% ниже аналогичного значения у крыс интактной группы (рис. 2). У животных 2-й опытной группы, с моделью ОС и получавших антиоксидант тиофан, содержание Са2+ в плазме крови приближалось к значениям крыс интактной группы.
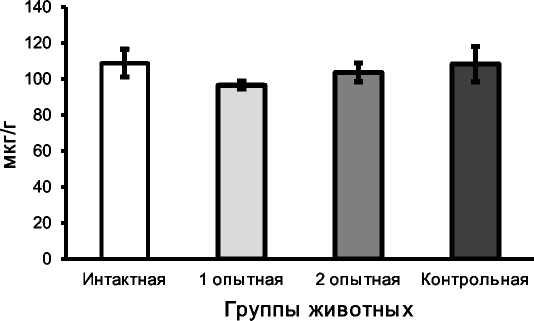
Рис. 2. Содержание Са2+ в плазме крови из русла нижней полой вены, мкг/г
Как известно, поддержание постоянства уровня Са2+ в плазме крови обеспечивается многоуровневой системой регуляции, допускающей лишь кратковременные и незначительные изменения данного показателя. Выявленные отличия между животными интактной и первой опытной группы по содержанию Са2+ в плазме крови могут свидетельствовать о глубоких структурных и функциональных нарушениях в органах обеспечения кальциевого гомеостаза. Подтверждение или опровержение данного заключения может быть основано на определении содержания Са2+ в костной ткани животных исследуемых групп.
При анализе содержания Са2+ в костной ткани грудных позвонков у животных обеих опытных и контрольной групп было установлено, что распределение данного катиона в образцах кости крыс исследуемых групп имеет статистически достоверно низкий показатель по сравнению с костной тканью интактных крыс (рис. 3). Известно, что в условиях нарушения абсорбции Са2+ в кишечнике обеспечение поддержания кальциевого гомеостаза должно осуществляться по механизму обратной связи за счет усиления резорбции костной ткани и транспорта катиона в общий кровоток.
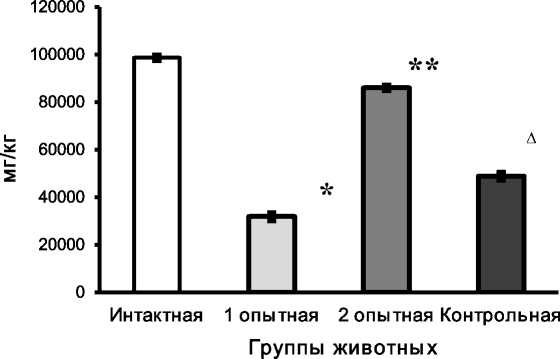
Рис. 3. Содержание Са2+ в костной ткани грудного позвонка, мг/кг:
отличие показателей крыс 1-й опытной группы от значений интактных крыс; ** различия показателей животных 1-й и 2-й опытных групп; А различия показателей животных 1-й опытной и контрольной групп (р<0,05)
Данные атомно-эмиссионнного анализа позволили выявить статистически достоверное превышение содержания Са2+ в костной ткани у животных 2-й опытной группы, по сравнению с крысами 1-й опытной и контрольной групп (в 2,7 и 1,8 раз соответственно). Объяснение полученных результатов исследования может основываться на реализации антиоксидантом тиофаном в условиях ОС своих специфических свойств в отношении структур плазматической мембраны эпителиальных клеток кишечника, ответственных за абсорбцию Са2+ в кишечнике.
В соотвествии с законом о единстве структуры и функции, изменение уровня абсорбции Са2+ в кишечнике и снижение его содержания в плазме крови животных всех групп безусловно должно сопровождаеться изменением параметров моделирования и ремоделирования костной ткани. По данным литературных источников, морфологическим отражением данных процессов является формирование различных форм остеопатий.
Таким образом, результаты исследования особенностей транспорта Са2+ в кишечнике крыс всех исследуемых групп и его распределения в плазме крови и костной ткани животных всех групп позволяют вполне обоснованно заключить, что в условиях глюкокортикоид-индуцированного ОС происходит нарушение транспорта Са2+ в тонком и толстом отделах кишечника. Доказательством преимущественного повреждения АКМ клеток эпителия кишечника является коррекция антиоксидантом тиофаном уровня абсорбции данного катиона в кишечнике и его содержания в костной ткани.


