Особенности органотопической перестройки костной ткани и имплантируемого костнопластического материала при нейроостеоартропатии Шарко
Автор: Оснач С.А., Процко В.Г., Кузнецов В.В., Оболенский В.Н., Тамоев С.К., Хамидуллина Ю.В., Борзунов Д.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.29, 2023 года.
Бесплатный доступ
Введение. Несмотря на признание МРТ как диагностического «золотого стандарта» при артропатии Шарко, в литературе имеются сведения о большей информативности МСКТ для объективной качественной и количественной диагностики состояния, в первую очередь, костного остова стопы Шарко в сравнении со стандартной рентгенографией. Чувствительность и специфичность указанных методов различны.Цель. Выявить особенности органотопической перестройки костной ткани и имплантируемого костнопластического материала при замещении субтотальных дефектов среднего и заднего отделов стопы при нейроостеоартропатии Шарко.Материалы и методы. Проведен анализ плотности костной ткани и имплантируемого костнопластического материала в серии наблюдений - 11 пациентов с нейроостеоартропатией Шарко, перенесших двухэтапную методику замещения костных дефектов заднего и среднего отделов стопы с фиксацией аппаратом Илизарова. Изучали КТ- и МРТ-томограммы с измерением плотности костного регенерата до лечения, на этапах чрескостного остеосинтеза и через 3, 6 и 12 месяцев после оперативного вмешательства.Результаты. У всех пациентов в разной степени визуализировали увеличение количества и объема костной ткани за счет интенсивного периостального костеобразования, а также формирование костных анкилозов в сочленениях с последовательным увеличением оптической плотности костных регенератов. Формирование новообразованной костной ткани проходило без признаков лизиса и секвестрирования. Проведенные исследования свидетельствуют о том, что размеры и архитектоника костных фрагментов более оптимально дифференцируются на КТ, чем на МРТ.Обсуждение. Известно, что кость, несмотря на высокую степень минерализации, непрерывно перестраивается, восстанавливается и адаптируется к определенным функциональным условиям. Этот постоянный динамический процесс адаптивной перестройки зависит, главным образом, от оптимального кровоснабжения, метаболической активности и скоординированной работы костных клеточных элементов. Полученные данные свидетельствуют о наличии ангиогенеза в скомпрометированных тканях у пациентов со стопой Шарко и последовательном ремоделировании трансплантата в новообразованную костную ткань.Заключение. Наличие аллокости в составе комбинированного костного трансплантата не снижает вероятность полного ремоделирования новообразованной костной ткани. Возможность создания большей денситометрической плотности при заполнении костного дефекта трансплантатом является отличием от дистракционных регенератов с изначально низкой денситометрической плотностью. До выполнения оперативного лечения высокоэффективными и информативными методами диагностики являются КТ и МРТ. При реконструктивных вмешательствах у пациентов со стопой Шарко в условиях чрескостного остеосинтеза предпочтение в выборе лучевых методов исследования необходимо отдавать компьютерной томографии.
Стопа шарко, костная пластика, перестройка регенерата, лучевые исследования
Короткий адрес: https://sciup.org/142239017
IDR: 142239017 | УДК: 617.586-007.248-089.844-073.756.8 | DOI: 10.18019/1028-4427-2023-29-4-395-401
Текст научной статьи Особенности органотопической перестройки костной ткани и имплантируемого костнопластического материала при нейроостеоартропатии Шарко
УДК 617.586-007.248-089.844-073.756.8
Одним из проблемных осложнений сахарного диабета является синдром диабетической стопы, который включает многокомпонентный патологический симпто-мокомплекс: периферические изменения иннервации, артериального и микроциркуляторного русла, деструкцию костно-суставного аппарата стопы с рисками развития гнойно-некротических процессов. По данным литературы, при сахарном диабете 1 типа нейропатическая стопа Шарко встречается в 17,9 %, при диабете 2 типа в 7,4 % клинических наблюдений [1]. Достаточно невысокая распространенность в структуре сахарного диабета стопы Шарко, несмотря на тяжесть патологии, объясняет наличие немногочисленных публикаций, основанных на достаточно небольшом количестве наблюдений и исследований. В литературе имеются публикации о важности дооперационных гистологических исследований деструктивных изменений хряща и костных структур при синдроме диабетической стопы (СДС) для планирования реконструктивных вмешательств на стопе, базирующихся на немногочисленных морфологических исследованиях, что, вероятно, основано на организационных ограничениях прижизненных исследований и их инвазивностью [2, 3]. В настоящее время в диагностике костной патологии, в основном на этапах дооперацион-ного планирования, при синдроме диабетической стопы (СДС) и диабетической остеоартропатии помимо традиционной рентгенографии (РГ) используется компьютерная томография (КТ) и магнитно-резонансная томография (МРТ). В международных (IWGDF Guidelines on the prevention and management of diabetic foot disease, 2019) и отечественных клинических рекомендациях МРТ признана диагностическим «золотым стандартом» [4]. Существуют классификации синдрома диабетической стопы, основанные на данных МРТ с оценкой наличия отека костного мозга в режиме жироподавления [5], что имеет определенные преимущества как метод, способный визуализировать костные и мягкотканные структуры стопы при отсутствии ионизирующего излучения [6].
Вместе с тем, в литературе имеются сведения о большей информативности МСКТ для объективной качественной и количественной диагностики состояния, в первую очередь, костного остова стопы Шарко в сравнении со стандартной рентгенографией [7].
КТ позволяет оценить не только структурные изменения костной ткани и кортикального слоя, но и выявить наличие свободнолежащих костных фрагментов и секвестров, визуализировать положение фрагментов [8, 9], а также выполнить 3D-реконструкцию для объёмного представления анатомических особенностей патологического процесса [10].
Однофотонная позитронно-эмиссионная компьютерная томография (ПЭТ-КТ) значительно повышает качество изображения при сканировании костей и точность диагностики артропатии Шарко даже при рент-ген-негативной стадии (1 стадии по классификации Eichenholtz [11]), позволяя определять степень и тяжесть поражения костных структур [12], анатомическую локализацию. Высокая достоверность ПЭТ-КТ позволяет более точно провести дифференцированную диагностику между острой стадией артропатии и остеомиелитом [13].
Любой диагностический поиск начинается с рентгенографии (РГ) стопы в стандартных проекциях. КТ имеет ряд преимуществ перед РГ, сопровождается большей лучевой нагрузкой. МРТ лишена данного недостатка, более информативна на ранних стадиях развития остеоартропатии, однако интерпретация данных и дифференциальная диагностика бывает затруднена. Ряд авторов отмечает высокую частоту ложноположительных результатов в диагностике инфекционных и асептических воспалительных процессов при диабетической стопе [14-20].
Чувствительность и специфичность указанных методов различна. Наибольшая чувствительность регистрируется при компьютерной томографии с 3D-моделированием и контрастным усилением (> 90 %) и магнитно-резонансной томографии (89-100 %). Наиболее высокая специфичность выявляется также при этих методах исследования (соответственно – > 90 % и 81-100 %) [20].
При проведении костно-пластических операций на стопе Шарко лучевой контроль должен не только оценить геометрию костных структур и наличие деструктивных процессов, но и зрелость костного регенерата.
С целью оценки состояния костного регенерата в разные годы были предложены различные методики с различной степенью достоверности получаемых данных: ряд лабораторных тестов (маркер формирования костного матрикса – N-терминальный пропептид проколлагена 1-го типа (P1NP), маркер костного ремоделирования (N-остеокальцин), маркеры костной резорбции (Бета-CrossLaps и Pyrilinks-D), паратиреоидный гормон и соматотропный гормоны, кальций и фосфор в сыворотке, витамин D (кальциферол), щелочная фосфатаза и др.), клинико-рентгенрадионуклидная, высокочастотная ультразвуковая допплерография, анализ оптической плотности регенерата, компьютерное моделирова- ние [21-24]. Однако далеко не все указанные методики доступны в повседневной практике, тем более для муниципального стационара. Поэтому наиболее востребованными являются все те же более тиражированные методы лучевой диагностики – РГ, КТ и МРТ.
Цель – выявить особенности органотопической перестройки костной ткани и имплантируемого костнопластического материала при замещении субтотальных дефектов среднего и заднего отделов стопы при нейроостеоартропатии Шарко.
МАТЕРИАЛЫ И МЕТОДЫ
Были проанализированы результаты КТ- и МРТ-исследований в серии случаев пациентов с остеоартропатией Шарко, которым на базе центра хирургии стопы и диабетической стопы ГКБ им. С.С. Юдина и отделения гнойной хирургии ГКБ № 13 ГБУЗ ДЗМ г. Москвы в 2020-2022 годы было проведено двухэтапное замещение костного дефекта заднего и среднего отделов стопы. Для стандартизации наблюдения мы использовали классификацию SEDW [24, 25]. Для уточнения локализации патологического процесса в среднем отделе стопы классификация Сандерса и Фрайкберга была дополнена пометками M (медиальная колонна), L (латеральная колонна) или Т (тотальное поражение).
В исследование были включены 11 пациентов: 8 пациентов с СД 2 типа и 3 пациента с СД 1 типа. Средний возраст пациентов – 49,1 года (24-61), женщин было 6 (55 %), мужчин – 5 (45 %).
На этапах лечения и наблюдения через 3, 6, 9 и 12 месяцев после проведения оперативного вмешательства проводили КТ-исследование зоны имплантированного костного трансплантата. Максимальный период наблюдения составил 13 месяцев. Определяли денситометрическую плотность костного регенерата в единицах Хаунсфилда и особенности изменения архитектоники новообразованной костной ткани и костнопластического материала. Для обработки данных КТ применяли программу RadiAnt Dicom.
Работа была выполнена в соответствии с этическими нормами Хельсинской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2013 г. и «Правилами клинической практики в Российской Федерации», утвержденными приказом Минздрава РФ от 19.06.2003 г. № 266. Пациенты подписали информированное согласие на проведение хирургического вмешательства и публикацию полученных данных без идентификации личности.
РЕЗУЛЬТАТЫ
Первичное сканирование проводили в условиях аппарата внешней фиксации, что затрудняло диагностику по причине МЕ-артефактов. На сроке фиксации 3 месяца у всех пациентов по данным КТ выявляли повышенную плотность костного трансплантата (396,5 ± 23,5 HU) в сравнении с плотностью реципиентной окружающей кости (123,5 ± 19,6 HU). Авторы связывают это с высокой денситометрической плотностью имплантационного материала и проведением интраоперационной компактизации трансплантата при заполнении дефекта.
Уже через 6 месяцев после операции у всех пациентов в зоне дефекта наблюдали костное уплотнение регенерата (447,6 ± 29,9 HU), увеличение количества и объема костных фрагментов за счет интенсивного костеобразования.
Через 12 месяцев после операции средняя плотность регенерата составила 623,5 ± 153,2 HU, а в окружающих костях – 186,3 ± 91,3 HU (табл. 1).
У одного пациента с замещением дефекта имплантационным материалом Биосит средняя плотность трансплантата по данным КТ через 3 месяца составила 1141 HU и сохранялась без явлений лизиса до окончания фиксации.
У пациентки с комбинированной пластикой (аутотрансплантат РИА + Биосит) через 3 месяца после замещения дефекта денситометрическая плотность составила 380 HU и к 12 месяцам достигла 871 HU.
Было проведено сравнение данных КТ пациентов на разных этапах фиксации и МРТ после демонтажа аппарата. По данным КТ более оптимально дифференцировались размеры и архитектоника костных фрагментов, а также качественные и количественные показатели изменения структуры и денситометрической плотности трансплантатов.
Возможность измерять в программе RadiAnt Dicom Viewer плотность костного регенерата в единицах Хаунс-филда позволила оценить динамическую органотипическую перестройку регенерата и его характеристики по сравнению с окружающими костными структурами.
Изменение плотности кости в зависимости от срока после замещения дефекта
Таблица 1
|
Сроки после операции |
Плотность костного трансплантата, HU |
Плотность окружающей кости, HU |
||
|
среднее значение |
min-max |
среднее значение |
min-max |
|
|
3 месяца |
396,5 |
313-442 |
123,5 |
60-211 |
|
6 месяцев |
447,6 |
352-553 |
114,1 |
61-154 |
|
12 месяцев |
623,5 |
261-884 |
186,3 |
24-405 |
У одного из пациентов определяли слабо выраженную положительную динамику формирования костного регенерата через 9 месяцев после операции, вероятно, за счет ингибирования биоматериала посредством фиброза, тем не менее, визуализировали ремоделирование костной ткани за счет формирования костной периостальной мозоли и анкилоза суставов стопы. Одной из причин длительного формирования костного блока стал более обширный дефект, требующий замещения и большее процентное соотношение аллотрансплантата к аутотрансплантату в имплантируемом костнопластическом материале, что потребовало более продолжительной полной органотипической перестройки новообразованной костной ткани [28].
У двух пациентов на КТ отмечали сохранение краевых остаточных полостей до 0,5 см3. По нашему мнению, это было связано с погрешностью заполнения дефекта костным трансплантатом в виде крошки, вместе с тем это не повлияло на общую динамику костной перестройки и сроки консолидации.
В среднем плотность регенерата по сравнению с окружающими костями была в 4,5 раза выше к сроку 6 месяцев после операции, а к 12 месяцам – в 3,5 раза (что авторы связывают с повышением плотности окружающих костей при возрастающей функциональной нагрузке на стопу).
Несмотря на разный генез аутотрансплантата и дистракционного регенерата, в своих исследованиях мы наблюдали постепенную перестройку биоматериала, с увеличением количества и объема костной массы без признаков лизиса и воспалительной деструкции, с динамической компактизацией новообразованной костной ткани, а также формирование межсуставных костных блоков (рис. 1-4).
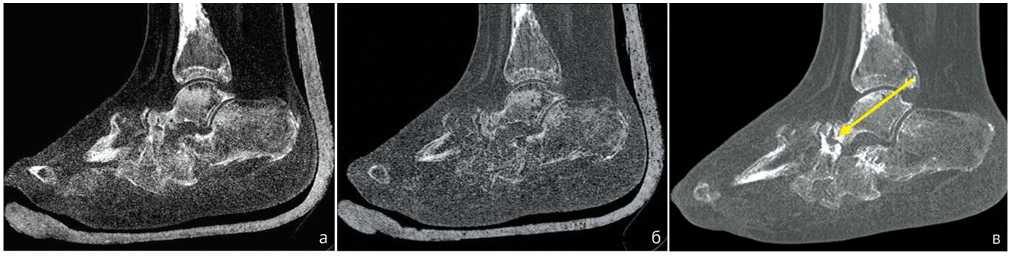
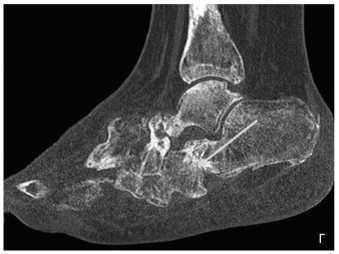
Рис. 1. Пациент Ш., 50 лет. МСКТ, сагиттальная плоскость, через 6 месяцев после операции (а, б): ремоделирование в таранно-ладьевидном и пяточно-кубовидном суставах, формирование костного регенерата в среднем отделе стопы. МСКТ, сагиттальная плоскость, через 12 месяцев после операции (в, г): формирование плотного костного регенерата в среднем отделе стопы с образованием анкилоза в пяточно-кубовидном суставе; перестройка костного регенерата
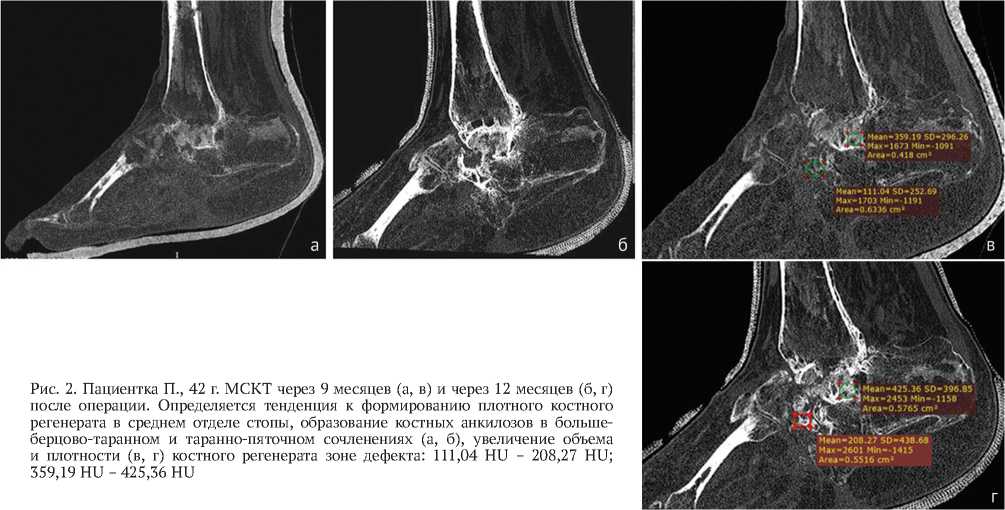
Рис. 2. Пациентка П., 42 г. МСКТ через 9 месяцев (а, в) и через 12 месяцев (б, г) после операции. Определяется тенденция к формированию плотного костного регенерата в среднем отделе стопы, образование костных анкилозов в большеберцово-таранном и таранно-пяточном сочленениях (а, б), увеличение объема и плотности (в, г) костного регенерата зоне дефекта: 111,04 HU – 208,27 HU; 359,19 HU – 425,36 HU
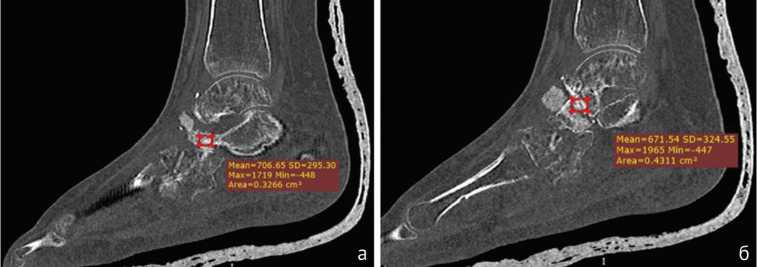
Рис. 3. Пациентка Я., 24 г. МСКТ стопы, сагиттальная плоскость (а, б). Через 6 мес. после операции наблюдаем формирование компактного костного регенерата (706,65 и 671,54 HU) в среднем отделе стопы; отмечаются очаги пониженной плотности за счет преходящего регионального остеопороза
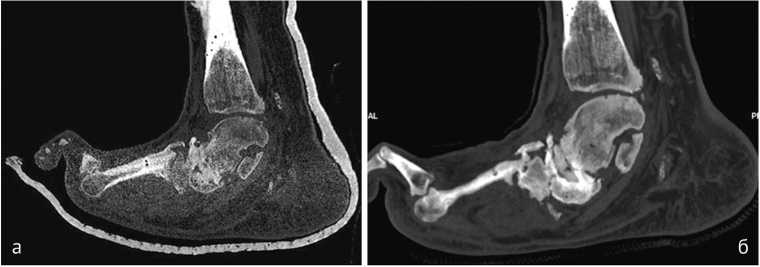
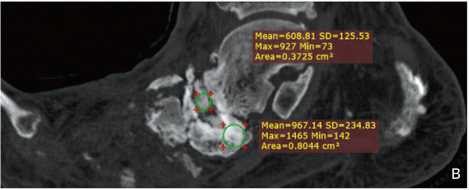
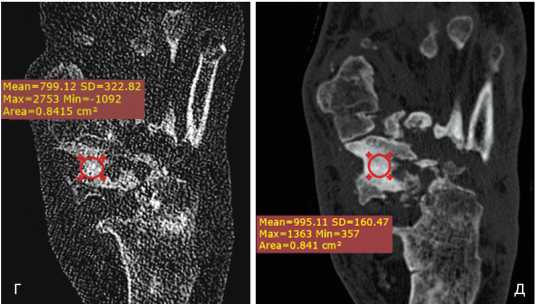
Рис. 4. Пациент Ж., 52 г. МСКТ стопы. Контрольные КТ-исследования через 6 (а, г) и 9 месяцев (б, в, д) после операции. Отмечается ремоделирование костной ткани, формирование костной мозоли и анкилоза. Прослеживается тенденция к компактизации регенерата
ОБСУЖДЕНИЕ
По данным доступной литературы, в настоящее время метод компьютерной томографии не признан ведущим для диагностики нейроартропатии Шарко. Наряду с рентгенографией, УЗИ и МРТ метод является основной процедурой оценки осложнений со стороны стоп, связанных с диабетом [26], однако каждый из методов не является достаточным для получения полной информации о патологии, поэтому в идеале диагностики следует использовать мультимодальный подход [27, 28]. Мы разделяем мнение коллег о важности привлечения КТ на этапах предоперационного планирования и постоперационного наблюдения пациентов со стопой Шарко с целью оценки особенностей изменения архитектоники костной ткани, формирования костного регенерата и определения его денситометри-ческой плотности, а также для достоверной качественной оценки сформированных анкилозов [29].
Несмотря на все очевидные преимущества магнитнорезонансной томографии, особенно для выявления ранней стадии диабетической остеоартропатии Шарко, данный метод не позволяет достоверно оценить формирование и регенерацию костной ткани по причине низкой дифференцировки кальция на фоне постоперационных изменений.
Кость, несмотря на высокую степень минерализации, непрерывно перестраивается, восстанавливается и адаптируется к определенным функциональным условиям. Этот постоянный динамический процесс адаптивной перестройки зависит, главным образом, от оптимального кровоснабжения, метаболической активности и скоординированной работы костных клеточных элементов. Как известно, ремоделирование кости происходит за счет двух процессов – резорбции костной ткани посредством остеокластов и ее нового формирования остеобластами [30, 31].
По такому же алгоритму происходит и ремоделирование ауто- и аллотрансплантата (деминерализованного костного матрикса), что было продемонстрировано в гистологических исследованиях Samy Bouaicha и со-авт. [32]. Первым этапом происходит резорбция аллотрансплантата остеокластами, реваскуляризация, а затем синтез новой кости путем активации остеобластов из аутотрансплантата и сохраненных фрагментов здоровой кости. Традиционно данный процесс называется ползучей линией замещения [32-34].
Brcic I. с соавт. в своем иcследовании определили реваскуляризациию костного аллотрансплантата и его ремоделирование, включающее остеокластическую и остеобластическую активность, через 10 недель [34].
Проводя аналогию с дистракционными регенератами при коррекции укорочения стоп, по данным МСКТ также отмечали аналогичную постепенную перестройку дистракционного регенерата с поэтапным повышением денситометрической плотности регенерата [35].
Так, плотность дистракционного регенерата менялась от плотности, равной плотности жировой ткани, до превышающей плотность окружающей костной ткани [36]. Этот тезис подтверждают МСКТ- и МРТ-исследования через 6 мес. после операции пациента М., 50 лет (рис. 5).
Отличием трансплантации аутокостного материала от дистракционного регенерата являлась возможность проведения интраоперационной компактизации материала, что по данным КТ на ранних сроках показывало большую денситометрическую плотность трансплантата, и только в случаях недостаточной компактизации при обширных костных дефектах отмечали низкую костную плотность, соответствующую плотности грануляционной ткани (жировой) так же, как и на ранних сроках формирования дистракционных регенератов. Наличие ангиотрофических расстройств у пациентов со стопой Шарко в условиях чрескостного остеосинтеза и использования свободных костных алло- и аутотрансплантатов не исключало возможности реконструкции стопы при дефектах ее среднего отдела и корня с формированием костных блоков, претерпевающих полную органотопическую перестройку. Полученные данные позволяют сделать предположение о ремоделировании трансплантата в компактную кость и наличии ангиогенеза в данной области. Вместе с тем, необходимо отметить сдержанное отношение к использованию внешней фиксации при реконструктивных операциях у пациентов со стопой Шарко, в литературе имеются публикации, в которых авторы делятся результатом одного лишь клинического наблюдения [37, 38].
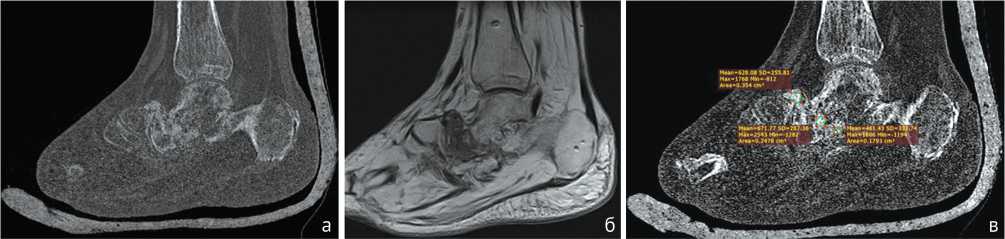
Рис. 5. МРТ (а) и МСКТ (б, в), сагиттальная плоскость, идентичные срезы. Исследование выполнено с разницей в несколько дней. МРТ PDW, сагиттальная плоскость (а) – определяется дезорганизация среднего отдела стопы, в ложе ладьевидной кости отмечается сниженная плотность регенерата, соответствующая оптической плотности фиброзной/грануляционной ткани с включениями в структуре костного регенерата. Последний визуализируется неубедительно. МСКТ MPR в сагиттальной плоскости (б, в) – более оптимально дифференцируются размеры и морфология (архитектоника) костных фрагментов в биоматериале, а также качественные показатели созревания трансплантата (566,6 ± 105,2 HU, минимальное и максимальное значение – 461,4 и 671,7 HU)
ЗАКЛЮЧЕНИЕ
Наличие аллокости в составе комбинированного костного трансплантата не снижает вероятность полного ремоделирования новообразованной костной ткани. Возможность достижения большей денситометри-ческой плотности при заполнении костного дефекта трансплантатом является отличием от дистракционных регенератов с изначально низкой денситометрической плотностью. Степень структурной перестройки кост- ных трансплантатов по данным КТ и/или МРТ у больных с костными дефектами при нейроостеоартропатии Шарко необходимо учитывать при проведении предоперационного планирования и оценке объёма замещаемого дефекта на протяжении всего процесса аппаратного лечения, при планировании сроков прекращения наружной фиксации и режима разгрузки и реабилитации при возрастании физиологической нагрузки на стопу.
Список литературы Особенности органотопической перестройки костной ткани и имплантируемого костнопластического материала при нейроостеоартропатии Шарко
- Галстян Г.Р., Викулова О.К., Исаков М.А. и др. Эпидемиология синдрома диабетической стопы и ампутаций нижних конечностей в Российской Федерации по данным федерального регистра больных сахарным диабетом (2013-2016 гг.). Сахарный диабет. 2018;21(3):170-177. doi: 10.14341/dm9688
- Ступина Т.А., Мигалкин Н.С., Суцницын А.С. Структурная реорганизация хрящевой ткани при хроническом остеомиелите костей стопы. Гений ортопедии. 2019;25(4):523-527. doi: 10.18019/1028-4427-2019-25-4-523-527
- Ступина Т.А., Мигалкин Н.С., Щудло М.М., Судницын А.С., Мезенцев И.Н. Микроскопическое исследование компонентов суставов стопы при диабетической остеоартропатии, осложненной остеомиелитом. Травматология и ортопедия России. 2020;26(4):112-120. doi: 10.21823/2311-2905-2020-26-4-112-120
- Алгоритмы специализированной медицинской помощи больным сахарным диабетом. Под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова. 10-й выпуск (дополненный). М.; 2021. doi: 10.14341/DM12802
- Chantelau EA, Grutzner G. Is the Eichenholtz classification still valid for the diabetic Charcot foot? Swiss Med Wkly. 2014;144:w13948. doi: 10.4414/ smw.2014.13948
- Завадовская В.Д., Зоркальцев М.А., Удодов В.Д., и др. Возможности программно-совмещенной однофотонной эмиссионной компьютерной томографии / магнитно-резонансной томографии в диагностике осложненного течения синдрома диабетической стопы. Вестник рентгенологии и радиологии. 2015;(6):24-29. EDN: VBTTTF.
- Божко О.В., Чураянц В.В., Гурьева И.В., Котухова Я.И. Наши наблюдения при диабетической нейроартропатии. Магнитно-резонансная томография. Медицинская визуализация. 2003;(2):101-108.
- Wurm M., Pagenstert G., Hunt M.M., et al. Charcot Neuroarthropathy of the Foot and Ankle. In: Foot and Ankle Disorders. Berlin; Heidelberg: Springer, 2016:531-553.
- Solomon MA, Gilula LA, Oloff LM, Oloff J. CT scanning of the foot and ankle: 2. Clinical applications and review of the literature. AJR Am J Roentgenol. 1986;146(6):1204-1214. doi: 10.2214/ajr.146.6.1204
- Гальчина Ю.С., Кармазановский Г.Г., Пасхалова Ю.С. Основные методы диагностики синдрома диабетической стопы. Медицинская визуализация. 2016;(6):100-117. EDN: XWTYRJ.
- Eichenholtz SN. Charcot joints. With a foreword by P.D. Wilson. Springfield (Ill): Charles C. Thomas; 1966.
- Ahluwalia R, Bilal A, Petrova N, et al. The Role of Bone Scintigraphy with SPECT/CT in the Characterization and Early Diagnosis of Stage 0 Charcot Neuroarthropathy. J Clin Med. 2020;9(12):4123. doi: 10.3390/jcm9124123
- Basu S, Zhuang H, Alavi A. FDG PET and PET/CT Imaging in Complicated Diabetic Foot. PET Clin. 2012;7(2):151-60. doi: 10.1016/j. cpet.2012.01.003
- Gold RH, Tong DJ, Crim JR, Seeger LL. Imaging the diabetic foot. Skeletal Radiol. 1995;24(8):563-71. doi: 10.1007/BF00204853
- Marcus CD, Ladam-Marcus VJ, Leone J, Malgrange D, Bonnet-Gausserand FM, Menanteau BP. MR imaging of osteomyelitis and neuropathic osteoarthropathy in the feet of diabetics. Radiographics. 1996;16(6):1337-48. doi: 10.1148/radiographics
- Tomas MB, Patel M, Marwin SE, Palestro CJ. The diabetic foot. Br J Radiol. 2000;73(868):443-50. doi: 10.1259/bjr.73.868.10844873
- Алексеева Е.А., Васильев А.Ю. Магнитно-резонансная томография в диагностике осложненных форм синдрома диабетической стопы. Кубанский научный медицинский вестник. 2010;(3-4):14-17.
- Клюшкин И.В., Фатыхов Р.И. Современные методы диагностики при синдроме диабетической стопы. Обзоры. Казанский медицинский журнал. 2012;93(2):298-300.
- Chantelau EA, Richter A. The acute diabetic Charcot foot managed on the basis of magnetic resonance imaging - a review of 71 cases. Swiss Med Wkly. 2013;143:w13831. doi: 10.4414/smw.2013.13831
- Seibel MJ. Biochemical markers of bone turnover: part I: biochemistry and variability. Clin Biochem Rev. 2005;26(4):97-122.
- Щуров В.А., Буторина Н.И., Щуров И.В. Высокочастотная ультразвуковая допплерография в диагностике состояния костного регенерата. Гений ортопедии. 2007;(4):25-7.
- Горбач Е.Н., Горбач Е.С., Кононович Н.А., Попков А.В. Анализ оптической плотности регенерата в условиях автоматического удлинения голени с повышенным темпом при разных способах нарушения целостности кости. Современные проблемы науки и образования. 2018;(4):156-158. doi: 10.17513/spno.27804
- Русаков С.А., Муха Ю.П. Методика определения осевой жесткости костного регенерата. Современные проблемы науки и образования. 2013;(2):239.
- Obolenskiy V.N., Protsko V.G, Komelyagina E.Y. Classification of diabetic foot, revisited. Wound Medicine. 2017;18:1-7. doi: 10.1016/j. wndm.2017.06.001
- Оснач С.А., Оболенский В.Н., Процко В.Г. и др. Метод двухэтапного лечения пациентов с тотальными и субтотальными дефектами стопы при остеоартропатиии Шарко. Гений ортопедии. 2022;28(4):523-531. doi: 10.18019/1028-4427-2022-28-4-523-531
- Senck S, Plank B, Kastner J, et al. Visualisierung lokaler kortikaler Defekte im Charcot-Fufi mittels Mikrocomputertomographie [Visualization of local cortical defects in Charcot foot using microcomputed tomography]. Orthopade. 2015;44(1):8-13. (In German) doi: 10.1007/s00132-014-3053-0
- Sanverdi SE, Ergen BF, Oznur A. Current challenges in imaging of the diabetic foot. Diabet Foot Ankle. 2012;3. doi: 10.3402/dfa.v3i0.18754
- Дьячкова Г.В., Судницын А.С., Клюшин Н.М., и др. МСКТ-семиотика диабетической остеоартропатии, осложненной хроническим остеомиелитом. Гений ортопедии. 2022;28(3):378-385. doi: 10.18019/1028-4427-2022-28-3-378-385. EDN: MHSSKB.
- Mautone M, Naidoo P. What the radiologist needs to know about Charcot foot. J Med Imaging Radiat Oncol. 2015;59(4):395-402. doi: 10.1111/17549485.12325
- Crockett JC, Rogers MJ, Coxon FP, et al. Bone remodelling at a glance. J Cell Sci. 2011;124(Pt 7):991-998. doi: 10.1242/jcs.063032
- Fierro FA, Nolta JA, Adamopoulos IE. Concise Review: Stem Cells in Osteoimmunology. Stem Cells. 2017;35(6):1461-1467. doi: 10.1002/stem.2625
- Bouaicha S, von Rechenberg B, Osterhoff G, et al. Histological remodelling of demineralised bone matrix allograft in posterolateral fusion of the spine - an ex vivo study. BMC Surg. 2013;13:58. doi: 10.1186/1471-2482-13-58
- Taira H, Moreno J, Ripalda P, Forriol F. Radiological and histological analysis of cortical allografts: an experimental study in sheep femora. Arch Orthop Trauma Surg. 2004;124(5):320-5. doi: 10.1007/s00402-004-0653-x
- Brcic I, Pastl K, Plank H, et al. Incorporation of an Allogenic Cortical Bone Graft Following Arthrodesis of the First Metatarsophalangeal Joint in a Patient with Hallux Rigidus. Life (Basel). 2021;11(6):473. doi: 10.3390/life11060473
- Дьячкова Г.В., Неретин А.С., Корабельников М.А., Нижечик С.А. Рентгенологические особенности регенерации костной ткани при лечении больных с аномалиями развития стопы. Гений ортопедии. 2005;(4):98-101. EDN: LDGXOR.
- Нижечик С.А. Рентгенологическая оценка костеобразования при устранении дефектов, деформаций и аномалий развития костей стопы методом чрескостного остеосинтеза: автореф. дис. ... кандидата мед. наук. Обнинск, 2010:18. EDN: QGVLVJ. Доступно по: https://www.dissercat. com/content/rentgenologicheskaya-otsenka-kosteobrazovaniya-pri-ustranenii-defektov-deformatsii-i-anomali. Ссылка активна на 12.05.2023.
- Судницин А.С., Клюшин Н.М. Азимов П.А. Лечение больного с синдромом диабетической остеоартропатии по методу Илизарова. Инновационная медицина Кубани. 2021;(1):61-65. doi: 10.35401/2500-0268-2021-21-1-61-65
- Pastl K, Pastl E, Flory D, et al. Arthrodesis and defect bridging of the upper ankle joint with allograft bone chips and allograft cortical bone screws (Shark Screw®) after removal of the salto-prosthesis in a multimorbidity patient: a case report. Life (Basel). 2022;12(7):1028. doi: 10.3390/life12071028


