Особенности ортопедического и соматического статуса у пациентов с несовершенным остеогенезом
Автор: Мингазов Эдуард Рифович, Рябых Татьяна Викторовна, Попков Дмитрий Арнольдович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
Введение. Несовершенный остеогенез (НО) представляет собой группу редких и сравнительно разнообразных генетических нарушений, характеризуемых частыми переломами, костными деформациям, низкой минеральной плотностью кости и остеопенией. Среди ортопедических проблем у пациентов с НО выделяют частые переломы, деформаций костей, ложные суставы; отдельно выделяют варусную деформацию шейки бедренной кости, сколиозы, протрузию вертлужной впадины, статические деформации стоп. Основной целью хирургического лечения возникших деформаций и переломов конечностей у пациентов с НО является восстановление и поддержание их двигательной активности, автономности и сохранение качества жизни при тяжелых формах НО. Целью данного исследования являлась оценка деформаций нижних конечностей и сопровождающих их других ортопедических нарушений, а также соматического статуса пациентов с тяжелыми формами несовершенного остеогенеза (III и IV по Sillence) при поступлении на этап оперативного ортопедического лечения. Материалы и методы. Под нашим наблюдением в период 2003-2016 находилось 43 пациента с тяжелыми формами несовершенного остеогенеза (III и IV тип), поступивших для оперативной коррекции деформаций нижних и верхних конечностей, ложных суставов, варусной деформации шейки бедренной кости. Средний возраст на момент поступления составил 14,4 ± 9,74 года (от 2 лет 9 месяцев до 46 лет). Результаты. Лечение переломов в большинстве случаев было консервативным, однако использовался остеосинтез спицами или эластичными стержнями с последующим их удалением у 4 пациентов, накостные ригидные пластины - 4 пациента, остеосинтез аппаратом Илизарова - в 3 случаях, интрамедуллярный остеосинтез ригидным стержнем - у 4 пациентов. Регулярный прием препаратов бисфосфонатов проводился у 9 пациентов, последняя доза препарата была введена не менее, чем за 4 месяца до поступления. Ранее реконструктивные вмешательства на костях нижних конечностей с целью коррекции деформаций перенесли 13 пациентов. Заключение. Деформации нижних конечностей у пациентов с НО тяжелых форм носят комплексный многоуровневый характер, что подразумевает необходимость многоуровневого ортопедического вмешательства для их коррекции. Высокая частота переломов, комплексный характер тяжелых деформаций костей скелета обусловливают потерю навыка к самостоятельному передвижению или даже изначальное отсутствие его развития. Неадекватные оперативные вмешательства, несвоевременно выполненные, нетелескопический характер остеосинтеза, отсутствие терапии бисфосфонатами способствуют формированию дополнительных ортопедических проблем и усугублению процесса потери автономности у пациентов данной категории, что может затруднить последующее специфическое ортопедическое хирургическое лечение.
Несовершенный остеогенез, деформации конечностей, рост, вес, индекс массы тела
Короткий адрес: https://sciup.org/142213641
IDR: 142213641 | УДК: 616.71-007.235+ | DOI: 10.18019/1028-4427-2018-24-2-177-184
Текст научной статьи Особенности ортопедического и соматического статуса у пациентов с несовершенным остеогенезом
Несовершенный остеогенез (НО) представляет собой группу редких и сравнительно разнообразных генетических нарушений, характеризуемых частыми переломами, костными деформациям, низкой минеральной плотностью кости и остеопенией [1–4]. В большин- стве случаев НО вызван доминантной мутацией генов COL1A1 или COL1A2енных [5]. Наиболее широко распространенная классификация НО основана на клинико-рентгенологической картине заболевания и включает I, II, III и IV типы заболевания, для которых характерен
аутосомно-доминантный тип наследования [1]. В более полной классификации, учитывающей и генетические аспекты, добавлены V (доминантно наследуемый, характерно образование объемных гипертрофированных костных мозолей, оссификация межкостных мембран), VI, VII и VIII (рецессивно наследуемые) типы, включающие пациентов без нарушений синтеза коллагена первого типа, но с клинико-рентгенологическими проявлениями НО [3, 4, 6].
Среди ортопедических проблем у пациентов с НО выделяют частые переломы, деформации костей, ложные суставы; отдельно выделяют варусную деформацию шейки бедренной кости, сколиозы, протрузию вертлужной впадины, статические деформации стоп [7–9]. Многочисленные переломы, которые сопровождаются деформациями конечностей, а также длительные периоды иммобилизации и отсутствие нагрузки на конечности способствуют уменьшению минеральной плотности костей, нарушению развития общей мото- рики ребенка, приобретению навыков вертикализации, самообслуживания и ходьбы, замедляется общее соматическое и функциональное развитие детей с тяжелыми формами НО [10–13]. Основной целью хирургического лечения возникших деформаций и переломов конечностей у пациентов с НО является восстановление и поддержание их двигательной активности, автономности и сохранение качества жизни при тяжелых формах НО [14–18]. Нужно понимать, что хирургическое ортопедическое лечение (реконструктивное и/или превентивное) должно проводиться на многих сегментах скелета, учитывая системный характер поражения, а также при соматическом неблагополучии пациентов.
Целью данного исследования являлась оценка деформаций нижних конечностей и сопровождающих их других ортопедических нарушений, а также соматического статуса пациентов с тяжелыми формами несовершенного остеогенеза (III и IV по Sillence) при поступлении на этап оперативного ортопедического лечения.
МАТЕРИАЛЫ И МЕТОДЫ
Под нашим наблюдением в период 2003–2016 годы находилось 43 пациента с тяжелыми формами несовершенного остеогенеза (III и IV тип), поступившие для оперативной коррекции деформаций нижних и верхних конечностей, ложных суставов, варусной деформации шейки бедренной кости. Средний возраст на момент поступления составил 14,4 ± 9,74 года (от 2 лет 9 месяцев до 46 лет).
Помимо ортопедического и клинического исследования у пациентов оценивались нарушения способности к самостоятельному передвижению по Gillette Functional Assessment Questionnaire Ambulation Scale [19]. В анамнестических данных учитывали количество переломов, способы их лечения, выполнение оперативного вмешательства, терапию препаратами бисфосфонатов. Уровень минеральной плотности учитывали по данным минеральной денситометрии, отмеченным в предоставленной медицинской документации.
По рентгенограммам сегментов нижних конечностей и рентгентелеметрии определяли уровень, локализацию вершины и величину деформации, наличие и положение материала остеосинтеза, локализацию несращений и ложных суставов, а также следующие рентгенанатомические показатели: механический латеральный проксимальный бедренный угол (mLPFA), анатомический медиальный проксимальный бедренный угол (aMPFA), анатомический и механический латеральные дистальные бедренные углы (aLDFA, mLDFA), анатомический задний дистальный бедренный угол (aPDFA), механический медиальный проксимальный большеберцовый угол (mMPTA), анатомический медиальный проксимальный большеберцовый угол (аMPTA), механический латеральный дистальный большеберцовый угол (mLDTA), анатомический задний проксимальный большеберцовый угол (aPPTA), анатомический передний дистальный большеберцовый угол (aАDTA) [20,21]. Торсионные деформации оценивались по клиническим данным и, в ряде случаев, по данным компьютерной томографии (Toshiba Aquilion-64, Япония).
Все пациенты до проведения оперативного лечения были консультированы педиатрами или терапевтами. При оценке соматического статуса и сопутствующей патологии у пациентов учитывались данные анамнеза, физикального обследования, стандартные антропометрические показатели (рост, вес, индекс массы тела – ИМТ), показатели лабораторных методов исследования, данные дополнительных методов исследования и результаты консультации узких специалистов.
Полученные количественные данные подвергали статистической обработке с использованием программы Microsoft Excel 2016. Статистическое исследование включало в себя описательную статистику: средние значения (М) и стандартное отклонение (SD).
РЕЗУЛЬТАТЫ
В итоге, в данное исследование было включено 43 пациента в возрасте от 2 лет 9 месяцев до 46 лет (14,4 ± 9,7 года). Клинико-рентгенологическая форма несовершенного остеогенеза III типа встречалась в 14 случаях, IV типа – у 29 больных. Диагноз был подтвержден молекулярно-генетическими исследованиями у 17 пациентов (6 – III типа,10 – IV типа, 1 – VIII типа). В анамнезе у всех больных присутствовали переломы, не менее 5 эпизодов (встречаемость варьировала от 5 до более 100 случаев). Лечение переломов в большинстве случаев было консервативным, однако использовался остеосинтез спицами или эластичными стержнями с последующим их удалением у 4 пациентов, накостные ригидные пластины – 4 пациента, остеосинтез аппаратом Илизарова – в 3 случаях, интрамедуллярный остеосинтез ригидным стержнем – у 4 пациентов. Регулярный прием препаратов бисфосфонатов проводился у 9 пациентов, последняя доза препарата была введена не менее чем за 4 месяца до поступления. Ранее реконструктивные вмешательства на костях нижних конечностей с целью коррекции деформаций перенесли 13 пациентов. В качестве остеосинтеза использовался аппарат Илизаров у шести пациентов, интрамедуллярный остеосинтез спицами или эластичными стержнями – у 5 пациентов, в одном случае применялась методика поднадкостничного размещения костных гомотрансплантатов с фиксацией их серкляжем, еще одной пациентке был выполнен интрамедуллярный остеосинтез телескопической системой Fassier-Duval бедра и голени с одной стороны и стержнем Rush – с другой.
Из всей исследуемой группы только 4 пациентов (IV тип НО) могли самостоятельно передвигаться в пределах жилого помещения или ограниченных пространств не используя костыли или трости (уровень 4 по Gillette Functional Assessment Questionnaire Ambulation Scale), в 13 случаях (III тип, 3 пациента; IV тип, 10 пациентов) больным для передвижения обязательно требовались костыли, но при этом они сохраняли автономность (уровень 3 Gillette Functional Assessment Questionnaire Ambulation Scale), в остальных 26 случаях (III тип, 11 больных; IV – 15 больных) пациенты могли перемещаться только в инвалидной коляске (уровень 1 и 2 по Gillette Functional Assessment Questionnaire Ambulation Scale). Важно отметить, что все пациенты, относящиеся к IV типу и кому проводилось лечение препаратами бисфосфонатов (4 человека), сохранили способность к самостоятельному передвижению. Из пяти пациентов с наиболее тяжелой формой НО (III тип), проходивших курсы антирезорбтивной терапии, только двое смогли сохранить способность к передвижению с помощью костылей и посторонней помощи и при условии использования ортезных изделий. Отметим также, 5 пациентов в возрасте до 6 лет никогда не начинали передвигаться в вертикальной позе, не приобрели этот навык.
Клинически значимый, регулярно отмечаемый болевой синдром интенсивностью уровня 3–4 по шкале Wong-Baker [22] или аналоговой шкале отмечался у 14 пациентов и был связан с наружной миграцией интрамедуллярных конструкций (2 случая), ложным суставом в присутствии нестабильного остеосинтеза (4 случая), при осевой нагрузке деформированных конечностей (4 случая), при движениях в тазобедренном или коленном суставах, поясничном отделе позвоночника (14 пациентов).
Деформации костей нижних конечностей в той или иной степени присутствовали у всех пациентов (рис. 1). В таблице 1 представлены типы угловых деформаций, отмечавшихся на уровне диафизарных отделов костей нижних конечностей по данным рентгенографии. При изучении данного вида деформаций учитывались лишь случаи при величине деформации 10 и более градусов.
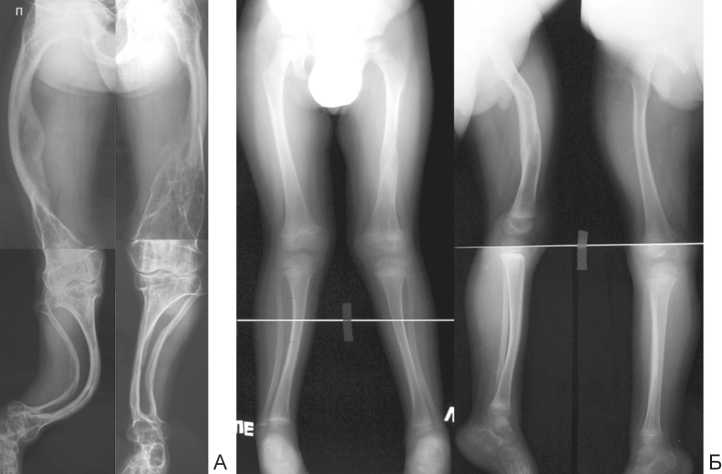
Рис. 1. Рентгентелеметрия нижних конечностей: А – пациента с III типом НО, Б – IV тип НО
Таблица 1
Угловые деформации бедренных и большеберцовых костей
|
Вид деформации |
Бедренная кость (n = 76) |
Большеберцовая кость (n = 76) |
|
Варусно-антекурвационная (10°–105°) |
47 |
4 |
|
Вальгусно-антекурвационная (10°–55°) |
3 |
30 |
|
Вальгусная (10°–50°) |
7 |
11 |
|
Антекурвационная (20°–64°) |
3 |
11 |
|
Варусно-рекурвационная (25°–42°) |
1 |
1 |
|
Варусная (10°–35°) |
10 |
– |
|
Вальгусно-рекурвационная (28°–35°) |
1 |
1 |
|
Нет деформации |
4 |
18 |
Как видно из таблицы 1, наиболее частой деформацией являлась варусно-антекурвационная бедренной кости и вальгусно-антекурвационная большеберцовой кости. Для пациентов данной группы были отдельно посчитаны углы ориентации суставных концов относительно анатомических и механических осей сегментов (табл. 2, рис. 2). Как видно по представленным данным, выраженных нарушений ориентации суставных концов бедренной и большеберцовой костей относительно анатомической оси прилежащих диафизарных отделов нет. С другой стороны, были отмечены явно патологические значения углов относительно механических осей сегментов. Данный факт указывает на локализацию вершины деформации преимущественно на уровне диафизов костей. Лишь в трех случаях (6 сегментов) мы обнаружили истинную варусную деформацию проксимального отдела бедра с локализацией CORA [20, 21] у основания шейки или в межвертельной зоне. При этом в двух случаях это сопровождалось развитием патологического перелома на данном уровне (рис. 3). Отдельно остановимся на значениях aLDFA ниже возрастной нормы. Мы полагаем, что данные изменения носят спонтанный адаптационный характер, развиваются в процессе роста бедренной кости, связаны с варусной деформацией диафизарного отдела и направлены на уменьшение медиальной девиации биомеханической оси всей конечности. Торсионные деформации клинически определялись на 67 сегментах: наружная торсия бедренной кости 30°–90° (46 сегментов), внутренняя торсия костей голени 20°–70° (28 сегментов), наружная торсия костей голени 35°–50° (3 сегмента). В 7 случаях деформации были подтверждены с помощью компьютерной томографии (рис. 4).
Таблица 2
Углы ориентации суставных концов относительно анатомических и механических осей сегментов у пациентов с варусно-антекурвационными деформациями на бедре и вальгусно-антекурвационными деформациями на голени
|
mLPFA |
aMPFA |
mLDFA |
aLDFA |
aPDFA |
|
74,7 ± 6,9 |
102,4 ± 9,1 |
94,9 ± 7,89 |
78,4 ± 5,9 |
81,7 ± 10,9 |
|
mMPTA |
aMPTA |
mLDTA |
aPPTA |
aADTA |
|
97,7 ± 7,04 |
84,8 ± 5,3 |
87,9 ± 7,5 |
86,8 ± 8,2 |
85,4 ± 12,9 |
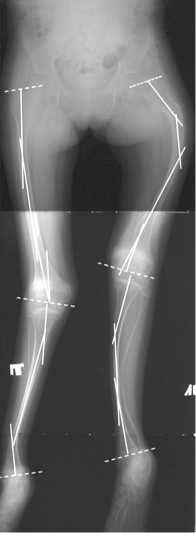
Рис. 2. Рентгенограммы нижних конечностей пациента с IV типом НО: пересечение сплошных линий соответствует вершинам деформаций (CORA), aLDFA: 75°(D), 78°(S)
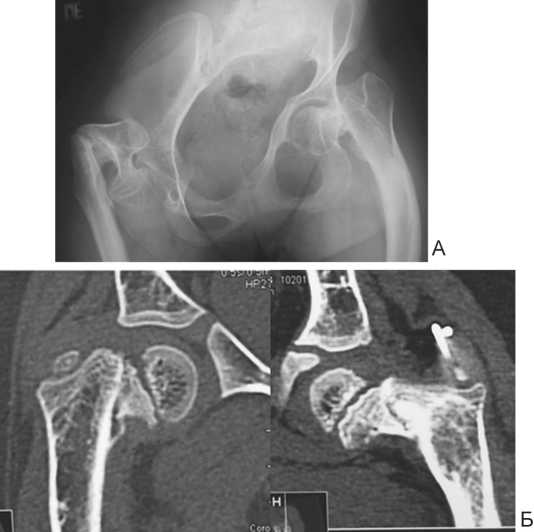
Рис. 3. Ложные суставы проксимального отдела бедренной кости: А – рентгенограмма таза в прямой проекции, Б – компьютерная томография
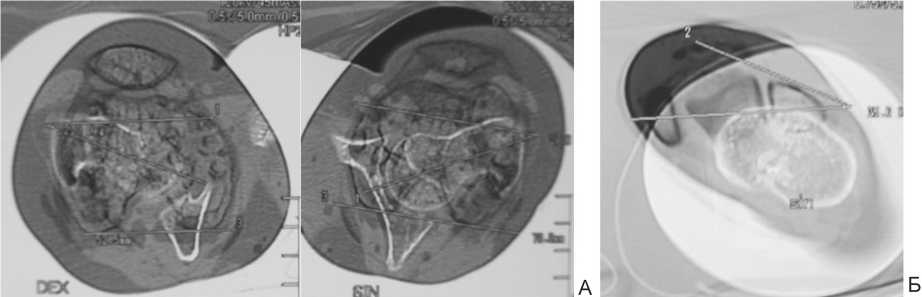
Рис. 4. Торсионные деформации, компьютерная томография: А – ретроверсия шеек бедер, Б – внутренняя торсия костей голени 35°
Рентгенологические признаки ложного сустава (рис. 5), замедленной консолидации после перелома, патологического перелома с локализацией вершины деформации на данном уровне отмечены: шейка бедра (2 сегмента), верхняя треть диафиза бедренной кости (1 сегмент), граница верхней и средней трети диафиза бедра (12), средняя треть бедра (6), нижняя треть бедра (2), средняя и нижняя треть диафиза большеберцовой кости (по 1 сегменту).
Наличие разнообразных элементов металлоостео-синтеза присутствовало на 18 сегментах (рис. 5): стержень Fassier-Duval с признаками ятрогенного эпифизиодеза (2), стержень Rush (4), накостная пластина с признаками нестабильности (4), внутрикостные спицы или тонкие стержни (6), серкляж (1), изогнутый или сломанный ригидный интрамедуллярный стержень (2).
Среди других ортопедических проявлений отметим, что сколиотическая деформация различной вы- раженности (23°–88°) присутствовала у 13 пациентов, неравенство длины нижних конечностей более 2 см – в 29 случаях, деформации верхних конечностей, вызывающие существенные для пациентов функциональные ограничения – в 7 случаях.
При исследовании антропометрических параметров был обнаружен патологически низкий рост у всех пациентов. Рост ниже 5-го перцентиля был у 36 пациентов, в промежутке 5–10-ый перцентиль – у 4 больных, 11–25-ый перцентиль – еще у трех пациентов. ИМТ ниже 10-го перцентиля был обнаружен у одного больного, а ИМТ, соответствующий уровню выше 90-го перцентиля – у 8 больных, что сопровождалось признаками избыточного веса и присутствовало у пациентов в возрасте 3, 9, 13, 14, 16, 37 лет. Отметим, что это заключение основано на интерпретации данных веса и роста для здоровой популяции.
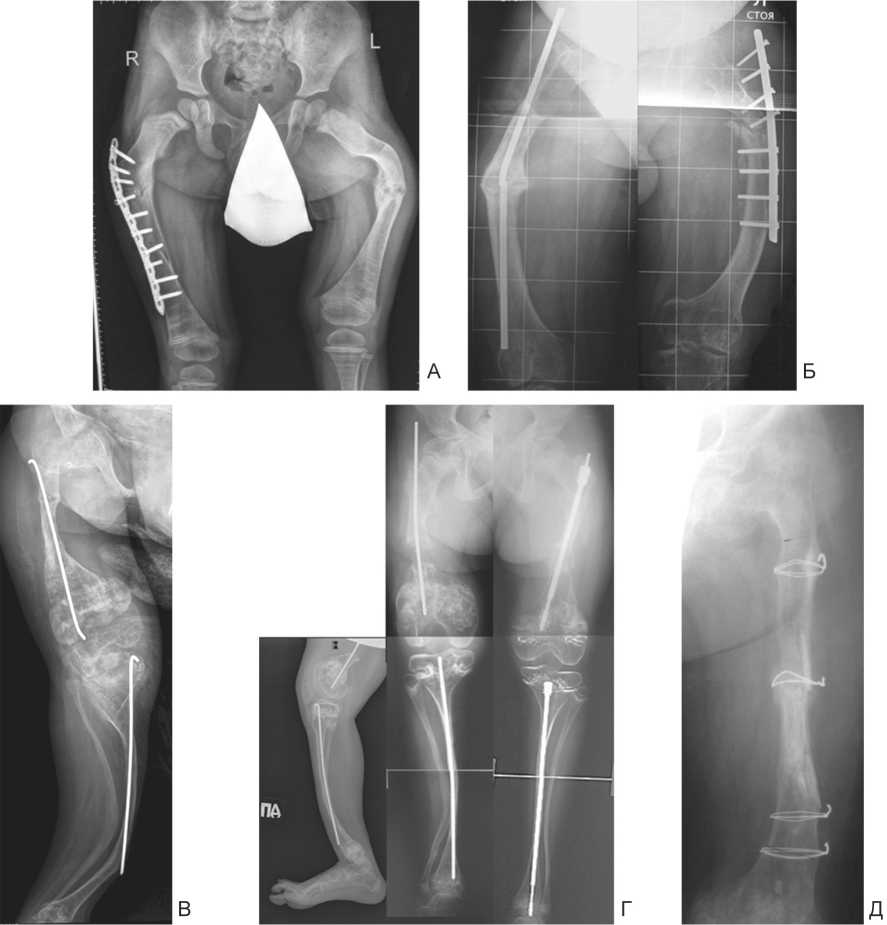
Рис. 5. Примеры ложных суставов, замедленных сращений, миграции материала остеосинтеза: А – миграция накостной пластины с угловой стабильностью, рецидив деформации (правое бедро), варусная деформация, ложный сустав (левое бедро); Б – ложные суставы обеих бедренных костей, перелом ригидного интрамедуллярного стержня (справа), миграция накостной пластины (слева); В – деформации при наличии внутрикостных прямых спиц; Г – телескопические стержни Fassier-Duval в левом бедре и большеберцовой кости, нерасхождение стержней, дистальный эпифизиодез бедренной кости и проксимальный – большеберцовой кости, стержни Rush в правом бедре и большеберцовой кости, дефект-диастаз бедренной кости, вальгусно-антекурвационная деформация большеберцовой кости, Д – серкляж левой бедренной кости, ситуация через 4 года после поднадкостничного размещения гомотрансплантатов, несращение в средней трети бедра, coxa vara
Данные (Z-score) о минеральной плотности тел позвонков поясничного отдела (L1–L4) варьировали от -4,3 до -2,4.
Среди сопутствующих заболеваний были обнаружены хронические инфекции верхних дыхательных путей (7), хронический бронхит (1), вегетососудистая дистония (4), синусовая тахикардия (4), артериальная гипертензия (2), хронический гепатит (1), хронический гастрит или гастродуоденит (3), запоры (12), миопия (6), снижение слуха (7), аллергический дерматит (1), фиброаденома молочной железы (1), нефроптоз (1), хроническая инфекция мочевыводящих путей (3).
ДИСКУССИЯ
Снижение минерализации и механической прочности костей скелета объясняет основные ортопедические проявления НО: переломы и деформации костей конечностей, деформации черепа, платиспондилию в сочетании с деформациями позвоночника или без них, уплощение основания черепа в сочетании с прогрессирующей компрессией стволовых структур [2, 4, 5, 9, 23]. В связи с системным характером поражения соединительной ткани, нередкими проявлениями НО являются нарушение дентиногенеза, нарушение слуха, недостаточность клапанов сердца, деформации грудной клетки [2, 4–6]. Частые переломы, выраженные деформации конечностей, длительные периоды иммобилизации в сочетании с ограничениями нагрузки на конечности ведет к дальнейшему уменьшению минеральной плотности костей, нарушению развития общей моторики пациента, приобретению навыков вертикализации и самообслуживания [15–18]. Наше исследование показало, что только 17 из 43 пациентов из исследуемой группы имели способность к передвижению, причем 13 из них вынуждены были пользоваться костылями и ортезными изделиями для вер-тикализации и передвижения с посторонней помощью.
Характер деформаций был типичным для тяжелых форм НО. Варусно-антекурвационные деформации на бедре и вальгусно-антекурвационные деформации голени в сочетании с выраженными торсионными деформациями сегментов нижних конечностей отмечены у большинства пациентов. Преимущественно такие же деформации отмечены в других исследованиях [4, 7, 13, 24]. Для нашей группы пациентов характерна высокая встречаемость ложных суставов, замедленных сращений после переломов, формирование патологических переломов на вершинах костных деформаций. Данные изменения также являются объектом хирургической коррекции, но их предотвращению способствует своевременно начатая терапия бисфосфонатами и превентивное телескопическое армирование [24–28]. В исследуемой группе до поступления в РНЦ «ВТО» имени академика Г.А. Илизарова данное сочетание лечебных методов не было отмечено ни в одном случае, что и объясняет, на наш взгляд, развитие тяжелых деформаций конечностей в сочетании с присутствием ложных суставов и замедленной консолидацией. Кроме того, у ряда пациентов применялись неадаптированные к механическим свойствам костной ткани методы остеосинтеза ригидными имплантами, что во всех случаях не привело к планируемому результату лечения (коррекции деформаций или сращению переломов), сопровождалось нестабильностью имплантов или даже их переломом. Известно, что накостные пластины противопоказаны при лечении пациентов с НО [29, 30].
Таким образом, многоуровневый характер выраженных деформаций нижних конечностей, сопровождающийся уже значительной потерей функциональных возможностей и автономности пациентов и требующий достаточно неотложной хирургической коррекции в группе наших пациентов, сочетался с редкой встречаемостью превентивных лечебных мероприятий (бисфосфонат-терапия) и ранее неадекватно проведенным ортопедическим хирургическим лечением, что, конечно, вносит дополнительные сложности и элементы в планируемое оперативное лечение.
Соматические проблемы у пациентов, отмеченные в нашем исследовании, были нередкими, включая специфические для НО [2, 18, 23, 31]: миопия, снижение слуха, запоры. Сопутствующая патология во всех случаях носила компенсированный характер, однако должна была быть учтена и требовала наблюдения специалиста в процессе лечения ребенка.
Низкий рост, низкая масса тела (-2 Z-score и ниже по данным для определенных возрастов здоровых детей) типичны для пациентов с тяжелыми формами НО [32–35]. Учитывая системный генетический характер заболевания невозможно применять стандартные антропометрические кривые для пациентов с НО. Известно, что повышенные значения ИМТ позитивно коррелируют с частотой переломов и снижением минеральной плотности [36]. Высокий уровень ИМТ является неблагоприятным фактором для сохранения функциональных возможностей пациентами с НО, отражает снижение их двигательной активности и должен быть откорректирован [37, 38]. В нашей группе ИМТ выше 90-го перцентиля отмечен у 8 пациентов (18,6 %).
ЗАКЛЮЧЕНИЕ
Деформации нижних конечностей у пациентов с НО тяжелых форм носят комплексный многоуровневый характер, что подразумевает необходимость многоуровневого ортопедического вмешательства для их коррекции. Высокая частота переломов, комплексный характер тяжелых деформаций костей скелета обусловливают потерю навыка к самостоятельному передвижению или даже изначальное отсутствие его развития. Неадекватные оперативные вмешательства, несвоевременно выполненные, нетелескопический характер остеосинтеза, отсутствие терапии бисфосфонатами способствуют формированию дополнительных ортопедических проблем и усугублению процесса потери автономности у пациентов данной категории, что может затруднить последующее специфическое ортопедическое хирургическое лечение.
Список литературы Особенности ортопедического и соматического статуса у пациентов с несовершенным остеогенезом
- Sillence D.O., Senn A., Danks D.M. Genetic heterogeneity in osteogenesis imperfect//J. Med. Genet. 1979. Vol. 16, No 2. P. 101-116.
- Cheung M.S., Glorieux F.H. Osteogenesis imperfecta: update on presentation and management//Rev. Endocr. Metab. Disord. 2008. Vol. 9, No 2. P. 153-160 DOI: 10.1007/s11154-008-9074-4
- Classification of osteogenesis imperfecta revisited/F.S. van Dijk, G. Pals, R.R. van Rijn, P.G. Nikkels, J.M. Cobben//Eur. J. Med. Genet. 2010. Vol. 53, No 1. P. 1-5 DOI: 10.1016/j.ejmg.2009.10.007
- Glorieux F.H. Osteogenesis imperfecta//Best Pract. Res. Clin. Rheumatol. 2008. Vol. 22, No 1. P. 85-100 DOI: 10.1016/j.berh.2007.12.012
- Osteogenesis imperfecta/C. Michell, V. Patel, R. Amirfeyz, M. Gargan//Curr. Orthop. 2007. Vol. 21. P. 236-241.
- Bishop N. Characterising and treating osteogenesis imperfect//Early Hum. Dev. 2010. Vol. 86, No 11. P. 743-746 DOI: 10.1016/j.earlhumdev.2010.08.002
- Rauch F., Glorieux F.H. Osteogenesis imperfecta//Lancet. 2004. Vol. 363, No 9418. P. 1377-1385 DOI: 10.1016/S0140-6736(04)16051-0
- Nosology and classification of genetic skeletal disorders: 2010 revision/M.L. Warman, V. Cormier-Daire, C. Hall, D. Krakow, R. Lachman, M. LeMerrer, G. Mortier, S. Mundlos, G. Nishimura, D.L. Rimoin, S. Robertson, R. Savarirayan, D. Sillence, J. Spranger, S. Unger, B. Zabel, A. Superti-Furga//Am. J. Med. Genet. A. 2011. Vol. 155A, No 5. P. 943-968 DOI: 10.1002/ajmg.a.33909
- Skeletal clinical characteristics of osteogenesis imperfecta caused by haploinsufficiency mutations in COL1A1/I.M. Ben Amor, P. Roughley, F.H. Glorieux, F. Rauch//J. Bone Miner. Res. 2013. Vol. 28, No 9. P. 2001-2007 DOI: 10.1002/jbmr.1942
- Osteogenesis imperfecta in childhood: prognosis for walking/R.H. Engelbert, C.S. Uiterwaal, V.A. Gulmans, H. Pruijs, P.J. Helders//J. Pediatr. 2000. Vol. 137, No 3. P. 397-402 DOI: 10.1067/mpd.2000.107892
- Binder H. Rehabilitation of infants with osteogenesis imperfect//Connect. Tissue Res. 1995. Vol. 31, No 4. P. S37-S39.
- Effect of intravenous pamidronate therapy on functional abilities and level of ambulation in children with osteogenesis imperfect/C. Land, F. Rauch, K. Montpetit, J. Ruck-Gibis, F.H. Glorieux//J. Pediatr. 2006. Vol. 148, No 4. P. 456-460 DOI: 10.1016/j.jpeds.2005.10.041
- Bone mineral density in children with mild osteogenesis imperfecta/L.E. Zionts, J.P. Nash, R. Rude, T. Ross, N.S. Stott//J. Bone Joint Surg. Br. 1995. Vol. 77, No 1. P. 143-147.
- Functional results of operation in osteogenesis imperfecta: elongating rods and nonelongating rods/S. Porat, E. Heller, D.S. Seidman, S. Meyer//J. Pediatr. Orthop. 1991. Vol. 11, No 2. P. 200-203.
- Intramedullary rodding in type III osteogenesis imperfecta. Effects on neuromotor development in 10 children/R.H. Engelbert, P.J. Helders, W. Keessen, H.E. Pruijs, R.H. Gooskens//Acta Orthop. Scand. 1995. Vol. 66, No 4. P. 361-364.
- From pediatric to adult care: strategic evaluation of a transition program for patients with osteogenesis imperfect/M.J. Dogba, F. Rauch, T. Wong, J. Ruck, F.H. Glorieux, C. Bedos//BMC Health Serv. Res. 2014. Vol. 14. P. 489 DOI: 10.1186/s12913-014-0489-1
- Activities and participation in young adults with osteogenesis imperfect/K. Montpetit, N. Dahan-Oliel, J. Ruck-Gibis, F. Fassier, F. Rauch, F. Glorieux//J. Pediatr. Rehabil. Med. 2011. Vol. 4, No 1. P. 13-22 DOI: 10.3233/PRM-2011-0149
- Multidisciplinary treatment of severe osteogenesis imperfecta: functional outcomes at skeletal maturity/K. Montpetit, T. Palomo, F.H. Glorieux, F. Fassier, F. Rauch//Arch. Phys. Med. Rehabil. 2015. Vol. 96, No 10. P. 1834-1839 DOI: 10.1016/j.apmr.2015.06.006
- Gillette Functional Assessment Questionnaire 22-item skill set: factor and Rasch analyses/G.E. Gorton 3rd, J.L. Stout, A.M. Bagley, K. Bevans, T.F. Novacheck, C.A. Tucker//Dev. Med. Child. Neurol. 2011. Vol. 53, No 3. P. 250-255 DOI: 10.1111/j.1469-8749.2010.03832.x
- Deformity planning for frontal and sagittal plane corrective osteotomies/D. Paley, J.E. Herzenberg, K. Tetsworth, J. McKie, A. Bhave//Orthop. Clin. North Am. 1994. Vol. 25, No 3. P. 425-465.
- Keenan N., Herzenberg J.E., Paley D. The normal radiological alignment of the lower limb in children//J. Bone Joint Surg. 1997. Vol. 79-B, No Suppl. II. P. 263-264.
- Wong D.L., Baker C.M. Smiling faces as anchor for pain intensity scales//Pain. 2001 Jan; 89 (2-3):295-300. Pain. 2001. Vol. 89, No 2-3. P. 295-300.
- Marr C., Seasman A., Bishop N. Managing the patient with osteogenesis imperfecta: a multidisciplinary approach//J. Multidiscip. Healthc. 2017. Vol. 10. P. 145-155 DOI: 10.2147/JMDH.S113483
- Fassier-Duval femoral rodding in children with osteogenesis imperfecta receiving bisphosphonates: functional outcomes at one year/J. Ruck, N. Dahan-Oliel, K. Montpetit, F. Rauch, F.Fassier//J. Child. Orthop. 2011. Vol. 5, No 3. P. 217-224 DOI: 10.1007/s11832-011-0341-7
- Pamidronate in children and adolescents with osteogenesis imperfecta: effect of treatment discontinuation/F. Rauch, C. Munns, C. Land, F.H. Glorieux//J. Clin. Endocrinol. Metab. 2006. Vol. 91, No 4. P. 1268-1274 DOI: 10.1210/jc.2005-2413
- Effects of intravenous pamidronate treatment in infants with osteogenesis imperfecta: clinical and histomorphometric outcome/C.F. Munns, F. Rauch, R. Travers, F.H. Glorieux//J. Bone Miner. Res. 2005. Vol. 20, No 7. P. 1235-1243 DOI: 10.1359/JBMR.050213
- Delayed osteotomy but not fracture healing in pediatric osteogenesis imperfecta patients receiving pamidronate/C.F. Munns, F. Rauch, L. Zeitlin, F. Fassier, F.H. Glorieux//J. Bone Miner. Res. 2004. Vol. 19, No 11. P. 1779-1786 DOI: 10.1359/JBMR.040814
- Osteotomy healing in children with osteogenesis imperfecta receiving bisphosphonate treatment/E.A. Anam, F. Rauch, F.H. Glorieux, F. Fassier, R. Hamdy//J. Bone Miner. Res. 2015. Vol. 30, No 8. P. 1362-1368 DOI: 10.1002/jbmr.2486
- Osteogenesis imperfecta: from diagnosis and multidisciplinary treatment to future perspectives/A. Bregou Bourgeois, B. Aubry-Rozier, L. Bonafé, L. Laurent-Applegate, D.P. Pioletti, P.Y. Zambelli//Swiss Med. Wkly. 2016. Vol. 146. P. w14322 DOI: 10.4414/smw.2016.14322
- Orthopaedic considerations for the adult with osteogenesis imperfecta/T.T. Roberts, D.J. Cepela, R.L. Uhl, J. Lozman//J. Am. Acad. Orthop. Surg. 2016. Vol. 24, No 5. P. 298-308 DOI: 10.5435/JAAOS-D-15-00275
- Mortality and causes of death in patients with osteogenesis imperfecta: a register-based nationwide cohort study/L. Folkestad, J.D. Hald, V. Canudas-Romo, J. Gram, A.P. Hermann, B. Langdahl, B. Abrahamsen, K. Brixen//J. Bone Miner. Res. 2016. Vol. 31, No 12. P. 2159-2166 DOI: 10.1002/jbmr.2895
- Pileggi V.N., Scalize A.R., Camelo Junior J.S. Phase angle and World Health Organization criteria for the assessment of nutritional status in children with osteogenesis imperfecta//Rev. Paul. Pediatr. 2016. Vol. 34, No 4. P. 484-488 DOI: 10.1016/j.rpped.2016.02.005
- Harrington J., Sochett E., Howard A. Update on the evaluation and treatment of osteogenesis imperfect//Pediatr. Clin. North Am. 2014. Vol. 61, No 6. P. 1243-1257 DOI: 10.1016/j.pcl.2014.08.010
- Height and weight development during four years of therapy with cyclical intravenous pamidronate in children and adolescents with osteogenesis imperfecta types I, III, and IV/L. Zeitlin, F. Rauch, H. Plotkin, F.H. Glorieux//Pediatrics. 2003. Vol. 111, No 5. Pt. 1. P. 1030-1036.
- Muscle function in Osteogenesis Imperfecta Type IV/L.N. Veilleux, V.B. Darsaklis, K. Montpetit, F.H. Glorieux, F. Rauch//Calcif. Tissue Int. 2017. May 4 DOI: 10.1007/s00223-017-0287-y
- Do patients with osteogenesis imperfecta need individualized Nutritional support?/C.E. Chagas, J.P. Roque, B. Santarosa Emo Peters, M. Lazaretti-Castro, L.A. Martini//Nutrition. 2012. Vol. 28, No 2. P. 138-142 DOI: 10.1016/j.nut.2011.04.003
- Weight loss surgery improves quality of life in pediatric patients with osteogenesis imperfecta/A. Zani, M. Ford-Adams, M. Ratcliff, D. Bevan, T.H. Inge, A. Desai//Surg. Obes. Relat. Dis. 2017. Vol. 13, No 1. P. 41-44 DOI: 10.1016/j.soard.2015.11.029
- Hamza R.T., Abdelaziz T.H., Elakkad M. Anthropometric and nutritional parameters in Egyptian children and adolescents with osteogenesis imperfecta//Horm. Res. Paediatr. 2015. Vol. 83, No 5. P. 311-320 DOI: 10.1159/000374111


